Потенциал-управляемый ионный канал
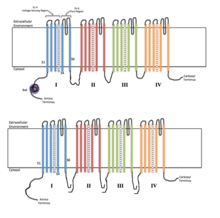 Каждый из четырех гомологичных доменов составляет одну субъединицу ионного канала. Сегменты измерения напряжения S4 (отмеченные символом +) показаны заряженными. | |
| Идентификаторы | |
|---|---|
| Символ | ВИК |
| Пфам Клан | CL0030 |
| TCDB | 1.А.1 |
| Суперсемейство OPM | 8 |
| белок OPM | 2а79 |

Потенциал-управляемые ионные каналы представляют собой класс трансмембранных белков , которые образуют ионные каналы , которые активируются изменениями клетки электрического мембранного потенциала вблизи канала. Мембранный потенциал изменяет конформацию белков каналов, регулируя их открытие и закрытие. Клеточные мембраны обычно непроницаемы для ионов , поэтому они должны диффундировать через мембрану через трансмембранные белковые каналы.
Потенциал-управляемые ионные каналы играют решающую роль в возбудимых клетках, таких как нейрональные и мышечные ткани, обеспечивая быструю и скоординированную деполяризацию в ответ на изменение напряжения . Расположенные вдоль аксона и в синапсе потенциалзависимые ионные каналы направленно распространяют электрические сигналы.
Потенциал-управляемые ионные каналы обычно являются ион-специфичными, а каналы, специфичные для натрия (Na + ), калий (К + ), кальций (Ca 2+ ) и хлорид (Cl − ) ионы были идентифицированы. [ 1 ] Открытие и закрытие каналов запускается изменением концентрации ионов и, следовательно, градиента заряда между сторонами клеточной мембраны. [ 2 ]
Структура
[ редактировать ]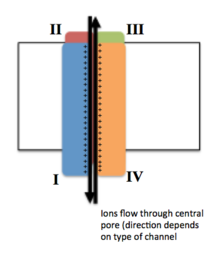
Потенциал-управляемые ионные каналы обычно состоят из нескольких субъединиц, расположенных таким образом, что имеется центральная пора, через которую ионы могут перемещаться вниз по своим электрохимическим градиентам . Каналы, как правило, специфичны для ионов, хотя иногда через них могут проходить ионы одинакового размера и заряда.
Функциональность потенциалзависимых ионных каналов объясняется тремя его основными дискретными блоками: датчиком напряжения, порой или проводящим путем и воротами. [ 3 ] Уже + , К + и Ка 2+ каналы состоят из четырех трансмембранных доменов, расположенных вокруг центральной поры; эти четыре домена являются частью одной α-субъединицы в случае большинства Na + и Ca 2+ каналов, тогда как в большинстве K есть четыре α-субъединицы, каждая из которых вносит свой вклад в один трансмембранный домен. + каналы. [ 4 ]
Все мембранные сегменты, обозначенные S1-S6, имеют форму альфа-спиралей со специализированными функциями. Пятый и шестой трансмембранные сегменты (S5 и S6) и поровая петля выполняют основную роль ионной проводимости, включая ворота и поры канала, а S1-S4 служат областью восприятия напряжения. [ 3 ]
Четыре субъединицы могут быть идентичными или отличаться друг от друга. Помимо четырех центральных α-субъединиц существуют еще регуляторные β-субъединицы, обладающие оксидоредуктазной активностью, которые расположены на внутренней поверхности клеточной мембраны и не пересекают мембрану и которые собираются вместе с α-субъединицами в эндоплазматическая сеть . [ 5 ]
Механизм
[ редактировать ]Кристаллографические структурные исследования калиевого канала показали, что когда разность потенциалов над мембраной вводится , связанное с ним электрическое поле вызывает конформационные изменения в калиевом канале. Конформационное изменение настолько искажает форму белков канала, что полость или канал открывается, обеспечивая приток или отток через мембрану. Это движение ионов вниз по градиенту концентрации впоследствии генерирует электрический ток, достаточный для деполяризации клеточной мембраны.
Потенциал-управляемые натриевые и кальциевые каналы состоят из одного полипептида с четырьмя гомологичными доменами. Каждый домен содержит 6 мембран, охватывающих альфа-спирали . Одна из этих спиралей, S4, является спиралью, чувствительной к напряжению. [ 6 ] Сегмент S4 содержит много положительных зарядов, поэтому высокий положительный заряд снаружи клетки отталкивает спираль, удерживая канал в закрытом состоянии.
В общем, часть ионного канала, чувствительная к напряжению, отвечает за обнаружение изменений трансмембранного потенциала, которые вызывают открытие или закрытие канала. Обычно считается, что эту роль выполняют альфа-спирали S1-4. В калиевых и натриевых каналах потенциал-чувствительные спирали S4 содержат положительно заряженные остатки лизина или аргинина в повторяющихся мотивах. [ 3 ] В состоянии покоя половина каждой спирали S4 контактирует с цитозолем клетки. При деполяризации положительно заряженные остатки доменов S4 движутся к экзоплазматической поверхности мембраны. Считается, что первые 4 аргинина отвечают за ток управления, движущийся к внеклеточному растворителю при активации канала в ответ на деполяризацию мембраны. Движение 10–12 из этих связанных с белком положительных зарядов вызывает конформационные изменения, которые открывают канал. [ 4 ] Точный механизм, посредством которого происходит это движение, в настоящее время не согласован, однако каноническая, транспортная, лопастная и скрученная модели являются примерами современных теорий. [ 7 ]
Движение датчика напряжения вызывает конформационное изменение ворот проводящего пути, контролируя поток ионов через канал. [ 3 ]
Основная функциональная часть потенциал-чувствительного белкового домена этих каналов обычно содержит область, состоящую из спиралей S3b и S4, известную как «лопатка» из-за ее формы, которая, по-видимому, представляет собой консервативную последовательность , взаимозаменяемую в широком диапазоне. клетки и виды. Подобная лопатка датчика напряжения также была обнаружена в семействе потенциал-чувствительных фосфатаз у различных видов. [ 8 ] Генная инженерия области лопасти из вида архебактерий, обитающих в вулкане , в калиевые каналы мозга крысы приводит к созданию полностью функционального ионного канала при условии, что вся неповрежденная лопасть будет заменена. [ 9 ] Эта « модульность » позволяет использовать простые и недорогие модельные системы для изучения функции этой области, ее роли в заболевании и фармацевтического контроля ее поведения, а не ограничиваться плохо охарактеризованными, дорогими и/или трудными для изучения препаратами. [ 10 ]
Хотя потенциалзависимые ионные каналы обычно активируются деполяризацией мембраны , некоторые каналы, такие как каналы ионов калия с внутренним выпрямителем , вместо этого активируются гиперполяризацией .
Считается, что затвор соединен с областями измерения напряжения каналов и, по-видимому, содержит механическое препятствие для потока ионов. [ 11 ] Хотя домен S6 считается сегментом, действующим как это препятствие, его точный механизм неизвестен. Возможные объяснения включают в себя: сегмент S6 совершает ножницеобразное движение, позволяя ионам проходить через него, [ 12 ] сегмент S6 распадается на два сегмента, обеспечивающих прохождение ионов через канал, [ 13 ] или канал S6, служащий самим шлюзом. [ 14 ] Механизм, с помощью которого движение сегмента S4 влияет на движение сегмента S6, до сих пор неизвестен, однако предполагается, что существует линкер S4-S5, движение которого позволяет открыть S6. [ 3 ]
Инактивация ионных каналов происходит в течение миллисекунд после открытия. Считается, что инактивация опосредуется внутриклеточными воротами, которые контролируют открытие пор внутри клетки. [ 15 ] Эти ворота моделируются в виде шара, привязанного к гибкой цепи . Во время инактивации цепочка складывается сама по себе, и шарик блокирует поток ионов через канал. [ 16 ] Быстрая инактивация напрямую связана с активацией, вызванной внутримембранными движениями сегментов S4. [ 17 ] хотя механизм, связывающий движение S4 и включение ворот инактивации, неизвестен.
Различные типы
[ редактировать ]Sodium (Na + ) каналы
[ редактировать ]Натриевые каналы имеют схожие функциональные свойства во многих разных типах клеток. Хотя идентифицировано десять человеческих генов, кодирующих натриевые каналы, их функция обычно консервативна у разных видов и разных типов клеток. [ 17 ]
Кальций (Ca 2+ ) каналы
[ редактировать ]Поскольку идентифицировано шестнадцать различных генов кальциевых каналов человека, этот тип каналов различается по функциям в зависимости от типа клеток. Калифорния 2+ каналы производят потенциалы действия аналогично Na + каналы в некоторых нейронах. Они также играют роль в высвобождении нейромедиаторов в пресинаптических нервных окончаниях. В большинстве клеток Ca 2+ каналы регулируют широкий спектр биохимических процессов благодаря их роли в контроле внутриклеточного кальция. 2+ концентрации. [ 13 ]
Калий (К + ) каналы
[ редактировать ]Калиевые каналы представляют собой самый большой и разнообразный класс потенциалзависимых каналов, в котором более 100 кодируют гены человека. Эти типы каналов существенно различаются по своим стробирующим свойствам; некоторые инактивируются очень медленно, а другие очень быстро. Эта разница во времени активации влияет на продолжительность и скорость срабатывания потенциала действия, что оказывает существенное влияние на электрическую проводимость по аксону, а также на синаптическую передачу. Калиевые каналы отличаются по структуре от других каналов тем, что они содержат четыре отдельные полипептидные субъединицы, в то время как другие каналы содержат четыре гомологичных домена, но на одной полипептидной единице. [ 7 ]
Хлорид (Cl − ) каналы
[ редактировать ]Хлоридные каналы присутствуют во всех типах нейронов. Основная ответственность за контроль возбудимости лежит на хлоридных каналах, которые способствуют поддержанию потенциала покоя клеток и помогают регулировать объем клеток. [ 1 ]
Протон (H + ) каналы
[ редактировать ]Потенциал-управляемые протонные каналы проводят токи, опосредованные ионами водорода в форме гидроксония , и активируются деполяризацией в зависимости от pH . Их функция заключается в удалении кислоты из клеток. [ 18 ] [ 19 ] [ 20 ]
Филогенетика
[ редактировать ]Филогенетические исследования белков, экспрессируемых в бактериях, выявили существование суперсемейства потенциалзависимых натриевых каналов. [ 21 ] Последующие исследования показали, что множество других ионных каналов и переносчиков филогенетически связаны с потенциал-управляемыми ионными каналами, в том числе:
- внутренне исправляя К + каналы ,
- рианодин-инозитол-1,4,5-трифосфатный рецептор Ca 2+ каналы ,
- временный рецепторный потенциал Ca 2+ каналы ,
- полицистиновые катионные каналы ,
- глутамат-управляемые ионные каналы ,
- кальцийзависимые хлоридные каналы ,
- одновалентный катион: антипортеры протонов типа 1 и
- переносчики калия . [ 22 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Перейти обратно: а б Первс Д., Августин Г.Дж., Фитцпатрик Д., Кац Л.К., ЛаМантия А.С., Макнамара Д.О., Уильямс С.М. (2001). «Ионные каналы, управляемые напряжением» . Нейронаука (2-е изд.). Сандерленд, Массачусетс: Sinauer Associates. ISBN 978-0-87893-742-4 .
- ^ Каттералл, Вашингтон (апрель 2000 г.). «От ионных токов к молекулярным механизмам: структура и функции потенциалзависимых натриевых каналов» . Нейрон . 26 (1): 13–25. дои : 10.1016/S0896-6273(00)81133-2 . ПМИД 10798388 .
- ^ Перейти обратно: а б с д и Безанилья Ф (март 2005 г.). «Ионные каналы, управляемые напряжением». Транзакции IEEE по нанобионаукам . 4 (1): 34–48. дои : 10.1109/tnb.2004.842463 . ПМИД 15816170 . S2CID 8212388 .
- ^ Перейти обратно: а б Лодиш Х., Берк А., Зипурски С.Л., Мацудайра П., Балтимор Д., Дарнелл Дж. (2000). «Раздел 21.3, Молекулярные свойства потенциал-управляемых ионных каналов» . Молекулярно-клеточная биология (4-е изд.). Нью-Йорк: Книги Scientific American. ISBN 978-0-7167-3136-8 .
- ^ Гулбис Дж. М., Манн С., Маккиннон Р. (июнь 1999 г.). «Структура потенциалзависимого К + бета-субъединица канала» . Cell . 97 (7): 943–52. doi : 10.1016/s0092-8674(00)80805-3 . PMID 10399921 .
- ^ Каттералл, Вашингтон (2010). «Датчики напряжения ионных каналов: строение, функции и патофизиология» . Нейрон . 67 (6): 915–28. дои : 10.1016/j.neuron.2010.08.021 . ПМЦ 2950829 . ПМИД 20869590 .
- ^ Перейти обратно: а б Сэндс З., Гроттези А., Сансом М.С. (2005). «Ионные каналы, управляемые напряжением» . Современная биология . 15 (2): Р44–7. Бибкод : 2005CBio...15..R44S . дои : 10.1016/j.cub.2004.12.050 . ПМИД 15668152 .
- ^ Мурата Ю., Ивасаки Х., Сасаки М., Инаба К., Окамура Ю. (июнь 2005 г.). «Активность фосфоинозитидфосфатазы, связанная с датчиком внутреннего напряжения». Природа . 435 (7046): 1239–43. Бибкод : 2005Natur.435.1239M . дои : 10.1038/nature03650 . ПМИД 15902207 . S2CID 4427755 .
- ^ Алаби А.А., Бахамонде М.И., Юнг Х.Дж., Ким Дж.И., Шварц К.Дж. (ноябрь 2007 г.). «Портативность функции лопастного мотива и фармакология в датчиках напряжения» . Природа . 450 (7168): 370–5. Бибкод : 2007Natur.450..370A . дои : 10.1038/nature06266 . ПМК 2709416 . ПМИД 18004375 .
- ^ Лонг С.Б., Тао X, Кэмпбелл Э.Б., Маккиннон Р. (ноябрь 2007 г.). «Атомная структура зависимого от напряжения K + канал в липидной мембраноподобной среде». Nature . 450 (7168): 376–82. : 2007Natur.450..376L . doi : 10.1038 /nature06265 . PMID 18004376. . S2CID 4320272 Bibcode
- ^ Йеллен Дж. (август 1998 г.). «Движущиеся части потенциалзависимых ионных каналов». Ежеквартальные обзоры биофизики . 31 (3): 239–95. дои : 10.1017/s0033583598003448 . ПМИД 10384687 . S2CID 2605660 .
- ^ Перозо Э., Кортес Д.М., Куэлло Л.Г. (июль 1999 г.). «Структурные перестройки, лежащие в основе К. + - ворота активации канала». Science . 285 (5424): 73–8. : 10.1126 /science.285.5424.73 . PMID 10390363. . S2CID 26775433 doi
- ^ Перейти обратно: а б Цзян Ю, Ли А, Чен Дж, Каден М, Чайт БТ, Маккиннон Р (май 2002 г.). «Кристаллическая структура и механизм кальций-управляемого калиевого канала». Природа . 417 (6888): 515–22. Бибкод : 2002Natur.417..515J . дои : 10.1038/417515a . ПМИД 12037559 . S2CID 205029269 .
- ^ Вебстер С.М., Дель Камино Д., Деккер Дж.П., Йеллен Дж. (апрель 2004 г.). «Открытие внутриклеточных ворот в шейкере К. + каналы, определяемые металлическими мостиками с высоким сродством». Nature . 428 (6985): 864–8. : 2004Natur.428..864W . doi : 10.1038 /nature02468 . PMID 15103379. Bibcode S2CID 1329210 .
- ^ Армстронг CM (июль 1981 г.). «Натриевые каналы и управляющие токи». Физиологические обзоры . 61 (3): 644–83. дои : 10.1152/physrev.1981.61.3.644 . ПМИД 6265962 .
- ^ Васильев П., Шойер Т., Каттералл В.А. (октябрь 1989 г.). «Ингибирование инактивации одиночных натриевых каналов сайт-направленным антителом» . Труды Национальной академии наук Соединенных Штатов Америки . 86 (20): 8147–51. Бибкод : 1989PNAS...86.8147V . дои : 10.1073/pnas.86.20.8147 . ПМК 298232 . ПМИД 2554301 .
- ^ Перейти обратно: а б Бенита Дж. П., Чен З., Бальсер Дж. Р., Томаселли Г. Ф., Марбан Э (март 1999 г.). «Молекулярная динамика пор натриевого канала меняется в зависимости от открытия: взаимодействие между движениями P-сегмента и инактивацией» . Журнал неврологии . 19 (5): 1577–85. doi : 10.1523/JNEUROSCI.19-05-01577.1999 . ПМК 6782169 . ПМИД 10024345 .
- ^ Черный, В.В.; Маркин В.С.; ДеКурси, Т.Э. (1995), «Активируемая напряжением проводимость ионов водорода в альвеолярных эпителиальных клетках крысы определяется градиентом pH», Journal of General Physiology , vol. 105, нет. 6 (опубликовано в июне 1995 г.), стр. 861–896, doi : 10.1085/jgp.105.6.861 , PMC 2216954 , PMID 7561747.
- ^ ДеКурси, TE (2003), «Потенциал-управляемые протонные каналы и другие пути переноса протонов», Physiological Reviews , vol. 83, нет. 2, стр. 475–579, doi : 10.1152/physrev.00028.2002 , OCLC 205658168 , PMID 12663866
- ^ Рэмси, И. Скотт; Мокраб, Юнес; Карвачо, Ингрид; Сэндс, Зара А.; Сэнсом, Марк С.П.; Клэпхэм, Дэвид Э. (2010). «Водный H + путь проникновения в потенциалзависимом протонном канале Hv1" . Nature Structural & Molecular Biology . 17 (7): 869–875. : 10.1038 /nsmb.1826 . PMC 4035905. doi PMID 20543828 .
- ^ Койши Р., Сюй Х., Рен Д., Наварро Б., Спиллер Б.В., Ши Кью, Клэпхэм Д.Э. (март 2004 г.). «Суперсемейство потенциалзависимых натриевых каналов у бактерий» . Журнал биологической химии . 279 (10): 9532–8. дои : 10.1074/jbc.M313100200 . ПМИД 14665618 .
- ^ Чанг, Авраам Б.; Лин, Рон; Стадли, В. Кейт; Тран, Джан В.; Сайер, Милтон Х. младший (2004). «Филогения как руководство к структуре и функциям мембранных транспортных белков». Мол Мембр Биол . 21 (3): 171–181. дои : 10.1080/09687680410001720830 . ПМИД 15204625 . S2CID 45284885 .
Внешние ссылки
[ редактировать ]- IUPHAR-DB Субъединицы потенциал-управляемых ионных каналов
- Сборник потенциал-управляемых ионных каналов IUPHAR, 2005 г.
- Потенциально-зависимые + анионные + каналы Национальной медицинской библиотеки США в медицинских предметных рубриках (MeSH)