Стеатотическая болезнь печени, связанная с метаболической дисфункцией
| Стеатотическая болезнь печени, связанная с метаболической дисфункцией | |
|---|---|
| Другие имена | MASLD, Неалкогольная жировая болезнь печени (НАЖБП), [ 1 ] Метаболическая (дисфункция), связанная с жировой болезнью печени (МАЖБП) [ 2 ] |
 | |
| Стадии стеатоза печени, связанного с метаболической дисфункцией, прогрессирующие от здоровых до стеатоза (накопления жира), воспаления, фиброза и цирроза печени. | |
| Специальность | Гепатология |
| Symptoms | Asymptomatic in the early stages In later stages: * Deposits of cholesterol on the eye lids * Fatigue * Crusty red nodules * Digestive issues Lastly causes liver disease and eventually liver failure |
| Complications | Cirrhosis, liver cancer, liver failure, cardiovascular disease[3][4] |
| Duration | Long term |
| Types | Metabolic dysfunction–associated steatotic liver (MASL), Metabolic dysfunction-associated steatohepatitis (MASH)[4][5] |
| Causes | Genetic, environmental |
| Risk factors | Obesity, metabolic syndrome, type 2 diabetes mellitus, liver disease |
| Diagnostic method | Ultrasound, Coexisting metabolic disorders, Liver biopsy |
| Treatment | Weight loss (in case of obesity) Dietary reduction of fructose and glucose[6] (diet and exercise)[4][7] |
| Prognosis | Depends on type[8] |
| Frequency | 24% in worldwide population, 80% in obese, 20% in normal-weight |
| Deaths | MASH: 2.6% risk of death per year[5] MAFL: Unknown[9] |
Стеатотическая болезнь печени, связанная с метаболической дисфункцией ( MASLD ), ранее известная как неалкогольная жировая болезнь печени ( НАЖБП ), [ а ] является разновидностью хронического заболевания печени . Это состояние диагностируется при наличии избыточного жира накопления в печени ( стеатоз печени ) и наличии хотя бы одного метаболического фактора риска. [ 1 ] [ 3 ] [ 4 ] Когда также наблюдается повышенное потребление алкоголя , используется термин MetALD, или метаболическая дисфункция и связанное с алкоголем заболевание печени, и его следует отличать от связанного с алкоголем заболевания печени (ALD) , где алкоголь является преобладающей причиной стеатоза печени . [ 1 ] [ 12 ] Термины «неалкогольная жировая дистрофия печени» ( НАЖЛ ) и «неалкогольный стеатогепатит» ( НАСГ , теперь «МАСГ» ) использовались для описания различных степеней тяжести, причем последний указывает на наличие дальнейшего воспаления печени . [ 4 ] [ 5 ] [ 8 ] НАФЛ менее опасна, чем НАСГ, и обычно не прогрессирует в нее. [ 4 ] но это прогрессирование может в конечном итоге привести к осложнениям, таким как цирроз печени , рак печени , печеночная недостаточность и сердечно-сосудистые заболевания . [ 4 ] [ 13 ]
Obesity and type 2 diabetes are strong risk factors for MASLD.[7] Other risks include being overweight, metabolic syndrome (defined as at least three of the five following medical conditions: abdominal obesity, high blood pressure, high blood sugar, high serum triglycerides, and low serum HDL cholesterol), a diet high in fructose, and older age.[4][8] Obtaining a sample of the liver after excluding other potential causes of fatty liver can confirm the diagnosis.[3][7][8]
Treatment for MASLD is weight loss by dietary changes and exercise;[5][14][15] bariatric surgery can improve or resolve severe cases.[14][16] There is some evidence for SGLT-2 inhibitors, GLP-1 agonists, pioglitazone, and vitamin E in the treatment of MASLD.[17][18] In March 2024, resmetirom was the first drug approved by the FDA for MASH.[19] Those with MASH have a 2.6% increased risk of dying per year.[5]
MASLD is the most common liver disorder in the world; about 25% of people have it.[20] It is very common in developed nations, such as the United States, and affected about 75 to 100 million Americans in 2017.[21][22][23][24] Over 90% of obese, 60% of diabetic, and up to 20% of normal-weight people develop MASLD.[25][26] MASLD was the leading cause of chronic liver disease[24][25] and the second most common reason for liver transplantation in the United States and Europe in 2017.[14] MASLD affects about 20 to 25% of people in Europe.[16] In the United States, estimates suggest that 30% to 40% of adults have MASLD, and about 3% to 12% of adults have MASH.[4] The annual economic burden was about US$103 billion in the United States in 2016.[25]
Definition
[edit]An abnormal accumulation of fat in the liver in the absence of secondary causes of fatty liver, such as significant alcohol use, viral hepatitis, or medications that can induce fatty liver, was the definition of NAFLD.[20] However, the term MASLD accepts there may be other conditions present, but focuses on the metabolic abnormalities contributing to the disorder.[1][12] MASLD encompasses a continuum of liver abnormalities, from metabolic dysfunction–associated steatotic liver (MASL, simple steatosis) to Metabolic dysfunction-associated steatohepatitis (MASH). These diseases begin with fatty accumulation in the liver (hepatic steatosis). A liver can remain fatty without disturbing liver function (MASL), but by various mechanisms and possible insults to the liver, it may also progress into steatohepatitis (MASH), a state in which steatosis is combined with inflammation and sometimes fibrosis.[1] MASH can then lead to complications such as cirrhosis and hepatocellular carcinoma.[3][5][27]
The new name, metabolic dysfunction-associated steatotic liver disease (MASLD), was proposed after 70% of a panel of experts expressed support for this name.[1] This new name was adopted in 2023.[1][10]
Signs and symptoms
[edit]People with MASLD often have no noticeable symptoms, and it is often only detected during routine blood tests or unrelated abdominal imaging or liver biopsy.[5][27] In some cases, it can cause symptoms related to liver dysfunction such as fatigue, malaise, and dull right-upper-quadrant abdominal discomfort. Mild yellow discoloration of the skin may occur, although this is rare.[28] MASH can severely impair liver function, leading to cirrhosis, liver failure, and liver cancer.[5]
Comorbidities
[edit]The condition is strongly associated with or caused by type 2 diabetes, insulin resistance, and metabolic syndrome (defined as at least three of the five following medical conditions: abdominal obesity, high blood pressure, high blood sugar, high serum triglycerides, and low serum high-density lipoprotein). It is also associated with hormonal disorders (panhypopituitarism, hypothyroidism, hypogonadism, polycystic ovary syndrome), persistently elevated transaminases, increasing age, and hypoxia caused by obstructive sleep apnea; some of these conditions predict disease progression.[3][7][13][29][21][25][30]
Most normal-weight people with MASLD ("lean MASLD") have impaired insulin sensitivity, are sedentary, and have increased cardiovascular disease risk and increased liver lipid levels. These are the consequences of a decreased capacity for storing fat and reduced mitochondrial function in fat and increased hepatic de novo lipogenesis.[7][25] A recent systematic review reported an increased risk of severe COVID-19 infection in MASLD patients, but no difference in mortality was observed between MASLD and non-MASLD patients.[31]
Risk factors
[edit]Genetics
[edit]Two-thirds of families with a history of diabetes type 2 report more than one family member having MASLD. There is a higher risk of fibrosis for family members where someone was diagnosed with MASH.[27] Asian populations are more susceptible to metabolic syndrome and MASLD than their western counterparts.[7] Hispanic persons have a higher prevalence of MASLD than white individuals, whereas the lowest prevalence is observed in black individuals.[25] MASLD is twice as prevalent in men as in women,[5] which might be explained by lower levels of estrogen in men.[32]
Genetic variations in two genes are associated with MASLD: non-synonymous single-nucleotide polymorphisms (SNPs) in PNPLA3 and TM6SF2.[33] Both correlate with MASLD presence and severity, but their roles for diagnosis remain unclear.[25][34] Although NAFLD has a genetic component, the American Association for the Study of Liver Diseases (AASLD) does not recommend screening family members as there is not enough confirmation of heritability,[5] although there is some evidence from familial aggregation and twin studies.[25]
From diet
[edit]According to the Asia-Pacific Working Group (APWG) on MASLD, overnutrition is a major factor of MASLD and MASH, particularly for lean MASLD.[7] Diet composition and quantity, in particular omega-6 fatty acid and fructose, have important roles in disease progression from MASL to MASH and fibrosis.[35][36] Choline deficiency can lead to the development of MASLD.[37]
Higher consumption of processed, red, and organ meats have been associated with higher risk of developing MASLD.[38][39][40] Some research also suggests eggs are also associated with developing MASLD.[41][42] On the other hand, studies have found healthful plant foods such as legumes and nuts, to be associated with a lower risk of developing MASLD.[43][44] Two different studies have found healthy plant-based diets rich in healthy plant foods and low in animal foods to be associated with a lower risk of developing MASLD, even after adjusting for BMI.[45][46]
From lifestyle
[edit]Habitual snoring may be a risk factor for MASLD. Severe snoring often signals the presence of obstructive sleep apnea (OSAS), a much more serious breathing condition. Blockage or narrowing of the airways, even temporarily, can cause the body to experience lowered oxygen levels in the blood. This in turn may cause a variety of changes within the body such as tissue inflammation, increased insulin resistance, and liver injury.[47] A prospective cohort study found the association between habitual snoring and MASLD development to be significant, and the trend was noted to be most prominent in lean individuals.[48]
Pathophysiology
[edit]The primary characteristic of MASLD is the accumulation of lipids in the liver, largely in the form of triglycerides.[20] However, the mechanisms by which triglycerides accumulate and the reasons that accumulation can lead to liver dysfunction are complex and incompletely understood.[20][49][50] MASLD can include steatosis along with varied signs of liver injury: either lobular or portal inflammation (a form of liver injury) or ballooning degeneration. Similarly, NASH can include histological features such as portal inflammation, polymorphonuclear cell infiltrates, Mallory bodies, apoptotic bodies, clear vacuolated nuclei, microvesicular steatosis, megamitochondria, and perisinusoidal fibrosis.[16] Hepatocyte death via apoptosis or necroptosis is increased in MASH compared with simple steatosis, and inflammation is a hallmark of MASH.[34] The degree of inflammation can be correlated to the number of inflammatory foci. Various definitions exist for an inflammatory focus, but one defines it as the presence of more than four mononuclear cells in close proximity inside the hepatic parenchyma.[51]
One debated mechanism proposes that hepatic steatosis progresses to steatosis with inflammation following some further injury, or second hit. Oxidative stress, hormonal imbalances, and mitochondrial abnormalities are potential causes of this "second hit" phenomenon.[27] A further nutrigenomics model named multiple hit extends the second hit model, suggesting that multiple disease biomarkers and factors such as genes and nutrition influence NAFLD and NASH progression. This model attempts to use these factors to predict the impact of lifestyle changes and genetics for the evolution of the NAFLD pathology.[52] Many researchers describe NAFLD as a multisystem disease, as it impacts and is influenced by organs and regulatory pathways other than the liver.[53][54][55]
The accumulation of senescent cells in the liver is seen in persons with NAFLD.[56] In mice, liver senescent hepatocytes result in increased liver fat deposition.[56] Treatment of NAFLD mice with senolytic agents has been shown to reduce hepatic steatosis.[56]
Based on gene knockout studies in murine models, it has been suggested that, among many other pathogenic factors, TGF beta signals may be crucially involved in promoting the progression of NASH.[57]
Fructose consumption
[edit]Non-alcoholic and alcoholic fatty liver disease share similar histological features, which suggests that they might share common pathogenic pathways. Fructose can cause liver inflammation and addiction similarly to ethanol by using similar metabolic pathways, unlike glucose. Therefore, some researchers argue that non-alcoholic and alcoholic fatty liver diseases are more alike than previously thought.[35][58] Furthermore, high fructose consumption promotes fat accumulation in the liver by stimulating de novo lipogenesis in the liver and reducing the beta-oxidation of fat.[20] Unlike the sugar glucose, the enzyme fructokinase rapidly metabolizes fructose. This leads to a decreased level of intracellular adenosine triphosphate (ATP).[20] The decrease in ATP increases oxidative stress and impairments in proper protein synthesis and mitochondrial function in the liver.[20]
Insulin resistance
[edit]Insulin resistance contributes to the accumulation of toxic fat in the liver in several ways. First, it promotes the release of free fatty acids (FFAs) from adipose tissue into the blood. Typically, adipose tissue stores lipids in the form of triglycerides, slowly releasing them into the bloodstream when insulin is low. In insulin-resistant adipose tissue, such as in people with obesity and type 2 diabetes, more triglycerides are broken down into FFAs and released into the bloodstream, promoting uptake by the liver.[20] Second, insulin promotes the production of new FFAs in the liver via de novo lipogenesis; this production of liver fats continues to be stimulated by insulin, even when other tissues are insulin-resistant.[20] These FFAs are combined back into triglycerides in the liver, forming the major constituent of the accumulated fat in the liver.[20] The three sources of free fatty acids that contribute to liver triglyceride accumulation include FFAs circulating in the bloodstream (59%), FFAs derived from carbohydrates such as fructose and glucose (26%), and diet (14%).[20] Despite the accumulation of triglycerides in the liver, they are not directly toxic to liver tissue.[20] Instead, alteration of the profile of the other lipid subtypes present in the liver, such as diacylglycerols, phospholipids, ceramides, and free cholesterol, have a more significant role in the pathogenesis of MASLD.[20]
Once MASLD progresses in severity to the point of NASH, this promotes further insulin resistance in the adipose tissue and liver, which results in a harmful cycle of insulin resistance, liver fat accumulation, and inflammation.[20] Adipose tissue dysfunction also decreases secretion of the insulin-sensitizing adipokine adiponectin in people with NAFLD.[20] Adiponectin has several properties that protect the liver.[20] These properties include improved liver fat metabolism, decreased de novo lipogenesis, decreased glucose production in the liver, anti-inflammatory properties, and anti-fibrotic properties.[20] Skeletal muscle insulin resistance may also play a role in MASLD. Insulin-resistant skeletal muscle is not as efficient at taking up glucose from the bloodstream after a meal.[20] This inefficient glucose uptake promotes the redistribution of consumed carbohydrates from glucose destined for use in glycogen stores in the skeletal muscles to being used as a substrate for de novo lipogenesis in the liver.[20]
Dysbiosis
[edit]Disruptions in the intestinal microbiota seem to influence NAFLD risk in several ways.[59] People with NASH can have elevated levels of blood ethanol and Pseudomonadota (which produce alcohol), with dysbiosis proposed as a mechanism for this elevation.[60] Alterations in the composition of the intestinal microbiota may influence NAFLD risk in several ways. These changes appear to increase the permeability of intestinal tissue, thereby facilitating increased liver exposure to harmful substances (e.g., translocated bacteria, bacterial toxins, and inflammatory chemical signals). The increased transport of these harmful substances to the liver promotes liver inflammation, enhances nutrient and calorie absorption, and alters choline metabolism.[60][61][62] Higher levels of intestinal bacteria that produce butyrate may be protective.[60]
Excessive macronutrient intake contributes to gut inflammation and perturbation of homeostasis, and micronutrients may also be involved.[63] In addition to reducing weight and risk factors, lifestyle changes may prompt positive changes in the gut microbiota.[64] In particular, diet diversity may play a role that was overlooked in animal studies, since they often compare a Western high-fat, low-diversity diet against a low-fat but higher-diversity chow.[65] The health benefits after bariatric surgery may also involve changes in the gut microbiota by increasing gut permeability.[65]
-
NASH (inflammation) and fibrosis stage 1
-
NASH (inflammation) and fibrosis stage 2
-
Two foci of lobular inflammation.
Diagnosis
[edit]
NAFLD was defined by the presence of excess fat in the liver that cannot be explained by another factor, such as excessive alcohol use (>21 standard drinks/week for men and >14 for women in the USA; >30 g daily for men and >20 g for women in UK and EU, >140 g/week for men and >70 g/week for women in Asia-Pacific), liver injury caused by drugs or toxins or viruses, nutritional deficiency, or endocrine conditions. In practice, diagnosis was often made simply based on the clinical presentation and a lack of high-volume alcohol consumption reported by the patient, but this is an unreliable method of diagnosis.[3][5][7][66][16][67]
NAFLD comprises two histological categories: NAFL, and the more aggressive form NASH. The presence of at least 5% fatty liver is common to both NAFL and NASH, but the features of substantial lobular inflammation and hepatocyte injuries such as ballooning or Mallory hyaline only occur in NASH. The majority of NAFL cases show minimal or no inflammation.[3][5][7] Pericentral and perisinusoidal fibrosis occur more often in adult-onset NASH, whereas portal fibrosis is more common in children with the disorder. NASH represents a more advanced stage of NAFL and is associated with poor outcomes such as cardiovascular events, cirrhosis, or hepatocellular carcinoma. ICD-11 does not use the term NAFL as it was deemed confusing with the family of disorders NAFLD. The preferred descriptions are instead: NAFLD without NASH or simple steatosis and "NASH". Also, the modifier with or without fibrosis or cirrhosis completes the diagnostic description.[3][7]
Following the renaming of NAFLD to MASLD,[1][10] these definitions are being updated.
Blood tests
[edit]Liver function tests may be abnormal, but they often remain within the normal range even in advanced disease.[13][66][25] Other blood tests that may be useful to confirm the diagnosis include erythrocyte sedimentation rate, serum glucose, and albumin. Because the liver is important for making proteins used in blood clotting, coagulation-related studies are often carried out, especially the prothrombin time. In people with fatty liver with associated inflammatory injury (steatohepatitis) blood tests are usually used to rule out certain types of viral hepatitis and autoimmune diseases. Low thyroid activity is more prevalent in people with NASH, which would be detected by determining the thyroid-stimulating hormone.[68] Some biomarker-based blood tests have been developed and may be useful for diagnosis.[69]
Although blood tests cannot diagnose MASLD, circulating serum biomarkers of liver fibrosis can give moderate estimates in the diagnosis of liver fibrosis and cirrhosis. The ratio of the transaminase liver enzyme aspartate aminotransferase (AST) to platelets in the blood, known as the AST/platelet ratio index (APRI score), and Fibrotest are recommended as the preferred noninvasive tests for cirrhosis by the Asian-Pacific Association for Study of the Liver (APASL).[70] Several other scores such as FIB-4 score and NAFLD fibrosis score can also reflect the burden of the fibrosis in the liver,[71] and previous studies have confirmed that these scores can predict future development of mortality and liver cancer.[72]
Imaging
[edit]
A liver ultrasound scan or magnetic resonance imaging (MRI) can diagnose steatosis,[73] but not fibrosis, and confirmation of early cirrhosis detection by ultrasound by other diagnostic methods is recommended.[70] The European Association for the Study of the Liver (EASL) recommends screening for steatosis whenever NAFLD is suspected as this is a strong predictor of the disease evolution and predicts future type 2 diabetes, cardiovascular events, and hypertension.[16] These non-invasive methods can be used for NAFLD screening but are not accepted as a substitute for liver biopsy in NAFLD nor NASH clinical trials, as only a liver biopsy can define liver pathology.[7][14]
Ultrasound presented average sensitivity and specificity for diagnosing the disease in children, while in the adult population, sensitivity and specificity were significantly higher. Proton density fat fraction magnetic resonance imaging has been increasingly used for the diagnosis of steatosis in pediatric patients.[citation needed]
Ultrasound elastography is an effective tool for staging liver fibrosis and discriminating NASH in children.[74]
Computerized tomography and magnetic resonance imaging are more accurate in detecting cirrhosis than conventional ultrasound.[70] Transient elastography is recommended for the initial assessment of liver fibrosis and cirrhosis and helps to predict complications and prognosis, but the interpretation of results is carefully weighed in the presence of limiting factors such as steatosis, high BMI, low amount of hepatic fibrosis, narrow spaces between the ribs, and portal hypertension. Transient elastography is not a substitute for liver biopsy.[70]
Magnetic resonance elastography (MRE) is an established method that can accurately assess hepatic fibrosis and is recommended by the APASL, AGA, ACR and AASLD.[70] MRE possesses excellent accuracy to detect fibrosis in NAFLD regardless of BMI and inflammation, and is suggested as a more reliable alternative to diagnose NAFLD and its progression to NASH compared to ultrasound and blood tests.[28][34][75][76]
Liver biopsy
[edit]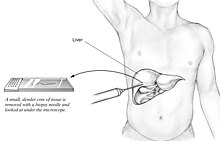

A liver biopsy (tissue examination) is the only test widely accepted (gold standard) as definitively diagnosing and distinguishing NAFLD (including NAFL and NASH) from other forms of liver disease and can be used to assess the severity of the inflammation and resultant fibrosis. However, since most people affected by NAFLD are likely to be asymptomatic, liver biopsy presents too high a risk for routine diagnosis, so other methods are preferred, such as liver ultrasonography or liver MRI. For young people, guidelines recommend liver ultrasonography, but biopsy remains the best evidence.[5][7][66][28] Liver biopsy is also the gold standard to detect hepatic fibrosis and assess its progression.[70] Routine liver function blood tests are not sensitive enough to detect MASLD, and biopsy is the only procedure that can reliably differentiate NAFL from NASH.[16]
There are several liver biopsy techniques available to obtain liver tissue. Percutaneous liver biopsy remains the most common practice. Biopsies can also be performed via the transvenous route, either during surgery or by laparoscopy, especially for people with contraindications to a percutaneous approach. The liver biopsy can also be image-guided, in real-time or not, which is recommended for some clinical situations such as people with known intra-hepatic lesions, previous intra-abdominal surgery who may have adhesions, a small liver that is difficult to percuss, obese people and people with evident ascites. Vital signs must be monitored frequently afterward (at least every 15 minutes in the hour following the biopsy).[70]
According to AASLD guidelines, a liver biopsy may be considered in people with NAFLD who are at increased risk of having steatohepatitis with or without advanced fibrosis, but only when all other competing chronic liver diseases are excluded (such as alcoholic liver disease). The presence of metabolic syndrome, NAFLD Fibrosis Score (FIB-4), or liver stiffness (as measured by Vibration-controlled transient elastography or MRE) can identify the individuals who are at higher risk of steatohepatitis or advanced fibrosis.[5]
| score | ||||
|---|---|---|---|---|
| 0 | 1 | 2 | 3 | |
| Steatosis | <5% | 5- 33% | >33- 66% | >66% |
| Lobular inflammation | None | <2 foci | 2- 4 foci | >4 foci |
| Hepatocyte ballooning |
None | Few | Many/prominent | |
The AASLD and ICD-11 consider that clinically useful pathology reporting distinguishes "between NAFL (steatosis), NAFL with inflammation and NASH (steatosis with lobular and portal inflammation and hepatocellular ballooning)" with the presence or absence of fibrosis being described and optionally comment on severity.[5][7] The EASL recommends the Fatty Liver Inhibition of Progression (FLIP) algorithm to grade the ballooning and classify MASLD-associated liver injury, and the use of the NAFLD Activity Score (NAS) to grade the severity of NASH rather than for its diagnosis. They also consider the steatosis, activity, and fibrosis (SAF) score to be an accurate and reproducible scoring system.[16] The AASLD recommends the use of the NAS scoring system with or without the SAF score if deemed appropriate.[5] The Asia-Pacific Working Group disadvises the use of NAS, as it is considered uninformative for NAFLD and inappropriate to diagnose NASH.[14]
For liver fibrosis assessment, percutaneous liver biopsy, with or without image guidance, is contraindicated in uncooperative people.[70] Transjugular liver biopsy is indicated for any person with diffuse liver disease who needs a biopsy but has a contraindication to percutaneous biopsy or needs a hemodynamic evaluation for diagnostic purposes. A transvenous liver biopsy is recommended instead of a percutaneous approach in people with clinically evident ascites, although percutaneous biopsy is an acceptable alternative approach after the removal of ascites.[70]
Management
[edit]MASLD warrants treatment regardless of whether the affected person is overweight or not.[7] MASLD is a preventable cause of death.[24] Guidelines are available from the American Association for the Study of Liver Diseases (AASLD), American Association of Clinical Endocrinologists (AACE) National Institute for Health and Care Excellence (NICE), the European Association for the Study of the Liver (EASL), and the Asia-Pacific Working Party on NAFLD.[5][7][14][66][16][78][79]
Lifestyle
[edit]Weight loss is the most effective treatment for NAFLD. A loss of 4% to 10% body weight is recommended, with 10% to 40% weight loss completely reversing NASH without cirrhosis. A structured weight loss program helps people with MASLD lose more weight compared with advice alone. This type of program also leads to improvements in NAFLD measured using blood tests, ultrasound, imaging, or liver biopsies. Although fibrosis improves with lifestyle interventions and weight loss, there is limited evidence for cirrhosis improvement.[7][14][78][80]
A combination of improved diet and exercise, rather than either alone, appears to best help manage NAFLD and reduce insulin resistance.[5][15][16][81][82] Motivational support, such as with cognitive behavioral therapy, is helpful, as most people with MASLD do not perceive their condition as a disease, and thus have a low motivation to change.[5][13][66][16][49]
Higher-intensity behavioral weight loss therapies (diet and exercise combined) may produce more weight loss than lower-intensity ones. A 2019 systematic review suggested a change of guidelines to recommend these therapies for MASLD management. Weight loss is associated with improvements in biomarkers, MASLD grade, and reduced chances of NASH, but its effect on long-term health was not known.[80]
2021 meta-analyses of trials over periods of 1 to 28 months found limited evidence to indicate that lifestyle modifications and nutritional supplementation have an effect on mortality, liver cirrhosis, liver decompensation, liver transplantation, and hepatocellular carcinoma in people with non-alcohol-related fatty liver disease; authors said that it was unlikely that differences in clinical outcomes would become apparent in trials with less than 5 years to 10 years of follow‐up, and that sample sizes needed to be much larger than had been used.[83][84]
Diet
[edit]Treatment of NAFLD typically involves counseling to improve nutrition and calorie restriction.[13][78][85] People with NAFLD can benefit from a moderate to low-carbohydrate diet and a low-fat diet.[13][86] The Mediterranean diet also showed promising results in a 6-week study with a reduction of NASH induced inflammation and fibrosis, independently from weight loss.[13][16][82][87] Tentative evidence supports dietary interventions in individuals with fatty liver who are not overweight.[88]
The EASL recommends energy restriction of 500–1000 kcal per week less than the normal daily diet, a target of 7–10% weight loss for obese/overweight MASLD, a low- to moderate-fat, and moderate- to high-carbohydrate diet, or a low-carbohydrate ketogenic or high-protein diet such as the Mediterranean diet, and avoiding all beverages and food containing fructose.[16]
Alcohol is an aggravating factor, and the AASLD recommends that people with NAFLD or NASH avoid alcohol consumption.[5][13][66][89] The EASL allows alcohol consumption below 30g/day for men and 20g/day for women.[16] The role of coffee consumption for NAFLD treatment is unclear though some studies indicate that regular coffee consumption may have protective effects.[16][90][91]
Herbal compounds such as silymarin (a milk thistle seed extract),[92] curcumin, a turmeric extract,[93] and green tea appear to improve NAFLD biomarkers and reduce the grade of NAFLD.[55] Studies suggest an association between microscopic organisms that inhabit the gut (microbiota) and MASLD. Reviews reported the use of probiotics and synbiotics (combinations of probiotics and prebiotics) were associated with improvement in liver-specific markers of hepatic inflammation, measurements of liver stiffness, and steatosis in persons with MASLD.[94][95]
Vitamin E does not improve established liver fibrosis in those with MASLD but seems to improve certain markers of liver function and reduces inflammation and fattiness of the liver in some people with MASLD.[5][13][66] The Asia-Pacific Work Group advises that Vitamin E may improve liver condition and aminotransferase levels, but only in adults without diabetes or cirrhosis who have NASH.[14] The NICE guidelines recommend Vitamin E as an option for children and adults with NAFLD with advanced liver fibrosis, regardless of whether the person has diabetes mellitus.[13][66]
Physical activity
[edit]Weight loss may improve MASLD and is recommended particularly for obese or overweight people;[96][97][98] similar physical activities and diets are advisable for overweight people with MASLD as for other obese and overweight people.[66][82] Although physical activity is less important for weight loss than dietary adaptations (to reduce caloric intake),[49] the NICE advises physical activity to reduce liver fat even if there is no overall bodyweight reduction.[13][66] Weight loss, through exercise or diet, is the most effective way to reduce liver fat and help NASH and fibrosis remission.[49] Exercise alone can prevent or reduce hepatic steatosis, but it remains unknown whether it can improve all other aspects of the liver; hence a combined approach with diet and exercise is advised.[5][15] Aerobic exercise may be more effective than resistance training, although there are contradictory results.[13][99] Vigorous training is preferable to moderate training, as only the high-intensity exercise reduced the chances of MASLD developing into NASH or advanced fibrosis.[13][100] The EASL recommends between 150 and 200 min/week in 3 to 5 sessions of moderate-intensity aerobic physical activity or resistance training. Since both effectively reduce liver fat, a pragmatic approach to the choice of physical activity that accounts for the individual's preferences for what they can maintain in the long-term is preferred. Any engagement in physical activity or increase over previous levels is better than remaining sedentary.[16]
Medication
[edit]While many treatments appear to improve biochemical markers such as alanine transaminase levels, most do not reverse histological abnormalities or improve outcomes.[5][14][101][needs update] Treatment with medications is primarily aimed at improving liver disease and is generally limited to those with biopsy-proven NASH and fibrosis.[5][66][16]
Insulin sensitizers (metformin and thiazolidinediones, such as pioglitazone) are not specifically recommended for MASLD as they do not directly improve the liver condition. They can be indicated for diabetic individuals, after a careful assessment of risks, to reduce insulin resistance and risks of complications.[5][14] Indeed, the side effects associated with thiazolidinedione medications, which include osteopenia, increased fracture risk, fluid retention, congestive heart failure, bladder cancer, and long-term weight gain, have limited their adoption.[13][102][103] Due to these side effects, the AASLD recommends the use of pioglitazone only for individuals with biopsy-proven NASH, and the Asia-Pacific Work Group recommends them only for individuals with MASLD with known diabetic issues. However, the AASLD advises against the use of metformin as studies were inconclusive about the improvement of the liver's histological condition. Although there was an improvement in insulin resistance and serum aminotransferases, this did not translate into NASH improvements.[5] The NICE provides similar guidelines to the AASLD regarding pioglitazone and recommends it be administered in secondary care to adults with advanced liver fibrosis irrespective of whether or not they have diabetes.[66]
Glucagon-like peptide-1 receptor agonists (GLP-1s) are at least as effective as pioglitazone and Vitamin E and significantly reduce steatosis, ballooning necrosis, lobular inflammation, and fibrosis according to a 2023 systematic review.[104] Dual glucose-dependent insulinotropic polypeptide (GIP) and glucagon-like peptide-1 (GLP-1) agonists appear to be effective treatments; tirzepatide was more effective than placebo for resolution of MASH without worsening of fibrosis in patients with biopsy-confirmed MASH and stage F2 or F3 (moderate or severe) fibrosis when given once-weekly for 52 weeks,[105] while survodutide decreased liver fat content and improved fibrosis compared to placebo, although with more frequent adverse effects of nausea, diarrhea, and vomiting[106]
SGLT-2 inhibitors have also found success in some clinical trials, and proved more beneficial than GLP-1 agonists in the only head-to-head-trial completed as of 2024.[17]
Statin medications appear to improve liver histology and markers of liver biochemistry in people with MASLD. Since people with NAFLD are at a higher risk of cardiovascular disease, statin treatment is indicated. People with NAFLD are not at higher risk for serious liver injury from statins, according to AASLD and EASL. However, even if statins are safe to use in people with NASH cirrhosis, the AASLD suggests avoiding them in people with decompensated cirrhosis.[5][16][107] Guidelines recommend statins to treat dyslipidemia for people with MASLD. According to NICE guidelines, statins can continue unless liver enzyme levels double within three months of starting statins.[66] Treatment with pentoxifylline is not recommended.[14]
Omega-3 fatty acids may reduce liver fat and improve blood lipid profile but do not seem to improve liver histology (fibrosis, cirrhosis, cancer).[14] The NICE does not recommend omega-3 fatty acid supplementation since randomized trials were inconclusive.[13][66] Previous systematic reviews found that omega-3 fatty acid supplementation in those with NAFLD/NASH using doses of one gram daily or more (median dose four grams/day with median treatment duration six months) has been associated with improvements in liver fat.[49][108] According to AASLD guidelines, "omega-3 fatty acids should not be used as a specific treatment of NAFLD or NASH, but they may be considered to treat hypertriglyceridemia for patients with NAFLD".[5]
Resmetirom (Rezdiffra) was approved for medical use in the United States in March 2024 for the treatment of noncirrhotic nonalcoholic steatohepatitis.[109][110]
Aspirin, 81 mg for 6 months, significantly reduced hepatic fat quantity compared with placebo among 40 randomized participants with MASLD in a 6-month, phase 2, randomized, double-blind clinical trial conducted at a single hospital in Boston, Massachusetts. [111]
In July 2024, two recent papers explore the metabolic effects of GLP-1 receptor agonists can be enhanced by combining them with other incretin hormones or molecules affecting complementary pathways. Two phase 2 trials reported by Loomba et al. and Sanyal et al. examined these enhanced treatments.[112][113] Tirzepatide, which combines a GLP-1 receptor agonist and a glucose-dependent insulinotropic polypeptide receptor agonist, has synergistic effects on appetite, food intake, and metabolic function.[113] Similarly, survodutide, a dual agonist of GLP-1 and glucagon receptors, promotes fat oxidation and reduces lipid synthesis in liver cells through its action on glucagon receptors.[112]
Surgery
[edit]
Bariatric surgery is an effective method for obese and diabetic individuals with MASLD to induce weight loss and reduce or resolve NASH inflammation, including fibrosis, and improve longevity.[13][14][16][49][114][115] For the AASLD, bariatric surgery can be considered only for NASH on a case-by-case basis by an experienced bariatric surgery program.[5] Indeed, some individuals might develop new or worsened features of MASLD.[115]
About 92% of people with MASLD saw an improvement in steatosis and 70% a complete resolution after bariatric surgery.[116]
A preoperative diet such as a low-calorie diet or a very-low-calorie diet is usually recommended to reduce liver volume by 16–20%. Preoperative weight loss is the only factor associated with postoperative weight loss.[117][118] Preoperative weight loss can reduce operative time and hospital stay,[117][119][120] although there is insufficient evidence whether preoperative weight loss reduces long-term morbidity or complications.[120][121] Weight loss and decreases in liver size may be independent of the amount of calorie restriction.[118]
The APWG on MASLD recommends bariatric surgery as a treatment option for those with class II obesity (BMI >32.5 kg/m2 for Asians, 35 kg/m2 for Caucasians). They consider its effects on improving liver-related complications as unproven yet, but it effectively increases longevity by improving cardiovascular factors.[14]
Surgery carries more risks for individuals with NASH cirrhosis, with a review estimating overall morbidity to be 21%. For people with MASLD who have undifferentiated cirrhosis, the APWG recommends an investigation to determine the cause of the cirrhosis as well as the person's liver function and whether they have portal hypertension.[14]
Screening
[edit]Cardiovascular system screening is considered mandatory by the EASL, as MASLD outcomes often result in cardiovascular complications,[16] which can manifest as subclinical atherosclerosis, the cause of the majority of MASLD-related deaths.[53][122] People with MASLD are at high risk for cardiovascular morbidity and mortality, and "aggressive modification of cardiovascular disease risk factors is warranted in all patients" according to AASLD.[5]
The AASLD further recommends for people with a cirrhotic NASH to be systematically screened for gastric and esophageal varices and liver cancer. They do not recommend routine liver biopsies and screening for liver cancer for non-cirrhotic people with NASH, but such screening sometimes occurs on a case-by-case basis.[5]
Also, people with MASLD may be considered for screening for hepatocellular carcinoma (liver cancer) and gastroesophageal varices. The NICE advises regular screening of NAFLD for advanced liver fibrosis every three years to adults and every two years for children using the enhanced liver fibrosis (ELF) blood test.[66] Follow-up is recommended for people with obesity and insulin resistance using the homeostasis model assessment of insulin resistance (HOMA-IR). People with NASH with fibrosis and hypertension merit closer monitoring as there is a higher risk of disease progression.[16]
Transplantation
[edit]MASLD is the second most common indication for liver transplantation in the US and Europe as of 2017.[14]
For people with NASH and end-stage liver disease, liver failure, or liver cancer, liver transplantation is an accepted procedure according to the EASL.[16] People with NASH cirrhosis NASH who are being considered for a liver transplant warrant systematic evaluation for cardiovascular diseases (whether the symptoms are apparent or not).[5]
The overall survival is comparable to transplantation following other diseases.[14][16] People with NASH cirrhosis who undergo liver transplantation are more likely to die post-transplant because of cardiovascular disease or chronic kidney disease. These people with NASH are often older and are thus more prone to these complications.[14] For these reasons and others, individuals with morbid obesity (BMI ≥ 40 kg/m2) and NASH with cirrhosis may be considered unfit for liver transplantation until they follow lifestyle modifications to reduce bodyweight.[14] Diabetic people with poor glycemic control are at similar risks, and optimal glycemic control is essential before attempting transplantation.[14]
The Asia Pacific Working Group guidelines recommend healthcare providers discuss lifestyle modifications before and after transplantation to reduce potential surgery risks and to assist with MASLD management after the transplant.[14]
Simultaneous bariatric surgery and liver transplantation were performed in exceptional circumstances.[14]
After transplantation, liver biopsy is the best method to monitor the evolution of post-transplant fibrosis, with significant fibrosis or portal hypertension one year after transplantation predicting rapid progression and graft loss and indicating the need for urgent intervention.[70]
Prognosis
[edit]The average progression rate from one stage of liver fibrosis to the next in humans with NASH is estimated to be seven years. The course of progression varies with different clinical manifestations among individuals.[25][27][123] Fibrosis in humans with MASH progressed more rapidly than in humans with MASLD.[13] Obesity predicts a worse long-term outcome than for lean individuals.[124][125] In the Asia-Pacific region, about 25% of MASLD cases progress to MASH under three years, but only a low proportion (3.7%) develop advanced liver fibrosis.[7] An international study showed that people with MASLD with advanced fibrosis had a 10-year survival rate of 81.5%.[5]
MASLD является фактором риска фиброза, гипертонии, хронической болезни почек, фибрилляции предсердий , инфаркта миокарда, ишемического инсульта и смерти от сердечно-сосудистых причин, что основано на доказательствах от очень низкого до низкого качества, полученных в обсервационных исследованиях. [66][126] Although MASLD can cause cirrhosis and liver failure and liver cancer, most deaths among people with NAFLD are attributable to cardiovascular disease.[53] Согласно метаанализу 34 000 человек с MASLD в течение семи лет, у этих людей на 65% повышен риск развития фатальных или несмертельных сердечно-сосудистых событий по сравнению с лицами без MASLD. [ 27 ]
MASLD и НАСГ повышают риск рака печени. Цирроз и рак печени, индуцированный НАЖБП, были второй причиной трансплантации печени в США в 2017 году. Рак печени развивается при НАСГ при отсутствии цирроза в 45% случаев, [ 127 ] а люди с НАСГ циррозом печени имеют повышенный риск развития рака печени. За период с 2002 по 2012 год в США заболеваемость раком печени, связанным с НАСГ, увеличилась в четыре раза, что больше, чем любая другая причина рака печени. MASLD представляет собой третий наиболее распространенный фактор риска рака печени. [ 128 ] Было обнаружено, что НАЖБП и НАСГ ухудшаются при циррозе печени у 2–3% и 15–20% людей соответственно в течение 10–20 лет. [ 13 ] Цирроз обнаруживают только примерно у 50% людей с MASLD и раком печени, поэтому рак печени и цирроз не всегда связаны между собой. [ 14 ]
MASLD является предшественником метаболического синдрома, хотя возможно двунаправленное влияние. [ 129 ] [ 130 ] [ 131 ] Наличие и стадия фиброза являются наиболее сильными прогностическими факторами для событий, связанных с печенью, и смертности, особенно для MASLD. [ 25 ]
Эпидемиология
[ редактировать ]
Заболеваемость MASLD быстро растет вместе с ожирением и диабетом и стала наиболее распространенной причиной заболеваний печени в развитых странах у взрослых, подростков и детей. [ 24 ] [ 25 ] Процент людей с MASLD колеблется от 9 до 36,9% в разных частях мира. [ 132 ] [ 133 ] Приблизительно 20% населения США и 25% населения Азиатско-Тихоокеанского региона страдают неалкогольной жировой болезнью печени. [ 7 ] [ 22 ] Аналогичную распространенность можно обнаружить и в Европе, хотя данных имеется меньше. [ 25 ] MASLD наиболее распространен на Ближнем Востоке (32%) и Южной Америке (30%), а в Африке самые низкие показатели (13%). [ 5 ] [ 25 ] По сравнению с 2000-ми годами в 2010-е годы в США НАФЛ и НАСГ увеличились соответственно в 2 и 2,5 раза. [ 134 ]
MASLD и НАСГ более распространены среди латиноамериканцев, что можно объяснить высоким уровнем ожирения и диабета 2 типа среди латиноамериканцев, промежуточным среди белых и самым низким среди чернокожих. [ 23 ] [ 25 ] [ 135 ] Было отмечено, что НАЖБП в два раза чаще встречается у мужчин, чем у женщин. [ 5 ] У людей с тяжелым ожирением распространенность MASLD возрастает более чем на 90%, у людей с диабетом - более чем на 60% и до 20% у людей с нормальным весом. [ 25 ] [ 26 ] MASLD присутствует у 65–90% людей, перенесших бариатрическую операцию, и до 75% из них имеют MASH. [ 14 ] Ультрасонография и исследования протонной ЯМР-спектроскопии показывают, что около 25% населения страдают от MASLD или MASH. [ 7 ] [ 25 ]
Хотя это заболевание обычно связано с ожирением, значительная часть заболевших имеют нормальный вес или худощавые. Бедный MASLD затрагивает от 10 до 20% американцев и европейцев и примерно 25% азиатов, хотя в некоторых странах заболеваемость выше (например, в Индии очень высока доля худого MASLD и почти нет ожирения MASLD). PNPLA3 может иметь значение для прогрессирования MASLD у худых людей. Таким образом, люди с MASLD заслуживают рассмотрения для лечения независимо от наличия или отсутствия ожирения. [ 7 ] [ 25 ] [ 49 ] [ 124 ]
У детей в возрасте от 1 до 19 лет распространенность составила примерно от 8% в общей популяции до 34% в исследованиях с данными клиник детского ожирения. [ 136 ]
Считается, что в большинстве случаев криптогенный цирроз печени обусловлен MASH. [ 7 ] Ожидается, что распространенность НАЖБП будет неуклонно расти. [ 137 ] с 25% в 2018 году до прогнозируемых 33,5% людей с MASLD во всем мире в 2030 году и с 20% до прогнозируемых 27% людей с MASLD перейдут в MASH. [ 138 ]
История
[ редактировать ]Первый подтвержденный случай неалкогольной жировой дистрофии печени, связанной с ожирением, наблюдался в 1952 году Сэмюэлем Зельманом. [ 139 ] [ 140 ] Зельман начал расследование после того, как заметил ожирение печени у сотрудника больницы, который выпивал более двадцати бутылок кока-колы в день. Затем он разработал исследование в течение полутора лет на 20 людях, страдающих ожирением, которые не были алкоголиками, и обнаружил, что около половины из них страдали ожирением печени. [ 139 ] Однако ожирение печени было связано с диабетом, по крайней мере, с 1784 года. [ 141 ] — наблюдение снова повторилось в 1930-х годах. [ 142 ] Исследования на экспериментальных животных выявили дефицит холина в 1920-х годах и чрезмерное потребление сахара в 1949 году. [ 143 ]
Название «неалкогольный стеатогепатит» (НАСГ) позднее было дано в 1980 году Юргеном Людвигом и его коллегами из клиники Майо. [ 144 ] повысить осведомленность о существовании этой патологии, поскольку ранее подобные сообщения были отвергнуты как «ложь пациентов». [ 140 ] В то время этот документ по большей части игнорировался, но в конечном итоге стал рассматриваться как знаковый документ, и, начиная с середины 1990-х годов, это состояние начало интенсивно изучаться, и с 1998 года по этой теме была проведена серия международных встреч. [ 145 ] Более широкий термин НАЖБП начал использоваться примерно в 2002 году. [ 145 ] [ 146 ] Начали разрабатываться диагностические критерии, и в 2005 году Комитет по патологии Сети клинических исследований NIH NASH предложил систему оценки NAS. [ 145 ]
Общество и культура
[ редактировать ]Политические рекомендации
[ редактировать ]EASL рекомендует органам общественного здравоохранения Европы «ограничить рекламу и маркетинг подслащенных сахаром напитков и промышленно обработанных пищевых продуктов с высоким содержанием насыщенных жиров, сахара и соли», а также «фискальные меры, препятствующие потреблению подслащенных сахаром напитков, и принять законодательство, препятствующее потреблению подслащенных сахаром напитков». обеспечить, чтобы пищевая промышленность улучшила маркировку и состав обработанных пищевых продуктов», а также «кампании по повышению осведомленности общественности о заболеваниях печени, подчеркивая, что они связаны не только с чрезмерным употреблением алкоголя». [ 137 ]
СМИ
[ редактировать ]Во Франции французский синдикат безалкогольных напитков Boissons Rafraîchissantes de France (в который входили такие производители безалкогольных напитков , как Coca-Cola France, Orangina, PepsiCo France) был обвинен французским журналом fr:Canard Enchainé в том, что он вводил потребителей в заблуждение с помощью сообщение на их веб-сайте под названием «Лучшее понимание патологии НАСГ», [ 147 ] объясняя, что «патологию НАСГ иногда называют содовой болезнью из-за языковых злоупотреблений или неудачного семантического сокращения, поскольку она не связана напрямую с употреблением безалкогольных напитков». Эта страница и другие страницы на том же веб-сайте, например страница под названием «Скажи нет дезинформации», с тех пор были удалены. [ 148 ]
Дети
[ редактировать ]О педиатрическом MASLD впервые сообщалось в 1983 году. [ 149 ] [ 150 ] Это наиболее распространенное хроническое заболевание печени среди детей и подростков, по крайней мере, с 2007 года, от которого в 2016 году в США пострадало от 10 до 20% из них. [ 25 ] [ 150 ] [ 151 ] MASLD связан с метаболическим синдромом , который представляет собой группу факторов риска, способствующих развитию сердечно-сосудистых заболеваний и сахарного диабета 2 типа. Исследования показали, что абдоминальное ожирение и резистентность к инсулину, в частности, вносят значительный вклад в развитие НАЖБП. [ 152 ] [ 153 ] [ 154 ] [ 155 ] [ 156 ] Сосуществующие заболевания печени, такие как гепатит С , и сердечно-сосудистые заболевания, такие как атеросклероз, также связаны с повышенным риском НАЖБП. [ 28 ] [ 53 ] Некоторым детям диагноз был поставлен уже в двухлетнем возрасте, средний возраст постановки диагноза - от 11 до 13 лет. [ 150 ] Средний возраст обычно превышает 10 лет, поскольку у детей также могут отмечаться неспецифические симптомы , и поэтому у них трудно диагностировать MASLD. [ 150 ]
У мальчиков чаще диагностируется MASLD, чем у девочек. [ 28 ] [ 136 ] Избыточный вес или даже увеличение веса в детстве и подростковом возрасте связано с повышенным риском MASLD в более позднем возрасте, при этом MASLD у взрослых прогнозируется в 31-летнем последующем исследовании по факторам риска в детстве, включая ИМТ, уровни инсулина в плазме, мужской пол. пол, генетический фон (варианты PNPLA3 и TM6SF2) и низкий вес при рождении — новый фактор риска MASLD во взрослом возрасте. [ 25 ] [ 28 ] В исследовании простой стеатоз присутствовал у 45% детей с клиническим подозрением на MASLD. [ 28 ] У детей с простым стеатозом прогноз хуже, чем у взрослых, при этом значительно чаще у них прогрессирует от НАЖБП к НАСГ по сравнению со взрослыми. Действительно, у 17-25% детей с MASLD развивается MASH в целом и до 83% у детей с тяжелым ожирением (по сравнению с 29% у взрослых), что также позволяет предположить, что фиброз печени, по-видимому, имеет более агрессивное клиническое течение у детей по сравнению с таковым у детей. взрослые. [ 150 ]
Ранняя диагностика MASLD у детей может помочь предотвратить развитие заболеваний печени во взрослом возрасте. [ 154 ] [ 157 ] Это сложно, поскольку у большинства детей с MASLD симптомы отсутствуют, и только у 42–59% наблюдаются боли в животе. [ 28 ] [ 157 ] Могут присутствовать и другие симптомы, такие как боль в правом подреберье или черный акантоз , последний из которых часто присутствует у детей с НАСГ. Увеличение печени встречается у 30–40% детей с НАЖБП. [ 28 ]
AASLD рекомендует диагностическую биопсию печени у детей, когда диагноз неясен или перед началом потенциально гепатотоксичной медикаментозной терапии. [ 5 ] EASL предлагает использовать тесты на фиброз, такие как эластография , визуализация акустического радиационного импульса и биомаркеры сыворотки, чтобы уменьшить количество биопсий. [ 16 ] В дальнейшем рекомендации NICE рекомендуют медицинским работникам предлагать детям регулярный MASLD-скрининг на прогрессирующий фиброз печени каждые два года с использованием анализа крови на усиленный фиброз печени (ELF). [ 66 ] Некоторые исследования также предлагают магнитно-резонансную эластографию как альтернативу менее надежному ультразвуковому исследованию. [ 28 ]
Интенсивные изменения образа жизни, включая физическую активность и изменения в питании, являются первой линией лечения согласно AASLD и EASL, поскольку они улучшают гистологию печени и уровень аминотрансфераз. Что касается фармакологического лечения, AASLD и EASL не рекомендуют метформин, но витамин Е может улучшить здоровье печени у некоторых детей. [ 5 ] [ 16 ] NICE рекомендует использовать витамин Е детям с прогрессирующим фиброзом печени, независимо от того, есть ли у них диабет или нет. [ 66 ] Единственное лечение, которое доказало свою эффективность при MASLD у детей, — это потеря веса. [ 158 ]
Некоторые данные указывают на то, что недостаточное или избыточное питание матери повышает восприимчивость ребенка к НАСГ и ускоряет его прогрессирование. [ 159 ]
Исследовать
[ редактировать ]Диагностика и биомаркеры
[ редактировать ]Поскольку диагноз MASLD, основанный на биопсии печени, является инвазивным и затрудняет оценку эпидемиологии, высоким приоритетом исследований является поиск точных, недорогих и неинвазивных методов диагностики и мониторинга заболевания MASLD и его прогрессирования. [ 34 ] [ 160 ] Поиск этих биомаркеров MASLD, НАФЛ и НАСГ включает липидомику , медицинскую визуализацию , протеомику , анализы крови и системы оценки. [ 34 ]
Согласно обзору, оценка фракции жира с помощью протонной плотности с помощью магнитно-резонансной томографии (MRI-PDFF) может считаться наиболее точным и даже золотым стандартным тестом для количественной оценки стеатоза печени. Они рекомендуют транзиентную эластографию на основе ультразвука для точной диагностики как фиброза, так и цирроза печени в рутинных клинических условиях, с большей объективностью, чем ультразвуковое исследование, но с меньшей точностью, чем магнитно-резонансная эластография; и уровни фрагмента плазменного цитокератина 18 (CK18) являются умеренно точным биомаркером стеатогепатита. [ 34 ] Однако транзиторная эластография может оказаться неудачной у людей с предпеченочной портальной гипертензией. [ 70 ]
Разработка лекарств
[ редактировать ]
различные лекарства с различным механизмом действия . В клинических испытаниях были протестированы [ 161 ] Клинические испытания можно разделить на четыре основные цели, которые, как полагают, замедляют прогрессирование заболевания или обращают его вспять: [ 162 ]
- Улучшение метаболизма (улучшение чувствительности к инсулину, ингибирование de novo липогенеза или усиление окисления жирных кислот ). [ 162 ] Метаболические модуляторы, протестированные при НАСГ, включают агонисты рецепторов глюкагоноподобного пептида-1 (агонисты GLP-1), GLP-1 и глюкозозависимый инсулинотропный полипептид (GIP) или глюкагона коагонисты и тиромиметики . Некоторые из этих препаратов могут лечить НАЖБП, значительно снижая массу тела. [ 163 ]
- Уменьшение воспаления, например, уменьшение окислительного стресса и гибели гепатоцитов. [ 162 ] Эти препараты, такие как антагонисты хемокинов , антиапоптотики , ингибиторы белка 1-й сосудистой адгезии и ингибиторы N-концевой киназы c-Jun , не показали положительного эффекта. [ 163 ]
- человека «Цели оси кишечник-печень», которые либо изменяют микробиом , либо воздействуют на желчные кислоты. [ 162 ]
- Антифиброзные препараты, [ 162 ] такие как аналоги фактора роста фибробластов , которые в большинстве случаев не достигли своих конечных результатов. [ 163 ]
Другие методы лечения, такие как фарнезоидного X-рецептора агонисты (FXR), агонисты рецептора, активирующего пролифератор пероксисом (PPAR), и ингибиторы ASK1 (киназы 1, регулирующей сигнал апоптоза), могут улучшить НАЖБП за счет нескольких механизмов одновременно. [ 163 ] К препаратам, находящимся в III фазе исследований с 2024 года, относятся тиромиметик ресметиром , ланифибранор (агонист пан-PPAR) и агонист GLP-1 семаглутид . [ 164 ]
Примечания
[ редактировать ]- ^ В 2023 году глобальная консенсусная группа, состоящая в основном из исследователей-гепатологов и врачей, рекомендовала изменить название стеатотического заболевания печени, связанного с метаболической дисфункцией ( MASLD ). [ 1 ] [ 10 ] [ 11 ] термин метаболическая (дисфункция), связанная с жировой болезнью печени ( МАЖБП ). Также использовался [ 2 ] Общий термин «стеатотическая болезнь печени» ( SLD ) охватывает MASLD, алкогольное заболевание печени (ALD) и MetALD, термин, обозначающий людей с MASLD, которые потребляют от 140 до 350 граммов алкоголя в неделю для женщин и от 210 до 420 граммов алкоголя в неделю. неделя для мужчин (промежуточный между MASLD и ALD). [ 1 ] [ 10 ]
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с д и ж г час я дж Ринелла М.Э., Лазарус Дж.В., Рациу В., Франк С.М., Саньял А.Дж., Канвал Ф. и др. (декабрь 2023 г.). «Заявление Delphi о новой номенклатуре жировых заболеваний печени», принятое межобщественным сообществом . Гепатология . 78 (6): 1966–1986. doi : 10.1097/HEP.0000000000000520 . ПМЦ 10653297 . ПМИД 37363821 . S2CID 259260747 .
- ^ Перейти обратно: а б Эслам М., Саньял А.Дж., Джордж Дж. (май 2020 г.). «MAFLD: предложенная на основе консенсуса номенклатура метаболически ассоциированной жировой болезни печени» . Гастроэнтерология . 158 (7): 1999–2014.e1. дои : 10.1053/j.gastro.2019.11.312 . ПМИД 32044314 .
- ^ Перейти обратно: а б с д и ж г час «DB92 Неалкогольная жировая болезнь печени» . ВОЗ . 18 июня 2018 года . Проверено 2 октября 2019 г.
- ^ Перейти обратно: а б с д и ж г час я «Неалкогольная жировая болезнь печени и НАСГ» . Национальный институт диабета, заболеваний органов пищеварения и почек . 7 ноября 2018 года . Проверено 2 апреля 2020 г.
- ^ Перейти обратно: а б с д и ж г час я дж к л м н тот п д р с т в v В х и С аа аб и объявление но из в ах есть также и Чаласани Н., Юносси З., Лавин Дж.Э., Чарльтон М., Куси К., Ринелла М. и др. (январь 2018 г.). «Диагностика и лечение неалкогольной жировой болезни печени: практическое руководство Американской ассоциации по изучению заболеваний печени» . Гепатология (Руководства Профессионального общества). 67 (1): 328–357. дои : 10.1002/hep.29367 . hdl : 1805/14037 . ПМИД 28714183 .
- ^ Дженсен Т., Абдельмалек М.Ф., Салливан С., Надо К.Дж., Грин М., Ронкал С. и др. (май 2018 г.). «Фруктоза и сахар: основные медиаторы неалкогольной жировой болезни печени» . Журнал гепатологии . 68 (5): 1063–1075. дои : 10.1016/j.jhep.2018.01.019 . ПМЦ 5893377 . ПМИД 29408694 .
- ^ Перейти обратно: а б с д и ж г час я дж к л м н тот п д р с т в Вонг В.В., Чан В.К., Читтури С., Чавла Й., Дэн Й.Ю., Дуседжа А. и др. (январь 2018 г.). «Руководство Азиатско-Тихоокеанской рабочей группы по неалкогольной жировой болезни печени, 2017 г. – Часть 1: Определение, факторы риска и оценка» . Журнал гастроэнтерологии и гепатологии (руководящие принципы профессионального общества). 33 (1): 70–85. дои : 10.1111/jgh.13857 . ПМИД 28670712 .
- ^ Перейти обратно: а б с д Изер Д., Райан М. (июль 2013 г.). «Жировая болезнь печени – практическое руководство для врачей общей практики». Австралийский семейный врач . 42 (7): 444–447. ПМИД 23826593 .
- ^ Дулай П.С., Сингх С., Патель Дж., Сони М., Прокоп Л.Дж., Юносси З. и др. (май 2017 г.). «Повышенный риск смертности на стадии фиброза при неалкогольной жировой болезни печени: систематический обзор и метаанализ» . Гепатология . 65 (5): 1557–1565. дои : 10.1002/hep.29085 . ПМЦ 5397356 . ПМИД 28130788 .
- ^ Перейти обратно: а б с д Смит Дж. (13 июля 2023 г.). «Заболевание печени получает новое название, критерии диагностики» . Медскейп . Проверено 5 июня 2024 г.
- ^ «Достижения в области MASLD/NAFLD – призыв к подаче рукописей» . Природно-коммуникационная медицина . 2023.
- ^ Перейти обратно: а б Лумба Р., Вонг Фольксваген (январь 2024 г.). «Последствия новой номенклатуры стеатотических заболеваний печени и определение стеатозных заболеваний печени, связанных с метаболической дисфункцией» . Алиментарная фармакология и терапия . 59 (2): 150–156. дои : 10.1111/кв.17846 . ПМЦ 10807722 . ПМИД 38153279 . S2CID 266561981 .
- ^ Перейти обратно: а б с д и ж г час я дж к л м н тот п д р Ринелла М.Э., Саньял А.Дж. (апрель 2016 г.). «Управление НАЖБП: поэтапный подход». Обзоры природы. Гастроэнтерология и гепатология . 13 (4): 196–205. дои : 10.1038/nrgastro.2016.3 . ПМИД 26907882 . S2CID 26643913 .
- ^ Перейти обратно: а б с д и ж г час я дж к л м н тот п д р с т в v В х Читтури С., Вонг В.В., Чан В.К., Вонг Г.Л., Вонг С.К., Соллано Дж. и др. (январь 2018 г.). «Руководство Азиатско-Тихоокеанской рабочей группы по неалкогольной жировой болезни печени, 2017 г. – Часть 2: Управление и специальные группы» . Журнал гастроэнтерологии и гепатологии (руководящие принципы профессионального общества). 33 (1): 86–98. дои : 10.1111/jgh.13856 . ПМИД 28692197 . S2CID 29648173 .
- ^ Перейти обратно: а б с Кеннелли С., Сьер Дж. Х., Мур Дж. Б. (1 июня 2017 г.). «Эффективность диетической и физической активности при неалкогольной жировой болезни печени: систематический обзор» . BMJ Открытая гастроэнтерология . 4 (1): e000139. doi : 10.1136/bmjgast-2017-000139 . ПМК 5508801 . ПМИД 28761689 .
- ^ Перейти обратно: а б с д и ж г час я дж к л м н тот п д р с т в v В х Европейская ассоциация по изучению печени (EASL), Европейская ассоциация по изучению диабета (EASD), Европейская ассоциация по изучению ожирения (EASO) (июнь 2016 г.). «Руководство по клинической практике EASL-EASD-EASO по лечению неалкогольной жировой болезни печени» . Журнал гепатологии (Руководства профессионального общества). 64 (6): 1388–1402. дои : 10.1016/j.jhep.2015.11.004 . ПМЦ 5644799 . ПМИД 27062661 .
- Разместить резюме в: Спар Л., Гуссенс Н. (25 января 2017 г.). «Неалкогольная стеатопатия» . Swiss Medical Review (на французском языке). дои : 10.53738/REVMED.2017.13.547.0215 .
- ^ Перейти обратно: а б Зачу М., Флевари П., Насири-Ансари Н., Варитимиадис С., Калаитзакис Е., Касси Е. и др. (1 января 2024 г.). «Роль антидиабетических препаратов при НАЖБП. Нашли ли мы Святой Грааль? Повествовательный обзор» . Европейский журнал клинической фармакологии . 80 (1): 127–150. дои : 10.1007/s00228-023-03586-1 . ISSN 1432-1041 . ПМЦ 10781828 . ПМИД 37938366 .
- ^ «Лечение НАЖБП и НАСГ – НИДДК» . Национальный институт диабета, заболеваний органов пищеварения и почек . Проверено 16 сентября 2023 г.
- ^ Канцелярия комиссара. «FDA одобрило первый метод лечения пациентов с рубцами в печени из-за жировой болезни печени» . FDA . Проверено 9 июня 2024 г.
- ^ Перейти обратно: а б с д и ж г час я дж к л м н тот п д р с Марджот Т., Мулла А., Кобболд Дж. Ф., Ходсон Л., Томлинсон Дж. В. (январь 2020 г.). «Неалкогольная жировая болезнь печени у взрослых: современные концепции этиологии, исходов и лечения» . Эндокринные обзоры . 41 (1): 66–117. дои : 10.1210/endrev/bnz009 . ПМИД 31629366 .
- ^ Перейти обратно: а б Юносси З.М., Кениг А.Б., Абделатиф Д., Фазель Ю., Генри Л., Ваймер М. (июль 2016 г.). «Глобальная эпидемиология неалкогольной жировой болезни печени. Метааналитическая оценка распространенности, заболеваемости и исходов» . Гепатология . 64 (1): 73–84. дои : 10.1002/hep.28431 . ПМИД 26707365 .
- ^ Перейти обратно: а б Ринелла М.Э. (июнь 2015 г.). «Неалкогольная жировая болезнь печени: систематический обзор». JAMA (Систематический обзор). 313 (22): 2263–2273. дои : 10.1001/jama.2015.5370 . hdl : 2318/1636665 . ПМИД 26057287 .
- ^ Перейти обратно: а б Рич Н.Э., Оджи С., Муфтий А.Р., Браунинг Дж.Д., Парих Н.Д., Одеволе М. и др. (февраль 2018 г.). «Расовые и этнические различия в распространенности, тяжести и результатах неалкогольной жировой болезни печени в Соединенных Штатах: систематический обзор и метаанализ» . Клиническая гастроэнтерология и гепатология . 16 (2): 198–210.е2. дои : 10.1016/j.cgh.2017.09.041 . ПМЦ 5794571 . ПМИД 28970148 .
- ^ Перейти обратно: а б с д «Эпидемия ожирения приводит к тому, что неалкогольная жировая болезнь печени (НАЖБП) становится самой распространенной причиной заболеваний печени в Европе» . EASL-Дом гепатологии . 25 сентября 2019 года. Архивировано из оригинала 5 октября 2019 года . Проверено 5 октября 2019 г.
- ^ Перейти обратно: а б с д и ж г час я дж к л м н тот п д р с т Юносси З., Ансти К.М., Мариетти М., Харди Т., Генри Л., Эслам М. и др. (январь 2018 г.). «Глобальное бремя НАЖБП и НАСГ: тенденции, прогнозы, факторы риска и профилактика». Обзоры природы. Гастроэнтерология и гепатология . 15 (1): 11–20. дои : 10.1038/nrgastro.2017.109 . hdl : 2318/1659230 . ПМИД 28930295 . S2CID 31345431 .
- ^ Перейти обратно: а б Юносси З.М. (март 2019 г.). «Неалкогольная жировая болезнь печени – глобальная перспектива общественного здравоохранения» . Журнал гепатологии . 70 (3): 531–544. дои : 10.1016/j.jhep.2018.10.033 . ПМИД 30414863 .
- ^ Перейти обратно: а б с д и ж Фридман С.Л., Нойшвандер-Тетри Б.А., Ринелла М., Саньял А.Дж. (июль 2018 г.). «Механизмы развития НАЖБП и стратегии лечения» . Природная медицина . 24 (7): 908–922. дои : 10.1038/s41591-018-0104-9 . ПМК 6553468 . ПМИД 29967350 .
- ^ Перейти обратно: а б с д и ж г час я дж Аль-Хатер С.А. (май 2015 г.). «Детская неалкогольная жировая болезнь печени: обзор». Обзоры ожирения . 16 (5): 393–405. дои : 10.1111/обр.12271 . ПМИД 25753407 . S2CID 39735609 .
- ^ Тилг Х., Мошен А.Р., Роден М. (январь 2017 г.). «НАЖБП и сахарный диабет». Обзоры природы. Гастроэнтерология и гепатология . 14 (1): 32–42. дои : 10.1038/nrgastro.2016.147 . ПМИД 27729660 . S2CID 22213841 .
- ^ Муссо Дж., Кассадер М., Оливетти С., Розина Ф., Карбоне Дж., Гамбино Р. (май 2013 г.). «Связь обструктивного апноэ во сне с наличием и тяжестью неалкогольной жировой болезни печени. Систематический обзор и метаанализ». Обзоры ожирения . 14 (5): 417–431. дои : 10.1111/обр.12020 . hdl : 2318/127880 . ПМИД 23387384 . S2CID 31153416 .
- ^ Сингх А., Хуссейн С., Энтони Б. (2021). «Неалкогольная жировая болезнь печени и клинические исходы у пациентов с COVID-19: комплексный систематический обзор и метаанализ» . Диабет и метаболический синдром . 15 (3): 813–822. дои : 10.1016/j.dsx.2021.03.019 . ПМК 8011308 . ПМИД 33862417 .
- ^ Баллестри С., Насимбени Ф., Балделли Е., Марраццо А., Романьоли Д., Лонардо А. (июнь 2017 г.). «НАЖБП как половое диморфное заболевание: роль пола и репродуктивного статуса в развитии и прогрессировании неалкогольной жировой болезни печени и неотъемлемого сердечно-сосудистого риска» . Достижения в терапии . 34 (6): 1291–1326. дои : 10.1007/s12325-017-0556-1 . ПМЦ 5487879 . ПМИД 28526997 .
- ^ Козлитина Дж., Смагрис Е., Стендер С., Нордестгаард Б.Г., Чжоу Х.Х., Тибьёрг-Хансен А. и др. (апрель 2014 г.). «Экзомное исследование ассоциации идентифицирует вариант TM6SF2, который придает предрасположенность к неалкогольной жировой болезни печени» . Природная генетика . 46 (4): 352–356. дои : 10.1038/ng.2901 . ПМЦ 3969786 .
- ^ Перейти обратно: а б с д и ж Вонг В.В., Адамс Л.А., де Лединген В., Вонг Г.Л., Сукоян С. (август 2018 г.). «Неинвазивные биомаркеры при НАЖБП и НАСГ – текущий прогресс и перспективы на будущее». Обзоры природы. Гастроэнтерология и гепатология . 15 (8): 461–478. дои : 10.1038/s41575-018-0014-9 . hdl : 11336/86757 . ПМИД 29844588 . S2CID 44102990 .
- ^ Перейти обратно: а б Лим Дж.С., Миетус-Снайдер М., Валенте А., Шварц Дж.М., Люстиг Р.Х. (май 2010 г.). «Роль фруктозы в патогенезе НАЖБП и метаболического синдрома». Обзоры природы. Гастроэнтерология и гепатология . 7 (5): 251–264. дои : 10.1038/nrgastro.2010.41 . ПМИД 20368739 . S2CID 2483983 .
- ^ Ври А., Бродерик Л., Кэнбэй А., Хоффман Х.М., Фельдштейн А.Е. (ноябрь 2013 г.). «От НАЖБП до НАСГ и до цирроза печени - новое понимание механизмов заболевания». Обзоры природы. Гастроэнтерология и гепатология . 10 (11): 627–636. дои : 10.1038/nrgastro.2013.149 . ПМИД 23958599 . S2CID 6899033 .
- ^ Леермейкерс Э.Т., Морейра Э.М., Кифте-де Йонг Дж.К., Дарвиш С.К., Виссер Т., Воортман Т. и др. (август 2015 г.). «Влияние холина на здоровье на протяжении всей жизни: систематический обзор» . Обзоры питания . 73 (8): 500–522. дои : 10.1093/nutrit/nuv010 . ПМИД 26108618 .
- ^ Ли Х., Чжэн Х., Сабина Р., Амриш Т., Мэн Г., Чжан К. и др. (июль 2023 г.). «Потребление субпродуктов и риск неалкогольной жировой болезни печени: когортное исследование Тяньцзиньского хронического системного воспаления низкой степени тяжести и здоровья» . Британский журнал питания . 130 (2): 276–283. дои : 10.1017/S0007114522000629 . ПМИД 35225189 .
- ^ Иванцовский-Вайцман Д., Флисс-Исаков Н., Гриншпан Л.С., Саломоне Ф., Лазарус Дж.В., Уэбб М. и др. (август 2022 г.). «Высокое потребление мяса потенциально связано с риском развития неалкогольной жировой болезни печени и предполагаемого значительного фиброза» . Питательные вещества . 14 (17): 3533. дои : 10.3390/nu14173533 . ПМЦ 9459934 . ПМИД 36079791 .
- ^ Хашемян М., Мерат С., Пустчи Х., Джафари Э., Радмард А.Р., Камангар Ф. и др. (август 2021 г.). «Потребление красного мяса и риск неалкогольной жировой болезни печени у населения с низким потреблением мяса: когортное исследование Голестана» . Американский журнал гастроэнтерологии . 116 (8): 1667–1675. дои : 10.14309/ajg.0000000000001229 . ПМЦ 8460710 . ПМИД 33767101 .
- ^ Мохтари З., Пустчи Х., Эслампараст Т., Хекматдуст А. (апрель 2017 г.). «Потребление яиц и риск неалкогольной жировой болезни печени» . Всемирный журнал гепатологии . 9 (10): 503–509. дои : 10.4254/wjh.v9.i10.503 . ПМК 5387362 . ПМИД 28443155 .
- ^ Чжан С., Мэн Г., Чжан Ц., Лю Л., Яо З., Ву Х. и др. (сентябрь 2021 г.). «Потребление консервированных яиц связано с умеренно повышенным риском неалкогольной жировой болезни печени у взрослых китайцев» . Журнал питания . 151 (9): 2741–2748. дои : 10.1093/jn/nxab163 . ПМИД 34049388 .
- ^ Чжан С., Фу Дж., Чжан К., Лю Л., Мэн Г., Яо З. и др. (сентябрь 2019 г.). «Связь между потреблением орехов и неалкогольной жировой болезнью печени у взрослых». Печень Интернационал . 39 (9): 1732–1741. дои : 10.1111/liv.14164 . ПМИД 31162803 . S2CID 174806063 .
- ^ Бахрами А., Теймури Ф., Эслампараст Т., Сохраб Г., Хиджази Э., Пустчи Х. и др. (февраль 2019 г.). «Потребление бобовых и риск неалкогольной жировой болезни печени». Индийский журнал гастроэнтерологии . 38 (1): 55–60. дои : 10.1007/s12664-019-00937-8 . ПМИД 30796701 . S2CID 73509821 .
- ^ Ли Х, Пэн З, Ли М, Цзэн Икс, Ли Х, Чжу Ю и др. (октябрь 2022 г.). «Здоровая растительная диета связана с меньшим риском развития неалкогольной жировой болезни печени» . Питательные вещества . 14 (19): 4099. дои : 10.3390/nu14194099 . ПМЦ 9572274 . ПМИД 36235752 .
- ^ Мазиди М., Кенгне А.П. (август 2019 г.). «Более строгое соблюдение растительной диеты связано с меньшей вероятностью ожирения печени». Клиническое питание . 38 (4): 1672–1677. дои : 10.1016/j.clnu.2018.08.010 . ПМИД 30578029 . S2CID 58667804 .
- ^ Танне Ф., Ганьяду Ф., Шазуйлер О., Флери Б., Вендум Д., Ласнье Э. и др. (июнь 2005 г.). «Хроническое повреждение печени при обструктивном апноэ во сне» . Гепатология . 41 (6): 1290–1296. дои : 10.1002/hep.20725 . ПМИД 15915459 .
- ^ Ван Х., Гао Ц., Хэ С., Бао Ю., Сунь Х., Мэн Л. и др. (июнь 2020 г.). «Храп, о котором сообщают сами люди, связан с неалкогольной жировой болезнью печени» . Научные отчеты . 10 (1): 9267. Бибкод : 2020NatSR..10.9267W . дои : 10.1038/s41598-020-66208-1 . ПМЦ 7283303 . ПМИД 32518245 .
- ^ Перейти обратно: а б с д и ж г Маркезини Дж., Петта С., Далле Грейв Р. (июнь 2016 г.). «Диета, потеря веса и здоровье печени при неалкогольной жировой болезни печени: патофизиология, данные и практика». Гепатология . 63 (6): 2032–2043. дои : 10.1002/hep.28392 . hdl : 10447/159316 . ПМИД 26663351 . S2CID 19914572 .
- ^ Хан Р.С., Ньюсом П.Н. (февраль 2018 г.). «НАЖБП в 2017 году: новое понимание механизмов прогрессирования заболевания». Обзоры природы. Гастроэнтерология и гепатология . 15 (2): 71–72. дои : 10.1038/nrgastro.2017.181 . ПМИД 29300050 . S2CID 10248663 .
- ^ Лофт А., Альфаро А.Дж., Шмидт С.Ф., Педерсен Ф.Б., Теркельсен М.К., Апулия М. и др. (2021). «Транскрипционные сети, активируемые фиброзом печени, управляют перепрограммированием гепатоцитов и внутрипеченочной коммуникацией» . Клеточные метаб . 33 (8): 1685–1700.e9. doi : 10.1016/j.cmet.2021.06.005 . ПМИД 34237252 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Делла Пепа Дж., Ветрани С., Ломбарди Дж., Бозцетто Л., Аннуцци Дж., Ривеллезе А.А. (сентябрь 2017 г.). «Изокалорические диетические изменения и неалкогольная жировая болезнь печени у лиц с высоким кардиометаболическим риском» . Питательные вещества . 9 (10): 1065. дои : 10.3390/nu9101065 . ПМЦ 5691682 . ПМИД 28954437 .
- ^ Перейти обратно: а б с д Бирн К.Д., Таргер Дж. (апрель 2015 г.). «НАЖБП: мультисистемное заболевание» . Журнал гепатологии . 62 (1 дополнение): S47–S64. дои : 10.1016/j.jhep.2014.12.012 . ПМИД 25920090 .
- ^ Чжан X, Цзи X, Ван Q, Ли JZ (февраль 2018 г.). «Новое понимание межорганных перекрестных помех, способствующих патогенезу неалкогольной жировой болезни печени (НАЖБП)» . Белок и клетка . 9 (2): 164–177. дои : 10.1007/s13238-017-0436-0 . ПМЦ 5818366 . ПМИД 28643267 .
- ^ Перейти обратно: а б Багерния М., Нобили В., Блессо К.Н., Сахебкар А. (апрель 2018 г.). «Лекарственные растения и биологически активные природные соединения в лечении неалкогольной жировой болезни печени: клинический обзор». Фармакологические исследования . 130 : 213–240. дои : 10.1016/J.phrs.2017.12.020 . ПМИД 29287685 . S2CID 207369426 .
- ^ Перейти обратно: а б с Палмер А.К., Густафсон Б., Киркланд Дж.Л., Смит Ю. (октябрь 2019 г.). «Клеточное старение: связь между старением и диабетом» . Диабетология . 62 (10): 1835–1841. дои : 10.1007/s00125-019-4934-x . ПМК 6731336 . ПМИД 31451866 .
- ^ Вакка М., Лесли Дж., Вирчу С., Лам Б.И., Говер О., Тиниакос Д. и др. (июнь 2020 г.). «Костный морфогенетический белок 8В способствует прогрессированию неалкогольного стеатогепатита» . Природный метаболизм . 2 (6): 514–531. дои : 10.1038/s42255-020-0214-9 . hdl : 10044/1/82228 . ПМИД 32694734 . S2CID 219933429 .
- ^ Люстиг Р.Х. (сентябрь 2010 г.). «Фруктоза: метаболические, гедонистические и социальные параллели с этанолом». Журнал Американской диетической ассоциации . 110 (9): 1307–1321. дои : 10.1016/j.jada.2010.06.008 . ПМИД 20800122 .
- ^ Токухара Д. (25 июня 2021 г.). «Роль кишечной микробиоты в регуляции неалкогольной жировой болезни печени у детей и подростков» . Границы в питании . 8 : 700058. doi : 10.3389/fnut.2021.700058 . ПМЦ 8267179 . PMID 34250000 .
- ^ Перейти обратно: а б с Люнг С., Ривера Л., Фернесс Дж.Б., Ангус П.В. (июль 2016 г.). «Роль кишечной микробиоты при НАЖБП». Обзоры природы. Гастроэнтерология и гепатология . 13 (7): 412–425. дои : 10.1038/nrgastro.2016.85 . ПМИД 27273168 . S2CID 24114749 .
- ^ Мехал В.З. (ноябрь 2013 г.). «Гордиев узел дисбактериоза, ожирения и НАЖБП». Обзоры природы. Гастроэнтерология и гепатология . 10 (11): 637–644. дои : 10.1038/nrgastro.2013.146 . ПМИД 23958600 . S2CID 20972307 .
- ^ Шарптон С.Р., Аджмера В., Лумба Р. (январь 2019 г.). «Новая роль кишечного микробиома при неалкогольной жировой болезни печени: от состава к функции» . Клиническая гастроэнтерология и гепатология . 17 (2): 296–306. дои : 10.1016/j.cgh.2018.08.065 . ПМК 6314895 . ПМИД 30196156 .
- ^ Пикетт-Блейкли О, Янг К., Карр Р.М. (2018). «Микронутриенты в патогенезе неалкогольной жировой болезни печени» . Клеточная и молекулярная гастроэнтерология и гепатология . 6 (4): 451–462. дои : 10.1016/j.jcmgh.2018.07.004 . ПМК 6170520 . ПМИД 30294653 .
- ^ Панасевич М.Р., Пепплер В.Т., Оертер Д.Б., Райт Д.К., ректор Р.С. (август 2017 г.). «Микробиом и НАЖБП: потенциальное влияние аэробной подготовки и модификации образа жизни» . Физиологическая геномика . 49 (8): 385–399. doi : 10.1152/физиологгеномика.00012.2017 . ПМИД 28600319 .
- ^ Перейти обратно: а б Хейман М.Л., Гринуэй, Флорида (май 2016 г.). «Здоровый желудочно-кишечный микробиом зависит от разнообразия питания» . Молекулярный метаболизм (обзор). 5 (5): 317–320. doi : 10.1016/j.molmet.2016.02.005 . ПМЦ 4837298 . ПМИД 27110483 .
Стабильные, разнообразные и здоровые микробные экосистемы желудочно-кишечного тракта являются важным компонентом, который следует учитывать при использовании диеты для нарушения физиологических систем в моделях заболеваний на животных, и этот аспект часто упускают из виду. Распространенной моделью изучения ожирения и резистентности к инсулину является модель, в которой диета переключается с основной диеты на «западную» или «высокожировую» диету с преобладанием жиров и сахара.
- ^ Перейти обратно: а б с д и ж г час я дж к л м н тот п д р «NG49: Неалкогольная жировая болезнь печени (НАЖБП): оценка и лечение | Руководство и рекомендации» . ХОРОШИЙ. Июль 2016. Глен Дж., Флорос Л., День C, Прайк Р. (сентябрь 2016 г.). «Неалкогольная жировая болезнь печени (НАЖБП): краткое изложение рекомендаций NICE». BMJ (Национальные рекомендации). 354 : i4428. дои : 10.1136/bmj.i4428 . ПМИД 27605111 . S2CID 32302328 .
- ^ Тошикуни Н., Цуцуми М., Арисава Т. (июль 2014 г.). «Клинические различия между алкогольной болезнью печени и неалкогольной жировой болезнью печени» . Всемирный журнал гастроэнтерологии . 20 (26): 8393–8406. дои : 10.3748/wjg.v20.i26.8393 . ПМК 4093692 . ПМИД 25024597 .
- ^ Лиангпунсакул С., Чаласани Н. (октябрь 2003 г.). «Является ли гипотиреоз фактором риска неалкогольного стеатогепатита?». Журнал клинической гастроэнтерологии . 37 (4): 340–343. дои : 10.1097/00004836-200310000-00014 . ПМИД 14506393 . S2CID 41849572 .
- ^ Муссо Дж., Гамбино Р., Кассадер М., Пагано Дж. (декабрь 2011 г.). «Метаанализ: естественное течение неалкогольной жировой болезни печени (НАЖБП) и диагностическая точность неинвазивных тестов тяжести заболевания печени». Анналы медицины . 43 (8): 617–649. дои : 10.3109/07853890.2010.518623 . ПМИД 21039302 . S2CID 207470810 .
- ^ Перейти обратно: а б с д и ж г час я дж к Шиха Г., Ибрагим А., Хелми А., Сарин С.К., Омата М., Кумар А. и др. (январь 2017 г.). «Консенсусные рекомендации Азиатско-Тихоокеанской ассоциации по изучению печени (APASL) по инвазивной и неинвазивной оценке фиброза печени: обновление 2016 года» . Hepatology International (Руководство профессионального общества). 11 (1): 1–30. дои : 10.1007/s12072-016-9760-3 . ПМИД 27714681 .
- ^ Пелег Н., Иссахар А., Снех-Арбиб О., Шломай А. (октябрь 2017 г.). «Индекс отношения АСТ к тромбоцитам и калькулятор показателей фиброза 4 для неинвазивной оценки фиброза печени у пациентов с неалкогольной жировой болезнью печени». Болезни пищеварения и печени . 49 (10): 1133–1138. дои : 10.1016/j.dld.2017.05.002 . ПМИД 28572039 .
- ^ Пелег Н., Снех Арбиб О., Иссахар А., Коэн-Нафтали М., Браун М., Шломай А. (2018). Веспасиани-Джентилуччи У (ред.). «Неинвазивные системы оценки позволяют прогнозировать рак печени и внепеченочный рак у пациентов с неалкогольной жировой болезнью печени» . ПЛОС ОДИН . 13 (8): e0202393. Бибкод : 2018PLoSO..1302393P . дои : 10.1371/journal.pone.0202393 . ПМК 6091950 . ПМИД 30106985 .
- ^ Вилгрейн В., Ронот М., Абдель-Рехим М., Заппа М., д'Ассиньи Г., Бруно О. и др. (2012). «Стеатоз печени: главная ловушка при визуализации печени» . Диагностическая и интервенционная визуализация (учебное пособие). 94 (7–8): 713–727. дои : 10.1016/j.diii.2013.03.010 . ПМИД 23751229 .
- ^ Папахристодулу А, Каввадас Д, Карамицос А, Папамицу Т, Хацидимитриу М, Сиога А (июнь 2021 г.). «Диагностика и стадирование детской неалкогольной жировой болезни печени: является ли классическое ультразвуковое исследование ответом?» . Педиатрические отчеты . 13 (2): 312–321. doi : 10.3390/pediatric13020039 . ПМЦ 8293345 . ПМИД 34201230 .
- ^ Сингх С., Венкатеш С.К., Лумба Р., Ван З., Сирлин С., Чен Дж. и др. (май 2016 г.). «Магнитно-резонансная эластография для определения стадии фиброза печени при неалкогольной жировой болезни печени: систематический обзор диагностической точности и объединенный анализ данных отдельных участников» . Европейская радиология (Систематический обзор). 26 (5): 1431–1440. дои : 10.1007/s00330-015-3949-z . ПМК 5051267 . ПМИД 26314479 .
- ^ Шриниваса Бабу А., Уэллс М.Л., Тейтелбойм О.М., Макки Дж.Е., Миллер Ф.Х., Йе Б.М. и др. (2015). «Эластография при хронических заболеваниях печени: методы, методы, ограничения и будущие направления» . Рентгенография (обзор). 36 (7): 1987–2006. дои : 10.1148/rg.2016160042 . ПМЦ 5584553 . ПМИД 27689833 .
- ^ Брант Э.М., Кляйнер Д.Е., Карпентер Д.Х., Ринелла М., Харрисон С.А., Лумба Р. и др. (май 2021 г.). «НАЖБП: сообщение о гистологических результатах в клинической практике» . Гепатология . 73 (5): 2028–2038. дои : 10.1002/hep.31599 . ПМИД 33111374 . S2CID 233449144 .
- ^ Перейти обратно: а б с Гарви В.Т., Механик Дж.И., Бретт Э.М., Гарбер А.Дж., Херли Д.Л., Ястребофф А.М. и др. (июль 2016 г.). «Комплексные клинические рекомендации Американской ассоциации клинических эндокринологов и Американского колледжа эндокринологии по медицинской помощи пациентам с ожирением» . Эндокринная практика (Руководства Профессионального общества). 22 (Приложение 3): 1–203. дои : 10.4158/EP161365.GL . ПМИД 27219496 .
- ^ Лонардо А., Наскимбени Ф., Таргер Г., Бернарди М., Бонино Ф., Бугианеси Е. и др. (май 2017 г.). «Документ по позиции AISF по неалкогольной жировой болезни печени (НАЖБП): обновления и будущие направления». Заболевания органов пищеварения и печени (руководства профессионального общества). 49 (5): 471–483. дои : 10.1016/j.dld.2017.01.147 . hdl : 2318/1636507 . ПМИД 28215516 .
- ^ Перейти обратно: а б Кутукидис Д.А., Эстбери Н.М., Тюдор К.Е., Моррис Э., Генри Дж.А., Норейк М. и др. (сентябрь 2019 г.). «Связь мер по снижению веса с изменениями биомаркеров неалкогольной жировой болезни печени: систематический обзор и метаанализ» . JAMA Внутренняя медицина . 179 (9): 1262–1271. doi : 10.1001/jamainternmed.2019.2248 . ПМК 6604126 . ПМИД 31260026 .
- ^ Пэрис Т., Джордж Э.С., Робертс С.К., Тирни А.С. (август 2017 г.). «Влияние диеты и образа жизни на резистентность к инсулину у пациентов с неалкогольной жировой болезнью печени: систематический обзор». Европейский журнал гастроэнтерологии и гепатологии . 29 (8): 867–878. doi : 10.1097/MEG.0000000000000890 . ПМИД 28471823 . S2CID 13768180 .
- ^ Перейти обратно: а б с Ромеро-Гомес М., Зельбер-Саги С., Тренелл М. (октябрь 2017 г.). «Лечение НАЖБП с помощью диеты, физической активности и физических упражнений» . Журнал гепатологии . 67 (4): 829–846. дои : 10.1016/j.jhep.2017.05.016 . ПМИД 28545937 .
- ^ Буззетти Э., Линден А., Бест Л.М., Мэдден А.М., Робертс Д., Чейз Т.Дж. и др. (июнь 2021 г.). «Модификации образа жизни при жировой болезни печени, не связанной с алкоголем: сетевой метаанализ» . Кокрановская база данных систематических обзоров . 2021 (6): CD013156. дои : 10.1002/14651858.cd013156.pub2 . ПМЦ 8193812 . ПМИД 34114650 .
- ^ Комолафе О., Буззетти Э., Линден А., Бест Л.М., Мэдден А.М., Робертс Д. и др. (июль 2021 г.). «Пищевые добавки при неалкогольной жировой болезни печени: сетевой метаанализ» . Кокрановская база данных систематических обзоров . 2021 (7): CD013157. дои : 10.1002/14651858.cd013157.pub2 . ПМЦ 8406904 . ПМИД 34280304 .
- ^ Русу Э., Эначе Г., Джинга М., Драгут Р., Нан Р., Попеску Х. и др. (2014). «Лечебная диетотерапия при неалкогольной жировой болезни печени – обзор литературы» . Журнал медицины и жизни . 8 (3): 258–262. ПМК 4556902 . ПМИД 26351523 .
- ^ Сюй CC, Несс Э, Каудли К.В. (март 2017 г.). «Подходы к питанию для снижения веса при неалкогольной жировой болезни печени» . Достижения в области питания . 8 (2): 253–265. дои : 10.3945/ан.116.013730 . ПМК 5347099 . ПМИД 28298270 .
- ^ Зельбер-Саги С., Саломоне Ф., Млынарский Л. (июль 2017 г.). «Средиземноморская диета как диета выбора при неалкогольной жировой болезни печени: доказательства и вероятные механизмы» . Печень Интернационал . 37 (7): 936–949. дои : 10.1111/liv.13435 . ПМИД 28371239 .
- ^ Торговец HA (сентябрь 2017 г.). «Может ли диета помочь людям, не страдающим ожирением, с неалкогольной жировой болезнью печени (НАЖБП)?» . Журнал клинической медицины . 6 (9): 88. дои : 10,3390/jcm6090088 . ПМЦ 5615281 . ПМИД 28925934 .
- ^ Вина Дж., Мурагундла А., Сидгидди С., Субраманиам С. (декабрь 2014 г.). «Неалкогольная жировая болезнь печени: необходимость сбалансированного источника питания» . Британский журнал питания . 112 (11): 1858–1872. дои : 10.1017/S0007114514002591 . ПМИД 25274101 .
- ^ Томик Д., Кемп В.В., Робертс С.К. (октябрь 2018 г.). «Неалкогольная жировая болезнь печени: современные концепции, эпидемиология и стратегии лечения». Европейский журнал гастроэнтерологии и гепатологии . 30 (10): 1103–1115. дои : 10.1097/MEG.0000000000001235 . ПМИД 30113367 . S2CID 52010921 .
- ^ Виджарнприча К., Тонгпраюн К., Унгпрасерт П. (февраль 2017 г.). «Потребление кофе и риск неалкогольной жировой болезни печени: систематический обзор и метаанализ». Европейский журнал гастроэнтерологии и гепатологии . 29 (2): e8–e12. дои : 10.1097/MEG.0000000000000776 . ПМИД 27824642 . S2CID 23243292 .
- ^ Чжун С., Фань Ю, Ян Ц, Фань Х, Ву Б, Хан Ю и др. (декабрь 2017 г.). «Терапевтический эффект силимарина при лечении неалкогольной жировой болезни: метаанализ (PRISMA) рандомизированных контрольных исследований» . Лекарство . 96 (49): е9061. дои : 10.1097/MD.0000000000009061 . ПМЦ 5728929 . ПМИД 29245314 .
- ^ Джалали М., Махмуди М., Мосалланежад З., Джалали Р., Имание М.Х., Мусавиан С.П. (январь 2020 г.). «Влияние добавок куркумина на функцию печени, метаболический профиль и состав тела у пациентов с неалкогольной жировой болезнью печени: систематический обзор и метаанализ рандомизированных контролируемых исследований» . Дополнительные методы лечения в медицине . 48 : 102283. doi : 10.1016/j.ctim.2019.102283 . ПМИД 31987259 .
- ^ Шарптон С.Р., Марай Б., Хардинг-Теобальд Э., Виттингхофф Э., Терро Н.А. (июль 2019 г.). «Терапия, нацеленная на кишечный микробиом, при неалкогольной жировой болезни печени: систематический обзор, метаанализ и метарегрессия» . Американский журнал клинического питания . 110 (1): 139–149. дои : 10.1093/ajcn/nqz042 . ПМК 6599739 . ПМИД 31124558 .
- ^ Хади А., Мохаммади Х., Мирагаджани М., Гаеди Э. (2019). «Эффективность приема синбиотиков у пациентов с неалкогольной жировой болезнью печени: систематический обзор и метаанализ клинических исследований: прием синбиотиков и НАЖБП». Критические обзоры в области пищевой науки и питания . 59 (15): 2494–2505. дои : 10.1080/10408398.2018.1458021 . ПМИД 29584449 . S2CID 5006292 .
- ^ Министерство здравоохранения и социальных служб США. (2017). «Руководство по питанию для американцев на 2015–2020 годы — health.gov» . Health.gov.ua . Скайхорс Паблишинг Инк . Проверено 30 сентября 2019 г.
- ^ Арнетт Д.К., Блюменталь Р.С., Альберт М.А., Бурокер А.Б., Гольдбергер З.Д., Хан Э.Дж. и др. (сентябрь 2019 г.). «Руководство ACC/AHA по первичной профилактике сердечно-сосудистых заболеваний, 2019 г.: отчет Целевой группы Американского колледжа кардиологов/Американской кардиологической ассоциации по рекомендациям по клинической практике» . Тираж . 140 (11): e596–e646. doi : 10.1161/CIR.0000000000000678 . ПМЦ 7734661 . ПМИД 30879355 .
- ^ Дженсен М.Д., Райан Д.Х., Аповиан К.М., Ард Дж.Д., Комуззи А.Г., Донато К.А. и др. (июнь 2014 г.). «Руководство AHA/ACC/TOS 2013 года по лечению избыточного веса и ожирения у взрослых: отчет Целевой группы Американского колледжа кардиологов/Американской кардиологической ассоциации по практическим рекомендациям и Общества по борьбе с ожирением» . Тираж . 129 (25 Приложение 2): S102–S138. doi : 10.1161/01.cir.0000437739.71477.ee . ПМЦ 5819889 . ПМИД 24222017 .
- ^ Хашида Р., Кавагути Т., Бекки М., Омото М., Мацусе Х., Наго Т. и др. (январь 2017 г.). «Аэробные упражнения против упражнений с отягощениями при неалкогольной жировой болезни печени: систематический обзор». Журнал гепатологии . 66 (1): 142–152. дои : 10.1016/j.jhep.2016.08.023 . ПМИД 27639843 .
- ^ Рациу В (январь 2017 г.). «Нефармакологические вмешательства у больных неалкогольной жировой болезнью печени» . Печень Интернационал . 37 (Приложение 1): 90–96. дои : 10.1111/liv.13311 . ПМИД 28052636 .
- ^ Рациу В., Гудман З., Саньял А. (апрель 2015 г.). «Современные усилия и тенденции в лечении НАСГ» . Журнал гепатологии . 62 (1 доп.): S65–S75. дои : 10.1016/j.jhep.2015.02.041 . ПМИД 25920092 .
- ^ Разиэль А., Сакран Н., Сольд А., Гойтейн Д. (апрель 2015 г.). «Современные решения проблем печени, связанных с ожирением: неалкогольная жировая болезнь печени и неалкогольный стеатогепатит» (PDF) . Журнал Израильской медицинской ассоциации . 17 (4): 234–238. ПМИД 26040050 .
- ^ «Для лучшего ухода: лекарства, которых следует избегать – обновление 2018 года» . www.prescrire.org . Прописать. 25 января 2018 г.
- ^ Гу Ю, Сунь Л, Хэ Ю, Ян Л, Дэн С, Чжоу Р и др. (март 2023 г.). «Сравнительная эффективность агонистов рецептора глюкагоноподобного пептида 1 (GLP-1), пиоглитазона и витамина Е для гистологии печени у пациентов с неалкогольной жировой болезнью печени: систематический обзор и пилотный сетевой метаанализ рандомизированных контролируемых исследований». Экспертный обзор гастроэнтерологии и гепатологии . 17 (3): 273–282. дои : 10.1080/17474124.2023.2172397 . ПМИД 36689199 . S2CID 256102760 .
- ^ Лумба Р., Хартман М.Л., Ловитц Э.Дж., Вуппаланчи Р., Бурсье Дж., Бугианеси Е. и др. (8 июня 2024 г.). «Тирзепатид при стеатогепатите, связанном с метаболической дисфункцией, с фиброзом печени» . Медицинский журнал Новой Англии . дои : 10.1056/NEJMoa2401943 . ISSN 0028-4793 . ПМИД 38856224 .
- ^ Саньял А.Дж., Бедосса П., Фрассдорф М., Нефф Г.В., Ловитц Э., Бугианеси Е. и др. (7 июня 2024 г.). «Рандомизированное исследование фазы 2 сурводутида при MASH и фиброзе» . Медицинский журнал Новой Англии . дои : 10.1056/NEJMoa2401755 . ISSN 0028-4793 . ПМИД 38847460 .
- ^ Чаласани Н., Юносси З., Лавин Дж.Э., Диль А.М., Брант Э.М., Куси К. и др. (июнь 2012 г.). «Диагностика и лечение неалкогольной жировой болезни печени: практическое руководство Американской гастроэнтерологической ассоциации, Американской ассоциации по изучению заболеваний печени и Американского колледжа гастроэнтерологии» . Гастроэнтерология . 142 (7): 1592–1609. дои : 10.1053/j.gastro.2012.04.001 . ПМИД 22656328 .
- ^ Паркер Х.М., Джонсон Н.А., Бердон К.А., Кон Дж.С., О'Коннор Х.Т., Джордж Дж. (апрель 2012 г.). «Добавки омега-3 и неалкогольная жировая болезнь печени: систематический обзор и метаанализ» . Журнал гепатологии (систематический обзор и метаанализ). 56 (4): 944–951. дои : 10.1016/j.jhep.2011.08.018 . ПМИД 22023985 .
- ^ «FDA одобрило первый метод лечения пациентов с рубцами в печени из-за жировой болезни печени» . США Управление по контролю за продуктами и лекарствами (FDA) (пресс-релиз). 14 марта 2024 г. Проверено 14 марта 2024 г.
 В данной статье использован текст из этого источника, находящегося в свободном доступе .
В данной статье использован текст из этого источника, находящегося в свободном доступе .
- ^ «Madrigal Pharmaceuticals объявляет об одобрении FDA препарата Рездиффра (ресметиром) для лечения пациентов с нецирротическим неалкогольным стеатогепатитом (НАСГ) с фиброзом печени от умеренной до выраженной степени» . Мадригал Фармасьютикалс (Пресс-релиз). 14 марта 2024 г. Проверено 14 марта 2024 г.
- ^ Саймон Т.Г., Вилечанский Р.М., Стоянова С., Гроссман А., Дихтель Л.Е., Лауэр Г.М. и др. (март 2024 г.). «Аспирин при стеатотическом заболевании печени без цирроза, связанном с метаболической дисфункцией: рандомизированное клиническое исследование». ДЖАМА . 331 (11): 920–929. дои : 10.1001/jama.2024.1215 . ПМЦ 10951738. ПМИД 38502074 .
- ^ Перейти обратно: а б Саньял А.Дж., Бедосса П., Фрассдорф М., Нефф Г.В., Ловитц Э., Бугианеси Е. и др. (25 июля 2024 г.). «Рандомизированное исследование фазы 2 сурводутида при MASH и фиброзе» . Медицинский журнал Новой Англии . 391 (4): 311–319. дои : 10.1056/NEJMoa2401755 . ISSN 0028-4793 .
- ^ Перейти обратно: а б Лумба Р., Хартман М.Л., Лавитц Э.Дж., Вуппаланчи Р., Бурсье Дж., Бугианеси Е. и др. (25 июля 2024 г.). «Тирзепатид при стеатогепатите, связанном с метаболической дисфункцией, с фиброзом печени» . Медицинский журнал Новой Англии . 391 (4): 299–310. дои : 10.1056/NEJMoa2401943 . ISSN 0028-4793 .
- ^ Ли Ю., Думурас А.Г., Ю Дж., Брар К., Банфилд Л., Гмора С. и др. (май 2019 г.). «Полное разрешение неалкогольной жировой болезни печени после бариатрической хирургии: систематический обзор и метаанализ» . Клиническая гастроэнтерология и гепатология . 17 (6): 1040–1060.e11. дои : 10.1016/j.cgh.2018.10.017 . ПМИД 30326299 .
- ^ Перейти обратно: а б Фахри Т.К., Мхаскар Р., Швиталла Т., Мурадова Е., Гонзалво Дж.П., Мурр М.М. (март 2019 г.). «Бариатрическая хирургия улучшает неалкогольную жировую болезнь печени: современный систематический обзор и метаанализ». Хирургия ожирения и связанных с ним заболеваний . 15 (3): 502–511. дои : 10.1016/j.soard.2018.12.002 . ПМИД 30683512 . S2CID 59275709 .
- ^ Муммади Р.Р., Кастури К.С., Ченнареддигари С., Суд Г.К. (декабрь 2008 г.). «Влияние бариатрической хирургии на неалкогольную жировую болезнь печени: систематический обзор и метаанализ». Клиническая гастроэнтерология и гепатология . 6 (12): 1396–1402. дои : 10.1016/j.cgh.2008.08.012 . ПМИД 18986848 .
- ^ Перейти обратно: а б Торелл А., Маккормик А.Д., Авад С., Рейнольдс Н., Рулен Д., Демартинс Н. и др. (сентябрь 2016 г.). «Руководство по периоперационному уходу в бариатрической хирургии: Рекомендации общества ускоренного восстановления после операции (ERAS)» . Всемирный журнал хирургии (руководства профессионального общества). 40 (9): 2065–2083. дои : 10.1007/s00268-016-3492-3 . ПМИД 26943657 .
- ^ Перейти обратно: а б Холдербаум М., Касагранде Д.С., Сюссенбах С., Бусс К. (февраль 2018 г.). «Влияние очень низкокалорийных диет на размер печени и потерю веса в предоперационном периоде бариатрической хирургии: систематический обзор». Хирургия ожирения и связанных с ним заболеваний (систематический обзор). 14 (2): 237–244. дои : 10.1016/j.soard.2017.09.531 . ПМИД 29239795 .
- ^ Ливхиц М., Меркадо С., Ермилов И., Парих Дж.А., Датсон Е., Мехран А. и др. (2008). «Улучшает ли потеря веса непосредственно перед бариатрической операцией результаты: систематический обзор». Хирургия ожирения и связанных с ним заболеваний . 5 (6): 713–721. дои : 10.1016/j.soard.2009.08.014 . ПМИД 19879814 .
- ^ Перейти обратно: а б Роман М., Монаган А., Серрайно Г.Ф., Миллер Д., Патак С., Лай Ф. и др. (февраль 2019 г.). «Метаанализ влияния изменений образа жизни для предоперационной потери веса на результаты хирургического вмешательства» . Британский журнал хирургии (метаанализ). 106 (3): 181–189. дои : 10.1002/bjs.11001 . hdl : 2381/43636 . ПМИД 30328098 .
- ^ Кэсси С., Менезес С., Берч Д.В., Ши Х, Кармали С. (2010). «Эффект предоперационной потери веса у бариатрических хирургических пациентов: систематический обзор». Хирургия ожирения и связанных с ним заболеваний (систематический обзор). 7 (6): 760–7, обсуждение 767. doi : 10.1016/j.soard.2011.08.011 . ПМИД 21978748 .
- ^ Чжоу Ю, Фу С (октябрь 2017 г.). «GW28-e0325 Ассоциация неалкогольной жировой болезни печени и субклинического атеросклероза: систематический обзор и метаанализ» . Журнал Американского колледжа кардиологов . 70 (16): С81. дои : 10.1016/j.jacc.2017.07.284 .
- ^ Сингх С., Аллен А.М., Ван З., Прокоп Л.Дж., Мурад М.Х., Лумба Р. (апрель 2015 г.). «Прогрессирование фиброза при неалкогольной жировой дистрофии печени по сравнению с неалкогольным стеатогепатитом: систематический обзор и метаанализ исследований парной биопсии» . Клиническая гастроэнтерология и гепатология . 13 (4): 643–54.e1–9, викторина e39–40. дои : 10.1016/j.cgh.2014.04.014 . ПМК 4208976 . ПМИД 24768810 .
- ^ Перейти обратно: а б Лу Ф.Б., Ху Э.Д., Сюй Л.М., Чен Л., Ву Дж.Л., Ли Х. и др. (май 2018 г.). «Взаимосвязь между ожирением и тяжестью неалкогольной жировой болезни печени: систематический обзор и метаанализ». Экспертный обзор гастроэнтерологии и гепатологии . 12 (5): 491–502. дои : 10.1080/17474124.2018.1460202 . ПМИД 29609501 . S2CID 4626474 .
- ^ Сукоян С., Пирола CJ (январь 2018 г.). «Систематический обзор с метаанализом: значение тяжести гистологического заболевания у худощавых пациентов с неалкогольной жировой болезнью печени» . Алиментарная фармакология и терапия . 47 (1): 16–25. дои : 10.1111/апт.14401 . hdl : 11336/86717 . ПМИД 29083036 .
- ^ Усман М.С., Сиддики Т.Дж. (октябрь 2017 г.). «Появляющиеся доказательства связи между неалкогольной жировой болезнью печени и сердечными аритмиями». Болезни пищеварения и печени . 49 (10): 1166. doi : 10.1016/j.dld.2017.07.013 . ПМИД 28822729 .
- ^ Беллентани С (январь 2017 г.). «Эпидемиология неалкогольной жировой болезни печени» . Печень Интернационал . 37 (Приложение 1): 81–84. дои : 10.1111/liv.13299 . ПМИД 28052624 .
- ^ Маренго А, Россо С, Буджианези Е (14 января 2016 г.). «Рак печени: связь с ожирением, ожирением печени и циррозом печени». Ежегодный обзор медицины . 67 (1): 103–117. doi : 10.1146/annurev-med-090514-013832 . hdl : 2318/1636160 . ПМИД 26473416 .
- ^ Лонардо А., Баллестри С., Маркезини Дж., Ангуло П., Лория П. (март 2015 г.). «Неалкогольная жировая болезнь печени: предшественник метаболического синдрома» . Болезни пищеварения и печени . 47 (3): 181–190. дои : 10.1016/j.dld.2014.09.020 . ПМИД 25739820 .
- ^ Юки-Ярвинен Х (ноябрь 2014 г.). «Неалкогольная жировая болезнь печени как причина и следствие метаболического синдрома». «Ланцет». Диабет и эндокринология . 2 (11): 901–910. дои : 10.1016/S2213-8587(14)70032-4 . ПМИД 24731669 .
- ^ Кацики Н., Перес-Мартинес П., Анагностис П., Михайлидис Д.П., Карагианнис А. (2018). «Действительно ли неалкогольная жировая болезнь печени является печеночным проявлением метаболического синдрома?». Современная сосудистая фармакология . 16 (3): 219–227. дои : 10.2174/1570161115666170621075619 . ПМИД 28669328 .
- ^ Омагари К., Кадокава И., Масуда Дж., Эгава И., Сава Т., Хазама Х. и др. (октябрь 2002 г.). «Жирная печень у взрослых японцев, не употребляющих алкоголь и не имеющих избыточного веса: заболеваемость и клинические характеристики». Журнал гастроэнтерологии и гепатологии . 17 (10): 1098–1105. дои : 10.1046/j.1440-1746.2002.02846.x . ПМИД 12201871 . S2CID 23627555 .
- ^ Хильден М., Кристофферсен П., Юл Э., Далгаард Дж.Б. (1977). «Гистология печени у «нормальной» популяции - исследование 503 последовательных дорожно-транспортных происшествий со смертельным исходом». Скандинавский журнал гастроэнтерологии . 12 (5): 593–597. дои : 10.3109/00365527709181339 . ПМИД 918553 .
- ^ Каббани М.Н., Кондживарам Сельвакумар П.К., Ватт К., Лопес Р., Аккрас З., Зейн Н. и др. (апрель 2017 г.). «Распространенность цирроза печени, связанного с неалкогольным стеатогепатитом, в Соединенных Штатах: анализ данных национального обследования здоровья и питания». Американский журнал гастроэнтерологии . 112 (4): 581–587. дои : 10.1038/ajg.2017.5 . ПМИД 28195177 . S2CID 39521696 .
- ^ Флегал К.М., Кэрролл, доктор медицинских наук, Огден К.Л., Джонсон К.Л. (октябрь 2002 г.). «Распространенность и тенденции ожирения среди взрослого населения США, 1999-2000 гг.» . ДЖАМА . 288 (14): 1723–1727. дои : 10.1001/jama.288.14.1723 . ПМИД 12365955 .
- ^ Перейти обратно: а б Андерсон Э.Л., Хоу Л.Д., Джонс Х.Э., Хиггинс Дж.П., Лоулор Д.А., Фрейзер А. (29 октября 2015 г.). «Распространенность неалкогольной жировой болезни печени у детей и подростков: систематический обзор и метаанализ» . ПЛОС ОДИН . 10 (10): e0140908. Бибкод : 2015PLoSO..1040908A . дои : 10.1371/journal.pone.0140908 . ПМК 4626023 . ПМИД 26512983 .
- ^ Перейти обратно: а б EASL (апрель 2019 г.). «Программное заявление: ожирение способствует росту неалкогольной жировой болезни печени (НАЖБП) в Европе» (PDF) . Архивировано из оригинала (PDF) 7 октября 2019 года.
- ^ Эстес С., Разави Х., Лумба Р., Юносси З., Саньял А.Дж. (январь 2018 г.). «Моделирование эпидемии неалкогольной жировой болезни печени демонстрирует экспоненциальный рост бремени болезней» . Гепатология . 67 (1): 123–133. дои : 10.1002/hep.29466 . ПМЦ 5767767 . ПМИД 28802062 .
- ^ Перейти обратно: а б Зельман С. (август 1952 г.). «Печень при ожирении». Архивы АМА внутренней медицины . 90 (2): 141–156. дои : 10.1001/archinte.1952.00240080007002 . ПМИД 14943295 .
- ^ Перейти обратно: а б Людвиг Дж., МакГилл Д.Б., Линдор К.Д. (май 1997 г.). «Обзор: неалкогольный стеатогепатит». Журнал гастроэнтерологии и гепатологии . 12 (5): 398–403. дои : 10.1111/j.1440-1746.1997.tb00450.x . ПМИД 9195388 . S2CID 34775647 .
- ^ Рабинович И.М. (июнь 1948 г.). «Связь между нарушением функции печени и преждевременным развитием атеросклероза при сахарном диабете» . Журнал Канадской медицинской ассоциации . 58 (6): 547–556. ПМК 1590957 . ПМИД 18862251 .
- ^ Ханссен П. (14 марта 1936 г.). «Увеличение печени при сахарном диабете». Журнал Американской медицинской ассоциации . 106 (11): 914. дои : 10.1001/jama.1936.02770110030011 .
- ^ Лучший чемпион, Хартрофт WS (ноябрь 1949 г.). «Повреждение печени, вызванное употреблением алкоголя или сахара, и его предотвращение с помощью холина» . Британский медицинский журнал . 2 (4635): 1002–6, пл. дои : 10.1136/bmj.2.4635.1001 . ПМК 2051633 . ПМИД 15393035 .
- ^ Людвиг Дж., Виджано Т.Р., МакГилл Д.Б., О БиДжей (июль 1980 г.). «Неалкогольный стеатогепатит: в клинике Мэйо обнаружена до сих пор неназванная болезнь». Труды клиники Мэйо . 55 (7): 434–438. ПМИД 7382552 .
- ^ Перейти обратно: а б с Фаррелл Г.К., Лартер Ч.З. (февраль 2006 г.). «Неалкогольная жировая болезнь печени: от стеатоза к циррозу» . Гепатология . 43 (2 Приложение 1): S99–S112. дои : 10.1002/hep.20973 . ПМИД 16447287 .
- ^ Дрю Л. (октябрь 2017 г.). «Жировая болезнь печени: переломный момент» . Природа . 550 (7675): С101. дои : 10.1038/550S101a . ПМИД 29019967 .
- ^ «Потребление и питание — освежающие напитки из Франции» . Архивировано из оригинала 25 апреля 2018 года.
- ^ «Он был печеньем из газировки». № 5102. Утка на цепи. Август 2018.
- ^ Моран-младший, Гишан Ф.К., Холтер С.А., Грин Х.Л. (июнь 1983 г.). «Стеатогепатит у детей с ожирением: причина хронической дисфункции печени». Американский журнал гастроэнтерологии . 78 (6): 374–377. ПМИД 6859017 .
- ^ Перейти обратно: а б с д и Темпл Дж.Л., Кордеро П., Ли Дж., Нгуен В., Обен Дж.А. (июнь 2016 г.). «Руководство по неалкогольной жировой болезни печени в детском и подростковом возрасте» . Международный журнал молекулярных наук . 17 (6): 947. doi : 10.3390/ijms17060947 . ПМЦ 4926480 . ПМИД 27314342 .
- ^ Папандреу Д., Руссо I, Мавромихалис I (август 2007 г.). «Новая информация о неалкогольной жировой болезни печени у детей». Клиническое питание . 26 (4): 409–415. дои : 10.1016/j.clnu.2007.02.002 . ПМИД 17449148 .
- ^ Кортес-Пинто Х, Камило М.Э., Баптиста А., Де Оливейра А.Г., Де Моура М.К. (декабрь 1999 г.). «Неалкогольная жировая дистрофия печени: еще одна особенность метаболического синдрома?». Клиническое питание . 18 (6): 353–358. дои : 10.1016/S0261-5614(99)80015-6 . ПМИД 10634920 .
- ^ Маркезини Г., Бризи М., Бьянки Г., Томассетти С., Буджанеси Е., Лензи М. и др. (август 2001 г.). «Неалкогольная жировая болезнь печени: особенность метаболического синдрома» . Диабет . 50 (8): 1844–1850. дои : 10.2337/диабет.50.8.1844 . ПМИД 11473047 .
- ^ Перейти обратно: а б Нобили В., Марчеллини М., Девито Р., Чампалини П., Пьемонте Ф., Компаркола Д. и др. (август 2006 г.). «НАЖБП у детей: проспективное клинико-патологическое исследование и влияние рекомендаций по образу жизни» . Гепатология . 44 (2): 458–465. дои : 10.1002/hep.21262 . ПМИД 16871574 .
- ^ Пагано Дж., Пачини Дж., Муссо Дж., Гамбино Р., Мекка Ф., Депетрис Н. и др. (февраль 2002 г.). «Неалкогольный стеатогепатит, инсулинорезистентность и метаболический синдром: дополнительные доказательства этиологической связи» . Гепатология . 35 (2): 367–372. дои : 10.1053/jhep.2002.30690 . ПМИД 11826410 .
- ^ Швиммер Дж. Б., Парди П. Е., Лавин Дж. Э., Блюмкин А. К., Кук С. (июль 2008 г.). «Факторы сердечно-сосудистого риска и метаболический синдром при неалкогольной жировой болезни печени у детей» . Тираж . 118 (3): 277–283. doi : 10.1161/CIRCULATIONAHA.107.739920 . ПМК 2996820 . ПМИД 18591439 .
- ^ Перейти обратно: а б Робертс Э.А. (июнь 2007 г.). «Детская неалкогольная жировая болезнь печени (НАЖБП): «растущая» проблема?» . Журнал гепатологии . 46 (6): 1133–1142. дои : 10.1016/j.jhep.2007.03.003 . ПМИД 17445934 .
- ^ Гибсон П.С., Ланг С., Дхаван А., Фицпатрик Э., Блумфилд М.Л., Труби Х. и др. (август 2017 г.). «Систематический обзор: питание и физическая активность в лечении неалкогольной жировой болезни печени у детей». Журнал детской гастроэнтерологии и питания . 65 (2): 141–149. дои : 10.1097/MPG.0000000000001624 . ПМИД 28737568 .
- ^ Весоловский С.Р., Касми К.К., Йоншер К.Р., Фридман Дж.Е. (февраль 2017 г.). «Происхождение НАЖБП: матка с разгадкой» . Обзоры природы. Гастроэнтерология и гепатология . 14 (2): 81–96. дои : 10.1038/nrgastro.2016.160 . ПМЦ 5725959 . ПМИД 27780972 .
- ^ Араужо А.Р., Россо Н., Бедоньи Г., Тирибелли С. , Беллентани С. (февраль 2018 г.). «Глобальная эпидемиология неалкогольной жировой болезни печени/неалкогольного стеатогепатита: что нам нужно в будущем» . Печень Интернационал . 38 (Приложение 1): 47–51. дои : 10.1111/liv.13643 . ПМИД 29427488 .
- ^ Харрисон С.А., Лумба Р., Дюбур Дж., Рациу В., Нуреддин М. (июль 2023 г.). «Пейзаж клинических исследований НАСГ». Клиническая гастроэнтерология и гепатология . 21 (8): 2001–2014. дои : 10.1016/j.cgh.2023.03.041 . ПМИД 37059159 . S2CID 258115543 .
- ^ Перейти обратно: а б с д и Ван Икс (август 2022 г.). «Проблемы и возможности неалкогольного стеатогепатита» . Медицинский обзор . 2 (4): 328–330. дои : 10.1515/мр-2022-0024 . ПМЦ 10388777 . ПМИД 37724322 .
- ^ Перейти обратно: а б с д Рациу В., Франк С., Саньял А. (июнь 2022 г.). «Прорывы в терапии НАСГ и оставшиеся проблемы» . Журнал гепатологии . 76 (6): 1263–1278. дои : 10.1016/j.jhep.2022.04.002 . ПМИД 35589249 . S2CID 248846797 .
- ^ Достижения в фармакологическом лечении НАЖБП/MASLD: акцент на метаболических и печеночных вмешательствах. Стефано Чьярдулло, Эмануэле Мурака, Микела Вергани, Пьетро Инверницци, Джанлука Персегин Отчет по гастроэнтерологии, том 12, 2024 г., goae029, https://doi.org/10.1093/gastro/goae029