Биполярная электрохимия

Биполярная электрохимия — явление в электрохимии, на поляризации проводящих основанное объектов в электрических полях . Действительно, эта поляризация создает разность потенциалов между двумя краями подложки, равную значению электрического поля, умноженному на размер объекта. Если эта разность потенциалов достаточно важна, то окислительно-восстановительные реакции , окисление будет происходить на одном конце и одновременно восстанавливаться на другом конце. на концах объекта могут возникать [1] [2] В простой экспериментальной установке, состоящей из платиновой проволоки в лодочке для взвешивания, содержащей раствор индикатора pH , напряжение 30 В на двух электродах приведет к уменьшению количества воды на одном конце проволоки (катоде) и увеличению pH (OH − образование) и окисление воды на анодном конце и снижение pH. Полюса биполярного электрода также совпадают с приложенным электрическим полем. [3]
Основы
[ редактировать ]Когда электропроводящий электрод помещен без прямого соединения в одном и том же электролите между анодом и катодом в гальванической ячейке с приложенным достаточным напряжением; электрод будет испытывать одновременную катодную и анодную реакцию в обоих крайностях. Это означает, что проводящий электрод станет биполярным электродом (БПЭ); электропроводящий материал, контактирующий с ионопроводящим электролитом, не имеющий прямой электронной связи с источником питания, способствующий электрохимическим (восстановительным и окислительным) реакциям на обоих его концах (полюсах); что означает, что это катод и анод одновременно. [4] [5] Это происходит из-за:
Корпус (А)
[ редактировать ]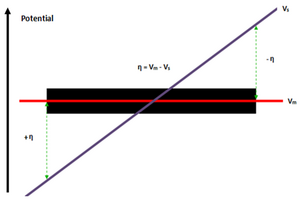
Разность потенциалов (η) между электропроводящим электродом (V m ) и электролитом (V s ) вызывает градиент потенциала, который позднее распределяется по границе раздела БПЭ-электролит, причем один крайний край имеет самый высокий потенциал (анод + η), а другой полюс имеет самый низкий потенциал (катод -η). [5] По сравнению с потенциалом электролита (V s ) градиент/падение; потенциал электрода (В м ) не меняется между полюсами БПЭ, это связано с высокой проводимостью электродов, превышающей 10 6 См/м для большинства стальных сплавов по сравнению с проводимостью раствора в диапазоне 5,5 мкСм/м для ионизированной воды и 5 См/м для морской воды . [5]
Случай (Б)
[ редактировать ]
Ток течет в BPE, поскольку он обеспечивает менее активное сопротивление, чем электролит. Как показано на рисунке; в результате тока, поступающего на сторону (D/Blue) от анода, сторона D будет поляризоваться катодно (потенциал станет более отрицательным). С другой стороны, сторона (B/Red), откуда уходит ток, будет анодно поляризоваться (потенциал станет более положительным) и подвергнется коррозии. Это происходит из-за поляризации, которая возникает противоположно направлению тока. [6]
Эта теория почти принята во всех классических [7] и последние книги по катодной защите, [8] NACE , публикации и стандарты [9] как объяснение коррозии и отслоения покрытия, вызванных помехами постоянного тока между трубопроводами и различными конструкциями (например, конструкциями с катодной защитой или незащищенными, железными дорогами и HVDC ). Это потому, что он больше подходит для крупномасштабных структур в гетерогенных средах с высоким сопротивлением, где потенциал раствора (V s ) играет менее решающую роль, а реакции в основном концентрируются только на полюсах (где ток входит и уходит). [7]
Случай (С)
[ редактировать ]Разность потенциалов на каждом полюсе БПЭ (которой может хватить, а может и не хватить для электрохимических реакций). [4]
Обратите внимание, что потенциал раствора не контролируется напрямую источником питания (например, потенциостатом ), поскольку он также зависит от состава раствора. Следовательно, чтобы электроны передавались для восстановления частиц в растворе, потенциал рабочего электрода должен быть установлен на более отрицательное значение, чем у электроактивной молекулы в растворе, и тогда - в зависимости от кинетики - электроны могут переноситься. Аналогичным образом происходят реакции окисления. [4] Кроме того, согласно закону Ома , электрическое поле и потенциал раствора (В с ) будут увеличиваться с увеличением удельного сопротивления раствора и приложенного тока во внешней цепи. [6]
Использование
[ редактировать ]Явление биполярной электрохимии известно с 1970-х годов. [10] и используется в промышленности в некоторых электролитических реакторах. Интерес научного сообщества к этой концепции, похоже, значительно возрос после того, как Мартин Флейшманн и его коллеги продемонстрировали, что расщепление воды возможно с использованием биполярных электродов микрометрового размера. [11] В последнее время появилось несколько приложений в таких областях, как синтез асимметричных микро- и наноструктур. [12] [13] аналитическая химия [14] [15] [16] материаловедение, [17] [6] микроэлектроника [18] и движение микрообъектов [19] [20] были разработаны.
Ссылки
[ редактировать ]- ^ Г. Логе; А. Кун (2011). «Формирование и исследование микро- и наномира с помощью биполярной электрохимии». Аналитическая и биоаналитическая химия . 400 (6): 1691–704. дои : 10.1007/s00216-011-4862-1 . ПМИД 21455656 . S2CID 44000438 .
- ^ Ф. Мавре; Р.К. Ананд; Законы ДР; К.-Ф. Чау; К. Чанг; Дж. А. Крукс; Р.М. Крукс (2010). «Особенные биполярные электроды: полезный инструмент для концентрирования, разделения и обнаружения аналитов в микроэлектрохимических системах». Анальный. хим. 82 (21): 8766–74. дои : 10.1021/ac101262v . ПМИД 20815405 .
- ^ Фосдик, SE; Кнуст, КН; Скида, К.; Крукс, РМ (2013). «Биполярная электрохимия». Энджью. хим. Межд. Эд . 52 (40): 10438–10456. дои : 10.1002/anie.201300947 . ПМИД 23843205 .
- ^ Перейти обратно: а б с Мавре, Франсуа; Ананд, Роббин К.; Лоус, Дерек Р.; Чоу, Квок-Фан; Чанг, Бён Ён; Крукс, Джон А.; Крукс, Ричард М. (3 сентября 2010 г.). «Биполярные электроды: полезный инструмент для концентрирования, разделения и обнаружения аналитов в микроэлектрохимических системах» . Аналитическая химия . 82 (21): 8766–8774. дои : 10.1021/ac101262v . ISSN 0003-2700 .
- ^ Перейти обратно: а б с Ульрих, Кристиан; Андерссон, Олоф; Нюхольм, Лейф; Бьёрефорс, Фредрик (7 апреля 2008 г.). «Формирование молекулярных градиентов на биполярных электродах» . Ангеванде Хеми . 120 (16): 3076–3078. дои : 10.1002/ange.200705824 . ISSN 0044-8249 .
- ^ Перейти обратно: а б с д Абдалраман, Мохамед Коко (2017). Применение биполярной электрохимии для коррозионной защиты нержавеющей стали типа 420 в растворе хлорида натрия (магистерская диссертация). Национальная физическая лаборатория. дои : 10.13140/RG.2.2.31999.71845 .
- ^ Перейти обратно: а б Бонс, Х.; Рихтер, Б. (1997), «Катодная защита судов» , Справочник по катодной защите от коррозии , Elsevier, стр. 391–414 , получено 12 февраля 2023 г.
- ^ Ахмад, Заки (2006), «ПРЕДУПРЕЖДЕНИЕ КОРРОЗИИ С помощью ПРОЕКТИРОВАНИЯ» , Принципы коррозионной инженерии и контроля коррозии , Elsevier, стр. 438–478 , получено 12 февраля 2023 г.
- ^ Уинстон., Реви, Р. (2011). Справочник Улига по коррозии . Уайли. ISBN 978-1-118-11003-4 . OCLC 927504000 .
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Гудридж, Ф.; Кинг, CJH; Райт, Арканзас (1 апреля 1977 г.). «Поведение биполярных электродов с насадочным слоем» . Электрохимика Акта . 22 (4): 347–352. дои : 10.1016/0013-4686(77)85085-8 . ISSN 0013-4686 .
- ^ М. Флейшманн; Дж. Горогчян; Д. Ролисон; С. Понс (1986). «Электрохимическое поведение дисперсий сферических ультрамикроэлектродов» . Дж. Физ. хим. 90 (23): 6392. doi : 10.1021/j100281a065 . Архивировано из оригинала 23 сентября 2017 года.
- ^ Г. Логе; В. Лапейр; П. Гарриг; К. Варакулвит; Дж. Лимтракул; М.-Х. Дельвиль; А. Кун (2011). «Универсальная процедура синтеза углеродных трубок типа Янус». хим. Матер. 23 (10): 2595. дои : 10,1021/см2001573 .
- ^ К. Варакулвит; Т. Нгуен; Ж. Мажимель; М.-Х. Дельвиль; В. Лапейр; П. Гарриг; В.Равейн; Дж. Лимтракул; А. Кун (2008). «Диссимметричные углеродные нанотрубки с помощью биполярной электрохимии». Нано Летт. 8 (2): 500–4. Бибкод : 2008NanoL...8..500W . дои : 10.1021/nl072652s . ПМИД 18189438 .
- ^ К.-Ф. Чау; К. Чанг; Б. А. Заккео; Ф. Мавре; Р.М. Крукс (2010). «Чувствительная платформа на основе электрорастворения Ag-биполярного электрода». Дж. Ам. хим. Соц. 132 (27): 9228. doi : 10.1021/ja103715u . ПМИД 20557051 .
- ^ Глушкоу Д., Пердью Р.К., Допешваркар Р., Крукс Р.М., Талларек У. (2009). «Фокусировка градиента электрического поля в микроканалах со встроенным биполярным электродом». Лабораторный чип . 9 (13): 1903. doi : 10.1039/b822404h . ПМИД 19532966 .
- ^ Ульрих К., Андерссон О., Нихольм Л., Бьёрефорс Ф. (2009). «Распределение плотности потенциала и тока на электродах, предназначенных для формирования биполярного рисунка». Анальный. хим. 81 (1): 453–459. дои : 10.1021/ac801871c . ПМИД 19125451 .
- ^ Рамакришнан С., Шеннон С. (2010). «Отображение твердотельных материалов с использованием биполярной электрохимии». Ленгмюр . 26 (7): 4602–4606. дои : 10.1021/la100292u . ПМИД 20229995 .
- ^ Джей Си Брэдли; Его Величество Чен; Дж. Кроуфорд; Дж. Эккерт; К. Ерназарова; Т. Курзея; М. Лин; М. МакГи; В. Надлер; С.Г. Стивенс (1997). «Создание электрических контактов между металлическими частицами с помощью направленного электрохимического роста». Природа . 389 (6648): 268. Бибкод : 1997Natur.389..268B . дои : 10.1038/38464 . S2CID 4329476 .
- ^ Г. Логе; А. Кун (2010). «Движение микрообъектов путем динамической биполярной саморегенерации». Дж. Ам. хим. Соц. 132 (45): 15918–9. дои : 10.1021/ja107644x . ПМИД 20964295 .
- ^ Г. Логе; А. Кун (2011). «Химическое движение проводящих объектов под действием электрического поля» . Природные коммуникации . 2 (11): 535. Бибкод : 2011NatCo...2E.535L . дои : 10.1038/ncomms1550 . ПМИД 22086336 .