Гидрофобное несоответствие
Гидрофобное несоответствие - это разница между толщинами гидрофобных областей трансмембранного белка и биологической мембраны , которую она простирается. [ 1 ] Чтобы избежать неблагоприятного воздействия гидрофобных поверхностей на воду, ожидается, что гидрофобные области трансмембранных белков будут иметь приблизительно такую же толщину, что и область гидрофобной (липидной ацильной цепи) окружающего липидного бислоя . Тем не менее, один и тот же мембранный белок может встречаться в бислоях разной толщины. [ 2 ] В эукариотических клетках плазматическая мембрана толще, чем мембраны эндоплазматического ретикулума. Тем не менее, все белки, которые обильны в плазматической мембране, первоначально интегрированы в эндоплазматический ретикулум при синтезе на рибосомах. [ 3 ] Трансмембранные пептиды или белки и окружающие липиды могут адаптироваться к гидрофобному несоответствию различными средствами.
Возможные адаптации к несоответствию
[ редактировать ]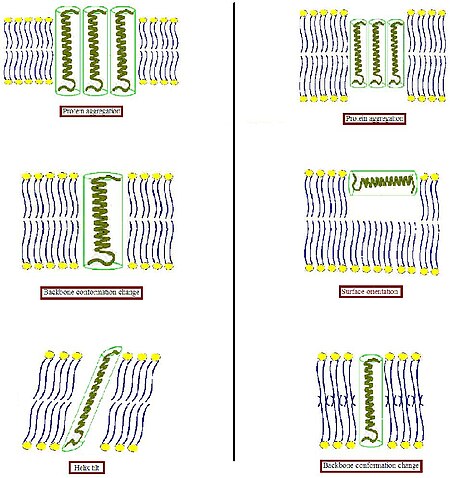
Чтобы избежать неблагоприятного воздействия на гидрофобные поверхности на гидрофильную среду, биологическая мембрана имеет тенденцию адаптироваться к такому несоответствию. Например, интегральный мембранный белок имеет тенденцию окружить себя липидами сопоставления размера и формы из -за сегрегации белка и липидов . [ 4 ] Поскольку белки относительно жесткие, тогда как липидные углеводородные цепи являются гибкими, состояние гидрофобного сопоставления может быть выполнено путем растяжения, разжигания и/или наклонения липидных цепей [ 5 ] [ 6 ] [ 7 ]
- Когда гидрофобная часть трансмембранного белка слишком толстая, чтобы соответствовать гидрофобной толщине бислоя (левая часть фигуры), белок может агрегировать в мембране, чтобы минимизировать обнаженную гидрофобную площадь или наклонить, чтобы уменьшить их эффективную гидрофобную толщину. Они также могут принять, изменяя ориентацию гидрофобных и гидрофильных боковых цепей вблизи границы раздела. Липиды, в свою очередь, могут модулировать толщину мембраны, растягивая их ацильные цепи.
- Когда гидрофобная часть трансмембранного белка слишком тонкая, чтобы соответствовать гидрофобной толщине бислоя (правая часть рисунка), это опять же, это может привести к агрегации белка или изменениям в конформации основных целей и/или ориентации боковой цепи. Слишком короткие пептиды могут принять локализацию поверхности. Липиды могут уменьшить локальную толщину бислоя путем расстройства их ацильных цепей.
Агрегация белка
[ редактировать ]Поскольку Mouritsen и Bloom [ 8 ] предложила подробную термодинамическую модель, которая включает в себя адаптацию липидов и индукцию сегрегации белка при более экстремальном несоответствии в их «модели матраса», было получено более дополнительное понимание агрегации белка, вызванной несоответствием. [ 9 ] Также было основано некоторые экспериментальные доказательства того, что гидрофобное несоответствие может привести к агрегации белка в бислое жидкости. [ 10 ] [ 11 ] [ 12 ] Исследования электронной микроскопии на бактериодопсине, восстановленном в насыщенных и ненасыщенных бислоях ПК жидкости с различной длиной цепи, показали, что агрегация белка происходила только с довольно большим несоответствием, и что толщина бислоя 4 Angstrom толще и 10 Angstrom тонкой, чем оценочная толщина гидрофона Белок допускается без индукции значительной агрегации. [ 13 ]
Наклона спирали
[ редактировать ]Наклон также является возможным результатом, если гидрофобная часть пептида или белка слишком длинная, чтобы охватывать мембрану. Предыдущее исследование лактозы пермеазы кишечной палочки показало, что при восстановлении белка у липидного бислоя PE/PG (3/1) увеличение наклона спирали происходит при увеличении содержания белка. [ 14 ] Этот наклон сопровождался уменьшением порядка липидов, что приводит к уменьшению толщины бислоя, что позволяет предположить, что это ответ, связанный с несоответствием. У больших белков, которые охватывают мембрану несколько раз, изменения в спиральном наклоне могут возникнуть с небольшим влиянием на липидную упаковку. Тем не менее, для одной трансмембранной спирали возможно, что наклон приведет к напряжению на окружающих липидах для размещения спирали в бислое. Таким образом, большая степень наклона может быть менее благоприятным вариантом для отдельных трансмембранных белков.
Поверхностная ориентация
[ редактировать ]Относительно небольшие гидрофобные пептиды могут не иметь возможности интегрироваться в мембрану, а в ответ принять ориентацию на поверхности мембраны. Экспериментальные данные были продемонстрированы флуоресцентным исследованием искусственного пептида с 19 -аминокислотной гидрофобной последовательности в основном лейцинах и окруженной с обеих сторон с лизинами в качестве якорных остатков. [ 15 ] Результаты показали, что преобразование от доминирующей трансмембранной в параллельную ориентацию пептида может индуцироваться путем модуляции толщины бислоя посредством добавления холестерина или увеличивая длину липидной цепи.
Изменение конформации костяка
[ редактировать ]Чтобы получить подробную информацию о последствиях несоответствия для конформации пептидов и белков в липидном бислое, наиболее подходящие малые мембранные пептиды. Все еще нужны исследования.
Теории о несоответствующих эффектах
[ редактировать ]Различные теоретические подходы были применены для описания затрат на энергию и термодинамических эффектов несоответствия, включая обработку мембраны как эластичную лист [ 16 ] [ 17 ] или микроскопический подход.
Матрас модель
[ редактировать ]
Модель матраса была предложена в качестве феноменологической теории подхода в 1984 году Mouritsen и Bloom. [ 18 ] Это двухкомпонентная теория реальных решений, основанная на теории неадеальных решений и, следовательно, позволяет разделить фазовое разделение. В своей модели они связывают энергию, хранящуюся в волнах мембраны, вызванной несоответствием с упругими свойствами липидов и белков. Они не включают в себя микроскопические детали липидов, но используют в качестве ввода известные термодинамические свойства чистой липидной системы. Они также включают непрямые липидные взаимодействия, вызванные несоответствием, а также прямым липидным белковым ван-дер-ваальсом взаимодействия между гидрофобными частями липидного бислоя и белков. Избыточный «гидрофобный эффект», связанный с гидрофобным несоответствием липидного белка, и свободной энергией упругих деформаций липидных цепей вблизи белка. Потенции взаимодействия оцениваются на основе экспериментальных данных, полученных из термодинамических и механических измерений мембранных свойств.
Схема моделирования Монте -Карло
[ редактировать ]Модель матраса была позже воспроизведена в схеме моделирования Монте -Карло Сперотто и Муритсеном. [ 19 ] Они позволили создать различные микротаты липидов, классифицированные в соответствии с моделью 10 штатов Pink. [ 20 ] следовательно, обеспечивая чистый липидный бислойский фазовый переход. Эта версия модели обеспечивает связь между микроскопическими характеристиками системы и ее термодинамическим поведением.
Молекулярная теория
[ редактировать ]В молекулярной теории липидных цепей мембраны пептиды с их гидрофобной длиной обрабатывали как обеспечивающие граничное состояние при конфигурации липидных цепей. [ 21 ] Молекулярное моделирование было объединено с феноменологическими вкладами свободной энергии, описывающим отталкивание группы липидной головки и натяжение поверхностного растворителя. Duque et al. [ 22 ]
Экспериментальные исследования гидрофобного несоответствия и наклона спирали
[ редактировать ]Знание реакции мембранных белков на несоответствие было получено из различных экспериментальных исследований. Различные типы экспериментальных подходов дают различные виды понимания вклада вышеупомянутых гипотетических молекулярных реакций. Например, белки или пептиды, оснащенные флуоресцентными или парамагнитными группами маркировки, могут использоваться в спектроскопии флуоресценции и исследованиях электронного спинового резонанса . Они могут выявить молекулярные детали как белковых липидных взаимодействий, так и белковых взаимодействий (характеристика ответа в стиле агрегации) и того, как они влияют на (MIS) условия соответствия. Исследования наклона спирали в зависимости от толщины мембраны также извлекли выгоду из использования твердотельных методов ЯМР, в частности, с использованием ориентированных мембран, которые дают прямое понимание угла наклона спирали. Ранние исследования модельных мембранных пептидов (таких как пептид WALP ) дали представление о различных факторах, которые влияют на ответ, включая мембранную состав, пептидную последовательность, а также, в частности, также наличие остатков межфазного привязки. В последние годы большие достижения в Кристаллография рентгеновских лучей и методы электронной микроскопии дали новое понимание липидных взаимодействий более крупных белков. Это иллюстрируется пониманием наклона спирали в кристаллизованном белке кальциевого насоса. [ 23 ]
Биологическое значение несоответствия
[ редактировать ]Гидрофобное несоответствие важно для сортировки белка и образования липидных плотов .
В эукариотических клетках уровень холестерина увеличивается через секреторный путь, от эндоплазматической ретикулумы до Гольджи до плазматической мембраны, [ 24 ] предполагая сопутствующее увеличение толщины мембраны. В соответствии с этим, средняя длина трансмембранного сегмента однопроизводительных белков плазматической мембраны обычно на пять аминокислот длиннее средней длины белков из Гольджи. [ 25 ] Было получено экспериментальные данные о том, что сортировка белка в Гольджи может основываться на этой разнице длины: для нескольких белков, которые обычно находятся в Гольджи, было показано, что увеличение их гидрофобной длины может перенаправить белки в плазматическую мембрану или наоборот, что, что, что, что, что, что, что, что, что, что, что, что, что, что, что, что, что, что, что, что, что, что, что, что, что, что, что Уменьшение гидрофобной длины белков из плазматической мембраны может вызвать их удержание в Гольджи. [ 26 ] [ 27 ]
Ракты представляют собой мембранные домены, обогащенные холестерином, сфингомиелином (SM) и некоторыми мембранными белками. [ 28 ] [ 29 ] Рэфты играют предполагаемую роль во многих физиологических процессах, таких как трансдукция сигнала, эндоцитоз, апоптоз, транспортировка белка и регуляция липидов. [ 30 ] [ 31 ] [ 32 ] [ 33 ] [ 34 ] Рэт -липиды обычно имеют насыщенные углеводородные цепи. [ 35 ] Липидные рафты имеют более высокую гидрофобную толщину, чем остальная часть липидного бислоя, что может привести к преференциальному разделению трансмембранных белков с более высокой гидрофобной толщиной в липидные рафты. [ 36 ] [ 37 ]
Смотрите также
[ редактировать ]Ссылки
[ редактировать ]- ^ Duke, D.; Ли, XJ, Катсов, К.; Schick, MJ Chem. Физический 2002, 116, 10478-10484.
- ^ Killian, Ja Biochemica et Biophysica Acta. 1998, 1376, 401-416.
- ^ Ван Меер, Г. Анну. Преподобный Клеточная органическая. 1989, 5, 247-275.
- ^ Fattal, Dr; Бен-Шаул, А. Биофиз. J. 1993, 65, 1795-1809.
- ^ Незил, Фа; Блум, М. Биофиз. J. 1992, 61, 1176-1183.
- ^ Kurrle, A.; Rieber, P.; Сакманн, Э. Биохимия. 1990, 29, 8274-8282.
- ^ Zhang, Y.; Льюис, ах; Ходжес, рупий; McElhaney, RN Biochemistry. 1992, 31, 11579-11588.
- ^ Mouritsen, и; Блум, М. Биофиз. J. 1984, 46, 141-153.
- ^ Mouritsen, og; Биохим. Биофиз. Акт. 1998, 1376, 245-266,
- ^ Льюис, ба; Энгельман, DMJ Mol. Большой. 1983, 166, 203-2
- ^ Ryba, N.J.; Marsh, D. Biochemistry 1992, 31, 7511-7518.
- ^ Kusumi, A.; Hyde, JS Biochemistry 1982, 21, 5978-5983.
- ^ Льюис, ба; Энгельман, DMJ Mol. Большой. 1983, 166, 203-2
- ^ Le Coutre, J.; Нарасимхан, LR; Кумар, C.; Патель, Н.; Кабак, HR Proc. Нат. Академический Наука США 1997, 94, 10167-10171.
- ^ Ren, J.; Lew, S.; Wang, Z.; Лондон, Э. Биохимия 1997, 36, 10213-10220.
- ^ Duke, D.; Ли, XJ, Катсов, К.; Schick, MJ Chem. Физический 2002, 116, 10478-10484.
- ^ Fattal, Dr; Бен-Шаул, А. Биофиз. J. 1993, 65, 1795-1809.
- ^ Mouritsen, и; Блум, М. Биофиз. J. 1984, 46, 141-153.
- ^ Сперотто, мм; Mouritsen, Og Eur. Биофиз. J. 1991, 19, 157–168.
- ^ Розовый, да; Чепмен, D. Proc. Нат. Академический Наука США. 1979, 76, 1542–1546.
- ^ Fattal DR; Бен-Шаул, А. Биофиз. J. 1993, 65, 1795-1809
- ^ Duke, D.; Ли, XJ, Катсов, К.; Schick, MJ Chem. Физический 2002, 116, 10478–10484.
- ^ Norimatsu, Y., Hasegawa, K., Shimizu, N., Toyoshima, C. Nature 2017, 545, 193-198
- ^ Сильвий, младший; McElhaney, RN Can. J. Biochem. 1978, 56, 462-469.
- ^ Bretscher, MS; Munro, S. Science 1993, 261, 1280-1281.
- ^ Munro, S. Embo J. 1995, 14, 4659-4704.
- ^ Masbay, as; Бахачо, PV; Boeggamman, Ee; Касба, PKJ Biol. Химический 1993, 268, 9908-9916.
- ^ Саймонс, К.; Туомр, Д. Нат. Преподобный Мол. Клеточная биол. 2000, 1, 31–39.
- ^ Саймонс, к .; Икона, Э. Природа. 1997, 387, 569–572.
- ^ Саймонс, к .; Икона, Э. Природа. 1997, 387, 569–572.
- ^ Томас, JL; Holowka, D.; Baird, B.; Уэбб, WWJ Cell Biol. 1994, 125, 795–802.
- ^ De Jong, K.; Geldwerth, D.; Kuypers, FA Biochemistry. 1997, 36, 6768–6776.
- ^ Эдидин, М. Тенденции Cell Biol. 2001, 11, 492–496.
- ^ Андерсон, RGW; Джейкобсон, К. Наука. 2002, 296, 1821–1825.
- ^ Ohvo-rekila, h.; Ramstedt, B.; Леппи, П.; Slotte, JP Prog. Res Lipid. 2002, 41, 66–97.]
- ^ Ван Меер, Г. Наука. 2002, 296, 855–856.
- ^ Макинтош, TJ Chem. Физический Липиды. 2004, 130, 83–98.