Соединения низковалентного магния
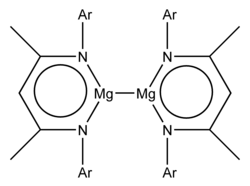
Известен ряд стабильных низковалентных соединений магния, содержащих связь металл-металл Mg-Mg, где магний проявляет формальную степень окисления +1. Эти соединения обычно имеют формулу L 2 Mg 2 , где L представляет собой объемистый лиганд. [ 1 ] О первых примерах этих стабильных соединений магния (I) сообщалось в 2007 году. [ 2 ] В химии Mg преобладает степень окисления +2, и до 2007 года были известны только примеры кристаллических соединений с короткими расстояниями Mg-Mg, которые могут указывать на связь Mg-Mg, такие как тройные гидриды металлов Mg 2 RuH 4 , Mg 3 RuH 3 , и Mg 4 IrH 5 и диборид магния , [ 3 ] Расчеты также показали стабильность Mg 2 2+ катион. [ 4 ]
Получение первых соединений включало восстановление Mg II комплексы йода с металлическим калием и объемистыми лигандами представляли собой: [ 2 ]
- гуанидинировать, «пойманный», [(Ar)NC(NPr я 2 )Н(Вкл)] − где Ar = 2,6-диизопропилфенил и Pr я = изопропил
- кетиминат, " накнак ", {[(Ar)NC(Me)] 2 CH} − ,- где Ar = 2,6-диизопропилфенил и Me = метил
Оба примера имеют формулу L 2 Mg 2 , где L представляет собой объемистый анионный бидентатный лиганд. [ 2 ] Рентгеновские кристаллографические исследования показали длину связи Mg-Mg 285,1 пм и 284,6 пм. [ 2 ] Теоретические исследования указывают на по существу ионную формулу Mg 2 2+ (Л − ) 2 . [ 2 ] Мг 2 2+ ион является группы 2 аналогом группы 12 Hg 2 2+ (присутствует, например, в хлориде ртути(I) ) и Cd 2 2+ ионы (присутствуют в тетрахлоралюминате кадмия (I) ).
С тех пор было получено множество стабильных соединений Mg(I), некоторые из которых плавятся при температуре более 200 ° C, некоторые бесцветные, другие окрашенные, но все они содержат очень объемистые лиганды. [ 1 ] Также были получены комплексы LMgMgL с монодентатными лигандами, в которых координация атома Mg увеличивается с трех до четырех. [ 1 ] Димеры магния (I) оказались полезными восстановителями, например, при получении соединений олова (I). [ 5 ]
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с Сташ, Андреас; Джонс, Кэмерон (2011). «Стабильные димерные соединения магния (i): от химических ориентиров до универсальных реагентов». Транзакции Далтона . 40 (21): 5659–5672. дои : 10.1039/C0DT01831G . ПМИД 21390353 .
- ^ Перейти обратно: а б с д и Грин, СП; Джонс С.; Сташ А. (декабрь 2007 г.). «Стабильные соединения магния (I) со связями Mg-Mg» . Наука . 318 (5857): 1754–1757. Бибкод : 2007Sci...318.1754G . дои : 10.1126/science.1150856 . ПМИД 17991827 .
- ^ Кинг, Р. Брюс (октябрь 2002 г.). «Топология химической связи сверхпроводников. 5. Сходство диборида магния и купратных сверхпроводников и роль субвалентного магния». Многогранник . 21 (23): 2347–2350. дои : 10.1016/S0277-5387(02)01183-X .
- ^ Хогрив, Х. (август 2004 г.). «Mg22+: долгоживущий метастабильный препарат». Письма по химической физике . 394 (1–3): 32–36. Бибкод : 2004CPL...394...32H . дои : 10.1016/j.cplett.2004.06.099 .
- ^ Чунг, Сэм Л.; Шенк, Кристиан; Сташ, Андреас; Данге, Дипак; Джонс, Кэмерон (2012). «Контрастное восстановление хлоридных комплексов металла (ii) группы 14: синтез [малого бета]-дикетиминато олова (i) димера». Химические коммуникации . 48 (19): 2504–2506. дои : 10.1039/C2CC18086C . ПМИД 22281528 .