Спектроскопия ядерного магнитного резонанса углеводов
В этой статье используются голые URL-адреса , которые неинформативны и уязвимы к порче ссылок . ( Август 2022 г. ) |
ЯМР-спектроскопия углеводов — это применение спектроскопии ядерного магнитного резонанса (ЯМР) для структурного и конформационного анализа углеводов . Этот метод позволяет ученым выяснить структуру моносахаридов , олигосахаридов , полисахаридов , гликоконъюгатов и других производных углеводов из синтетических и природных источников. Среди структурных свойств, которые можно определить с помощью ЯМР, - первичная структура (включая стереохимию), конформация сахарида, стехиометрия заместителей и соотношение отдельных сахаридов в смеси. Современные приборы ЯМР высокого поля, используемые для образцов углеводов, обычно с частотой 500 МГц или выше, способны проводить серию 1D, 2D и 3D экспериментов для определения структуры углеводных соединений.
Наблюдаемые ЯМР углеводов
[ редактировать ]Химический сдвиг
[ редактировать ]Обычные диапазоны химических сдвигов ядер в углеводных остатках:
- Типичный 1 Химические сдвиги протонов углеводного кольца ЯМР 1Н составляют 3–6 м.д. (4,5–5,5 м.д. для аномерных протонов).
- Типичный 13 Химические сдвиги атомов углерода углеродного кольца ЯМР 1С составляют 60–110 м.д.
В случае простых молекул моно- и олигосахаридов все сигналы протонов обычно отделены друг от друга (обычно на приборах ЯМР с частотой 500 МГц или лучше) и могут быть определены только с использованием 1D ЯМР-спектра. Однако более крупные молекулы демонстрируют значительное перекрытие сигналов протонов, особенно в неаномерной области (3-4 м.д.). ЯМР углерода-13 преодолевает этот недостаток за счет большего диапазона химических сдвигов и специальных методов, позволяющих блокировать спиновое взаимодействие углерод-протон, что делает все сигналы углерода высокими и узкими синглетами, отличимыми друг от друга.
Типичные диапазоны специфических химических сдвигов углерода углерода в незамещенных моносахаридах составляют:
- Аномерные углероды: 90-100 частей на миллион.
- Углероды сахарного кольца, несущие гидроксильную функцию: 68-77.
- Углероды сахара в открытой форме, несущие гидроксильную функцию: 71-75.
- Углероды сахарного кольца, несущие аминофункцию: 50-56.
- Экзоциклические гидроксиметильные группы: 60-64.
- Экзоциклические карбоксильные группы: 172-176.
- Углерод в дезоксигенированном сахарном кольце: 31-40
- Углерод в замыкании пиранозного кольца: 71–73 (α-аномеры), 74–76 (β-аномеры)
- Углерод при замыкании фуранозного кольца: 80-83 (α-аномеры), 83-86 (β-аномеры)
Константы связи
[ редактировать ]Константы прямого взаимодействия углерод-протон используются для изучения аномерной конфигурации сахара.Вицинальные константы протон-протонного взаимодействия используются для изучения стереоориентации протонов относительно других протонов внутри сахарного кольца, таким образом идентифицируя моносахарид.Вицинальные гетероядерные константы взаимодействия HCOC используются для изучения углов скручивания вдоль гликозидной связи между сахарами или вдоль экзоциклических фрагментов, выявляя таким образом молекулярную конформацию.
Сахарные кольца представляют собой относительно жесткие молекулярные фрагменты, поэтому характерны вицинальные протон-протонные связи:
- Экваториально-осевой: 1–4 Гц
- От экваториального к экваториальному: 0–2 Гц.
- Аксиально-аксиальный неаномерный: 9–11 Гц.
- Аксиально-аксиальный аномер: 7–9 Гц.
- Аксиально экзоциклическому гидроксиметилу: 5 Гц, 2 Гц
- Геминаль между гидроксиметильными протонами: 12 Гц.
Ядерные эффекты Оверхаузера (NOE)
[ редактировать ]NOE чувствительны к межатомным расстояниям, что позволяет использовать их в качестве конформационного зонда или доказательства образования гликозидной связи. Обычной практикой является сравнение расчетных и экспериментальных протон-протонных NOE в олигосахаридах для подтверждения теоретической конформационной карты. Расчет NOE подразумевает оптимизацию молекулярной геометрии.
Другие наблюдаемые ЯМР
[ редактировать ]Сообщалось, что релаксивность, скорость ядерной релаксации, форма линий и другие параметры полезны при структурных исследованиях углеводов. [1]
Определение структуры углеводов методом ЯМР-спектроскопии
[ редактировать ]Структурные параметры углеводов
[ редактировать ]Ниже приводится список структурных особенностей, которые можно выявить с помощью ЯМР:
- Химическая структура каждого углеводного остатка в молекуле, включая
- размер углеродного скелета и тип сахара (альдоза/кетоза)
- размер цикла (пираноза/фураноза/линейный)
- стереоконфигурация всех атомов углерода (идентификация моносахаридов)
- стереоконфигурация аномерного углерода (α/β)
- абсолютная конфигурация (D/L)
- расположение амино-, карбокси-, дезокси- и других функций
- Химическая структура неуглеводных остатков в молекуле (аминокислоты, жирные кислоты, спирты, органические агликоны и т. д.)
- Позиции замещения в остатках
- Последовательность остатков
- Стехиометрия концевых остатков и боковых цепей
- Расположение фосфатных и сульфатдиэфирных связей
- Степень полимеризации и положение рамки (для полисахаридов)
ЯМР-спектроскопия по сравнению с другими методами
[ редактировать ]Широко известные методы структурных исследований, такие как масс-спектрометрия и рентгеноструктурный анализ, лишь ограниченно применимы к углеводам. [1] Такие структурные исследования, как определение последовательности или идентификация новых моносахаридов, приносят наибольшую пользу от ЯМР-спектроскопии.Абсолютную конфигурацию и степень полимеризации не всегда можно определить только с помощью ЯМР, поэтому процесс структурного выяснения может потребовать дополнительных методов. Хотя состав мономеров можно определить с помощью ЯМР, хроматографические и масс-спектроскопические методы иногда позволяют получить эту информацию проще. Остальные особенности структуры, перечисленные выше, можно определить исключительно методами ЯМР-спектроскопии. Ограничением структурных исследований углеводов с помощью ЯМР является то, что выяснение структуры вряд ли может быть автоматизировано и требует, чтобы эксперт-человек получил структуру на основе спектров ЯМР.
Применение различных методов ЯМР к углеводам
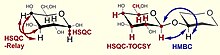
[ редактировать ]Сложные гликаны обладают множеством перекрывающихся сигналов, особенно в протонном спектре. Следовательно, для определения сигналов выгодно использовать 2D-эксперименты.В таблице и на рисунках ниже перечислены наиболее распространенные методы ЯМР, используемые при исследовании углеводов.

| ЯМР-эксперимент | Описание | Полученная информация |
|---|---|---|
| 1 Ч 1Д | 1D протонный спектр | измерение связей, общая информация, идентификация остатков, основа для определения спектра углерода |
| 13 С ББ | 1D спектр углерода-13 с протонной развязкой | подробная информация, идентификация остатков, позиции замещения |
| 31 П ББ, 15 Н ББ | Спектры одномерных гетероядер, разделенных протонами | Дополнительная информация |
| АПТ, 13 ОТДЕЛ С | прикрепленный протонный тест, управляемый усиленным переносом поляризации (отредактированный 1D спектр углерода-13) | назначение CH 2 групп |
| 13 C Закрытый, 31 П Закрытый | Протон-связанные 1D спектры углерода-13 и гетероядер | измерение гетероядерных связей, выяснение аномерной конфигурации, конформационные исследования |
| 1 ЧАС, 1 H J-разрешено | График 2D ЯМР, показывающий J-муфты во втором измерении | точные J-связи и значения химического сдвига для переполненных спектральных областей |
| 1 Н ДОЗА | График 2D ЯМР со спектрами протонов в зависимости от коэффициента молекулярной диффузии | измерение коэффициента диффузии, оценка размера/массы молекул, спектральное разделение различных молекул в смеси |
| 1 ЧАС, 1 Ч УЮТНЫЙ | Корреляция спина протона | назначение спектра протонов с использованием вицинальных связей |
| УЮТНЫЙ RCT, УЮТНЫЙ RCT2 | Корреляция спина протона с одно- или двухступенчатой эстафетной передачей когерентности | назначение спектра протонов, при котором сигналы соседних вицинальных протонов перекрываются |
| DQF УЮТНЫЙ | Двухквантовая фильтрованная спиновая корреляция протонов | Величины J-связи и количество протонов, участвующих в J-связи |
| 1 H HD диф. | Селективная дифференциальная гоморазвязка | анализ формы линий перекрывающихся сигналов протонов |
| ТОКСИ (ХОХАХА) | Полная корреляция всех протонов в спиновой системе | различение спиновых систем остатков |
| 1D ТОКСИ | TOCSY одного сигнала | извлечение спиновой системы определенного остатка |
| НОЭСИ, РОЗИ | Корреляция гомоядерного ядерного эффекта Оверхаузера (через пространство) | выявление пространственно близких пар протонов, определение последовательности остатков, определение усредненной конформации |
| 1 H НЕКОТОРЫЕ различия | Выборочное дифференциальное измерение NOE | исследования пространственных контактов протонов |
| 1 ЧАС, 13 С HSQC | Гетероядерная одноквантовая когерентность, прямая спиновая корреляция протон-углерод | присвоение спектра углерода |
| 1 ЧАС, 31 П HSQC | Гетероядерная одноквантовая когерентность, спиновая корреляция протона и фосфора | локализация остатков фосфорной кислоты в фосфогликанах |
| 1 ЧАС, 13 С HMBC | Гетероядерная корреляция множественных связей, вицинальная спиновая корреляция протон-углерод | определение последовательности остатков, характера ацетилирования/амидирования, подтверждение положений замен |
| 1 Н,Х 1D HMBC | HMBC для одиночного сигнала | отнесение протона к определенному углероду или гетероатому |
| 1 ЧАС, 13 C Реле HSQC | Неявная углерод-углеродная корреляция через вицинальные связи присоединенных протонов | присвоение соседних атомов углерода |
| 1 ЧАС, 13 C HSQC-TOCSY | Корреляция протонов со всеми атомами углерода внутри спиновой системы и наоборот. | отнесение C5 с помощью H6 и решение подобных задач, разделение спектра углерода на подспектры остатков |
| 1 H,X 1D ЧТО-ТО | Гетероядерное измерение NOE | гетероядерные пространственные контакты, конформации |
Схема исследования
[ редактировать ]ЯМР-спектроскопические исследования включают в себя следующие этапы:
- Экстракция углеводного материала (для природных гликанов)
- Химическое удаление фрагментов, маскирующих закономерности (для полимеров)
- Разделение и очистка углеводного материала (для экспериментов 2D ЯМР рекомендуется 10 мг или более)
- Подготовка проб (обычно в D 2 O)
- Получение 1D-спектров
- Планирование, сбор и обработка других экспериментов ЯМР (обычно требуется от 5 до 20 часов)
- Назначение и интерпретация спектров (см. примерный рисунок)
- Если структурную проблему невозможно решить: химическая модификация/разложение и ЯМР-анализ продуктов.
- Получение спектров нативного (немаскированного) соединения и их интерпретация на основе модифицированной структуры.
- Представление результатов

Базы данных и инструменты ЯМР углеводов
[ редактировать ]Было создано множество баз данных о химических сдвигах и связанных с ними услуг для облегчения структурного выяснения и экспертного анализа их спектров ЯМР. Из них несколько информационных инструментов посвящены исключительно углеводам:
- GlycoSCIENCES.de
- более 4000 ЯМР-спектров гликанов млекопитающих [2]
- поиск структуры по сигналам ЯМР и наоборот
- CSDB (база данных о структуре углеводов [3] [4] ) содержит:
- более 20 000 ЯМР-спектров (по состоянию на 2024 г.) бактериальных, растительных, грибковых и протистальных гликанов,
- поиск структуры по сигналам ЯМР и наоборот
- процедура моделирования эмпирических спектров, оптимизированная для углеводов, [5]
- статистическая оценка химического сдвига на основе алгоритма HOSE, оптимизированного для углеводов, [6] [7]
- инструмент генерации структуры и ранжирования на основе ЯМР. [6]
- CASPER (компьютерная оценка спектра обычных полисахаридов). [8] [9] содержит:
- база данных химических сдвигов,
- процедура моделирования эмпирических спектров, оптимизированная для углеводов,
- онлайн-интерфейс.
- инструмент сопоставления структур. Химические сдвиги как протона, так и углерода C и H можно использовать для доступа к структурной информации.
Моделирование наблюдаемых ЯМР
[ редактировать ]
Были рассмотрены несколько подходов к моделированию наблюдаемых ЯМР углеводов. [1] Они включают в себя:
- Подходы к универсальным статистическим базам данных (ACDLabs, Modgraph и т. д.)
- Использование нейронных сетей для уточнения прогнозов
- Методы на основе регрессии
- ЗАРЯЖАТЬ
- Эмпирические схемы, оптимизированные по углеводам (CSDB/BIOPSEL, CASPER).
- Комбинированный расчет молекулярной механики/динамической геометрии и квантовомеханическое моделирование/итерация наблюдаемых ЯМР (программное обеспечение PERCH NMR)
- Подходы ONIOM (оптимизация разных частей молекулы с разной точностью)
- Расчеты ab initio .
Растущая вычислительная мощность позволяет использовать тщательные квантово-механические расчеты на высоких уровнях теории и большие базисные наборы для уточнения молекулярной геометрии углеводов и последующего прогнозирования наблюдаемых ЯМР с использованием GIAO и других методов с учетом эффекта растворителя или без него. Среди комбинаций теоретического уровня и базисного набора, которые были признаны достаточными для предсказаний ЯМР, были B3LYP/6-311G++(2d,2p) и PBE/PBE (см. обзор). Для сахаридов было показано, что эмпирические схемы, оптимизированные по углеводам, обеспечивают значительно лучшую точность (0,0–0,5 ppm на миллион). 13 C-резонанс), чем квантово-химические методы (более 2,0 ppm на резонанс), которые считаются лучшими для моделирования ЯМР и работают в тысячи раз быстрее. Однако эти методы могут предсказывать только химические сдвиги и плохо работают для неуглеводных частей молекул.В качестве репрезентативного примера см. рисунок справа.
См. также
[ редактировать ]- Методы 1D и 2D ЯМР-спектроскопии в структурных исследованиях природных гликополимеров (лекция) [10]
- Базы данных по углеводам за последнее десятилетие (лекция; включает данные моделирования ЯМР) [11]
- Углеводы
- Гликан
- Ядерный магнитный резонанс
- Спектроскопия ядерного магнитного резонанса нуклеиновых кислот
- Спектроскопия ядерно-магнитного резонанса белков
- ЯМР-спектроскопия
- Ядерный эффект Оверхаузера
Ссылки
[ редактировать ]- ^ Jump up to: а б с Тукач Ф.В.; Анаников В.П. (2013). «Последние достижения в вычислительном прогнозировании параметров ЯМР для выяснения структуры углеводов: методы и ограничения» . Обзоры химического общества . 42 (21): 8376–8415. дои : 10.1039/C3CS60073D . ПМИД 23887200 .
- ^ http://csdb.glicosciences.de
- ^ «Российский ЦКББ» . csdb.glicoscience.ru .
- ^ Тукач Ф.В. (2011). «База данных структуры бактериальных углеводов 3: принципы и реализация». Журнал химической информации и моделирования . 51 (1): 159–170. дои : 10.1021/ci100150d . ПМИД 21155523 .
- ^ «Помощь CSDB: миграция из бактериальной и растительно-грибной CSDB» .
- ^ Jump up to: а б «Помощь CSDB: миграция из бактериальной и растительно-грибной CSDB» . csdb.glicoscience.ru .
- ^ Капаев Р.Р.; Егорова К.С.; Тукач Ф.В. (2014). «Схема обобщения структуры углеводов для моделирования экспериментальных наблюдаемых величин на основе базы данных, таких как химические сдвиги ЯМР». Журнал химической информации и моделирования . 54 (9): 2594–2611. дои : 10.1021/ci500267u . ПМИД 25020143 .
- ^ «КАСПЕР - Главная страница» .
- ^ П.-Э. Янссон; Р. Стенуц; Г. Видмальм (2006). «Определение последовательности олигосахаридов и обычных полисахаридов с использованием ЯМР-спектроскопии и новой веб-версии компьютерной программы CASPER». Исследование углеводов . 341 (8): 1003–1010. дои : 10.1016/j.carres.2006.02.034 . ПМИД 16564037 .
- ^ Тукач, Фил. «1D и 2D ЯМР-спектроскопия в структурных исследованиях природных гликополимеров» . Фил Тукач .
- ^ Тукач, Фил. «Фил Тукач: базы данных Glyco» . Фил Тукач .
Дальнейшее чтение
[ редактировать ]- Д. Ловицкий; А. Черный; Дж. Млынарский (2013). Ядерный магнитный резонанс: ЯМР углеводов . Королевское химическое общество . стр. 383. ISBN 978-1-84973-577-3 .
Внешние ссылки
[ редактировать ] СМИ, связанные со спектроскопией ядерного магнитного резонанса углеводов, на Викискладе?
СМИ, связанные со спектроскопией ядерного магнитного резонанса углеводов, на Викискладе?