Аллотропы мышьяка

Мышьяк в твердом состоянии встречается в виде серых, черных или желтых аллотропов . Эти различные формы имеют разнообразные структурные мотивы, причем желтый мышьяк обеспечивает самый широкий диапазон реакционной способности. В частности, реакция желтого мышьяка с элементами основной группы и переходных металлов приводит к образованию соединений с широким спектром структурных мотивов, причем бабочки , сэндвича и реальгара наиболее заметными являются фрагменты типа .
Серый мышьяк
[ редактировать ]
Серый мышьяк, также называемый серым мышьяком или металлическим мышьяком, является наиболее стабильным аллотропом элемента при комнатной температуре и, как таковой, является его наиболее распространенной формой. [1] Этот мягкий, хрупкий аллотроп мышьяка имеет стально-серый металлический цвет и является хорошим проводником. [2] Ромбоэдрическая форма этого аллотропа аналогична аллотропу фосфора - черному фосфору. В своей α-форме кольца As 6 в конфирматах стула конденсируются в упакованные слои, лежащие перпендикулярно кристаллографической оси c . Внутри каждого слоя вицинальные расстояния связи As-As составляют 2,517 Å, а расстояния связи As-As между слоями составляют 3,120 Å. Общая структура имеет искаженную октаэдрическую геометрию, что приводит к преимущественно металлическим свойствам этого аллотропа. При сублимации при 616 °C молекулы мышьяка в газовой фазе теряют эту упаковку и образуют небольшие кластеры As 4 , As 2 и As, хотя As 4 в этой фазе, безусловно, наиболее распространен. [1] Если эти пары быстро конденсируются на холодной поверхности (<200 К), образуется твердый желтый мышьяк (As 4 ) из-за недостатка энергии, необходимой для образования ромбоэдрической решетки серого мышьяка. И наоборот, конденсация паров мышьяка на нагретой поверхности приводит к образованию аморфного черного мышьяка. Кристаллическую форму черного мышьяка также можно выделить, а аморфную форму можно отжечь, чтобы вернуть металлическую форму серого мышьяка. Желтый мышьяк также можно легко вернуть в серый аллотроп путем воздействия света или возврата молекулы к комнатной температуре. [1]
Реактивность
[ редактировать ]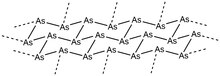
Сообщалось об относительно небольшом количестве реакций in-situ с участием серого мышьяка из-за его низкой растворимости, хотя на воздухе он реагирует с образованием газообразного As 2 O 3 . Известны два примера реакционной способности серого мышьяка по отношению к переходным металлам. [3] [4] В этих реакциях циклопентадиенильные комплексы молибдена, вольфрама и хрома через потерю монооксида углерода реагируют с серым мышьяком и образуют моно-, ди- и тримышьяковые соединения.

Черный мышьяк
[ редактировать ]
Черный, или аморфный мышьяк (химическая формула As n ) синтезируется сначала путем сублимации серого мышьяка с последующей конденсацией на нагретой поверхности. Эта структура считается мышьяковистым аналогом красного фосфора . Структура черного мышьяка в его кристаллической фазе, хотя и не синтезируется в чистом виде, в широком смысле аналогична черному фосфору и принимает ромбическую структуру, построенную из As 6 колец . Черный мышьяк пока синтезирован только в присутствии атомарных примесей, в том числе ртути, [5] фосфор и кислород, хотя чистая форма черного мышьяка была обнаружена в регионе Копьяпо в Чили . Механическое расслоение минерала арсеноламприта, найденного в чилийских пещерах, выявило молекулярную структуру с высокой синфазной анизотропией и потенциалом полупроводникового материала. [6]
Желтый мышьяк
[ редактировать ]
Быстрая конденсация паров мышьяка на холодной поверхности приводит к образованию желтого мышьяка (As 4 ), состоящего из четырех атомов мышьяка, расположенных в тетраэдрической геометрии, аналогичной белому фосфору . Хотя это единственная известная растворимая форма мышьяка, желтый мышьяк метастабилен : при комнатной температуре или в присутствии света структура быстро разлагается, принимая низкоэнергетическую конфигурацию серого мышьяка. По этой причине необходимы тщательные меры предосторожности для поддержания желтого мышьяка в состоянии, пригодном для реакции, включая строгое исключение света и поддержание температуры ниже -80 ° C. [1] Желтый мышьяк является аллотропом, наиболее подходящим для исследований реакционной способности из-за его растворимости (низкой, но сравнительно высокой по сравнению с металлическим аллотропом) и молекулярной природы. По сравнению с его более легким родственником, фосфором , реакционная способность мышьяка относительно недостаточно изучена. Исследования по изучению реакций с мышьяком касаются прежде всего активации соединений основной группы и переходных металлов; в случае комплексов переходных металлов As 4 продемонстрировал компетентную реакционную способность в d-блоке периодической таблицы.
Реакционная способность по отношению к соединениям основной группы
[ редактировать ]О первой активации соединения основной группы желтым мышьяком сообщили в 1992 году Уэст и его коллеги, включавшие реакцию As 4 с дисиленовым соединением, тетрамезитилдисиленом, с образованием смеси соединений, включающей структурный мотив «бабочка» из мостиковых атомов мышьяка. [7] Примечательно, что смесь продуктов, полученная в этой реакции, отличается от аналогичной реакции с P 4 , в результате которой образуется только соединение «бабочка», подчеркивая, что реакционная способность желтого мышьяка и белого фосфора не может считаться одинаковой. Первое органозамещенное соединение As 4 было получено Шеером и его коллегами в 2016 году путем реакции с Cp. Домашний питомец радикальный. [8] Аналогично соединению-бабочке, полученному группой Уэста, продукт, полученный в этой реакции, имел мостиковый мотив As 4 , который обратимо возвращал As 4 и родительский радикал в присутствии света или тепла. Эта характеристика делает Cp Домашний питомец 2 Комплекс As 4 представляет собой уникально подходящую молекулу «хранилища» для желтого мышьяка, поскольку он стабилен при хранении при комнатной температуре в темноте, но может выделять As 4 в термических или фотохимических растворах.

Было показано, что в других реакциях соединений основной группы с желтым мышьяком участвуют звенья мышьяка с более чем четырьмя атомами. В реакции с силиленовым соединением [PhC(N t Bu) 2 SiN(SiMe 3 ) 2 ] наблюдалось агрегирование As 4 с образованием каркасного соединения из десяти атомов мышьяка, включая семичленное мышьяковистое кольцо в его центре. [9]
Реакционная способность по отношению к соединениям переходных металлов
[ редактировать ]
Металлы 4 и 5 групп
[ редактировать ]Среди ранних элементов переходных металлов (группы 4 и 5) на сегодняшний день зарегистрировано несколько примеров активации мышьяком. Показано, что монооксидные комплексы циркония с дериватизированными циклопентадиенильными лигандами реагируют с желтым мышьяком в кипящем ксилоле с выделением CO и связыванием фрагмента As 4 в η. 1:1 -мода. [11] Следовые количества димера циркония, связанного мостиком (μ,η 2:2:1 -Как 5 В этом исследовании также сообщалось о )-фрагменте, в котором комплексы описывались как возможные реагенты для переноса As 4 . В группе 5 более широко изучена активация мышьяка, известны комплексы как ниобия, так и тантала. [10] [12] Исследование топологии электронной плотности в системе фосфор/мышьяк/ниобий продемонстрировало уникальную η 2 -конфигурация связи в этих комплексах, в которой двойная связь мышьяк-фосфор боком связана с ниобиевым центром.
Металлы 6 группы
[ редактировать ]
Реакции желтого мышьяка с переходными металлами 6-й группы в основном протекают через термолитическое отщепление монооксида углерода в карбонильных комплексах хрома и молибдена. Яркие примеры включают образование трехэтажных комплексов [(Cp Р Мо) 2 (м, н 6 -As 6 )] и [{Cp Р Cr} 2 (μ,η 5 -As 5 )] по реакции соответствующих димеров молибдена и хрома с желтым мышьяком. [14] [13] Эти замечательные структуры представляют собой три плоских кольца, расположенных параллельно, что дает идеализированную точечную группу D 5h для комплекса хрома. Обе эти реакции требуют жестких условий реакции, таких как кипение ксилола, чтобы преодолеть высокие барьеры активации As 4 . И наоборот, использование более стерически требовательных к металлоцентру лигандов позволило проводить реакции в более мягких условиях с молибденом и хромом. Катализатор Cummins Mo(N( t Bu)Ar) 3 , также известный как расщепитель тройной связи NN в динитроге, реагирует с желтым мышьяком с образованием концевого мышьяковистого фрагмента, связанного тройной связью с металлическим центром - одного из немногих соединений, которые, как известно, содержат концевой атом мышьяка. [15] Комплексы с кратными связями металл-металл также обеспечивают мягкую As 4 активацию параметра . Образец с пятикратной связью хром-хром, о котором сообщил Кемпе, реагирует с желтым мышьяком с образованием краун-комплекса, в котором четыре атома мышьяка образуют примерно тетраэдрическую структуру, при этом каждый атом хрома связан с тремя атомами мышьяка. [16]
Металлы 8 и 9 групп
[ редактировать ]
Металлы 8-й и 9-й групп обладают наиболее обширной библиотекой реакционных способностей с желтым мышьяком, зафиксированной в научной литературе, при этом особое внимание уделяется реакциям комплексов железа и кобальта с As 4 . Подобно сэндвич-комплексам хрома и молибдена (Cp Р Комплексы железа Fe(CO) 2 ] 2 реагируют с желтым мышьяком с образованием аналогичных биметаллических продуктов с «трехэтажной» геометрией. В этих отчетах также подробно описано выделение ключевого промежуточного продукта пентаарсаферроцена ([Cp Р Fe(μ 5 -Как 5 )]). [18] Это промежуточное соединение, изолобальное ферроцену, заменяет один из циклопентадиенильных лигандов циклическим лигандом As 5 , который имеет длину связи As-As 2,312 Å (в соответствии с делокализованными двойными связями As-As). Эту реакционную способность «сэндвич-формирования» можно существенно регулировать путем введения более объемных лигандов. Модификация циклопентадиенильных групп гораздо более объемистыми производными дает совершенно другой набор продуктов. комплекс «бабочка» с центральной единицей As 4 Сначала формируется . Облучение светом приводит к дальнейшему удалению CO и образованию мостикового комплекса-бабочки, который затем перестраивается в уникальный комплекс с центральным фрагментом As 8 . Этот лиганд, формально тетраанионный, образует восьмичленное кольцо, соединяющее всего четыре атома железа. [17]
Большая часть такой же реакционной способности, включая образование соединений «бабочка» и «сэндвич», была описана для комплексов кобальта в присутствии желтого мышьяка. Помимо этих соединений, история реакционной способности кобальта и желтого мышьяка восходит к 1978 году, когда Саккони и его коллеги сообщили о реакции тетрафторбората кобальта и желтого мышьяка в присутствии 1,1,1-трис(дифенилфосфинометил)этана . Образующийся комплекс содержит циклический фрагмент As 3 , соединяющий два кобальтовых центра, первый из которых формально обозначается как 3π-электронная система. [19] Реакция димера [Cp*Co(CO)] 2 с желтым мышьяком была показана Scherer et al. для производства широкого спектра изолируемых продуктов, содержащих смесь связывающих фрагментов мышьяка, включая циклобутаноподобные комплексы и комплексы типа «бабочка». [20] Известны аналогичные реакции с комплексами родия. [21]
Металлы 10 и 11 групп
[ редактировать ]Среди элементов групп 10 и 11 никель и медь наиболее заметно фигурируют в литературных реакциях с желтым мышьяком. Соли тетрафторбората никеля реагируют аналогично комплексам кобальта в присутствии трифоса с образованием сэндвич-структуры с центральным циклическим фрагментом As 3 . Как и в случае с железом, реакция циклопентадиенилкарбонильных комплексов никеля с As 4 приводит к образованию разнообразных би- и мультиметаллических продуктов в зависимости от размера присутствующих лигандов, хотя природа и геометрическое строение этих соединений отличаются от наблюдаемых с железом. [19] К ним относятся тримеры с мостиковыми фрагментами As 4 и As 5 в кубановых структурных схемах при использовании лигандов Cp меньшего размера, а также комплексы с искаженной гексагональной призмой с двумя фрагментами никеля и четырьмя атомами мышьяка при введении более объемных групп Cp.
Реакция комплекса меди [L 2 Cu(NCMe)] (L 2 = [{N(C 6 H 3 i Pr 2 -2,6)C(Me)} 2 CH]) с желтым мышьяком дает As 4 -мостиковый димер [{L 2 Cu} 2 - (m,n 2:2 -Ас 4 )]. [22] Четырехатомный фрагмент мышьяка в этом комплексе считался «неповрежденным» желтым мышьяком на основе расчетов теории функционала плотности, определяющих изменение критических точек связи между свободными и связанными молекулами мышьяка. В частности, наблюдался лишь небольшой сдвиг в критических точках связи между атомами мышьяка, участвующими в связывании с медью; остальные критические точки связи были очень похожи на свободный желтый мышьяк.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б с д и ж г Зайдль, Михаэль; Балаж, Габор; Шеер, Манфред (22 марта 2019 г.). «Химия желтого мышьяка» . Химические обзоры . 119 (14): 8406–8434. doi : 10.1021/acs.chemrev.8b00713 . ISSN 0009-2665 . ПМИД 30900440 . S2CID 85448636 .
- ^ «Аллотроп: Мышьяк» . dirkncl.github.io . Проверено 1 ноября 2020 г.
- ^ Jump up to: а б Зиглер, М.Л. (1988). «Получение и характеристика тетраэдранов типа Cp3M3As(CO)6 и Cp2M2As2(CO)4 (Cp = C5H5, M = Mo, W), а также производных этих тетраэдранов». Химические отчеты . 121 (1). дои : 10.1002/cber.v121:1 . ISSN 0009-2940 .
- ^ Jump up to: а б Го, Лай Юн.; Вонг, Ричард CS; Ага, Вай Хин.; Мак, Томас CW (1991). «Синтез и термолиз ди- и тримышьяковых комплексов хрома. Кристаллическая структура [CpCr(CO)2]2As2» . Металлоорганические соединения . 10 (4): 875–879. дои : 10.1021/om00050a015 . ISSN 0276-7333 .
- ^ Антонатос, Николас; Люкса, Ян; Стурала, Иржи; Софер, Зденек (2020). «Черный мышьяк: новый метод синтеза путем каталитической кристаллизации мышьяковистого стекла» . Наномасштаб . 12 (9): 5397–5401. дои : 10.1039/C9NR09627B . ISSN 2040-3372 . ПМИД 31894222 . S2CID 209544160 .
- ^ Чен, Ябин; Чен, Чаоюй; Килхофер, Роберт; Лю, Хуэйли; Юань, Чжицюань; Цзян, Лили; Эх, Джунки; Пак, Чонсук; Ко, Чанхён; Чхве, Хван Сон; Авила, Хосе (2018). «Черный мышьяк: слоистый полупроводник с экстремальной анизотропией в плоскости» . Продвинутые материалы . 30 (30): 1800754. arXiv : 1805.00418 . дои : 10.1002/adma.201800754 . ISSN 1521-4095 . ПМИД 29893020 .
- ^ Тан, Робин П.; Комерлато, Надя М.; Пауэлл, Дуглас Р.; Уэст, Роберт (1992). «Реакция тетрамезитилдисилена с As4: синтез и структура новой трициклической кольцевой системы мышьяк-кремний» . Angewandte Chemie International Edition на английском языке . 31 (9): 1217–1218. дои : 10.1002/anie.199212171 . ISSN 1521-3773 .
- ^ Jump up to: а б Хейнл, Себастьян; Балаж, Габор; Штаубер, Андреас; Шеер, Манфред (15 ноября 2016 г.). «CpPEt2As4-органически замещенное соединение As4-бабочка» . Международное издание «Прикладная химия» . 55 (50): 15524–15527. дои : 10.1002/anie.201608478 . ISSN 1433-7851 . ПМИД 27862725 .
- ^ Jump up to: а б Зейтц, Андреас Э.; Экхардт, Мария; Сен, Сакья С.; Эрлебах, Андреас; Пересыпкина Евгения Владимировна; Роски, Герберт В.; Серка, Марек; Шеер, Манфред (2017). «Различная реакционная способность As4 по отношению к дисиленам и силиленам» . Angewandte Chemie, международное издание . 56 (23): 6655–6659. дои : 10.1002/anie.201701740 . ISSN 1521-3773 . ПМИД 28471032 .
- ^ Jump up to: а б Спинни, Хизер А.; Пиро, Николас А.; Камминс, Кристофер К. (11 ноября 2009 г.). «Реакционная способность тройной связи промежуточного соединения комплекса AsP: синтез на основе молекулярного мышьяка, As4» . Журнал Американского химического общества . 131 (44): 16233–16243. дои : 10.1021/ja906550h . hdl : 1721.1/65118 . ISSN 0002-7863 . ПМИД 19842699 .
- ^ Шмидт, Моника; Зейтц, Андреас Э.; Экхардт, Мария; Балаж, Габор; Пересыпкина Евгения Владимировна; Вировец, Александр Васильевич; Ридльбергер, Феликс; Боденштайнер, Майкл; Цольнхофер, Ева М.; Мейер, Карстен; Шеер, Манфред (27 сентября 2017 г.). «Реагент для связывания изомеров комплексов железа» . Журнал Американского химического общества . 139 (40): 13981–13984. дои : 10.1021/jacs.7b07354 . ISSN 0002-7863 . ПМИД 28933848 .
- ^ Шерер, Отто Дж.; Вондунг, Юрген; Вольмерсхойзер, Готхельф (1989). «Тетрафосфациклобутадиен как комплексный лиганд» . Международное издание «Прикладная химия» на английском языке . 28 (10): 1355–1357. дои : 10.1002/anie.198913551 . ISSN 1521-3773 .
- ^ Jump up to: а б Шерер, Отто Дж.; Видеманн, Вольфганг; Вольмерсхойзер, Готхельф (1990). «Комплексы хрома с цикло-Asx-лигандами» . Химические отчеты (на немецком языке). 123 (1): 3–6. дои : 10.1002/cber.19901230102 .
- ^ Jump up to: а б Шерер, О.Дж. (1989). «Трёхэтажный сэндвич-комплекс с ненапряженным циклическим средним слоем пентаарсана». Дж. Органомет. Хим . 361 : C11-C14. дои : 10.1016/0022-328X(89)87363-2 .
- ^ Керли, Джон Дж.; Пиро, Николас А.; Камминс, Кристофер К. (19 октября 2009 г.). «Концевой комплекс арсенида молибдена, синтезированный из желтого мышьяка» . Неорганическая химия . 48 (20): 9599–9601. дои : 10.1021/ic9016068 . hdl : 1721.1/64721 . ISSN 0020-1669 . ПМИД 19764796 .
- ^ Шварцмайер, Кристоф; Нур, Аваль; Глатц, Гермунд; Забель, Манфред; Тимошкин Алексей Юрьевич; Коссарт, Брэнди М.; Камминс, Кристофер С.; Кемпе, Ретт; Шеер, Манфред (2011). «Образование цикло-Е42- звеньев (E4=P4, As4, AsP3) комплексом с пятерной связью Cr-Cr» . Angewandte Chemie, международное издание . 50 (32): 7283–7286. дои : 10.1002/anie.201102361 . ISSN 1521-3773 . ПМИД 21698734 .
- ^ Jump up to: а б Шварцмайер, Кристоф; Тимошкин Алексей Юрьевич; Балаж, Габор; Шеер, Манфред (2014). «Селективное образование и необычная реакционная способность тетраарсабицикло[1.1.0]бутановых комплексов» . Angewandte Chemie, международное издание . 53 (34): 9077–9081. дои : 10.1002/anie.201404653 . ISSN 1521-3773 . ПМИД 25123699 .
- ^ Шерер, О.Дж.; Блат, Кристоф; Вольмерсхойзер, Готхельф (1 мая 1990 г.). «Ферроцены с пентаарсациклопентадиенильным лигандом» . Журнал металлоорганической химии (на немецком языке). 387 (2): C21–C24. дои : 10.1016/0022-328X(90)80029-Y . ISSN 0022-328X .
- ^ Jump up to: а б Ди Вайра, Массимо; Мидоллини, Стефано; Саккони, Луиджи (1979). «Циклотрифосфор и циклотриарсен как лиганды в комплексах «двойного сэндвича» кобальта и никеля» . Журнал Американского химического общества . 101 (7): 1757–1763. дои : 10.1021/ja00501a019 . ISSN 0002-7863 .
- ^ Шерер, Отто Дж.; Пфайффер, Карл; Вольмерсхойзер, Готхельф (1 ноября 1992 г.). «Комплексы кобальта с лигандами As4» . Химические отчеты . 125 (11): 2367–2372. дои : 10.1002/cber.19921251107 . ISSN 0009-2940 .
- ^ Шерер, Отто Дж.; Хёбель, Бернд; Вольмерсхойзер, Готхельф (1992). «P10-дигидрофульвален с двойным краем как 16-электронный донорный лиганд» . Прикладная химия . 104 (8): 1042–1043. дои : 10.1002/anie.19921040811 . ISSN 0044-8249 .
- ^ Спитцер, Фабиан; Серка, Марек; Латронико, Марио; Мастрорилли, Пьеро; Вировец, Александр Васильевич; Шеер, Манфред (2015). «Фиксация и освобождение неповрежденных тетраэдров E4 (E = P, As)» . Angewandte Chemie, международное издание . 54 (14): 4392–4396. дои : 10.1002/anie.201411451 . ISSN 1521-3773 . ПМИД 25677593 .