Аллотропы фосфора


Элементарный фосфор может существовать в нескольких аллотропах , наиболее распространенными из которых являются белые и красные твердые вещества. Известны также сплошные фиолетовые и черные аллотропы. Газообразный фосфор существует в виде дифосфора и атомарного фосфора.
Белый фосфор
[ редактировать ] Образец белого фосфора с куском, удаленным из угла, чтобы обнажить неокисленный материал | |
 Молекула тетрафосфора | |
| Имена | |
|---|---|
| ИЮПАК имена Белый фосфор Тетрафосфор | |
| Систематическое название ИЮПАК 1,2,3,4-Тетрафосфаттрицикло[1.1.0.0 2,4 ]бутан | |
Другие имена
| |
| Идентификаторы | |
3D model ( JSmol ) | |
| ХимическийПаук | |
ПабХим CID | |
| Число | 1381 |
| Характеристики | |
| PP4 | |
| Молярная масса | 123.895 g·mol −1 |
| Плотность | 1,82 г/см 3 |
| Температура плавления | 44,1 °С; 111,4 ° F; 317,3 К |
| Точка кипения | 280 °С; 536 °Ф; 553 К |
| Опасности | |
| NFPA 704 (огненный алмаз) | |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |

Белый фосфор , желтый фосфор или просто тетрафосфор ( P 4 ) существует в виде молекул из четырех атомов фосфора в тетраэдрической структуре, соединенных шестью одинарными фосфор-фосфорными связями . Тетраэдрическое и расположение приводит к деформации кольца нестабильности. [1] Хотя оба они называются «белым фосфором», на самом деле известны два разных кристаллических аллотропа, обратимо меняющихся местами при 195,2 К. [2] элемента Стандартное состояние — это объемноцентрированная кубическая α-форма, которая на самом деле метастабильна при стандартных условиях . [1] Считается, что β-форма имеет гексагональную кристаллическую структуру. [2]
Расплавленный и газообразный белый фосфор также сохраняет тетраэдрические молекулы до 800 ° C (1500 ° F; 1100 К), когда он начинает разлагаться на P.
2 молекулы. [3] П
Молекула 4 в газовой фазе имеет длину связи PP r g = 2,1994(3) Å, что было определено методом газовой электронной дифракции . [4] β-форма белого фосфора содержит три немного разных P
4 молекулы, т.е. 18 различных длин связей ПП — от 2,1768(5) до 2,1920(5) Å. Средняя длина связи ПП составляет 2,183(5) Å. [3]
Белый фосфор представляет собой полупрозрачное воскообразное твердое вещество, быстро желтеющее на свету, а нечистый белый фосфор по этой причине называют желтым фосфором. Он светится зеленоватым светом в темноте (при воздействии кислорода), легко воспламеняется и пирофорен (самовоспламеняется) при контакте с воздухом. Он токсичен , вызывая серьезные повреждения печени при проглатывании и окаменевшую челюсть при хроническом проглатывании или вдыхании. Запах горения этой формы имеет характерный чесночный запах, а образцы обычно покрыты белым « пентоксидом дифосфора », состоящим из P 4 O 10 тетраэдрический, в котором между атомами фосфора и в их вершинах внедрен кислород. Белый фосфор мало растворим в воде и может храниться под водой. Действительно, белый фосфор не подвержен самовозгоранию при погружении в воду; из-за этого непрореагировавший белый фосфор может оказаться опасным для любителей пляжного отдыха , которые могут собирать вымытые образцы, не подозревая об их истинной природе. [5] [6] P 4 растворим в бензоле , маслах , сероуглероде и дихлориде серы .
Производство и применение
[ редактировать ]Белый аллотроп можно получить несколькими методами. В промышленном процессе фосфоритную руду нагревают в электрической или топливной печи в присутствии углерода и кремнезема . [7] Элементарный фосфор затем выделяется в виде пара и может быть собран в фосфорной кислоте . Идеализированное уравнение этой карботермической реакции показано для фосфата кальция (хотя фосфоритная руда содержит значительные количества фторапатита ):
- 2 Ca 3 (PO 4 ) 2 + 6 SiO 2 + 10 C → 6 CaSiO 3 + 10 CO + P 4
Белый фосфор имеет значительное давление паров при обычных температурах. Плотность пара указывает на то, что пар состоит из Молекулы P 4 примерно до 800 °C. Выше этой температуры происходит диссоциация на Молекулы P 2 встречаются.
В основании белый фосфор самопроизвольно диспропорционируется с фосфином и различными оксикислотами фосфора . [8]
Он самопроизвольно воспламеняется на воздухе при температуре около 50 ° C (122 ° F) и при гораздо более низких температурах, если он мелко измельчен (из-за снижения температуры плавления ). Фосфор реагирует с кислородом, обычно образуя два оксида в зависимости от количества доступного кислорода: P 4 O 6 ( триоксид фосфора ) при реакции с ограниченным запасом кислорода, и P 4 O 10 при реакции с избытком кислорода. В редких случаях, Р 4 О 7 , P 4 O 8 и P 4 O 9 также образуются, но в небольших количествах. В результате сгорания образуется оксид фосфора (V):
- П 4 + 5 О 2 → П 4 О 10
Благодаря этому свойству белый фосфор используется в качестве оружия .
Пентахлорид фосфора получают реакцией белого фосфора с избытком сухого хлора . [9]
- P 4 + 10Cl 2 → 4PCl 5
Его также можно получить действием сульфурилхлорида на белый фосфор. [9]
- P 4 + 10SO 2 Cl 2 → 4PCl 5 + 10SO 2
Другие аналоги многогранников
[ редактировать ]Хотя белый фосфор образует тетраэдр , простейший из возможных платоновых углеводородов , другие многогранные фосфорные кластеры неизвестны. [10] Белый фосфор превращается в термодинамически более стабильный красный аллотроп, но этот аллотроп не представляет собой изолированные многогранники.
Кубанский , в частности, вряд ли сформируется, [10] и наиболее близким вариантом является полуфосфорное соединение. P 4 (CH) 4 , получают из фосфаалкинов . [11] Другие кластеры более термодинамически выгодны, а некоторые частично образовались как компоненты более крупных полиэлементных соединений. [10]
Красный фосфор
[ редактировать ]

Красный фосфор может образоваться при нагревании белого фосфора до 300 °C (570 °F) в отсутствие воздуха или при воздействии на белый фосфор солнечного света . Красный фосфор существует в виде аморфной сетки. При дальнейшем нагревании аморфный красный фосфор кристаллизуется. Объемный красный фосфор не воспламеняется на воздухе при температуре ниже 240 °C (460 °F), тогда как кусочки белого фосфора воспламеняются при температуре около 30 °C (86 °F).
В стандартных условиях он более стабилен, чем белый фосфор, но менее стабилен, чем термодинамически стабильный черный фосфор. Стандартная энтальпия образования красного фосфора составляет -17,6 кДж/моль. [1] Красный фосфор кинетически наиболее стабилен.
Впервые оно было представлено Антоном фон Шрёттером перед Венской академией наук 9 декабря 1847 года, хотя другие, несомненно, имели это вещество в своих руках и раньше, например Берцелиус. [12]
Приложения
[ редактировать ]Красный фосфор можно использовать в качестве очень эффективного антипирена , особенно в термопластах (например, полиамиде ) и термореактивных материалах (например, эпоксидных смолах или полиуретанах ). Огнезащитный эффект основан на образовании полифосфорной кислоты . Вместе с органическим полимерным материалом эти кислоты образуют обугливание, препятствующее распространению пламени. Риски безопасности, связанные с образованием фосфина и чувствительностью красного фосфора к трению, можно эффективно минимизировать за счет стабилизации и микрокапсулирования . Для облегчения обращения красный фосфор часто используется в виде дисперсий или маточных смесей в различных системах-носителях. Однако в электронных/электрических системах огнезащитный состав на основе красного фосфора фактически запрещен крупными OEM-производителями из-за его склонности вызывать преждевременные выходы из строя. [13] Одна из постоянных проблем заключается в том, что красный фосфор в эпоксидных формовочных массах вызывает повышенный ток утечки в полупроводниковых устройствах. [14] Другой проблемой было ускорение реакций гидролиза в изоляционном материале ПБТ . [15]
Красный фосфор также может использоваться при незаконном производстве метамфетамина и крокодила .
Красный фосфор можно использовать в качестве элементарного фотокатализатора образования водорода из воды. [16] Они демонстрируют устойчивую скорость выделения водорода 633 мкмоль / (ч⋅г) за счет образования мелкоразмерного волокнистого фосфора. [17]
Фиолетовый фосфор или фосфор Гитторфа.
[ редактировать ]


Моноклинный фосфор , или фиолетовый фосфор , также известен как металлический фосфор Хитторфа . [18] [19] В 1865 году Иоганн Вильгельм Хитторф нагрел красный фосфор в запаянной трубке при температуре 530°С. Верхняя часть трубки поддерживалась при температуре 444°С. блестящие непрозрачные моноклинные или ромбоэдрические В результате сублимировались кристаллы. Фиолетовый фосфор также можно получить, растворив белый фосфор в расплавленном свинце в запечатанной трубке при температуре 500 ° C в течение 18 часов. При медленном охлаждении аллотроп Хитторфа кристаллизуется . Кристаллы можно обнаружить, растворив свинец в разбавленной азотной кислоте с последующим кипячением в концентрированной соляной кислоте . [20] Кроме того, существует фиброзная форма с аналогичными фосфорными клетками. Решетчатая структура фиолетового фосфора была представлена Турном и Кребсом в 1969 году. [21] Мнимые частоты, указывающие на иррациональность или нестабильность структуры, были получены для описанной фиолетовой структуры в 1969 году. [22] Также был получен монокристалл фиолетового фосфора. дифракции получена структура решетки фиолетового фосфора, Методом монокристаллической рентгеновской моноклинная с пространственной группой P 2/ n (13) ( a = 9,210, b = 9,128, c = 21,893 Å, β = 97,776°, CSD-1935087 ). Оптическая запрещенная зона фиолетового фосфора, измеренная с помощью спектроскопии диффузного отражения, составила около 1,7 эВ. Температура термического разложения была на 52 °C выше, чем у его аналога из черного фосфора. Фиолетовый фосфорен легко получить как механическим, так и растворным эксфолиированием.
Реакции фиолетового фосфора
[ редактировать ]Фиолетовый фосфор не воспламеняется на воздухе до нагревания до 300 °С и нерастворим во всех растворителях. Он не подвергается воздействию щелочей и лишь медленно реагирует с галогенами . Его можно окислить до азотной кислотой фосфорной кислоты .
Если его нагреть в атмосфере инертного газа, например азота или углекислого газа , он сублимируется , а пары конденсируются в виде белого фосфора. Если его нагреть в вакууме и быстро конденсировать пары, получится фиолетовый фосфор. По-видимому, фиолетовый фосфор представляет собой полимер с высокой относительной молекулярной массой, который при нагревании распадается на Р 2 Молекулы . При охлаждении они обычно димеризуются с образованием Молекулы P 4 (т.е. белого фосфора), но в вакууме они снова соединяются, образуя полимерный аллотроп фиолетового цвета.
Черный фосфор
[ редактировать ]

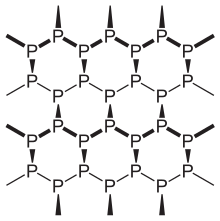
Черный фосфор представляет собой термодинамически стабильную форму фосфора при комнатной температуре и давлении с теплотой образования -39,3 кДж/моль (по отношению к белому фосфору, который определяется как стандартное состояние). [1] Впервые он был синтезирован путем нагрева белого фосфора под высоким давлением (12 000 атмосфер) в 1914 году. Как двумерный материал, по внешнему виду, свойствам и структуре черный фосфор очень похож на графит: он одновременно черный и чешуйчатый, проводник электричества. и имеющие сморщенные листы связанных атомов. [23]
Черный фосфор имеет орторомбическую складчатую сотовую структуру и является наименее реакционноспособным аллотропом из-за его решетки из взаимосвязанных шестичленных колец, где каждый атом связан с тремя другими атомами. [24] [25] В этой структуре каждый атом фосфора имеет пять электронов на внешней оболочке. [26] Черный и красный фосфор также могут иметь кубическую структуру кристаллической решетки. [27] Первый синтез кристаллов черного фосфора под высоким давлением осуществил лауреат Нобелевской премии Перси Уильямс Бриджмен в 1914 году. [28] Соли металлов катализируют синтез черного фосфора. [29]
Датчики на основе черного фосфора обладают рядом превосходящих качеств по сравнению с традиционными материалами, используемыми в пьезоэлектрических или резистивных датчиках. Черный фосфор, характеризующийся своей уникальной сотовой решетчатой структурой, обеспечивает исключительную подвижность носителей. Это свойство обеспечивает его высокую чувствительность и механическую устойчивость, что делает его интересным кандидатом для сенсорной технологии . [30] [31]
фосфорен
[ редактировать ]Сходство с графитом также включает возможность расслаивания (расслоения) скотча, в результате чего получается фосфорен , графеноподобный 2D-материал с превосходными свойствами переноса заряда, свойствами теплопереноса и оптическими свойствами. Отличительные особенности, представляющие научный интерес, включают зависимость ширины запрещенной зоны, которой нет в графене. [32] Это в сочетании с высоким коэффициентом включения/выключения ~10 5 делает фосфорен многообещающим кандидатом для полевых транзисторов (FET). [33] Перестраиваемая запрещенная зона также предполагает перспективное применение в фотодетекторах среднего инфракрасного диапазона и светодиодах. [34] [35] Расслоенный черный фосфор сублимируется при 400 °С в вакууме. [36] Он постепенно окисляется под воздействием воды в присутствии кислорода, что вызывает беспокойство, если рассматривать его, например, как материал для изготовления транзисторов. [37] [38] Расслоенный черный фосфор — это новый анодный материал в области аккумуляторов, демонстрирующий высокую стабильность и способность хранить литий . [39]
Кольцевой фосфор
[ редактировать ]Кольцевой фосфор был теоретически предсказан в 2007 году. [40] Кольцеобразный фосфор был самоорганизован внутри вакуумированных многостенных углеродных нанотрубок с внутренним диаметром 5–8 нм методом паровой капсулирования. Кольцо диаметром 5,30 нм, состоящее из 23 стр. 8 и 23 Единицы P 2, содержащие в общей сложности 230 атомов P, наблюдались внутри многостенной углеродной нанотрубки с внутренним диаметром 5,90 нм в атомном масштабе. Расстояние между соседними кольцами составляет 6,4 Å. [41]
The Молекула P 6 в форме кольца не стабильна изолированно.
Синий фосфор
[ редактировать ]Однослойный синий фосфор впервые был получен в 2016 году методом молекулярно-лучевой эпитаксии из черного фосфора в качестве прекурсора. [42]
Дифосфор
[ редактировать ]

дифосфора Аллотроп ( P 2 ) обычно можно получить только в экстремальных условиях (например, из P 4 при 1100 К). В 2006 году двухатомная молекула была получена в гомогенном растворе при нормальных условиях с использованием переходных металлов комплексов (например, вольфрама и ниобия ). [43]
Дифосфор — это газообразная форма фосфора , термодинамически стабильная форма при температуре от 1200 до 2000 °C. Диссоциация тетрафосфора ( P 4 ) начинается при более низкой температуре: процент P 2 при 800 °С составляет ≈ 1%. При температуре выше примерно 2000°С молекула дифосфора начинает диссоциировать на атомарный фосфор.
Фосфорные наностержни
[ редактировать ]P 12 Полимеры наностержней были выделены из комплексов CuI-P с помощью низкотемпературной обработки. [44]
Было показано, что красный/коричневый фосфор стабилен на воздухе в течение нескольких недель и имеет свойства, отличные от свойств красного фосфора. Электронная микроскопия показала, что красный/коричневый фосфор образует длинные параллельные наностержни диаметром от 3,4 до 4,7 Å. [44]
Характеристики
[ редактировать ]| Форма | белый(α) | белый(β) | фиолетовый | черный |
|---|---|---|---|---|
| Симметрия | Телоцентрированная кубическая | Триклиника | Моноклиника | орторомбический |
| Символ Пирсона | ап24 | МП84 | ОС8 | |
| Космическая группа | я 4 3 мес. | П 1 № 2 | П2/к № 13 | Смка № 64 |
| Плотность (г/см 3 ) | 1.828 | 1.88 | 2.36 | 2.69 |
| запрещенная зона ( эВ ) | 2.1 | 1.5 | 0.34 | |
| Показатель преломления | 1.8244 | 2.6 | 2.4 |
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Перейти обратно: а б с д Хаускрофт, CE; Шарп, AG (2004). Неорганическая химия (2-е изд.). Прентис Холл. п. 392. ИСБН 978-0-13-039913-7 .
- ^ Перейти обратно: а б Дуриф, А.; Авербух-Пушо, Монтана (1996). Темы химии фосфатов . Сингапур [ua]: World Scientific. п. 3. ISBN 978-981-02-2634-3 .
- ^ Перейти обратно: а б Саймон, Арндт; Боррманн, Хорст; Хорах, Йорг (1997). «О полиморфизме белого фосфора». Химические отчеты . 130 (9): 1235–1240. дои : 10.1002/cber.19971300911 .
- ^ Коссарт, Брэнди М.; Камминс, Кристофер С.; Руководитель Эшли Р.; Лихтенбергер, Деннис Л.; Бергер, Рафаэль Дж. Ф.; Хейс, Стюарт А.; Митцель, Норберт В.; Ву, Банда (01.06.2010). «О молекулярной и электронной структуре AsP3 и P4». Журнал Американского химического общества . 132 (24): 8459–8465. дои : 10.1021/ja102580d . ISSN 0002-7863 . ПМИД 20515032 .
- ^ «Опасное руководство по пляжному отдыху» .
- ^ «Женщина на немецком пляже приняла боеприпасы времен Второй мировой войны за драгоценный камень | DW | 05.08.2017» . Немецкая волна .
- ^ Трелфолл, RE, (1951). 100 лет производства фосфора: 1851–1951 гг . Олдбери: Albright and Wilson Ltd.
- ^ Энгель, Роберт; Коэн, Хайме Ли Иолани (2004). Синтез углерод-фосфорных связей (2-е изд.). Бока-Ратон: CRC Press . §2.3. ISBN 0-8493-1617-0 . LCCN 2003060796 .
- ^ Перейти обратно: а б Химия, часть I, класс XII (PDF) (перепечатанное издание). Индия: НСЕРТ. Январь 2019. с. 177. ИСБН 81-7450-648-9 .
- ^ Перейти обратно: а б с Корбридж, DEC (1995) «Фосфор: очерк его химии, биохимии и технологии», 5-е издание Elsevier: Амстердам. § 4.1.12. ISBN 0-444-89307-5 .
- ^ Штребель, Райнер (1995). «Фосфаалкиновые циклоолигомеры: от димеров к гексамерам - первые шаги на пути к фосфорно-углеродным каркасным соединениям». Angewandte Chemie International Edition на английском языке . 34 (4): 436–438. дои : 10.1002/anie.199504361 .
- ^ Кон, Мориц (1 ноября 1944 г.). «Открытие красного фосфора (1847 г.) Антоном фон Шрёттером (1802–1875)» . Журнал химического образования . 21 (11): 522. Бибкод : 1944ЖЧЭд..21..522К . дои : 10.1021/ed021p522 . ISSN 0021-9584 .
- ^ «Предупреждение о надежности красного фосфора» (PDF) . Архивировано из оригинала (PDF) 02 января 2018 г. Проверено 1 января 2018 г.
- ^ Крейг Хиллман, Отказы в инкапсулированных схемах, вызванные красным фосфором, https://www.dfrsolutions.com/hubfs/Resources/services/Red-Phosphorus-Induced-Failures-in-Encapsulated-Circuits.pdf?t=1513022462214
- ^ Док Браун, Возвращение красного антипирена, SMTAI 2015, https://www.dfrsolutions.com/hubfs/Resources/services/The-Return-of-the-Red-Retardant.pdf?t=1513022462214
- ^ Прикладной катализ B: Environmental, 2012, 111–112, 409–414.
- ^ Международное издание Applied Chemistry, 2016, 55, 9580–9585.
- ^ Карри, Роджер (8 июля 2012 г.). «Металлический фосфор Хитторфа 1865 года» . БОКОВАЯ НАУКА . Проверено 16 ноября 2014 г.
- ^ Моноклинный фосфор образуется из паров в присутствии щелочного металла, патент США 4620968.
- ^ Хитторф, В. (1865). «О познании фосфора» . Анналы физики . 202 (10): 193–228. Бибкод : 1865АнП...202..193H . дои : 10.1002/andp.18652021002 .
- ^ Турн, Х.; Кребс, Х. (15 января 1969 г.). «О строении и свойствах полуметаллов. XXII. Кристаллическая структура фосфора Гитторфа». Acta Crystallographica Раздел B (на немецком языке). 25 (1): 125–135. Бибкод : 1969AcCrB..25..125T . дои : 10.1107/S0567740869001853 . ISSN 0567-7408 .
- ^ Чжан, Лихуэй; Чжан, Бо; Гу, Чжао, Дэн; Чжоу, Цзюнь; Чэн, Чжан, Цзинин (2020). Свойства фиолетового фосфора и его фосфореновое отшелушивание». Angewandte Chemie . 132 (3): 1090–1096. Бибкод : 2020AngCh.132.1090Z . doi : /ange.201912761 . ISSN 1521-3757 . PMID 317139 . 59 .С2КИД 241932000 10.1002
- ^ Корольков Владимир Владимирович; Тимохин Иван Георгиевич; Хаубрихс, Рольф; Смит, Эмили Ф.; Ян, Лисюй; Ян, Сихай; Чампнесс, Нил Р.; Шредер, Мартин; Бетон, Питер Х. (09 ноября 2017 г.). «Супрамолекулярные сети стабилизируют и функционализируют черный фосфор» . Природные коммуникации . 8 (1): 1385. Бибкод : 2017NatCo...8.1385K . дои : 10.1038/s41467-017-01797-6 . ISSN 2041-1723 . ПМК 5680224 . ПМИД 29123112 .
- ^ Браун, А.; Рундквист, С. (1965). «Уточнение кристаллической структуры черного фосфора». Акта Кристаллографика . 19 (4): 684–685. Бибкод : 1965AcCry..19..684B . дои : 10.1107/S0365110X65004140 .
- ^ Картц, Л.; Шриниваса, СР; Риднер, Р.Дж.; Йоргенсен, доктор юридических наук; Уорлтон, Т.Г. (1979). «Влияние давления на связь черного фосфора». Журнал химической физики . 71 (4): 1718. Бибкод : 1979JChPh..71.1718C . дои : 10.1063/1.438523 .
- ^ Линг, Си; Ван, Хан; Хуан, Шэнси; Ся, Фэннянь; Дрессельхаус, Милдред С. (27 марта 2015 г.). «Возрождение черного фосфора» . Труды Национальной академии наук . 112 (15): 4523–4530. arXiv : 1503.08367 . Бибкод : 2015PNAS..112.4523L . дои : 10.1073/pnas.1416581112 . ISSN 0027-8424 . ПМК 4403146 . ПМИД 25820173 .
- ^ Ахуджа, Раджив (2003). «Расчеты превращений кристаллической структуры фосфора под высоким давлением». Физический статус Solidi B. 235 (2): 282–287. Бибкод : 2003ПССБР.235..282А . дои : 10.1002/pssb.200301569 . S2CID 120578034 .
- ^ Бриджмен, военнопленный (1 июля 1914 г.). «Две новые модификации фосфора» . Журнал Американского химического общества . 36 (7): 1344–1363. дои : 10.1021/ja02184a002 . ISSN 0002-7863 .
- ^ Ланге, Стефан; Шмидт, Пер; Нильгес, Том (2007). «Au3SnP7@Black Phosphorus: легкий доступ к черному фосфору». Неорганическая химия . 46 (10): 4028–35. дои : 10.1021/ic062192q . ПМИД 17439206 .
- ^ Вагасия, Джайрадж В.; Майорга-Мартинес, Кармен К.; Выскочил, Ян; Пумера, Мартин (3 января 2023 г.). «Человеко-машинный интерфейс связи на основе черного фосфора» . Природные коммуникации . 14 (1): 2. Бибкод : 2023NatCo..14....2В . дои : 10.1038/s41467-022-34482-4 . ISSN 2041-1723 . ПМЦ 9810665 . ПМИД 36596775 .
- ^ Химия, Университет; Прага, Технологии. «Человеко-машинный интерфейс на основе черного фосфора: прорыв в вспомогательных технологиях» . techxplore.com . Проверено 16 июня 2023 г.
- ^ «Порошок и кристаллы черного фосфора» . Оссила . Проверено 23 августа 2019 г.
- ^ Чжан, Юаньбо; Фэн, Дунлай; У, Хуа; Гэ, Цинцин; Ли, Ликай (май 2014 г.). . Природа нанотехнологии . 9 ): 372–377. : 1401.4117 . Бибкод : 2014NatNa ...9..372L : 10.1038 / nnano.2014.35 . ( 5 doi arXiv 93 2CID . 172186 .
- ^ Ван, Дж.; Руссо, А.; Ян, М.; Лоу, Т.; Франкёр, С.; Кена-Коэн, С. (2020). «Поляризованное излучение черного фосфора в среднем инфракрасном диапазоне». Нано-буквы . 20 (5): 3651–3655. arXiv : 1911.09184 . Бибкод : 2020NanoL..20.3651W . дои : 10.1021/acs.nanolett.0c00581 . ПМИД 32286837 . S2CID 208202133 .
- ^ Смит, Б.; Вермеерш, Б.; Каррет, Дж.; Оу, Э.; Ким, Дж.; Ли, С. (2017). «Температурная и толщинная зависимости анизотропной плоскостной теплопроводности черного фосфора» . Адв Матер . 29 (5): 1603756. Бибкод : 2017AdM....2903756S . дои : 10.1002/adma.201603756 . ОСТИ 1533031 . ПМИД 27882620 . S2CID 5479539 .
- ^ Лю, Сяолун Д.; Вуд, Джошуа Д.; Чен, Кань-Шэн; Чо, ЫнГён; Херсам, Марк К. (9 февраля 2015 г.). «Термическое разложение расслоенного двумерного черного фосфора in situ». Журнал писем по физической химии . 6 (5): 773–778. arXiv : 1502.02644 . doi : 10.1021/acs.jpclett.5b00043 . ПМИД 26262651 . S2CID 24648672 .
- ^ Вуд, Джошуа Д.; Уэллс, Спенсер А.; Джаривала, Дип; Чен, Кань-Шэн; Чо, ЫнГён; Сангван, Винод К.; Лю, Сяолун; Лаухон, Линкольн Дж.; Маркс, Тобин Дж.; Херсам, Марк К. (7 ноября 2014 г.). «Эффективная пассивация расслоенных транзисторов из черного фосфора против деградации под воздействием окружающей среды». Нано-буквы . 14 (12): 6964–6970. arXiv : 1411.2055 . Бибкод : 2014NanoL..14.6964W . дои : 10.1021/nl5032293 . ПМИД 25380142 . S2CID 22128620 .
- ^ Ву, Райан Дж.; Топсакал, Мехмет; Лоу, Тони; Роббинс, Мэтью С.; Харатипур, Назила; Чон, Чон Сок ; Венцкович, Рената М.; Кестер, Стивен Дж.; Мхоян, К. Андре (01 ноября 2015 г.). «Атомная и электронная структура расслаивающегося черного фосфора». Журнал вакуумной науки и технологий А. 33 (6): 060604. Бибкод : 2015JVSTA..33f0604W . дои : 10.1116/1.4926753 . ISSN 0734-2101 .
- ^ Чжэн, Вейран; Ли, Чонён; Гао, Чжи-Вэнь; Ли, Юн; Линь, Шэнхуан; Лау, Шу Пин; Ли, Лоуренс Юн Сок (30 июня 2020 г.). «Сверхбыстрое лазерное отшелушивание черного фосфора в жидкости регулируемой толщины для литий-ионных аккумуляторов». Передовые энергетические материалы . 10 (31): 1903490. doi : 10.1002/aenm.201903490 . hdl : 10397/100139 . S2CID 225707528 .
- ^ Карттунен, Антти Дж.; Линнолахти, Микко; Пакканен, Тапани А. (15 июня 2007 г.). «Икосаэдрические и кольцевые аллотропы фосфора». Химия – Европейский журнал . 13 (18): 5232–5237. дои : 10.1002/chem.200601572 . ПМИД 17373003 .
- ^ Чжан, Цзиньин, Дань; Ма, Чуаньшэн; Ли, Синь, Лихуэй; Хуан, Хун-Линь; 6 февраля 2017 г.). «Сборка кольцевого фосфора в нанореакторах из углеродных нанотрубок». Angewandte Chemie International Edition . 56 (7): 1850–1854 10.1002 / anie.201611740 . : doi .
- ^ Чжан, Цзя Линь; Чжао, Сонгтао (30 июня 2016 г.). «Эпитаксиальный рост однослойного синего фосфора: новая фаза двумерного фосфора». Нано-буквы . 16 (8): 4903–4908. Бибкод : 2016NanoL..16.4903Z . дои : 10.1021/acs.nanolett.6b01459 . ПМИД 27359041 .
- ^ Пиро, На; Фигероа, Дж. С.; Маккеллар, Дж.Т.; Камминс, CC (2006). «Реакционная способность тройной связи молекул дифосфора». Наука . 313 (5791): 1276–9. Бибкод : 2006Sci...313.1276P . дои : 10.1126/science.1129630 . ПМИД 16946068 . S2CID 27740669 .
- ^ Перейти обратно: а б Пфицнер, А; Брау, Мф; Цель, Дж; Брунклаус, Г; Эккерт, Х. (август 2004 г.). «Фосфорные наностержни – две аллотропные модификации давно известного элемента» . Международное издание «Прикладная химия» на английском языке . 43 (32): 4228–31. дои : 10.1002/anie.200460244 . ПМИД 15307095 .
- ^ А. Холлеман; Н. Виберг (1985). «XV 2.1.3». Учебник неорганической химии (33-е изд.). де Грюйтер. ISBN 978-3-11-012641-9 .
- ^ Бергер, Л.И. (1996). Полупроводниковые материалы . ЦРК Пресс. п. 84 . ISBN 978-0-8493-8912-2 .
Внешние ссылки
[ редактировать ]- Белый фосфор
- Белый фосфор в Периодической таблице видео (Ноттингемский университет)
- Дополнительная информация о белом фосфоре (и пятиокисье фосфора) в Периодической таблице видео (Ноттингемский университет)
- Химия фосфора в Chemistry LibreTexts.
