Азот
 Жидкий азот (N 2 при температуре ниже −196 °C ) | |||||||||||||||||||||||||||||||||
| Азот | |||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Аллотропы | см . § Аллотропы | ||||||||||||||||||||||||||||||||
| Появление | бесцветный газ, жидкость или твердое вещество | ||||||||||||||||||||||||||||||||
| Standard atomic weight Ar°(N) | |||||||||||||||||||||||||||||||||
| Nitrogen in the periodic table | |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| Atomic number (Z) | 7 | ||||||||||||||||||||||||||||||||
| Group | group 15 (pnictogens) | ||||||||||||||||||||||||||||||||
| Period | period 2 | ||||||||||||||||||||||||||||||||
| Block | p-block | ||||||||||||||||||||||||||||||||
| Electron configuration | [He] 2s2 2p3 | ||||||||||||||||||||||||||||||||
| Electrons per shell | 2, 5 | ||||||||||||||||||||||||||||||||
| Physical properties | |||||||||||||||||||||||||||||||||
| Phase at STP | gas | ||||||||||||||||||||||||||||||||
| Melting point | (N2) 63.23[3] K (−209.86[3] °C, −345.75[3] °F) | ||||||||||||||||||||||||||||||||
| Boiling point | (N2) 77.355 K (−195.795 °C, −320.431 °F) | ||||||||||||||||||||||||||||||||
| Density (at STP) | 1.2506 g/L[4] at 0 °C, 1013 mbar | ||||||||||||||||||||||||||||||||
| when liquid (at b.p.) | 0.808 g/cm3 | ||||||||||||||||||||||||||||||||
| Triple point | 63.151 K, 12.52 kPa | ||||||||||||||||||||||||||||||||
| Critical point | 126.21 K, 3.39 MPa | ||||||||||||||||||||||||||||||||
| Heat of fusion | (N2) 0.72 kJ/mol | ||||||||||||||||||||||||||||||||
| Heat of vaporisation | (N2) 5.57 kJ/mol | ||||||||||||||||||||||||||||||||
| Molar heat capacity | (N2) 29.124 J/(mol·K) | ||||||||||||||||||||||||||||||||
Vapour pressure
| |||||||||||||||||||||||||||||||||
| Atomic properties | |||||||||||||||||||||||||||||||||
| Oxidation states | −3, −2, −1, 0,[5] +1, +2, +3, +4, +5 (a strongly acidic oxide) | ||||||||||||||||||||||||||||||||
| Electronegativity | Pauling scale: 3.04 | ||||||||||||||||||||||||||||||||
| Ionisation energies |
| ||||||||||||||||||||||||||||||||
| Covalent radius | 71±1 pm | ||||||||||||||||||||||||||||||||
| Van der Waals radius | 155 pm | ||||||||||||||||||||||||||||||||
| Other properties | |||||||||||||||||||||||||||||||||
| Natural occurrence | primordial | ||||||||||||||||||||||||||||||||
| Crystal structure | hexagonal (hP4) | ||||||||||||||||||||||||||||||||
| Lattice constants | a = 411.6 pm c = 673.4 pm (at t.p.)[6] | ||||||||||||||||||||||||||||||||
| Thermal conductivity | 25.83×10−3 W/(m⋅K) | ||||||||||||||||||||||||||||||||
| Magnetic ordering | diamagnetic | ||||||||||||||||||||||||||||||||
| Speed of sound | 353 m/s (gas, at 27 °C) | ||||||||||||||||||||||||||||||||
| CAS Number | 17778-88-0 7727-37-9 (N2) | ||||||||||||||||||||||||||||||||
| History | |||||||||||||||||||||||||||||||||
| Discovery | Daniel Rutherford (1772) | ||||||||||||||||||||||||||||||||
| Named by | Jean-Antoine Chaptal (1790) | ||||||||||||||||||||||||||||||||
| Isotopes of nitrogen | |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
Азот – химический элемент ; он имеет символ N и атомный номер 7. Азот — неметалл и самый легкий член группы 15 таблицы Менделеева , часто называемый пниктогенами . Это распространенный элемент во Вселенной , занимающий седьмое место по общему распространению в Млечном Пути и Солнечной системе . При стандартных температуре и давлении два атома элемента соединяются с образованием N 2 без цвета и запаха , двухатомного газа . N 2 составляет около 78% атмосферы Земли , что делает его наиболее распространенным химическим веществом в воздухе. Из-за летучести соединений азота азот относительно редко встречается в твердых частях Земли.
Впервые он был обнаружен и выделен шотландским врачом Дэниелом Резерфордом в 1772 году и независимо Карлом Вильгельмом Шееле и Генри Кавендишем примерно в то же время. Название нитроген было предложено французским химиком Жаном-Антуаном-Клодом Шапталем в 1790 году, когда было обнаружено, что азот присутствует в азотной кислоте и нитратах . Антуан Лавуазье предложил вместо этого название «азот » от древнегреческого : ἀζωτικός «нет жизни», так как это удушающий газ ; это имя используется во многих языках и появляется в английских названиях некоторых соединений азота, таких как гидразин , азиды и азосоединения .
Elemental nitrogen is usually produced from air by pressure swing adsorption technology. About 2/3 of commercially produced elemental nitrogen is used as an inert (oxygen-free) gas for commercial uses such as food packaging, and much of the rest is used as liquid nitrogen in cryogenic applications. Many industrially important compounds, such as ammonia, nitric acid, organic nitrates (propellants and explosives), and cyanides, contain nitrogen. The extremely strong triple bond in elemental nitrogen (N≡N), the second strongest bond in any diatomic molecule after carbon monoxide (CO),[7] dominates nitrogen chemistry. This causes difficulty for both organisms and industry in converting N2 into useful compounds, but at the same time it means that burning, exploding, or decomposing nitrogen compounds to form nitrogen gas releases large amounts of often useful energy. Synthetically produced ammonia and nitrates are key industrial fertilisers, and fertiliser nitrates are key pollutants in the eutrophication of water systems. Apart from its use in fertilisers and energy stores, nitrogen is a constituent of organic compounds as diverse as aramids used in high-strength fabric and cyanoacrylate used in superglue.
Nitrogen occurs in all organisms, primarily in amino acids (and thus proteins), in the nucleic acids (DNA and RNA) and in the energy transfer molecule adenosine triphosphate. The human body contains about 3% nitrogen by mass, the fourth most abundant element in the body after oxygen, carbon, and hydrogen. The nitrogen cycle describes the movement of the element from the air, into the biosphere and organic compounds, then back into the atmosphere. Nitrogen is a constituent of every major pharmacological drug class, including antibiotics. Many drugs are mimics or prodrugs of natural nitrogen-containing signal molecules: for example, the organic nitrates nitroglycerin and nitroprusside control blood pressure by metabolizing into nitric oxide. Many notable nitrogen-containing drugs, such as the natural caffeine and morphine or the synthetic amphetamines, act on receptors of animal neurotransmitters.
History

Nitrogen compounds have a very long history, ammonium chloride having been known to Herodotus. They were well-known by the Middle Ages. Alchemists knew nitric acid as aqua fortis (strong water), as well as other nitrogen compounds such as ammonium salts and nitrate salts. The mixture of nitric and hydrochloric acids was known as aqua regia (royal water), celebrated for its ability to dissolve gold, the king of metals.[8]
The discovery of nitrogen is attributed to the Scottish physician Daniel Rutherford in 1772, who called it noxious air.[9][10] Though he did not recognise it as an entirely different chemical substance, he clearly distinguished it from Joseph Black's "fixed air", or carbon dioxide.[11] The fact that there was a component of air that does not support combustion was clear to Rutherford, although he was not aware that it was an element. Nitrogen was also studied at about the same time by Carl Wilhelm Scheele,[12] Henry Cavendish,[13] and Joseph Priestley,[14] who referred to it as burnt air or phlogisticated air. French chemist Antoine Lavoisier referred to nitrogen gas as "mephitic air" or azote, from the Greek word άζωτικός (azotikos), "no life", due to it being asphyxiant.[15][16] In an atmosphere of pure nitrogen, animals died and flames were extinguished. Though Lavoisier's name was not accepted in English since it was pointed out that all gases but oxygen are either asphyxiant or outright toxic, it is used in many languages (French, Italian, Portuguese, Polish, Russian, Albanian, Turkish, etc.; the German Stickstoff similarly refers to the same characteristic, viz. ersticken "to choke or suffocate") and still remains in English in the common names of many nitrogen compounds, such as hydrazine and compounds of the azide ion. Finally, it led to the name "pnictogens" for the group headed by nitrogen, from the Greek πνίγειν "to choke".[8]
The English word nitrogen (1794) entered the language from the French nitrogène, coined in 1790 by French chemist Jean-Antoine Chaptal (1756–1832),[17] from the French nitre (potassium nitrate, also called saltpeter) and the French suffix -gène, "producing", from the Greek -γενής (-genes, "begotten"). Chaptal's meaning was that nitrogen is the essential part of nitric acid, which in turn was produced from nitre. In earlier times, niter had been confused with Egyptian "natron" (sodium carbonate) – called νίτρον (nitron) in Greek – which, despite the name, contained no nitrate.[18]
The earliest military, industrial, and agricultural applications of nitrogen compounds used saltpeter (sodium nitrate or potassium nitrate), most notably in gunpowder, and later as fertiliser. In 1910, Lord Rayleigh discovered that an electrical discharge in nitrogen gas produced "active nitrogen", a monatomic allotrope of nitrogen.[19] The "whirling cloud of brilliant yellow light" produced by his apparatus reacted with mercury to produce explosive mercury nitride.[20]
For a long time, sources of nitrogen compounds were limited. Natural sources originated either from biology or deposits of nitrates produced by atmospheric reactions. Nitrogen fixation by industrial processes like the Frank–Caro process (1895–1899) and Haber–Bosch process (1908–1913) eased this shortage of nitrogen compounds, to the extent that half of global food production now relies on synthetic nitrogen fertilisers.[21] At the same time, use of the Ostwald process (1902) to produce nitrates from industrial nitrogen fixation allowed the large-scale industrial production of nitrates as feedstock in the manufacture of explosives in the World Wars of the 20th century.[22][23]
Properties
Atomic

A nitrogen atom has seven electrons. In the ground state, they are arranged in the electron configuration 1s2
2s2
2p1
x2p1
y2p1
z. It, therefore, has five valence electrons in the 2s and 2p orbitals, three of which (the p-electrons) are unpaired. It has one of the highest electronegativities among the elements (3.04 on the Pauling scale), exceeded only by chlorine (3.16), oxygen (3.44), and fluorine (3.98). (The light noble gases, helium, neon, and argon, would presumably also be more electronegative, and in fact are on the Allen scale.)[24] Following periodic trends, its single-bond covalent radius of 71 pm is smaller than those of boron (84 pm) and carbon (76 pm), while it is larger than those of oxygen (66 pm) and fluorine (57 pm). The nitride anion, N3−, is much larger at 146 pm, similar to that of the oxide (O2−: 140 pm) and fluoride (F−: 133 pm) anions.[24] The first three ionisation energies of nitrogen are 1.402, 2.856, and 4.577 MJ·mol−1, and the sum of the fourth and fifth is 16.920 MJ·mol−1. Due to these very high figures, nitrogen has no simple cationic chemistry.[25]The lack of radial nodes in the 2p subshell is directly responsible for many of the anomalous properties of the first row of the p-block, especially in nitrogen, oxygen, and fluorine. The 2p subshell is very small and has a very similar radius to the 2s shell, facilitating orbital hybridisation. It also results in very large electrostatic forces of attraction between the nucleus and the valence electrons in the 2s and 2p shells, resulting in very high electronegativities. Hypervalency is almost unknown in the 2p elements for the same reason, because the high electronegativity makes it difficult for a small nitrogen atom to be a central atom in an electron-rich three-center four-electron bond since it would tend to attract the electrons strongly to itself. Thus, despite nitrogen's position at the head of group 15 in the periodic table, its chemistry shows huge differences from that of its heavier congeners phosphorus, arsenic, antimony, and bismuth.[26]
Nitrogen may be usefully compared to its horizontal neighbours' carbon and oxygen as well as its vertical neighbours in the pnictogen column, phosphorus, arsenic, antimony, and bismuth. Although each period 2 element from lithium to oxygen shows some similarities to the period 3 element in the next group (from magnesium to chlorine; these are known as diagonal relationships), their degree drops off abruptly past the boron–silicon pair. The similarities of nitrogen to sulfur are mostly limited to sulfur nitride ring compounds when both elements are the only ones present.[27]
Nitrogen does not share the proclivity of carbon for catenation. Like carbon, nitrogen tends to form ionic or metallic compounds with metals. Nitrogen forms an extensive series of nitrides with carbon, including those with chain-, graphitic-, and fullerenic-like structures.[28]
It resembles oxygen with its high electronegativity and concomitant capability for hydrogen bonding and the ability to form coordination complexes by donating its lone pairs of electrons. There are some parallels between the chemistry of ammonia NH3 and water H2O. For example, the capacity of both compounds to be protonated to give NH4+ and H3O+ or deprotonated to give NH2− and OH−, with all of these able to be isolated in solid compounds.[29]
Nitrogen shares with both its horizontal neighbours a preference for forming multiple bonds, typically with carbon, oxygen, or other nitrogen atoms, through pπ–pπ interactions.[27] Thus, for example, nitrogen occurs as diatomic molecules and therefore has very much lower melting (−210 °C) and boiling points (−196 °C) than the rest of its group, as the N2 molecules are only held together by weak van der Waals interactions and there are very few electrons available to create significant instantaneous dipoles. This is not possible for its vertical neighbours; thus, the nitrogen oxides, nitrites, nitrates, nitro-, nitroso-, azo-, and diazo-compounds, azides, cyanates, thiocyanates, and imino-derivatives find no echo with phosphorus, arsenic, antimony, or bismuth. By the same token, however, the complexity of the phosphorus oxoacids finds no echo with nitrogen.[27] Setting aside their differences, nitrogen and phosphorus form an extensive series of compounds with one another; these have chain, ring, and cage structures.[30]
Table of thermal and physical properties of nitrogen (N2) at atmospheric pressure:[31][32]
| Temperature (K) | Density (kg m−3) | Specific heat (kJ kg−1 °C−1) | Dynamic viscosity (kg m−1 s−1) | Kinematic viscosity (m2 s−1) | Thermal conductivity (W m−1 °C−1) | Thermal diffusivity (m2 s−1) | Prandtl number |
Isotopes

Nitrogen has two stable isotopes: 14N and 15N. The first is much more common, making up 99.634% of natural nitrogen, and the second (which is slightly heavier) makes up the remaining 0.366%. This leads to an atomic weight of around 14.007 u.[24] Both of these stable isotopes are produced in the CNO cycle in stars, but 14N is more common as its proton capture is the rate-limiting step. 14N is one of the five stable odd–odd nuclides (a nuclide having an odd number of protons and neutrons); the other four are 2H, 6Li, 10B, and 180mTa.[33]
The relative abundance of 14N and 15N is practically constant in the atmosphere but can vary elsewhere, due to natural isotopic fractionation from biological redox reactions and the evaporation of natural ammonia or nitric acid.[34] Biologically mediated reactions (e.g., assimilation, nitrification, and denitrification) strongly control nitrogen dynamics in the soil. These reactions typically result in 15N enrichment of the substrate and depletion of the product.[35]
The heavy isotope 15N was first discovered by S. M. Naudé in 1929, and soon after heavy isotopes of the neighbouring elements oxygen and carbon were discovered.[36] It presents one of the lowest thermal neutron capture cross-sections of all isotopes.[37] It is frequently used in nuclear magnetic resonance (NMR) spectroscopy to determine the structures of nitrogen-containing molecules, due to its fractional nuclear spin of one-half, which offers advantages for NMR such as narrower line width. 14N, though also theoretically usable, has an integer nuclear spin of one and thus has a quadrupole moment that leads to wider and less useful spectra.[24] 15N NMR nevertheless has complications not encountered in the more common 1H and 13C NMR spectroscopy. The low natural abundance of 15N (0.36%) significantly reduces sensitivity, a problem which is only exacerbated by its low gyromagnetic ratio, (only 10.14% that of 1H). As a result, the signal-to-noise ratio for 1H is about 300 times as much as that for 15N at the same magnetic field strength.[38] This may be somewhat alleviated by isotopic enrichment of 15N by chemical exchange or fractional distillation. 15N-enriched compounds have the advantage that under standard conditions, they do not undergo chemical exchange of their nitrogen atoms with atmospheric nitrogen, unlike compounds with labelled hydrogen, carbon, and oxygen isotopes that must be kept away from the atmosphere.[24] The 15N:14N ratio is commonly used in stable isotope analysis in the fields of geochemistry, hydrology, paleoclimatology and paleoceanography, where it is called δ15N.[39]
Of the thirteen other isotopes produced synthetically, ranging from 9N to 23N, 13N has a half-life of ten minutes and the remaining isotopes have half-lives less than eight seconds.[40][41] Given the half-life difference, 13N is the most important nitrogen radioisotope, being relatively long-lived enough to use in positron emission tomography (PET), although its half-life is still short and thus it must be produced at the venue of the PET, for example in a cyclotron via proton bombardment of 16O producing 13N and an alpha particle.[42]
The radioisotope 16N is the dominant radionuclide in the coolant of pressurised water reactors or boiling water reactors during normal operation. It is produced from 16O (in water) via an (n,p) reaction, in which the 16O atom captures a neutron and expels a proton. It has a short half-life of about 7.1 s,[41] but its decay back to 16O produces high-energy gamma radiation (5 to 7 MeV).[41][43] Because of this, access to the primary coolant piping in a pressurised water reactor must be restricted during reactor power operation.[43] It is a sensitive and immediate indicator of leaks from the primary coolant system to the secondary steam cycle and is the primary means of detection for such leaks.[43]
Allotropes

Atomic nitrogen, also known as active nitrogen, is highly reactive, being a triradical with three unpaired electrons. Free nitrogen atoms easily react with most elements to form nitrides, and even when two free nitrogen atoms collide to produce an excited N2 molecule, they may release so much energy on collision with even such stable molecules as carbon dioxide and water to cause homolytic fission into radicals such as CO and O or OH and H. Atomic nitrogen is prepared by passing an electric discharge through nitrogen gas at 0.1–2 mmHg, which produces atomic nitrogen along with a peach-yellow emission that fades slowly as an afterglow for several minutes even after the discharge terminates.[27]
Given the great reactivity of atomic nitrogen, elemental nitrogen usually occurs as molecular N2, dinitrogen. This molecule is a colourless, odourless, and tasteless diamagnetic gas at standard conditions: it melts at −210 °C and boils at −196 °C.[27] Dinitrogen is mostly unreactive at room temperature, but it will nevertheless react with lithium metal and some transition metal complexes. This is due to its bonding, which is unique among the diatomic elements at standard conditions in that it has an N≡N triple bond. Triple bonds have short bond lengths (in this case, 109.76 pm) and high dissociation energies (in this case, 945.41 kJ/mol), and are thus very strong, explaining dinitrogen's low level of chemical reactivity.[27][44]
Other nitrogen oligomers and polymers may be possible. If they could be synthesised, they may have potential applications as materials with a very high energy density, that could be used as powerful propellants or explosives.[45] Under extremely high pressures (1.1 million atm) and high temperatures (2000 K), as produced in a diamond anvil cell, nitrogen polymerises into the single-bonded cubic gauche crystal structure. This structure is similar to that of diamond, and both have extremely strong covalent bonds, resulting in its nickname "nitrogen diamond".[46]

At atmospheric pressure, molecular nitrogen condenses (liquefies) at 77 K (−195.79 °C) and freezes at 63 K (−210.01 °C)[47] into the beta hexagonal close-packed crystal allotropic form. Below 35.4 K (−237.6 °C) nitrogen assumes the cubic crystal allotropic form (called the alpha phase).[48] Liquid nitrogen, a colourless fluid resembling water in appearance, but with 80.8% of the density (the density of liquid nitrogen at its boiling point is 0.808 g/mL), is a common cryogen.[49] Solid nitrogen has many crystalline modifications. It forms a significant dynamic surface coverage on Pluto[50] and outer moons of the Solar System such as Triton.[51] Even at the low temperatures of solid nitrogen it is fairly volatile and can sublime to form an atmosphere, or condense back into nitrogen frost. It is very weak and flows in the form of glaciers and on Triton geysers of nitrogen gas come from the polar ice cap region.[52]
Chemistry and compounds
Dinitrogen complexes

The first example of a dinitrogen complex to be discovered was [Ru(NH3)5(N2)]2+ (see figure at right), and soon many other such complexes were discovered. These complexes, in which a nitrogen molecule donates at least one lone pair of electrons to a central metal cation, illustrate how N2 might bind to the metal(s) in nitrogenase and the catalyst for the Haber process: these processes involving dinitrogen activation are vitally important in biology and in the production of fertilisers.[53][54]
Dinitrogen is able to coordinate to metals in five different ways. The more well-characterised ways are the end-on M←N≡N (η1) and M←N≡N→M (μ, bis-η1), in which the lone pairs on the nitrogen atoms are donated to the metal cation. The less well-characterised ways involve dinitrogen donating electron pairs from the triple bond, either as a bridging ligand to two metal cations (μ, bis-η2) or to just one (η2). The fifth and unique method involves triple-coordination as a bridging ligand, donating all three electron pairs from the triple bond (μ3-N2). A few complexes feature multiple N2 ligands and some feature N2 bonded in multiple ways. Since N2 is isoelectronic with carbon monoxide (CO) and acetylene (C2H2), the bonding in dinitrogen complexes is closely allied to that in carbonyl compounds, although N2 is a weaker σ-donor and π-acceptor than CO. Theoretical studies show that σ donation is a more important factor allowing the formation of the M–N bond than π back-donation, which mostly only weakens the N–N bond, and end-on (η1) donation is more readily accomplished than side-on (η2) donation.[27]
Today, dinitrogen complexes are known for almost all the transition metals, accounting for several hundred compounds. They are normally prepared by three methods:[27]
- Replacing labile ligands such as H2O, H−, or CO directly by nitrogen: these are often reversible reactions that proceed at mild conditions.
- Reducing metal complexes in the presence of a suitable co-ligand in excess under nitrogen gas. A common choice includes replacing chloride ligands with dimethylphenylphosphine (PMe2Ph) to make up for the smaller number of nitrogen ligands attached to the original chlorine ligands.
- Converting a ligand with N–N bonds, such as hydrazine or azide, directly into a dinitrogen ligand.
Occasionally the N≡N bond may be formed directly within a metal complex, for example by directly reacting coordinated ammonia (NH3) with nitrous acid (HNO2), but this is not generally applicable. Most dinitrogen complexes have colours within the range white-yellow-orange-red-brown; a few exceptions are known, such as the blue [{Ti(η5-C5H5)2}2-(N2)].[27]
Nitrides, azides, and nitrido complexes
Nitrogen bonds to almost all the elements in the periodic table except the first two noble gases, helium and neon, and some of the very short-lived elements after bismuth, creating an immense variety of binary compounds with varying properties and applications.[27] Many binary compounds are known: with the exception of the nitrogen hydrides, oxides, and fluorides, these are typically called nitrides. Many stoichiometric phases are usually present for most elements (e.g. MnN, Mn6N5, Mn3N2, Mn2N, Mn4N, and MnxN for 9.2 < x < 25.3). They may be classified as "salt-like" (mostly ionic), covalent, "diamond-like", and metallic (or interstitial), although this classification has limitations generally stemming from the continuity of bonding types instead of the discrete and separate types that it implies. They are normally prepared by directly reacting a metal with nitrogen or ammonia (sometimes after heating), or by thermal decomposition of metal amides:[55]
- 3 Ca + N2 → Ca3N2
- 3 Mg + 2 NH3 → Mg3N2 + 3 H2 (at 900 °C)
- 3 Zn(NH2)2 → Zn3N2 + 4 NH3
Many variants on these processes are possible. The most ionic of these nitrides are those of the alkali metals and alkaline earth metals, Li3N (Na, K, Rb, and Cs do not form stable nitrides for steric reasons) and M3N2 (M = Be, Mg, Ca, Sr, Ba). These can formally be thought of as salts of the N3− anion, although charge separation is not actually complete even for these highly electropositive elements. However, the alkali metal azides NaN3 and KN3, featuring the linear N−
3 anion, are well-known, as are Sr(N3)2 and Ba(N3)2. Azides of the B-subgroup metals (those in groups 11 through 16) are much less ionic, have more complicated structures, and detonate readily when shocked.[55]
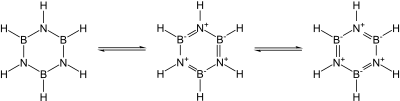
Many covalent binary nitrides are known. Examples include cyanogen ((CN)2), triphosphorus pentanitride (P3N5), disulfur dinitride (S2N2), and tetrasulfur tetranitride (S4N4). The essentially covalent silicon nitride (Si3N4) and germanium nitride (Ge3N4) are also known: silicon nitride, in particular, would make a promising ceramic if not for the difficulty of working with and sintering it. In particular, the group 13 nitrides, most of which are promising semiconductors, are isoelectronic with graphite, diamond, and silicon carbide and have similar structures: their bonding changes from covalent to partially ionic to metallic as the group is descended. In particular, since the B–N unit is isoelectronic to C–C, and carbon is essentially intermediate in size between boron and nitrogen, much of organic chemistry finds an echo in boron–nitrogen chemistry, such as in borazine ("inorganic benzene"). Nevertheless, the analogy is not exact due to the ease of nucleophilic attack at boron due to its deficiency in electrons, which is not possible in a wholly carbon-containing ring.[55]
The largest category of nitrides are the interstitial nitrides of formulae MN, M2N, and M4N (although variable composition is perfectly possible), where the small nitrogen atoms are positioned in the gaps in a metallic cubic or hexagonal close-packed lattice. They are opaque, very hard, and chemically inert, melting only at very high temperatures (generally over 2500 °C). They have a metallic lustre and conduct electricity as do metals. They hydrolyse only very slowly to give ammonia or nitrogen.[55]
The nitride anion (N3−) is the strongest π donor known among ligands (the second-strongest is O2−). Nitrido complexes are generally made by the thermal decomposition of azides or by deprotonating ammonia, and they usually involve a terminal {≡N}3− group. The linear azide anion (N−
3), being isoelectronic with nitrous oxide, carbon dioxide, and cyanate, forms many coordination complexes. Further catenation is rare, although N4−
4 (isoelectronic with carbonate and nitrate) is known.[55]
Hydrides

Industrially, ammonia (NH3) is the most important compound of nitrogen and is prepared in larger amounts than any other compound because it contributes significantly to the nutritional needs of terrestrial organisms by serving as a precursor to food and fertilisers. It is a colourless alkaline gas with a characteristic pungent smell. The presence of hydrogen bonding has very significant effects on ammonia, conferring on it its high melting (−78 °C) and boiling (−33 °C) points. As a liquid, it is a very good solvent with a high heat of vaporisation (enabling it to be used in vacuum flasks), that also has a low viscosity and electrical conductivity and high dielectric constant, and is less dense than water. However, the hydrogen bonding in NH3 is weaker than that in H2O due to the lower electronegativity of nitrogen compared to oxygen and the presence of only one lone pair in NH3 rather than two in H2O. It is a weak base in aqueous solution (pKb 4.74); its conjugate acid is ammonium, NH+
4. It can also act as an extremely weak acid, losing a proton to produce the amide anion, NH−
2. It thus undergoes self-dissociation, similar to water, to produce ammonium and amide. Ammonia burns in air or oxygen, though not readily, to produce nitrogen gas; it burns in fluorine with a greenish-yellow flame to give nitrogen trifluoride. Reactions with the other nonmetals are very complex and tend to lead to a mixture of products. Ammonia reacts on heating with metals to give nitrides.[57]
Известно множество других бинарных гидридов азота, но наиболее важными являются гидразин (N 2 H 4 ) и азид водорода (HN 3 ). OH) хотя и не является гидридом азота, но Гидроксиламин (NH 2 по свойствам и строению также подобен аммиаку и гидразину. Гидразин — дымящая бесцветная жидкость, по запаху напоминающая аммиак. Его физические свойства очень похожи на свойства воды (температура плавления 2,0 °С, температура кипения 113,5 °С, плотность 1,00 г/см). 3 ). Несмотря на то, что это эндотермическое соединение, оно кинетически стабильно. Он быстро и полностью сгорает на воздухе очень экзотермически с образованием азота и водяного пара. Это очень полезный и универсальный восстановитель, более слабое основание, чем аммиак. [58] Его также часто используют в качестве ракетного топлива. [59]
Гидразин обычно получают реакцией аммиака со щелочным гипохлоритом натрия в присутствии желатина или клея: [58]
- NH 3 + OCl − → NH 2 Cl + OH −
- NH 2 Cl + NH 3 → N
22Ч +
5 +Кл − (медленный) - Н
22Ч +
5 + ОН − → N 2 H 4 + H 2 O (быстрый)
(Атака гидроксида и аммиака может быть обращена вспять, проходя, таким образом, через промежуточный NHCl. − вместо этого.) Причина добавления желатина заключается в том, что он удаляет ионы металлов, таких как Cu. 2+ катализирует разрушение гидразина по реакции с монохлорамином (NH 2 Cl) с образованием хлорида аммония и азота. [58]
Азид водорода (HN 3 ) был впервые получен в 1890 году окислением водного гидразина азотистой кислотой. Он очень взрывоопасен, и даже разбавленные растворы могут быть опасны. Он имеет неприятный и раздражающий запах и является потенциально смертельным (но не кумулятивным) ядом. Ее можно рассматривать как кислоту, сопряженную с азид-анионом, и она аналогична галогенводородным кислотам . [58]
Галогениды и оксогалогениды

Известны все четыре простых тригалогенида азота. Известно несколько смешанных галогенидов и гидрогалогенидов, но они в основном нестабильны; примеры включают NClF 2 , NCl 2 F, NBrF 2 , NF 2 H, NFH 2 , NCl 2 H и NClH 2 . [60]
Трифторид азота (NF 3 , впервые полученный в 1928 году) представляет собой бесцветный газ без запаха, который термодинамически стабилен и наиболее легко получается электролизом расплавленного фторида аммония, растворенного в безводном фтористом водороде . Как и тетрафторид углерода , он совсем не реакционноспособен и стабилен в воде или разбавленных водных кислотах или щелочах. Только при нагревании он действует как фторирующий агент, а с медью , мышьяком, сурьмой и висмутом при контакте при высоких температурах реагирует с образованием тетрафторгидразина (N 2 F 4 ). Катионы NF +
4 и Н
22F +
3 также известны (последний в результате реакции тетрафторгидразина с сильными акцепторами фторида, такими как пентафторид мышьяка ), как и ONF 3 , который вызвал интерес из-за короткого расстояния N–O, подразумевающего частичную двойную связь, а также высокополярных и длинных N– Ф-облигация. Тетрафторгидразин, в отличие от самого гидразина, может диссоциировать при комнатной температуре и выше с образованием радикала NF 2 •. Азид фтора (FN 3 ) очень взрывоопасен и термически нестабилен. Дифторид азота (N 2 F 2 ) существует в виде термически взаимопревращаемых цис- и транс -изомеров и впервые был обнаружен как продукт термического разложения FN 3 . [60]
Трихлорид азота (NCl 3 ) представляет собой плотную, летучую и взрывоопасную жидкость, физические свойства которой аналогичны свойствам четыреххлористого углерода , хотя одно отличие состоит в том, что NCl 3 легко гидролизуется водой, а CCl 4 - нет. Впервые он был синтезирован в 1811 году Пьером Луи Дюлонгом , который потерял три пальца и глаз из-за его взрывных тенденций. В разбавленном состоянии он менее опасен и поэтому используется в промышленности для отбеливания и стерилизации муки. Трибромид азота (NBr 3 ), впервые полученный в 1975 году, представляет собой темно-красное, чувствительное к температуре, летучее твердое вещество, взрывоопасное даже при -100 °C. Трийодид азота (NI 3 ) еще более нестабилен и был получен только в 1990 году. Его аддукт с аммиаком, известный ранее, очень чувствителен к ударам: его можно поджечь прикосновением пера, смещением воздушных потоков или даже альфа-частицы . [60] [61] По этой причине небольшие количества трийодида азота иногда синтезируют в качестве демонстрации студентам-химикам старших классов или в качестве акта «химической магии». [62] Азид хлора (ClN 3 ) и азид брома (BrN 3 ) чрезвычайно чувствительны и взрывоопасны. [63] [64]
Известны две серии оксогалогенидов азота: нитрозилгалогениды (XNO) и нитрилгалогениды (XNO 2 ). Первый — это очень химически активные газы, которые можно получить путем прямого галогенирования закиси азота. Нитрозилфторид (NOF) бесцветен и является сильным фторирующим агентом. Нитрозилхлорид (NOCl) ведет себя примерно таким же образом и часто используется в качестве ионизирующего растворителя. Нитрозилбромид (NOBr) имеет красный цвет. Реакции галогенидов нитрила во многом аналогичны: фторид нитрила (FNO 2 ) и хлорид нитрила (ClNO 2 ) также являются химически активными газами и сильными галогенирующими агентами. [60]
Оксиды

2 превращается в бесцветный четырехокись азота ( N
22О
4 ) при низких температурах превращается в NO.
2 при более высоких температурах.
Азот образует девять молекулярных оксидов, некоторые из которых были первыми газами, которые были идентифицированы: N 2 O ( закись азота ), NO ( оксид азота ), N 2 O 3 ( триоксид азота ), NO 2 ( диоксид азота ), N 2 O 4 ( тетроксид диазота ), N 2 O 5 ( пятиокись азота ), N 4 O ( нитрозилазид ), [65] и N(NO 2 ) 3 ( тринитрамид ). [66] Все они термически нестабильны по отношению к разложению на свои элементы. Еще одним возможным оксидом, который еще не синтезирован, является оксатетразол (N 4 O), ароматическое кольцо. [65]
Закись азота (N 2 O), более известная как веселящий газ, получается термическим разложением расплавленного нитрата аммония при температуре 250°C. Это окислительно-восстановительная реакция, поэтому в качестве побочных продуктов также образуются оксид азота и азот. Он в основном используется в качестве пропеллента и аэратора для распыляемых взбитых сливок в банках , а раньше широко использовался в качестве анестетика. Несмотря на внешний вид, его нельзя считать ангидридом азотистой кислоты ( H 2 N 2 O 2 ), поскольку эта кислота не образуется при растворении закиси азота в воде. Он довольно инертен (не реагирует с галогенами, щелочными металлами и озоном при комнатной температуре, хотя реакционная способность увеличивается при нагревании) и имеет несимметричную структуру N–N–O (N≡N + ТО − ↔ − Н=Н + =O): выше 600 °C он диссоциирует, разрывая более слабую связь N–O. [65] Оксид азота (NO) — простейшая стабильная молекула с нечетным числом электронов. У млекопитающих, включая человека, это важная клеточная сигнальная молекула, участвующая во многих физиологических и патологических процессах. [67] Он образуется в результате каталитического окисления аммиака. Это бесцветный парамагнитный газ, который, будучи термодинамически нестабильным, разлагается на газообразный азот и кислород при 1100–1200 °С. Его связь аналогична связи в азоте, но к разрыхляющей орбитали π * добавляется один дополнительный электрон, и, таким образом, порядок связи снижается примерно до 2,5; следовательно, димеризация до O=N–N=O невыгодна, за исключением случаев, когда температура ниже точки кипения (где цис- изомер более стабилен), поскольку она фактически не увеличивает общий порядок связей и поскольку неспаренный электрон делокализуется поперек молекулы NO, что дает возможность стабильность. Есть также свидетельства существования асимметричного красного димера O = N – O = N, когда оксид азота конденсируется с полярными молекулами. Он реагирует с кислородом с образованием коричневого диоксида азота и с галогенами с образованием нитрозилгалогенидов. Он также реагирует с соединениями переходных металлов с образованием нитрозильных комплексов, большинство из которых имеют яркую окраску. [65]
Синий триоксид диазота (N 2 O 3 ) доступен только в твердом виде, поскольку он быстро диссоциирует при температуре выше точки плавления с образованием оксида азота, диоксида азота (NO 2 ) и тетроксида диазота (N 2 O 4 ). Последние два соединения несколько трудно изучать по отдельности из-за равновесия между ними, хотя иногда тетраоксид диазота может реагировать путем гетеролитического деления с образованием нитрозония и нитрата в среде с высокой диэлектрической проницаемостью. Диоксид азота — едкий, едкий коричневый газ. Оба соединения можно легко получить разложением сухого нитрата металла. Оба реагируют с водой с образованием азотной кислоты . Четырехокись азота очень полезна для получения безводных нитратов металлов и нитратокомплексов, и она стала предпочтительным хранимым окислителем для многих ракет как в Соединенных Штатах, так и в СССР к концу 1950-х годов . Это связано с тем, что это гиперголическое топливо в сочетании с гидразина на основе ракетным топливом , и его можно легко хранить, поскольку оно находится в жидком состоянии при комнатной температуре. [65]
Термически нестабильный и очень реакционноспособный пятиокись азота (N 2 O 5 ) представляет собой ангидрид азотной кислоты и может быть получен из нее путем дегидратации пятиокисью фосфора . Представляет интерес для приготовления взрывчатых веществ. [68] Это расплывчатое бесцветное кристаллическое вещество, чувствительное к свету. В твердом состоянии он ионный со структурой [NO 2 ] + [НЕТ 3 ] − ; в газе и в растворе – молекулярный O 2 N–O–NO 2 . Гидратация до азотной кислоты происходит легко, как и аналогичная реакция с перекисью водорода с образованием пероксонитовой кислоты (HOONO 2 ). Это сильный окислитель. Газообразная пятиокись азота разлагается следующим образом: [65]
- Н 2 О 5 ⇌ НЕТ 2 + НЕТ 3 → НЕТ 2 + О 2 + НЕТ
- Н 2 О 5 + НЕТ ⇌ 3 НЕТ 2
Оксокислоты, оксоанионы и соли оксокислот
множество азотистых оксокислот Известно , однако большинство из них в чистом виде нестабильны и известны только в виде водных растворов или солей. Гипонитистая кислота (H 2 N 2 O 2 ) — слабая дипротонная кислота со структурой HON=NOH (p K a1 6,9, p K a2 11,6). Кислые растворы довольно стабильны, но при pH выше 4 происходит разложение, катализируемое основаниями, через [HONNO] − на закись азота и гидроксид-анион. Гипонитриты (с участием N
22О 2−
2- анион) устойчивы к восстановителям и чаще сами действуют как восстановители. Они являются промежуточной стадией окисления аммиака в нитрит, происходящего в круговороте азота . Гипонитрит может действовать как мостиковый или хелатирующий бидентатный лиганд. [69]
Азотистая кислота (HNO 2 ) не известна как чистое соединение, но является обычным компонентом в газовом равновесии и важным водным реагентом: ее водные растворы могут быть получены путем подкисления холодного водного нитрита ( NO −
2 , изогнутая) растворов, хотя уже при комнатной температуре диспропорция нитрата и оксида азота значительна. Это слабая кислота с pK 3,35 при 18 °C. Их можно анализировать титриметрически по окислению до нитрата перманганатом . Они легко восстанавливаются до закиси азота и оксида азота двуокисью серы , до азотистой кислоты оловом (II), до аммиака сероводородом . Соли гидразиния N
22Ч +
5 реагируют с азотистой кислотой с образованием азидов, которые в дальнейшем реагируют с образованием закиси азота и азота. Нитрит натрия умеренно токсичен в концентрациях выше 100 мг/кг, но небольшие количества часто используются для консервирования мяса и в качестве консерванта, чтобы избежать бактериальной порчи. Он также используется для синтеза гидроксиламина и диазотирования первичных ароматических аминов следующим образом: [69]
- ArNH 2 + HNO 2 → [ArNN]Cl + 2 H 2 O
Нитрит также является распространенным лигандом, который может координироваться пятью способами. Наиболее распространенными являются нитро (связанные с азотом) и нитрито (связанные с кислородом). Распространена изомерия нитро-нитрито, при этом нитрито-форма обычно менее стабильна. [69]

Азотная кислота (HNO 3 ) на сегодняшний день является наиболее важной и наиболее стабильной из азотистых оксокислот. Это одна из трех наиболее часто используемых кислот (две другие — серная кислота и соляная кислота ), впервые обнаруженная алхимиками в 13 веке. Его получают путем каталитического окисления аммиака до оксида азота, который окисляется до диоксида азота, а затем растворяется в воде с образованием концентрированной азотной кислоты. В Соединенных Штатах Америки ежегодно производится более семи миллионов тонн азотной кислоты, большая часть которой используется, среди прочего, для производства нитратов для удобрений и взрывчатых веществ. Безводную азотную кислоту можно получить перегонкой концентрированной азотной кислоты с пятиокисью фосфора при низком давлении в стеклянном аппарате в темноте. Ее можно производить только в твердом состоянии, так как при плавлении она самопроизвольно разлагается на диоксид азота, а жидкая азотная кислота подвергается самоионизации в большей степени, чем любая другая ковалентная жидкость, следующим образом: [69]
- 2 ХНО 3 ⇌ Ч
2 НЕТ +
3 + НЕТ −
3 ⇌ H 2 O + [NO 2 ] + + [НЕТ 3 ] −
два гидрата, HNO 3 ·H 2 O и HNO 3 ·3H 2 Известны O, которые поддаются кристаллизации. Это сильная кислота, а концентрированные растворы являются сильными окислителями, хотя золото , платина , родий и иридий невосприимчивы к воздействию. Смесь концентрированной соляной и азотной кислот в соотношении 3:1, называемая царской водкой , еще сильнее и успешно растворяет золото и платину, поскольку образуются свободный хлор и нитрозилхлорид, а хлорид-анионы могут образовывать прочные комплексы. В концентрированной серной кислоте азотная кислота протонируется с образованием нитрония , который может действовать как электрофил при ароматическом нитровании: [69]
- HNO 3 + 2 H 2 SO 4 ⇌ НЕТ +
2 + Н3О + + 2 ХСО −
4
Термическая стабильность нитратов (с участием тригонального плоского NO −
3 анион) зависит от основности металла, как и продукты разложения (термолиза), которые могут варьироваться между нитритом (например, натрия), оксидом (калий и свинец ) или даже самим металлом ( серебро ) в зависимости от их относительной стабильности. Нитрат также является распространенным лигандом со многими способами координации. [69]
Наконец, хотя ортонитровой кислоты (H 3 NO 4 ), которая была бы аналогом ортофосфорной кислоты , не существует, тетраэдрический ортонитрат- анион NO 3−
4 известен в виде натриевых и калиевых солей: [69]
Эти белые кристаллические соли очень чувствительны к водяному пару и углекислому газу в воздухе: [69]
- Na 3 NO 4 + H 2 O + CO 2 → NaNO 3 + NaOH + NaHCO 3
Несмотря на ограниченный химический состав, ортонитрат-анион интересен со структурной точки зрения из-за его правильной тетраэдрической формы и короткой длины связи N–O, что предполагает значительный полярный характер связи. [69]
Органические соединения азота
Азот — один из важнейших элементов органической химии . Многие органические функциональные группы включают связь углерод-азот , например амиды (RCONR 2 ), амины (R 3 N), имины (RC(=NR)R), имиды (RCO) 2 NR, азиды (RN 3 ), азо соединения (RN 2 R), цианаты (ROCN), изоцианаты (RNCO), нитраты (RONO 2 ) , нитрилы (RCN ), изонитрилы (RNC), нитриты (RONO), нитросоединения (RNO 2 ), нитрозосоединения (RNO) , оксимы (RC(=NOH)R) и пиридина производные . Связи C–N сильно поляризованы в сторону азота. В этих соединениях азот обычно трехвалентен (хотя в четвертичных аммониевых солях он может быть четырехвалентным , R 4 N + ), с неподеленной парой, которая может придавать соединению основность за счет координации с протоном. Это может быть компенсировано другими факторами: например, амиды не являются основными, поскольку неподеленная пара делокализована в двойную связь (хотя они могут действовать как основания при очень низком pH, будучи протонированными по атому кислорода), а пиррол не является основным, потому что неподеленная пара делокализована как часть ароматического кольца. [70] Количество азота в химическом веществе можно определить методом Кьельдаля . [71] В частности, азот является важным компонентом нуклеиновых кислот , аминокислот и, следовательно, белков , а также переносящей энергию молекулы аденозинтрифосфата и, таким образом, жизненно важен для всей жизни на Земле. [70]
возникновение

Азот — самый распространенный чистый элемент на Земле, составляющий 78,1% объема атмосферы . [8] (75,5% по массе), около 3,89 миллиона гигатонн . Несмотря на это, его не так много в земной коре, составляя где-то около 19 частей на миллион , наравне с ниобием , галлием и литием . (Это составляет от 300 000 до миллиона гигатонн азота, в зависимости от массы земной коры. [72] ) Единственными важными азотистыми минералами являются селитра ( нитрат калия , селитра) и селитра натриевая ( нитрат натрия , чилийская селитра). Однако они не были важным источником нитратов с 1920-х годов, когда стал обычным явлением промышленный синтез аммиака и азотной кислоты. [73]
Соединения азота постоянно обмениваются между атмосферой и живыми организмами. Азот сначала необходимо переработать или « фиксировать » в форму, пригодную для использования в растениях, обычно аммиак. Некоторая фиксация азота осуществляется ударами молнии, образуя оксиды азота, но большая часть осуществляется диазотрофными бактериями с помощью ферментов, известных как нитрогеназы (хотя сегодня промышленная фиксация азота до аммиака также имеет большое значение). Когда аммиак поглощается растениями, он используется для синтеза белков. Эти растения затем перевариваются животными, которые используют соединения азота для синтеза белков и выделения азотсодержащих отходов. Наконец, эти организмы умирают и разлагаются, подвергаясь бактериальному и экологическому окислению и денитрификации , возвращая свободный азот в атмосферу. Промышленная фиксация азота методом Габера в основном используется в качестве удобрения, хотя избыток азотсодержащих отходов при выщелачивании приводит к эвтрофикации пресной воды и созданию морских мертвых зон , поскольку рост бактерий, вызванный азотом, истощает водный кислород до такой степени, что все высшие организмы погибают. Кроме того, закись азота, образующаяся при денитрификации, разрушает атмосферный воздух. озоновый слой . [73]
Многие морские рыбы производят большое количество оксида триметиламина, чтобы защитить их от сильного осмотического воздействия окружающей среды; Преобразование этого соединения в диметиламин ответственно за ранний запах несвежей морской рыбы. [74] У животных свободный радикал оксида азота (полученный из аминокислоты ) служит важной регуляторной молекулой кровообращения. [75]
Быстрая реакция оксида азота с водой у животных приводит к образованию его метаболита нитрита . , Метаболизм азота в белках у животных, как правило, приводит к тогда как выделению мочевины у животных метаболизм нуклеиновых кислот приводит к выделению мочевины и мочевой кислоты . Характерный запах разложения мяса животных вызван образованием длинноцепочечных азотсодержащих аминов , таких как путресцин и кадаверин , которые являются продуктами распада аминокислот орнитина и лизина соответственно при разложении белков. [76]
Производство
Газообразный азот — это промышленный газ , получаемый фракционной перегонкой жидкого воздуха или механическим способом с использованием газообразного воздуха ( мембрана обратного осмоса под давлением или адсорбция с переменным давлением ). Генераторы азотного газа, использующие мембраны или адсорбцию при переменном давлении (PSA), обычно более экономичны и энергоэффективны, чем азот, доставляемый в больших количествах. [77] Технический азот часто является побочным продуктом обработки воздуха для промышленного обогащения кислорода для производства стали и других целей. При поставке в сжатом виде в баллонах его часто называют ОФН (бескислородный азот). [78] Азот технического качества уже содержит не более 20 частей на миллион кислорода, специально очищенные сорта, содержащие не более 2 частей на миллион кислорода и 10 частей на миллион аргона . также доступны [79]
В химической лаборатории его готовят обработкой водного раствора хлорида аммония нитритом натрия . [80]
- NH 4 Cl + NaNO 2 → N 2 + NaCl + 2 H 2 O
небольшие количества примесей NO и HNO 3 В этой реакции также образуются . Примеси можно удалить, пропуская газ через водную серную кислоту, содержащую дихромат калия . [80]
Его также можно получить термическим разложением дихромата аммония . [81]
- 3(NH 4 ) 2 Cr 2 O 7 → 2N 2 + 9H 2 O + 3Cr 2 O 3 + 2NH 3 + 32O 2
Очень чистый азот можно получить термическим разложением азида бария или азида натрия . [82]
- 2 NaN 3 → 2 Na + 3 N 2
Приложения
Применение соединений азота, естественно, чрезвычайно широко разнообразно из-за огромного размера этого класса: следовательно, здесь будет рассматриваться только применение самого чистого азота. Две трети (2/3) азота, производимого промышленностью, продается в виде газа, а оставшаяся треть (1/3) – в жидком виде.
Газ
Газ в основном используется в качестве безопасной атмосферы с низкой реакционной способностью там, где кислород в воздухе может представлять опасность пожара, взрыва или окисления. Вот некоторые примеры: [79]
- В качестве модифицированной атмосферы , чистой или смешанной с диоксидом углерода , для азотирования и сохранения свежести упакованных или нерасфасованных пищевых продуктов (путем замедления прогоркания и других форм окислительного повреждения ). Чистый азот в качестве пищевой добавки маркируется в Европейском Союзе номером E E941. [83]
- В лампах накаливания как недорогая альтернатива аргону . [84]
- В системах пожаротушения для оборудования информационных технологий (ИТ) . [79]
- При производстве нержавеющей стали . [85]
- При цементировании стали азотированием . [86]
- В топливных системах некоторых самолетов для снижения пожароопасности (см. систему инертизации ).
- Накачивать шины гоночных автомобилей и самолетов , [87] уменьшение проблем неравномерного расширения и сжатия, вызванных влажностью и кислородом в естественном воздухе. [79]
Азот обычно используется при подготовке проб в химическом анализе . Он используется для концентрации и уменьшения объема жидких проб. Направление потока азота под давлением перпендикулярно поверхности жидкости приводит к испарению растворителя, оставляя растворенное вещество(а) и неиспарившийся растворитель. [88]
Азот можно использовать вместо углекислого газа или в сочетании с ним для повышения давления в кегах с некоторыми сортами пива , особенно со стаутами и британскими элями , поскольку он образует меньшие пузырьки , что делает пиво более гладким и пьянящим . [89] Чувствительная к давлению азотная капсула, известная как « виджет », позволяет упаковывать заряженное азотом пиво в банки и бутылки . [90] [91] Баллоны с азотом также заменяют углекислый газ в качестве основного источника энергии для пейнтбольных ружей . Азот должен храниться под более высоким давлением, чем CO 2 , что делает резервуары с азотом тяжелее и дороже. [92]
Оборудование
Некоторое строительное оборудование использует сжатый азот, чтобы помочь гидравлической системе обеспечить дополнительную мощность для таких устройств, как гидравлический молот . Газообразный азот, образующийся при разложении азида натрия , используется для надувания подушек безопасности . [93]
Исполнение
Поскольку азот сам по себе является удушающим газом, в некоторых юрисдикциях удушение путем вдыхания чистого азота рассматривается как средство смертной казни (в качестве замены смертельной инъекции ). [94] [95] [96] В январе 2024 года Кеннет Юджин Смит стал первым человеком, казненным путем удушья азотом. [97]
Жидкость
Жидкий азот — криогенная жидкость , похожая на воду . При изоляции в соответствующих контейнерах, таких как сосуды Дьюара , его можно транспортировать и хранить с низким уровнем потерь от испарения . [98]

Как и сухой лед , жидкий азот в основном используется для охлаждения до низких температур. Он используется при криоконсервации биологических материалов, таких как кровь и репродуктивные клетки ( сперма и яйцеклетки ). Его используют в криотерапии для удаления кист и бородавок на коже путем их замораживания. [99] Он используется в лабораторных холодных ловушках и крионасосах для получения более низкого давления в с вакуумной откачкой системах . Он используется для охлаждения термочувствительной электроники, такой как инфракрасные детекторы и детекторы рентгеновского излучения . Другие области применения включают шлифовку замораживанием и обработку материалов, которые являются мягкими или эластичными при комнатной температуре, термоусадку и сборку инженерных компонентов, а также, в более общем плане, для достижения очень низких температур, где это необходимо. Из-за своей низкой стоимости жидкий азот часто используется для охлаждения, даже когда такие низкие температуры не являются строго необходимыми, например, охлаждение продуктов питания, замораживание скота, замораживание труб для остановки потока при отсутствии клапанов и уплотнение нестабильной почвы путем замерзает всякий раз, когда под ним ведутся раскопки. [79]
Безопасность
Газ
Хотя азот нетоксичен, при попадании в закрытое пространство он может вытеснять кислород и, следовательно, представляет опасность удушья . человека Это может произойти с небольшим количеством предупредительных симптомов, поскольку каротидное тело представляет собой относительно плохую и медленную систему восприятия низкого уровня кислорода (гипоксии). [100] Пример произошел незадолго до запуска первой миссии космического корабля "Шаттл" 19 марта 1981 года, когда два техника умерли от удушья после того, как вошли в пространство, расположенное на мобильной пусковой платформе космического корабля "Шаттл" , которое было заполнено чистым азотом под давлением в качестве меры предосторожности против возгорания. . [101]
При вдыхании при высоких парциальных давлениях (более примерно 4 бар, встречается на глубинах ниже 30 м при подводном плавании с аквалангом ) азот является анестетиком, вызывающим азотный наркоз — временное состояние умственного расстройства, подобное интоксикации закисью азота . [102] [103]
Азот растворяется в крови и жирах организма. Быстрая декомпрессия (например, когда дайверы слишком быстро всплывают или космонавты слишком быстро декомпрессируют давление в кабине до давления в скафандре) может привести к потенциально смертельному состоянию, называемому декомпрессионной болезнью (ранее известной как кессонная болезнь или изгибы ), когда в кровотоке образуются пузырьки азота, нервы, суставы и другие чувствительные или жизненно важные области. [104] [105] Пузырьки других «инертных» газов (газов, отличных от углекислого газа и кислорода) вызывают те же эффекты, поэтому замена азота в дыхательных газах может предотвратить азотный наркоз, но не предотвращает декомпрессионную болезнь. [106]
Жидкость
Как криогенная жидкость, жидкий азот может быть опасен, вызывая холодные ожоги при контакте, хотя эффект Лейденфроста обеспечивает защиту при очень коротком воздействии (около одной секунды). [107] Проглатывание жидкого азота может привести к серьезным внутренним повреждениям. Например, в 2012 году молодой женщине в Англии пришлось удалить желудок после того, как она приняла коктейль из жидкого азота. [108]
азота из жидкости в газ Поскольку коэффициент расширения составляет 1:694 при 20 °C, при быстром испарении жидкого азота в закрытом пространстве может возникнуть огромная сила. Во время инцидента, произошедшего 12 января 2006 года в Техасском университете A&M , устройства сброса давления в резервуаре с жидким азотом вышли из строя и позже были опломбированы. В результате последующего повышения давления резервуар катастрофически вышел из строя. Силы взрыва было достаточно, чтобы пробить резервуар через потолок непосредственно над ним, разрушить железобетонную балку непосредственно под ним и снести стены лаборатории на высоту 0,1–0,2 м от фундамента. [109]
Жидкий азот легко испаряется с образованием газообразного азота, поэтому меры предосторожности, связанные с газообразным азотом, применимы и к жидкому азоту. [110] [111] [112] Например, датчики кислорода иногда используются в качестве меры предосторожности при работе с жидким азотом, чтобы предупредить рабочих о разливах газа в замкнутом пространстве. [113]
Сосуды, содержащие жидкий азот, могут конденсировать кислород из воздуха. Жидкость в таком сосуде становится все более обогащаемой кислородом (температура кипения -183 ° C, выше, чем у азота) по мере испарения азота, и может вызвать бурное окисление органических материалов. [114]
Мониторы дефицита кислорода
Мониторы дефицита кислорода используются для измерения уровня кислорода в замкнутых пространствах и в любом месте, где хранится или используется газообразный или жидкий азот. В случае утечки азота и снижения содержания кислорода до заданного уровня сигнализации монитор дефицита кислорода можно запрограммировать на подачу звуковых и визуальных сигналов тревоги, тем самым обеспечивая оповещение о возможной надвигающейся опасности. Чаще всего персоналу следует предупредить уровень кислорода, когда уровень кислорода падает ниже 19,5%. OSHA указывает, что к опасной атмосфере может относиться атмосфера, в которой концентрация кислорода ниже 19,5% или выше 23,5%. [115] Мониторы дефицита кислорода можно либо закрепить, закрепить на стене и жестко подключить к электросети здания, либо просто подключить к розетке, либо к портативному ручному или носимому монитору.
См. также
Ссылки
- ^ «Стандартные атомные массы: азот» . ЦИАВ . 2009.
- ^ Прохаска, Томас; Ирргехер, Йоханна; Бенефилд, Жаклин; Бёлке, Джон К.; Чессон, Лесли А.; Коплен, Тайлер Б.; Дин, Типинг; Данн, Филип Дж. Х.; Грёнинг, Манфред; Холден, Норман Э.; Мейер, Харро Эй Джей (04 мая 2022 г.). «Стандартные атомные веса элементов 2021 (Технический отчет ИЮПАК)» . Чистая и прикладная химия . дои : 10.1515/pac-2019-0603 . ISSN 1365-3075 .
- ↑ Перейти обратно: Перейти обратно: а б с Лиде, Дэвид Р. (1990–1991). Справочник CRC по физике и химии (71-е изд.). Бока-Ратон, Анн-Арбор, Бостон: CRC Press, Inc. стр. 4–22 (одна страница).
- ^ «Газы – Плотность» . Инженерный набор инструментов . Проверено 27 января 2019 г.
- ^ Тетразолы содержат в кольце пару атомов азота с двойной связью со степенью окисления 0. Синтез исходного 1H-тетразола, CH 2 N 4 (два атома N(0)) приведен в Генри, Рональд А.; Финнеган, Уильям Г. (1954). «Улучшенная процедура дезаминирования 5-аминотетразола». Журнал Американского химического общества . 76 (1): 290–291. дои : 10.1021/ja01630a086 . ISSN 0002-7863 .
- ^ Арбластер, Джон В. (2018). Некоторые значения кристаллографических свойств элементов . Парк материалов, Огайо: ASM International. ISBN 978-1-62708-155-9 .
- ^ Общие энергии связи (D) и длины связи (r). Архивировано 15 мая 2010 г. в Wayback Machine . Wiredchemist.com
- ↑ Перейти обратно: Перейти обратно: а б с Гринвуд и Эрншоу, стр. 406–07.
- ^ Резерфорд, Дэниел (1772) « Dissertatio Inauguralis de aere fixo, aut mephitico. Архивировано 6 августа 2020 г. в Wayback Machine » (первая диссертация в эфире [называемая] фиксированной или мефитической), докторская диссертация, Эдинбургский университет, Шотландия. Английский перевод: Доббин, Леонард (1935). «Вступительная диссертация Дэниела Резерфорда». Журнал химического образования . 12 (8): 370–75. Бибкод : 1935JChEd..12..370D . дои : 10.1021/ed012p370 .
- ^ Уикс, Мария Эльвира (1932). «Открытие элементов. IV. Три важных газа». Журнал химического образования . 9 (2): 215. Бибкод : 1932ЖЧЭд...9..215Вт . дои : 10.1021/ed009p215 .
- ^ Иде, Аарон Дж. (1964). Развитие современной химии . Нью-Йорк: Харпер и Роу.
- ^ Карл Вильгельм Шееле, Химический трактат о воздухе и огне (Упсала, Швеция: Магнус Сведерус, 1777; и Лейпциг (Германия): Зигфрид Лебрехт Крузиус, 1777). В разделе «Воздух должен состоять из упругих жидкостей двух видов». (Воздух должен состоять из упругих жидкостей двух сортов), на стр. 6–14 Шееле представлены результаты восьми опытов, в которых воздух реагировал с различными веществами. Он заключил ( стр. 13 ): «Из упомянутых опытов я вижу вот что, что воздух состоит из двух различных жидкостей, одна из которых вовсе не обладает свойством притягивать флогистон, а другая действительно способна к такому притяжению и которые составляют между 3-й и 4-й частью всей воздушной массы». (Итак, я вижу [это] многое из проведенных опытов: что воздух состоит из двух жидкостей, [которые] отличаются друг от друга, из которых одна совершенно не выражает свойства притягивать флогистон; другой же способен к такому притяжению и составляет от 1/3 до 1/4 части всей массы воздуха.)
- ^ Пристли, Джозеф (1772). «Наблюдения за разными видами воздуха». Философские труды Лондонского королевского общества . 62 : 147–256. дои : 10.1098/rstl.1772.0021 . S2CID 186210131 . ; см. стр. 225. Архивировано 3 сентября 2016 г. в Wayback Machine.
- ^ Пристли, Джозеф (1772). «Наблюдения за разными видами воздуха». Философские труды Лондонского королевского общества . 62 : 147–256. дои : 10.1098/rstl.1772.0021 . S2CID 186210131 . ; см.: «VII. О воздухе, зараженном дымами горящего угля». стр. 225–28. Архивировано 3 сентября 2016 г. в Wayback Machine.
- ^ Лавуазье, Антуан с Робертом Керром, пер., Элементы химии , 4-е изд. (Эдинбург, Шотландия: Уильям Крич, 1799), стр. 85–86. [стр. 85 :] Архивировано 6 августа 2020 г. в Wayback Machine «Размышляя об обстоятельствах этого эксперимента, мы легко понимаем, что ртуть во время своего прокаливания [т. е. обжига на воздухе] поглощает целебную и пригодную для дыхания часть воздух, или, говоря более строго, основа этой вдыхаемой части, что оставшийся воздух представляет собой разновидность мефиита [т. е. ядовитого газа, выделяющегося из земли], неспособного поддерживать горение или дыхание...» [р; . 86 :] Архивировано 6 августа 2020 г. в Wayback Machine «Впоследствии я покажу, что, по крайней мере в нашем климате, атмосферный воздух состоит из вдыхаемого и токсического воздуха в пропорции 27 и 73; ...»
- ^ Лавуазье, Антуан с Робертом Керром, пер., Элементы химии , 4-е изд. (Эдинбург, Шотландия: Уильям Крич, 1799), с. 101: «Химические свойства ядовитой части атмосферного воздуха до сих пор были мало известны, и мы были удовлетворены тем, что получили название ее основы из-за ее известного свойства убивать таких животных, которые вынуждены ею дышать, дав ей название азота » , от греческих частных частиц α и ξωη, vita ; отсюда и название вредной части атмосферного воздуха — азотный газ .
- ^ Чаптал, Дж. А. и Николсон, Уильям пер. (1800) Элементы химии , 3-е изд. Лондон, Англия: CC и Дж. Робинсон, том. 1. С. xxxv–xxxvi: «Чтобы исправить Номенклатуру по этому поводу [т. е. в этом отношении], не нужно ничего больше, как заменить [т. е.] это слово наименованием, полученным из общей системы. использовал; и я осмелился предположить, что газ азота. Во-первых, это выведено из характерного и исключительного свойства этого газа, который образует радикал азотной кислоты. комбинации [т. е. соединения] этого вещества под полученными [т. е. преобладающими] наименованиями, такими как азотная кислота, нитраты, нитриты и т. д.».
- ^ азот. Архивировано 2 июля 2017 г. в Wayback Machine . Этимонлайн.com. Проверено 26 октября 2011 г.
- ^ Стратт, Р.Дж. (1911) «Бейкеровская лекция. Химически активная модификация азота, производимая электрическим разрядом» , Архивировано 20 декабря 2016 г. в Wayback Machine Proceedings of the Royal Society A , 85 (577): 219–29. .
- ↑ Активный азот лорда Рэлея . Архивировано 1 ноября 2012 г. в Wayback Machine . Lateralscience.co.uk. Проверено 26 октября 2011 г.
- ^ Эрисман, Ян Виллем; Саттон, Марк А.; Галлоуэй, Джеймс; Климонт, Збигнев; Винивартер, Уилфрид (2008). «Как век синтеза аммиака изменил мир». Природа Геонауки . 1 (10): 636. Бибкод : 2008NatGe...1..636E . дои : 10.1038/ngeo325 . S2CID 94880859 .
- ^ GB 190200698 , Оствальд, Вильгельм , «Усовершенствования в производстве азотной кислоты и оксидов азота», опубликовано 20 марта 1902 г.
- ^ GB 190208300 , Оствальд, Вильгельм , «Усовершенствования в производстве азотной кислоты и оксидов азота и связанные с ними», опубликовано 26 февраля 1903 г.
- ↑ Перейти обратно: Перейти обратно: а б с д и Гринвуд и Эрншоу, стр. 411–12.
- ^ Гринвуд и Эрншоу, с. 550
- ^ Каупп, Мартин (1 декабря 2006 г.). «Роль радиальных узлов атомных орбиталей для химической связи и таблицы Менделеева» . Журнал вычислительной химии . 28 (1): 320–25. дои : 10.1002/jcc.20522 . ПМИД 17143872 . S2CID 12677737 .
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г час я дж Гринвуд и Эрншоу, стр. 412–16.
- ^ Миллер, Т.С.; Белен, А.; Сутер, ТМ; Селла, А.; Кора, А.; Макмиллан, ПФ (2017). «Нитриды углерода: синтез и характеристика нового класса функциональных материалов» . Физическая химия Химическая физика . 19 (24): 15613–15638. Бибкод : 2017PCCP...1915613M . дои : 10.1039/C7CP02711G . ПМИД 28594419 .
- ^ Хаус, Дж. Э.; Хаус, Калифорния (2016). Описательная неорганическая химия . Амстердам: Эльзевир. п. 198. ИСБН 978-0-12-804697-5 .
- ^ Рой, АК; Бернс, GT; Григора, С.; Ложь, GC (1994). «Поли(алкил/арилоксотиазены), [N=S(O)R] n : Новое направление в неорганических полимерах». В Висиан-Нилсоне, П.; Алкок, HR; Винн, К.Дж. (ред.). Неорганические и металлоорганические полимеры II: современные материалы и полупродукты . Американское химическое общество. стр. 344–357. дои : 10.1021/bk-1994-0572.ch026 .
- ^ Холман, Джек П. (2002). Теплопередача (9-е изд.). Нью-Йорк, штат Нью-Йорк: McGraw-Hill Companies, Inc., стр. 600–606. ISBN 9780072406559 . OCLC 46959719 .
- ^ Инкропера 1 Девитт 2 Бергман 3 Лавин 4, Фрэнк П. 1 Дэвид П. 2 Теодор Л. 3 Адриенн С. 4 (2007). Основы тепломассообмена (6-е изд.). Хобокен, Нью-Джерси: John Wiley and Sons, Inc., стр. 941–950. ISBN 9780471457282 . OCLC 62532755 .
{{cite book}}: CS1 maint: числовые имена: список авторов ( ссылка ) - ^ Бете, ХА (1939). «Производство энергии в звездах» . Физический обзор . 55 (5): 434–56. Бибкод : 1939PhRv...55..434B . дои : 10.1103/PhysRev.55.434 . ПМИД 17835673 .
- ^ ЦИАВ (2003). «Атомный вес азота» . ciaaw.org . ЦИАВ. Архивировано из оригинала 14 октября 2016 года . Проверено 13 октября 2016 г.
- ^ Фланаган, Лоуренс Б.; Элерингер, Джеймс Р.; Патаки, Дайан Э. (15 декабря 2004 г.). Стабильные изотопы и биосферно-атмосферные взаимодействия: процессы и биологический контроль . Эльзевир. стр. 74–75. ISBN 978-0-08-052528-0 . Архивировано из оригинала 5 февраля 2016 года . Проверено 20 декабря 2015 г.
- ^ Гринвуд и Эрншоу, с. 408
- ^ «Извлечение и отображение файла оцененных ядерных данных (ENDF)» . Национальный центр ядерных данных. Архивировано из оригинала 9 августа 2020 г. Проверено 23 ноября 2016 г.
- ^ Артур Дж. Палмер (2007). ЯМР-спектроскопия белков . Эльзевир Академик Пресс. ISBN 978-0-12-164491-8 .
- ^ Катценберг, Массачусетс (2008). «Глава 13: Анализ стабильных изотопов: инструмент для изучения прошлой диеты, демографии и истории жизни». Биологическая антропология человеческого скелета (2-е изд.). Уайли. ISBN 978-0-471-79372-4 .
- ^ Чо, Адриан (25 сентября 2023 г.). «Мимолетная форма азота расширяет возможности ядерной теории до предела» . Science.org . Проверено 27 сентября 2023 г.
- ↑ Перейти обратно: Перейти обратно: а б с Ауди, Жорж; Берсильон, Оливье; Блашо, Жан; Вапстра, Аалдерт Хендрик (2003), « Оценка NUBASE свойств ядра и распада» , Nuclear Physics A , 729 : 3–128, Бибкод : 2003NuPhA.729....3A , doi : 10.1016/j.nuclphysa.2003.11 .001
- ^ Карлсон, Нил (22 января 2012 г.). Физиология поведения . Методы и стратегии исследования. Том. 11-е издание. Пирсон. п. 151. ИСБН 978-0-205-23939-9 .
- ↑ Перейти обратно: Перейти обратно: а б с Нееб, Карл Хайнц (1997). Радиохимия атомных электростанций с легководными реакторами . Берлин-Нью-Йорк: Вальтер де Грюйтер. п. 227. ИСБН 978-3-11-013242-7 . Архивировано из оригинала 05 февраля 2016 г. Проверено 20 декабря 2015 г.
- ^ «Universal Industrial Gases, Inc... Свойства азота N2, использование, применение - газ и жидкость» .
- ^ Льюарс, Эррол Г. (2008). Чудесное моделирование: вычислительное предвидение новых молекул . Springer Science+Business Media . стр. 141–63. дои : 10.1007/978-1-4020-6973-4 . ISBN 978-1-4020-6972-7 .
- ^ «Синтезирован полимерный азот» . physorg.com. 5 августа 2004 г. Архивировано из оригинала 24 января 2012 г. Проверено 22 июня 2009 г.
- ^ Грей, Теодор (2009). Элементы: визуальное исследование каждого известного атома во Вселенной . Нью-Йорк: Black Dog & Leventhal Publishers. ISBN 978-1-57912-814-2 .
- ^ Шуч, А.Ф.; Миллс, Р.Л. (1970). «Кристаллические структуры трех модификаций азота 14 и азота 15 при высоком давлении». Журнал химической физики . 52 (12): 6000–08. Бибкод : 1970ЖЧФ..52.6000С . дои : 10.1063/1.1672899 .
- ^ Янку, резюме; Райт, скорая помощь; Хейманн, Дж.Б.; Дженсен, Дж.Дж. (2006). «Сравнение жидкого азота и жидкого гелия как криогенов для электронной криотомографии». Журнал структурной биологии . 153 (3): 231–40. дои : 10.1016/j.jsb.2005.12.004 . ПМИД 16427786 .
- ^ «Текущие азотные ледники видны на поверхности Плутона после пролета аппарата «Новые горизонты»» . Новости АВС . 25 июля 2015 года. Архивировано из оригинала 29 сентября 2015 года . Проверено 6 октября 2015 г.
- ^ Маккиннон, Уильям Б.; Кирк, Рэндольф Л. (2014). «Тритон» . В Споне, Тилман; Брейер, Дорис; Джонсон, Торренс (ред.). Энциклопедия Солнечной системы (3-е изд.). Амстердам; Бостон: Эльзевир . стр. 861–82. ISBN 978-0-12-416034-7 . Архивировано из оригинала 3 сентября 2016 г. Проверено 30 апреля 2016 г.
- ^ «Нептун: Спутники: Тритон» . НАСА . Архивировано из оригинала 15 октября 2011 года . Проверено 21 сентября 2007 г.
- ^ Фризук, доктор медицинских наук и Джонсон, С.А. (2000). «Продолжение истории активации динитрогена». Обзоры координационной химии . 200–202: 379. doi : 10.1016/S0010-8545(00)00264-2 .
- ^ Шрок, Р.Р. (2005). «Каталитическое восстановление азота до аммиака в едином молибденовом центре» . Акк. хим. Рез. 38 (12): 955–62. дои : 10.1021/ar0501121 . ПМЦ 2551323 . ПМИД 16359167 .
- ↑ Перейти обратно: Перейти обратно: а б с д и Гринвуд и Эрншоу, стр. 417–20.
- ^ Гринвуд и Эрншоу, стр. 434–38.
- ^ Гринвуд и Эрншоу, стр. 420–26.
- ↑ Перейти обратно: Перейти обратно: а б с д Гринвуд и Эрншоу, стр. 426–33.
- ^ Виейра, Р.; К. Фам-Хуу; Н. Келлер; МЖ Леду (2002). «Новый композит углеродного нановолокна и графитового войлока для использования в качестве катализатора каталитического разложения гидразина». Химические коммуникации (9): 954–55. дои : 10.1039/b202032g . ПМИД 12123065 .
- ↑ Перейти обратно: Перейти обратно: а б с д Гринвуд и Эрншоу, стр. 438–42.
- ^ Боуден, ФП (1958). «Инициирование взрыва нейтронами, α-частицами и продуктами деления». Труды Лондонского королевского общества А. 246 (1245): 216–19. Бибкод : 1958RSPSA.246..216B . дои : 10.1098/rspa.1958.0123 . S2CID 137728239 .
- ^ Форд, Луизиана; Грундмайер, EW (1993). Химическая магия . Дувр. п. 76 . ISBN 978-0-486-67628-9 .
- ^ Фриерсон, WJ; Кронрад Дж.; Браун, AW (1943). «Азид хлора, ClN 3.I ». Журнал Американского химического общества . 65 (9): 1696–1698. дои : 10.1021/ja01249a012 .
- ^ Лихс, Бенджамин; Блязер, Дитер; Вёльпер, Кристоф; Шульц, Стефан; Янсен, Георг (20 февраля 2012 г.). «Твердотельная структура азида брома» (PDF) . Angewandte Chemie, международное издание . 51 (8): 1970–1974. дои : 10.1002/anie.201108092 . ПМИД 22250068 . Архивировано (PDF) из оригинала 25 августа 2021 года . Проверено 25 августа 2021 г.
- ↑ Перейти обратно: Перейти обратно: а б с д и ж Гринвуд и Эрншоу, стр. 443–58.
- ^ Рам, Мартин; Двинских Сергей В.; Фуро, Иштван; Бринк, Торе (23 декабря 2010 г.). «Экспериментальное обнаружение тринитрамида, N(NO 2 ) 3 ». Angewandte Chemie, международное издание . 50 (5): 1145–48. дои : 10.1002/anie.201007047 . ПМИД 21268214 . S2CID 32952729 .
- ^ Хоу, ЮК; Янчук А.; Ван, PG (1999). «Современные тенденции развития доноров оксида азота». Текущий фармацевтический дизайн . 5 (6): 417–41. дои : 10.2174/138161280506230110111042 . ПМИД 10390607 .
- ^ Талавар, МБ; и др. (2005). «Создание технологической технологии производства пятиокиси азота и ее использование для синтеза самого мощного взрывчатого вещества на сегодняшний день - CL-20». Журнал опасных материалов . 124 (1–3): 153–64. Бибкод : 2005JHzM..124..153T . дои : 10.1016/j.jhazmat.2005.04.021 . ПМИД 15979786 .
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г час я Гринвуд и Эрншоу, стр. 459–72.
- ↑ Перейти обратно: Перейти обратно: а б Марч, Джерри (1985), Продвинутая органическая химия: реакции, механизмы и структура, 3-е издание , Нью-Йорк: Wiley, ISBN 9780471854722 , OCLC 642506595
- ^ Редей, Джордж П. (2008). «Метод Кьельдаля». Энциклопедия генетики, геномики, протеомики и информатики . п. 1063. дои : 10.1007/978-1-4020-6754-9_9066 . ISBN 978-1-4020-6753-2 .
- ^ В зависимости от средней толщины, которая составляет от 10 до 30 км, масса земной коры составляет от 15 × 10. 18 и 45 × 10 18 тонн.
- ↑ Перейти обратно: Перейти обратно: а б Гринвуд и Эрншоу, стр. 407–09.
- ^ Нильсен, МК; Йоргенсен, Б.М. (июнь 2004 г.). «Количественная связь между активностью триметиламиноксидальдолазы и накоплением формальдегида в белых мышцах гадиформных рыб при хранении в замороженном виде». Журнал сельскохозяйственной и пищевой химии . 52 (12): 3814–22. дои : 10.1021/jf035169l . ПМИД 15186102 .
- ^ Нокс, Джорджия (2007). Биология Южного океана . ЦРК Пресс. п. 392. ИСБН 978-0-8493-3394-1 . Архивировано из оригинала 01 октября 2021 г. Проверено 24 августа 2020 г.
- ^ Викерстафф Джонеха; Дженис М. (2004). Пищеварение, диета и болезни: синдром раздраженного кишечника и функция желудочно-кишечного тракта . Издательство Университета Рутгерса. п. 121. ИСБН 978-0-8135-3387-2 . Архивировано из оригинала 01 октября 2021 г. Проверено 24 августа 2020 г.
- ^ Фрелих, Питер (май 2013 г.). «Устойчивый подход к поставкам азота» . www.parker.com . Корпорация Паркер Ханнифин. Архивировано из оригинала 16 марта 2016 года . Проверено 24 ноября 2016 г.
- ^ Райх, Мюррей; Капенекас, Гарри (1957). «Очистка азота. Опытная установка по удалению кислорода». Промышленная и инженерная химия . 49 (5): 869–73. дои : 10.1021/ie50569a032 .
- ↑ Перейти обратно: Перейти обратно: а б с д и Гринвуд и Эрншоу, стр. 409–11.
- ↑ Перейти обратно: Перейти обратно: а б Бартлетт, Дж. К. (1967). «Анализ нитрита по выделению азота: лабораторный эксперимент по общей химии». Журнал химического образования . 44 (8): 475. Бибкод : 1967ЖЧЭд..44..475Б . дои : 10.1021/ed044p475 .
- ^ Махье, Б.; Аперс, диджей; Капрон, ПК (1971). «Термическое разложение дихромата аммония». Журнал неорганической и ядерной химии . 33 (9). Эльзевир Б.В.: 2857–2866. дои : 10.1016/0022-1902(71)80047-7 . ISSN 0022-1902 .
- ^ Еремец, М.И.; Попов, М.Ю.; Троян, Айова; Денисов В.Н.; Белер, Р.; Хемли, Р.Дж. (2004). «Полимеризация азота в азиде натрия». Журнал химической физики . 120 (22): 10618–23. Бибкод : 2004JChPh.12010618E . дои : 10.1063/1.1718250 . ПМИД 15268087 .
- ^ Министры, Совет Северных стран (2002 г.). Пищевые добавки в Европе 2000 . Совет министров Северных стран. п. 591. ИСБН 978-92-893-0829-8 . Архивировано из оригинала 05 февраля 2016 г. Проверено 20 декабря 2015 г.
- ^ Хардинг, Чарли, изд. (2002). Элементы блока p . Кембридж: Королевское химическое общество. ISBN 978-0-85404-690-4 . Архивировано из оригинала 01 октября 2021 г. Проверено 24 августа 2020 г.
- ^ Гаврилюк В.Г.; Бернс, Ганс (1999). Высокоазотистые стали: структура, свойства, производство, применение . Спрингер. ISBN 978-3-540-66411-6 . Архивировано из оригинала 01 октября 2021 г. Проверено 24 августа 2020 г.
- ^ Мека, СР; Чаухан, А.; Штайнер, Т.; Бишофф, Э.; Гош, ПК; Миттемейер, Э.Дж. (2015). «Создание дуплексных микроструктур методом азотирования; азотирование сплава Fe–Mn на основе железа» . Материаловедение и технологии . 32 (9): 1743284715Y.000. дои : 10.1179/1743284715Y.0000000098 .
- ^ «Почему они не используют обычный воздух в шинах гоночных автомобилей?» . Как все работает. 16 марта 2001 г. Архивировано из оригинала 12 июля 2011 г. Проверено 22 июля 2006 г.
- ^ Кеммоти, Ю; Цуцуми, К.; Арикава, А.; Наказава, Х. (2002). «Центробежный концентратор для замены микроконцентрирования продувкой азотом при подготовке проб диоксина / полихлордифенила». Журнал хроматографии А. 943 (2): 295–97. дои : 10.1016/S0021-9673(01)01466-2 . ПМИД 11833649 .
- ^ Бакстер, Э. Дениз; Хьюз, Пол С. (2001). Пиво: качество, безопасность и питательные аспекты . Королевское химическое общество. п. 22. ISBN 978-0-85404-588-4 . Архивировано из оригинала 21 марта 2020 г. Проверено 20 июня 2015 г.
- ^ «Как может работать виджет в пиве?» . Как все работает. 16 августа 2000 г. Архивировано из оригинала 2 ноября 2007 г. Проверено 30 июля 2008 г.
- ^ Денни, Марк (1 ноября 2009 г.). Пена!: Наука пива . Издательство Университета Джонса Хопкинса + ORM. п. 131. ИСБН 978-0-8018-9569-2 . Архивировано из оригинала 5 февраля 2016 года . Проверено 20 декабря 2015 г.
- ^ Кеннетт, Эндрю Дж. (2008). Проектирование системы переключения передач с пневматическим усилителем для гонок Формулы SAE (Диссертация). Кафедра машиностроения Массачусетского технологического института. hdl : 1721.1/45820 .
- ^ Беттертон, Э.А. (2003). «Экологическая судьба азида натрия, полученного из автомобильных подушек безопасности». Критические обзоры в области экологических наук и технологий . 33 (4): 423–58. Бибкод : 2003CREST..33..423B . дои : 10.1080/10643380390245002 . S2CID 96404307 .
- ^ Сэнберн, Джош (10 апреля 2015 г.). «Рассвет новой формы смертной казни» . Время . Архивировано из оригинала 11 апреля 2015 г. Проверено 11 апреля 2015 г.
- ^ Секстон, Майк (18 декабря 2012 г.). «Сторонник эвтаназии под пристальным вниманием» . АВС . Архивировано из оригинала 7 июля 2013 года . Проверено 6 мая 2013 г.
- ^ Берман, Марк (17 апреля 2015 г.). «Оклахома заявляет, что теперь будет использовать газообразный азот в качестве резервного метода казни» . Вашингтон Пост . Архивировано из оригинала 23 июня 2019 года . Проверено 22 июня 2019 г.
- ^ «Кеннет Юджин Смит казнен посредством гипоксии азота в Алабаме, что стало первым случаем смертной казни» . Новости CBS . 26 января 2024 г.
- ^ Каганер, М.Г.; Кожеров В., Левина Ж. Л. (1967). «Сосуды для хранения и транспортировки жидкого кислорода и азота». Химическое и нефтяное машиностроение . 3 (12): 918–22. дои : 10.1007/BF01136404 . S2CID 96762552 .
- ^ Ахмед I; Агарвал С; Ильчишин А; Чарльз-Холмс С; Берт-Джонс Дж (май 2001 г.). «Криотерапия обыкновенных бородавок жидким азотом: криоспрей против ватной палочки». Бр. Дж. Дерматол . 144 (5): 1006–09. дои : 10.1046/j.1365-2133.2001.04190.x . ПМИД 11359389 . S2CID 221325640 .
- ^ «Биологическая безопасность – Криогенные материалы. Риски, которые они представляют» . Университет Бата. Архивировано из оригинала 6 февраля 2007 года . Проверено 3 января 2007 г.
- ^ «Краткие факты о космическом шаттле Колумбия» . Си-Эн-Эн. 30 сентября 2013. Архивировано из оригинала 2 февраля 2016 года . Проверено 20 января 2016 г.
- ^ Фаулер, Б.; Эклз, КН; Порлье, Г. (1985). «Влияние наркоза инертным газом на поведение – критический обзор» . Подводный биомед. Рез . 12 (4): 369–402. ПМИД 4082343 . Архивировано из оригинала 25 декабря 2010 г. Проверено 21 сентября 2008 г.
{{cite journal}}: CS1 maint: неподходящий URL ( ссылка ) - ^ Роджерс, Вашингтон; Мёллер, Г. (1989). «Влияние кратких повторных гипербарических воздействий на восприимчивость к азотному наркозу» . Подводный биомед. Рез . 16 (3): 227–32. ОСЛК 2068005 . ПМИД 2741255 . Архивировано из оригинала 1 сентября 2009 г. Проверено 21 сентября 2008 г.
{{cite journal}}: CS1 maint: неподходящий URL ( ссылка ) - ^ Экотт, К. (1999). «Краткая история дайвинга и декомпрессионной болезни» . Журнал Общества подводной медицины Южно-Тихоокеанского региона . 29 (2). OCLC 16986801 . Архивировано из оригинала 5 сентября 2011 г. Проверено 21 сентября 2008 г.
{{cite journal}}: CS1 maint: неподходящий URL ( ссылка ) - ^ Киндволл, EP; Баз, А.; Лайтфут, Англия; Ланфье, Э.Г.; Сейрег, А. (1975). «Выведение азота у человека при декомпрессии» . Подводный биомед. Рез . 2 (4): 285–97. ОСЛК 2068005 . ПМИД 1226586 . Архивировано из оригинала 27 июля 2011 г. Проверено 21 сентября 2008 г.
{{cite journal}}: CS1 maint: неподходящий URL ( ссылка ) - ^ Руководство по водолазному делу ВМС США, 6-я редакция . США: Командование морских систем ВМС США. 2006. Архивировано из оригинала 2 мая 2008 г. Проверено 24 апреля 2008 г.
- ^ Уокер, Джерл. «Кипение и эффект Лейденфроста» (PDF) . Основы физики : 1–4. Архивировано (PDF) из оригинала 13 декабря 2019 года . Проверено 11 октября 2014 г.
- ^ «Коктейль с жидким азотом оставил подростка в больнице» . Новости Би-би-си. 08.10.2012. Архивировано из оригинала 12 апреля 2017 г.
- ^ Мэттокс, Брент С. «Отчет о расследовании химического взрыва цилиндра 301A» (PDF) . Техасский университет A&M. Архивировано из оригинала (перепечатка) 30 апреля 2014 г.
- ^ Британская ассоциация по сжатым газам (2000) Кодекс практики BCGA CP30. «Безопасное использование сосудов Дьюара с жидким азотом объемом до 50 литров» . ISSN 0260-4809 . Архивировано из оригинала 18 июля 2007 г. .
- ^ «Вход в замкнутое пространство: рабочий и потенциальный спасатель задохнулись» (PDF) . Анализ случая удушья на нефтеперерабатывающем заводе Valero. Архивировано из оригинала (PDF) 22 сентября 2015 г.
- ^ «Расследование после гибели человека в результате утечки химикатов» . Новости Би-би-си. 25 октября 1999 г. Архивировано из оригинала 7 января 2017 г.
- ^ Жидкий азот – Правила обращения с ним . Великобритания: Биркбек, Лондонский университет. 2007. Архивировано из оригинала 12 июня 2018 г. Проверено 8 февраля 2012 г.
- ^ Леви, Кристофер Г. «Безопасность жидкого азота» . Инженерная школа Тайера в Дартмуте. Архивировано из оригинала 05 марта 2016 г. Проверено 23 ноября 2016 г.
- ^ Национальные институты здравоохранения. Протокол использования и технического обслуживания устройств контроля кислорода. Февраль 2014 г., 1:35 UTC. Доступно по адресу: https://www.ors.od.nih.gov/sr/dohs/documents/protocoloxygenmonitoring.pdf . Архивировано 5 декабря 2020 г. в Wayback Machine . По состоянию на 23 июня 2020 г.
Библиография
- Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8 .
Внешние ссылки
- Этимология азота
- Азот в периодической таблице видео (Ноттингемский университет)
- Подкаст об азоте Королевского химического общества от Chemistry World


![{\displaystyle {\ce {NaNO3{}+Na2O->[{\ce {Ag~тигель}}][{\ce {300^{\circ }C~for~7days}}]Na3NO4}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ec729bc88f520e08fdce8a013dec8ae601d28509)
