Диазометан
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Диазометан | |
| Другие имена Азимиэтилен, Азометилен, | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ЧЭБИ | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.005.803 |
| Номер ЕС |
|
| КЕГГ | |
ПабХим CID | |
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| Ч 2 Н 2 | |
| Молярная масса | 42.04 g/mol |
| Появление | Желтый газ |
| Запах | затхлый |
| Плотность | 1,4 (воздух=1) |
| Температура плавления | -145 ° C (-229 ° F; 128 К) |
| Точка кипения | -23 ° C (-9 ° F; 250 К) |
| гидролиз [1] | |
| Конъюгатная кислота | Метилдиазоний |
| Структура | |
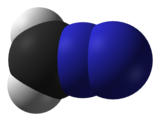
| линейный C=N=N | |
| Опасности | |
| Безопасность и гигиена труда (OHS/OSH): | |
Основные опасности | токсичный и взрывоопасный |
| СГС Маркировка : | |
  | |
| Опасность | |
| Н350 | |
| П201 , П202 , П281 , П308+П313 , П405 , П501 | |
| NFPA 704 (огненный алмаз) | |
| Летальная доза или концентрация (LD, LC): | |
ЛК 50 ( средняя концентрация ) | 175 частей на миллион (кошка, 10 мин) [3] |
| NIOSH (пределы воздействия на здоровье в США): | |
МЕХ (Допускается) | TWA 0,2 ppm (0,4 мг/м 3 ) [2] |
РЕЛ (рекомендуется) | TWA 0,2 ppm (0,4 мг/м 3 ) [2] |
IDLH (Непосредственная опасность) | 2 частей на миллион [2] |
| Родственные соединения | |
Родственные функциональные группы ; соединения | RN=N=N ( азид ), RN=NR (азо); R 2 CN 2 R = Ph, тмс, CF 3 |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
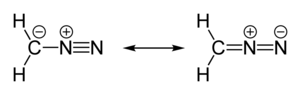
Диазометан — органическое химическое соединение с формулой CH 2 N 2 , открытое немецким химиком Гансом фон Пехманом в 1894 году. Это простейшее диазосоединение . В чистом виде при комнатной температуре это чрезвычайно чувствительный взрывоопасный желтый газ ; таким образом, он почти повсеместно используется в виде раствора в диэтиловом эфире . Это соединение является популярным метилирующим агентом в лабораторных условиях, но оно слишком опасно, чтобы его можно было использовать в промышленных масштабах без особых мер предосторожности. [4] Использование диазометана было значительно сокращено за счет внедрения более безопасного и эквивалентного реагента триметилсилилдиазометана . [5]
Использовать
[ редактировать ]В целях безопасности и удобства диазометан при необходимости всегда приготавливают в виде раствора в эфире и используют в таком виде. Он превращает карбоновые кислоты в метиловые эфиры, а фенолы в их метиловые эфиры . Считается, что реакция протекает через перенос протона от карбоновой кислоты к диазометану с образованием катиона метилдиазония , который реагирует с ионом карбоксилата с образованием метилового эфира и газообразного азота. Исследования по маркировке показывают, что первоначальный перенос протона происходит быстрее, чем этап переноса метила. [6] Поскольку для протекания реакции необходим перенос протона, эта реакция селективна в отношении более кислых карбоновых кислот (р Ка ~ 5) и фенолов (р Ка ~ 10) по сравнению с алифатическими спиртами (р Ка ~ 15). [7]

В более специализированных приложениях диазометан и другие диазоалкильные реагенты используются в реакции Арндта-Эйстерта и реакции Бюхнера-Куртиуса-Шлоттербека для омологации различных соединений. [8] [9]

Диазометан реагирует со спиртами или фенолами в присутствии трифторида бора (BF 3 ) с образованием метиловых эфиров .
Диазометан также часто используется в качестве источника карбена . Он легко участвует в 1,3-диполярном циклоприсоединении .
Подготовка
[ редактировать ]Лабораторный масштаб
[ редактировать ]
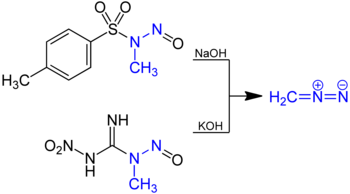
Разработано множество маршрутов лабораторного производства диазометана. [10] В общем, их синтез включает добавление метиламина к электронодефицитным соединениям перед обработкой нитритом и минеральной кислотой ( азотистой кислотой ) с образованием N -метилнитрозамида. Диазометан получают гидролизом эфирного раствора этих N -метилнитрозамидов водным основанием. Примеры включают в себя:
- N- нитрозо- N -метилмочевина (НМУ), [11] [12] об оригинальном предшественнике, о котором впервые сообщил Ганс фон Пехманн в 1894 году, и исторически он был одним из самых популярных вариантов. [13] [14] Его популярность постепенно пошла на убыль из-за его нестабильности при температуре выше 20 ° C и некоторой чувствительности к ударам .
- N- нитрозо-β-метиламиноизобутилметилкетон (Liquizald), еще один ранний предшественник, который используется и по сей день. [10] [15]
- N , N' - диметил- N , N' - динитрозотерефталамид (ДМДМТ) [16]
- N -метил- N' -нитро- N -нитрозогуанидин (МННГ), [17] [18] используется как биохимический инструмент и источник диазометана.
- N -метил- N -нитрозо- п -толуолсульфонамид (Диазальд), [19] один из самых популярных современных прекурсоров.
Диазометан реагирует с щелочными растворами D 2 O с образованием дейтерированного производного CD 2 N 2 . [20] Это можно использовать для исследований по мечению изотопов .
Промышленное использование
[ редактировать ]Легкость взрыва диазометана делает обращение с ним в больших количествах слишком опасным. Несмотря на это, его можно использовать в промышленных масштабах с использованием проточной химии по требованию . В этих процессах скорость производства соответствует скорости потребления, так что количество диазометана, присутствующего в любой момент времени, очень мало. [21] [4]
Анализ
[ редактировать ]Концентрацию CH 2 N 2 можно определить любым из двух удобных способов. Ее можно обработать избытком бензойной кислоты в холодном Et 2 O. Непрореагировавшую бензойную кислоту затем титруют стандартным раствором NaOH. Альтернативно, концентрацию CH 2 N 2 в Et 2 O можно определить спектрофотометрически при длине волны 410 нм, где его коэффициент экстинкции ε равен 7,2. [ нужна ссылка ] Концентрацию диазометана в газовой фазе можно определить с помощью фотоакустической спектроскопии . [4]
Родственные соединения
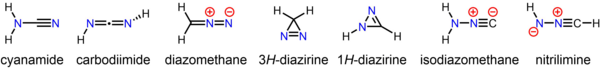
[ редактировать ]Диазометан является одновременно изомерным и изоэлектронным с более стабильным цианамидом , но они не превращаются друг в друга.Получено множество замещенных производных диазометана:
- Очень стабильный (CF 3 ) 2 CN 2 (2-диазо-1,1,1,3,3,3-гексафторпропан; температура кипения 12–13 °С), [22]
- Ph 2 CN 2 ( диазодифенилметан ; т.пл. 29–30°С). [23]
- (CH 3 ) 3 SiCHN 2 ( триметилсилилдиазометан ), который коммерчески доступен в виде раствора и столь же эффективен, как и CH 2 N 2, для метилирования. [24]
- PhC(H)N 2 , красная жидкость с температурой кипения < 25 °C и 0,1 мм рт. ст. [25]
Безопасность
[ редактировать ]Диазометан токсичен при вдыхании или контакте с кожей или глазами (ПДК 0,2 ppm). Симптомы включают дискомфорт в груди, головную боль, слабость и, в тяжелых случаях, коллапс. [26] Симптомы могут проявляться с задержкой. Сообщалось о смертельных случаях от отравления диазометаном. В одном случае работник лаборатории съел гамбургер возле дымохода, где вырабатывалось большое количество диазометана, и умер через четыре дня от молниеносной пневмонии. [27] Ожидается, что, как и любой другой алкилирующий агент, он будет канцерогенным, но подобные опасения затмеваются его серьезной острой токсичностью.
CH 2 N 2 может взорваться при контакте с острыми краями, например, стыками матового стекла, или даже царапинами на стеклянной посуде. [28] Стеклянную посуду следует проверять перед использованием, а подготовка должна проводиться за защитным экраном. Специализированные наборы для приготовления диазометана с пламенной полировкой соединений имеются в продаже.
Соединение взрывается при нагревании выше 100 °C, под воздействием интенсивного света, щелочных металлов или сульфата кальция. При использовании этого состава настоятельно рекомендуется использовать взрывозащитный экран.
Была проведена работа по проверке концепции с использованием микрофлюидики , в которой непрерывный синтез на месте использования из N -метил- N -нитрозомочевины и 0,93 М гидроксида калия в воде сопровождался конверсией на месте использования бензойной кислотой , в результате чего с выходом 65% метилбензоатного эфира в течение нескольких секунд при температуре от 0 до 50 °C. Выход был лучше, чем в капиллярных условиях; микрофлюидике приписывают «подавление горячих точек, низкую задержку, изотермические условия и интенсивное перемешивание». [29]
Изомеры
[ редактировать ]Стабильное соединение цианамид , минорным таутомером которого является карбодиимид , является изомером диазометана. Менее стабильные, но все же выделяемые изомеры диазометана включают циклический 3 H -диазирин и изоцианоамин ( изодиазометан ). [30] [31] Кроме того, исходный нитрилимин наблюдался в условиях матричной изоляции. [32]
Ссылки
[ редактировать ]- ^ ICSC 1256 - ДИАЗОМЕТАН
- ^ Jump up to: а б с Карманный справочник NIOSH по химическим опасностям. «#0182» . Национальный институт охраны труда и здоровья (NIOSH).
- ^ «Диазометан» . Непосредственно опасные для жизни и здоровья концентрации (IDLH) . Национальный институт охраны труда и здоровья (NIOSH).
- ^ Jump up to: а б с Проктор, Ли Д.; Уорр, Энтони Дж. (ноябрь 2002 г.). «Разработка непрерывного процесса промышленного производства диазометана». Исследования и разработки органических процессов . 6 (6): 884–892. дои : 10.1021/op020049k .
- ^ Сиоири, Такаюки; Аояма, Тоёхико; Сноуден, Тимоти (2001). «Триметилсилилдиазометан». Энциклопедия реагентов для органического синтеза . Электронная энциклопедия реагентов для органического синтеза EROS . дои : 10.1002/047084289X.rt298.pub2 . ISBN 0471936235 .
- ^ ван дер Мерве, К.Дж.; Стейн, PS; Эггерс, С.Х. (январь 1964 г.). «Простое приготовление меченных дейтерием О-метильных групп для масс-спектрометрии» . Буквы тетраэдра . 5 (52): 3923–3925. дои : 10.1016/S0040-4039(01)89341-2 .
- ^ Клейден, Джонатан. (2012). Органическая химия . Гривз, Ник., Уоррен, Стюарт Г. (2-е изд.). Оксфорд: Издательство Оксфордского университета. ISBN 978-0-19-927029-3 . OCLC 761379371 .
- ^ Бюхнер, Э.; Курций, Т. (1885). «Синтез эфиров кетоновых кислот из альдегидов и эфиров диазоуксусной кислоты» . Отчеты Немецкого химического общества . 18 (2): 2371–2377. дои : 10.1002/cber.188501802118 .
- ^ Шлоттербек, Ф. (1907). «Превращение альдегидов и кетонов через диазометан» . Отчеты Немецкого химического общества . 40 : 479–483. дои : 10.1002/cber.19070400179 .
- ^ Jump up to: а б Хорват-Гербер, Филип; Олиг, Доминик; Привет, король Куок Мими; Дедман, Бенджамин; Аттрилл, Робин П.; Хеллгардт, Клаус (16 февраля 2024 г.). «Жидкий — термически стабильный предшественник N-нитрозамина для диазометана» . Исследования и разработки органических процессов . 28 (2): 597–608. дои : 10.1021/acs.oprd.3c00456 .
- ^ «НИТРОСОМЕТИЛМОЧИНА». Органические синтезы . 15 : 48. 1935. doi : 10.15227/orgsyn.015.0048 .
- ^ «ДИАЗОМЕТАН». Органические синтезы . 15 :3. 1935. doi : 10.15227/orgsyn.015.0003 .
- ^ Пехманн, Х.В. (май 1894 г.). «О диазометане». Отчеты Немецкого химического общества . 27 (2): 1888–1891. дои : 10.1002/cber.189402702141 .
- ^ в. Пехманн, Х. (январь 1895 г.). «О диазометане». Отчеты Немецкого химического общества . 28 (1): 855–861. дои : 10.1002/cber.189502801189 .
- ^ «ДИАЗОМЕТАН». Органические синтезы . 25:28 . 1945. doi : 10.15227/orgsyn.025.0028 .
- ^ «ДИАЗОМЕТАН». Органические синтезы . 41 : 16. 1961. doi : 10.15227/orgsyn.041.0016 .
- ^ «Синтез и материальное познание» . сайт органический-btc-ilmenaus! (на немецком языке) . Проверено 2 ноября 2020 г.
- ^ Рид, Дональд Э.; Джеймс А. Мур (1961). «ДИАЗОМЕТАН». Органические синтезы . 41 : 16. дои : 10.15227/orgsyn.041.0016 .
- ^ «п-ТОЛИЛСУЛЬФОНИЛМЕТИЛНИТРОЗАМИД». Органические синтезы . 34 : 96. 1954. doi : 10.15227/orgsyn.034.0096 .
- ^ П.Г. Гассман и У.Дж. Гринли (1988). «Дидейтродиазометан» . Органические синтезы ; Сборник томов , т. 6, с. 432 .
- ^ Ян, Хунвэй; Мартин, Бенджамин; Шенкель, Бертольд (20 апреля 2018 г.). «Производство и потребление диазометана по требованию в многоступенчатых системах непрерывного действия». Исследования и разработки органических процессов . 22 (4): 446–456. дои : 10.1021/acs.oprd.7b00302 .
- ^ Миддлтон, штат Вашингтон; Гейл, DM (1970). «Бис(трифторметил)диазометан». Органические синтезы . 50 :6. дои : 10.15227/orgsyn.050.0006 .
- ^ Л.И. Смит; К.Л. Ховард (1955). «Дифенилдиазометан» » . Органический синтез ; Сборник томов , т. 3, с. 351 .
- ^ Т. Сиойри; Т. Аояма; С. Мори. «Триметилсилилдиазометан» . Органические синтезы ; Сборник томов , т. 8, с. 612 .
- ^ X. Крири (1990). «Пиролиз тозилгидразоновых солей: фенидиазометаны» . Органические синтезы ; Сборник томов , т. 7, с. 438 .
- ^ Мьюир, Г.Д. (ред.) 1971, Опасности в химической лаборатории , Королевский институт химии, Лондон.
- ^ ЛеВинн, Э.Б. «Отравление диазометаном: отчет о смертельном случае при вскрытии», Американский журнал медицинских наук , 1949, 218, 556-562.
- ^ де Бур, Т. Дж.; Бэкер, HJ (1956). «ДИАЗОМЕТАН». Органические синтезы . 36 : 16. дои : 10.15227/orgsyn.036.0016 .
- ^ Владимир Решетиловский (13 сентября 2013 г.). Микрореакторы в препаративной химии: практические аспекты биопереработки, нанотехнологии, катализа и т. д . Уайли. п. 6–15. ISBN 9783527652914 .
- ^ Ансельм, Ж.-П. (1 мая 1977 г.). «Возврат к изодиазометану. N-аминоизонитрилы». Журнал химического образования . 54 (5): 296. Бибкод : 1977ЖЧЭд..54..296А . дои : 10.1021/ed054p296 . ISSN 0021-9584 .
- ^ Ансельм, JP (1 ноября 1966 г.). «Химия изодиазометана». Журнал химического образования . 43 (11): 596. Бибкод : 1966ЖЧЭд..43..596А . дои : 10.1021/ed043p596 . ISSN 0021-9584 .
- ^ Комплексные преобразования органических функциональных групп II . Катрицки, Алан Р., Тейлор, Ричард Дж. К. (1-е изд.). Амстердам: Эльзевир. 2005. ISBN 9780080523477 . OCLC 213375246 .
{{cite book}}: CS1 maint: другие ( ссылка )
Внешние ссылки
[ редактировать ]- Паспорт безопасности диазометана
- CDC - Карманный справочник NIOSH по химическим опасностям
- Технический бюллетень Sigmaaldrich (PDF)
- Применение диазометана Sigma-Aldrich и коммерческая доступность прекурсора (Диазальд)
- Идентификация артефактов (побочных продуктов) реакций диазометана и триметилсилилдиазометана