Алкоголь (химия)

В химии спирт — это тип органического соединения , которое содержит по крайней мере один гидроксил ( −OH ) функциональная группа, связанная с углеродом. [2] [3] Спирты варьируются от простых, таких как метанол и этанол , до сложных, таких как сахара и холестерин . Наличие группы ОН сильно изменяет свойства углеводородов, придавая им гидрофильные (водолюбивые) свойства. Группа ОН обеспечивает место, в котором могут происходить многие реакции.
История [ править ]
Огнеопасность испарений вина уже была известна древним натурфилософам, таким как Аристотель (384–322 до н.э.), Теофраст ( ок. 371–287 до н.э.) и Плиний Старший (23/24–79 н.э.). [4] Однако это не сразу привело к выделению алкоголя, даже несмотря на развитие более совершенных методов дистилляции в Римском Египте второго и третьего веков . [5] Важным признанием, впервые обнаруженным в одном из сочинений, приписываемых Джабиру ибн Хайяну (девятый век нашей эры), было то, что добавление соли вина в кипящее вино, что увеличивает относительную летучесть , может повысить воспламеняемость образующихся паров. [6] Дистилляция вина засвидетельствована в арабских работах, приписываемых аль-Кинди ( ок. 801–873 гг. н.э.) и аль-Фараби ( ок. 872–950 ), а также в 28-й книге аз-Захрави (лат. Абулкасис). , 936–1013) Китаб ат-Тасриф (позже переведенный на латынь как Liber servatoris ). [7] В двенадцатом веке рецепты приготовления aqua ardens («горящей воды», т. е. спирта) путем перегонки вина с солью стали появляться в ряде латинских сочинений, а к концу тринадцатого века он стал широко известное вещество среди западноевропейских химиков. [8]
В работах Таддео Альдеротти (1223–1296) описан метод концентрирования спирта, включающий повторную фракционную перегонку через перегонный куб с водяным охлаждением, с помощью которого можно было получить спирт чистотой 90%. [9] Лекарственные свойства этанола изучали Арнальд Вилланова (1240–1311 гг. н.э.) и Иоанн Рупескисса ( ок. 1310–1366 ), последний из которых считал его жизнесохраняющим веществом, способным предотвратить все болезни ( вода жизни). или «вода жизни», также названная Иоанном квинтэссенцией вина). [10]
Номенклатура [ править ]
Этимология [ править ]
Слово «алкоголь» происходит от арабского kohl ( араб . الكحل , латинизировано : al-kuḥl ), порошка, используемого в качестве подводки для глаз. [11] Первая часть слова ( al- ) — это арабский определенный артикль , эквивалентный the в английском языке. Вторая часть слова ( kuḥl ) имеет несколько предшественников в семитских языках , в конечном итоге происходящих от аккадского 𒎎𒋆𒁉𒍣𒁕 ( guḫlum ), что означает антимонит или сурьма . [12]
Как и его предшественники в арабском и более древних языках, термин «спирт» первоначально использовался для обозначения очень мелкого порошка, полученного путем сублимации природного минерала антимонита с образованием трисульфида сурьмы. Сб 2 С 3 . Считалось, что это сущность или «дух» этого минерала. Его использовали в качестве антисептика , подводки для глаз и косметического средства . Позже значение алкоголя было распространено на дистиллированные вещества в целом, а затем снова сузилось до этанола, когда «спиртные напитки» стали синонимом крепких спиртных напитков . [13]
Парацельс и Либавиус использовали термин «спирт» для обозначения мелкого порошка, причем последний говорил о спирте, полученном из сурьмы. В то же время Парацельс использует это слово для обозначения летучей жидкости; слово alcool или alcool vini . В его произведениях часто встречается [14]
Варфоломей Трахерон в своем переводе «Иоанна Виго » в 1543 году вводит это слово как термин, используемый «варварскими» авторами для обозначения «тонкого порошка». Виго писал: «Варварские художники используют алкоголь или (как я иногда нахожу) алкоголь для получения самого изысканного пудра». [15]
Уильяма Джонсона 1657 года В «Lexicon Chymicum» это слово толкуется как «сурьма с сурьмой». [16] В более широком смысле это слово стало обозначать любую жидкость, полученную путем дистилляции, включая «винный спирт», дистиллированную сущность вина. Либавий в «Алхимии» (1594 г.) упоминает « «Спирт вина или подщелачиваемое вино ». Джонсон (1657) определяет спирт вина как «алкоголь вина». когда все излишки вина отделяются от вина, так что оно горит до тех пор, пока все не выгорит, и на дне отбросов или слизи ничего не остается ». сегодня как этанол ) в 18 веке и был распространен на класс веществ, так называемых «спиртов» в современной химии после 1850 года. [15]
Термин «этанол» был изобретен в 1892 году путем смешения « этана » с окончанием «-ол» слова «спирт», которое было обобщено как libfix . [17]
Термин «алкоголь» первоначально относился к первичному спирту этанолу (этиловому спирту), который используется в качестве наркотика и является основным спиртом, присутствующим в алкогольных напитках .
Суффикс -ол появляется в Международного союза теоретической и прикладной химии (IUPAC) химическом названии всех веществ, в которых гидроксильная группа является функциональной группой с наивысшим приоритетом. Когда в соединении присутствует группа с более высоким приоритетом, префикс гидрокси- в его названии IUPAC используется . Суффикс -ол в названиях, не входящих в IUPAC (например, парацетамол или холестерин ), также обычно указывает на то, что вещество представляет собой спирт. Однако некоторые соединения, содержащие гидроксильные функциональные группы, имеют тривиальные названия , не включающие суффикс -ол или префикс гидрокси- , например сахара глюкоза и сахароза .
Систематические названия [ править ]
Номенклатура ИЮПАК используется в научных публикациях и в трудах, где важна точная идентификация вещества. При названии простых спиртов в названии алкановой цепи теряется концевая е и добавляется суффикс -ол , например , как в слове «этанол» от названия алкановой цепи « этан ». [18] При необходимости положение гидроксильной группы указывается числом между названием алкана и -ол : пропан-1-ол для CH 3 CH 2 CH 2 OH , пропан-2-ол для СН 3 СН(ОН)СН 3 . Если присутствует группа с более высоким приоритетом (например, альдегид , кетон или карбоновая кислота префикс гидрокси- , ), то используется [18] например, как в 1-гидрокси-2-пропаноне ( СН3С ) (О ) СН2ОН . [19] Соединения, имеющие более одной гидроксильной группы, называются полиолами . Их называют с использованием суффиксов -диол, -триол и т. д., следуя списку номеров положений гидроксильных групп, как в пропан-1,2-диоле для CH 3 CH(OH)CH 2 OH (пропиленгликоль).
| Структурная формула | Скелетная формула | Предпочтительное название ИЮПАК | Другие систематические названия | Общие имена | Степень |
|---|---|---|---|---|---|
| СН 3 -СН 2 -СН 2 -ОН | пропан-1-ол | 1-пропанол; н- пропиловый спирт | пропанол | начальный | |
 |  | пропан-2-ол | 2-пропанол | изопропиловый спирт; изопропанол | вторичный |
 |  | циклогексанол | вторичный | ||
 | 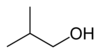 | 2-метилпропан-1-ол | 2-метил-1-пропанол | изобутиловый спирт; изобутанол | начальный |
 | трет- амиловый спирт | 2-метилбутан-2-ол; 2-метил-2-бутанол | СЕГОДНЯ | высшее |
В тех случаях, когда гидроксильная группа связана с sp. 2 углерода в ароматическом кольце , молекула классифицируется отдельно как фенол и получает название с использованием правил ИЮПАК для обозначения фенолов. [20] Фенолы обладают особыми свойствами и не относятся к спиртам.
Общие имена [ править ]
В других, менее формальных контекстах, спирт часто называют по названию соответствующей алкильной группы, за которым следует слово «спирт», например, метиловый спирт, этиловый спирт. Пропиловым спиртом может быть н- пропиловый спирт или изопропиловый спирт , в зависимости от того, связана ли гидроксильная группа с концевым или средним углеродом прямой пропановой цепи. Как описано в разделе «Систематическое наименование», если приоритет имеет другая группа в молекуле, спиртовую часть часто обозначают с помощью префикса «гидрокси-». [21]
В архаичной номенклатуре спирты можно назвать производными метанола с окончанием «-карбинол». Например, (CH 3 ) 3 COH можно назвать триметилкарбинолом .
Первичный, вторичный и третичный [ править ]
Затем спирты подразделяются на первичные, вторичные ( втор- , s- ) и третичные ( трет- , t- ) в зависимости от количества атомов углерода, связанных с атомом углерода, который несет гидроксильную функциональную группу . Соответствующие числовые сокращения 1°, 2° и 3° иногда используются в неформальной обстановке. [22] Первичные спирты имеют общие формулы РЧ 2 ОН . Простейший первичный спирт — метанол ( CH 3 OH ), для которого R = H, а следующим идет этанол, для которого R = CH 3 , метильная группа . Вторичные спирты — это спирты формы RR'CHOH, простейшим из которых является 2-пропанол ( R = R' = CH 3 ). Для третичных спиртов общая форма — RR'R"COH. Простейшим примером является трет -бутанол (2-метилпропан-2-ол), для которого каждый из R, R' и R" представляет собой Ч 3 . В этих сокращениях R, R' и R" представляют собой заместители , алкил или другие присоединенные, обычно органические группы.
Примеры [ править ]
| Тип | Формула | ИЮПАК Название | Общее имя |
|---|---|---|---|
| одноатомный спирты | СН 3 ОН | Метанол | Древесный спирт |
| С 2 Н 5 ОН | Этанол | Алкоголь | |
| C3H7C3H7OH | Пропан-2-ол | изопропиловый спирт, Медицинский спирт | |
| C4H9C4H9OH | Бутан-1-ол | Бутанол, Бутиловый спирт | |
| С 5 Н 11 ОН | Пентан-1-ол | Пентанол, Амиловый спирт | |
| C16H33C16H33OH | Гексадекан-1-ол | Цетиловый спирт | |
| Многоатомный спирты (сахар спирты) | С 2 Н 4 (ОН) 2 | Этан-1,2-диол | Этиленгликоль |
| С 3 Н 6 (ОН) 2 | Пропан-1,2-диол | Пропиленгликоль | |
| С 3 Н 5 (ОН) 3 | Пропан-1,2,3-триол | Глицерин | |
| С 4 Н 6 (ОН) 4 | Бутан-1,2,3,4-тетраол | Эритрит , Треитол | |
| С 5 Н 7 (ОН) 5 | Пентан-1,2,3,4,5-пентол | Ксилит | |
| C6H8 ( ) ОН 6 | гексан-1,2,3,4,5,6-гексол | Маннитол , Сорбитол | |
| С 7 Н 9 (ОН) 7 | Гептан-1,2,3,4,5,6,7-гептол | Волемитол | |
| Ненасыщенный алифатические спирты | C3H5C3H5OH | Проп-2-ен-1-ол | Аллиловый спирт |
| С 10 Н 17 ОН | 3,7-Диметилокта-2,6-диен-1-ол | Гераниол | |
| C3H3C3H3OH | 2-в-1 опора | Пропаргиловый спирт | |
| Алициклические спирты | С 6 Н 6 (ОН) 6 | Циклогексан-1,2,3,4,5,6-гексол | Инозитол |
| С 10 Н 19 ОН | 5-Метил-2-(пропан-2-ил)циклогексан-1-ол | Ментол |
Приложения [ править ]

Спирты имеют долгую историю бесчисленного применения. Среди простых моноспиртов, которым посвящена данная статья, наиболее важными являются следующие технические спирты: [24]
- метанол, в основном для производства формальдегида и в качестве добавки к топливу.
- этанол, в основном для алкогольных напитков, топливная добавка, растворитель
- 1-пропанол, 1-бутанол и изобутиловый спирт для использования в качестве растворителя и предшественника растворителей.
- Спирты C6–C11, используемые в качестве пластификаторов , например, в поливинилхлориде.
- жирные спирты (C12–C18), предшественники моющих средств
Метанол является наиболее распространенным техническим спиртом: в 1980 году производилось около 12 миллионов тонн в год. Совокупная мощность остальных спиртов примерно одинакова и распределена примерно поровну. [24]
Токсичность [ править ]
Что касается острой токсичности, простые спирты обладают низкой острой токсичностью . Дозы в несколько миллилитров переносятся. Для пентанолов , гексанолов , октанолов и длинных спиртов LD50 варьируется в пределах 2–5 г/кг (крысы, перорально). Этанол менее токсичен. [25] Все спирты вызывают легкие раздражения кожи. [24]
Метанол и этиленгликоль более токсичны, чем другие простые спирты. На их метаболизм влияет присутствие этанола, который имеет более высокое сродство к алкогольдегидрогеназе печени . Таким образом, метанол будет выводиться с мочой в неизмененном виде. [26] [27] [28]
Физические свойства [ править ]
В общем, гидроксильная группа делает спирты полярными . Эти группы могут образовывать водородные связи друг с другом и с большинством других соединений. Благодаря наличию полярных ОН спирты более растворимы в воде, чем простые углеводороды. Метанол, этанол и пропанол смешиваются с водой. 1-Бутанол с четырехуглеродной цепью умеренно растворим.
Из-за водородных связей спирты имеют тенденцию иметь более высокие температуры кипения, чем сопоставимые углеводороды и простые эфиры . Температура кипения спирта этанола составляет 78,29 °C по сравнению с 69 °C для углеводородного гексана и 34,6 °C для диэтилового эфира .
Встречаемость в природе [ править ]
Спирты широко встречаются в природе в виде производных глюкозы, таких как целлюлоза и гемицеллюлоза , а также в виде фенолов и их производных, таких как лигнин . [29] Из биомассы в промышленных масштабах производится 180 миллиардов тонн сложных углеводов (полимеров сахаров) в год (по состоянию на 2014 год). [30] Многие другие спирты широко распространены в организмах, что проявляется в других сахарах, таких как фруктоза и сахароза , в полиолах, таких как глицерин , и в некоторых аминокислотах , таких как серин . Простые спирты, такие как метанол, этанол и пропанол, встречаются в природе в небольших количествах и промышленно синтезируются в больших количествах для использования в качестве химических предшественников, топлива и растворителей.
Производство [ править ]
Гидроксилирование [ править ]
Многие спирты производятся путем гидроксилирования , т. е. установки гидроксильной группы с использованием кислорода или родственного окислителя. Гидроксилирование — это способ, с помощью которого организм перерабатывает многие яды , превращая липофильные соединения в гидрофильные производные, которые легче выводятся из организма. Ферменты, называемые гидроксилазами и оксидазами, облегчают эти преобразования.
Многие технические спирты, например циклогексанол для производства нейлона , получают путем гидроксилирования.
Циглера и процессы - оксо
В процессе Циглера линейные спирты получают из этилена и триэтилалюминия с последующим окислением и гидролизом. [24] идеализированный синтез 1-октанола Показан :
В результате этого процесса образуется ряд спиртов, которые отделяются перегонкой .
Многие высшие спирты получают гидроформилированием алкенов с последующим гидрированием. При применении к терминальному алкену , как это обычно бывает, обычно получают линейный спирт: [24]
Такие процессы дают жирные спирты , которые используются в качестве моющих средств.
Реакции гидратации [ править ]
Некоторые низкомолекулярные спирты промышленного значения получают добавлением воды к алкенам. этанол, изопропанол, 2-бутанол и трет Этим общим методом получают -бутанол. Используются две реализации: прямой и косвенный методы. Прямой метод позволяет избежать образования стабильных промежуточных продуктов, обычно с использованием кислотных катализаторов. При непрямом методе алкен преобразуется в сульфатный эфир , который впоследствии гидролизуется. При прямой гидратации используется этилен ( гидратация этилена ). [31] или другие алкены от крекинга фракций перегнанной сырой нефти .
Гидратация также используется в промышленности для получения диол -этиленгликоля из оксида этилена .
Ферментация [ править ]
Этанол получают путем ферментации глюкозы ( которую часто получают из крахмала ) в присутствии дрожжей. Углекислый газ когенерируется. Как и этанол, бутанол можно производить процессами ферментации. Saccharomyces Известно, что дрожжи производят эти высшие спирты при температуре выше 75 ° F (24 ° C). Бактерия Clostridium acetobutylicum может питаться целлюлозой (также спиртом) для производства бутанола в промышленных масштабах. [32]
Замена [ править ]
Первичные алкилгалогениды реагируют с водным раствором NaOH или КОН с образованием спиртов нуклеофильного алифатического замещения . Вместо этого вторичные и особенно третичные алкилгалогениды дают продукт отщепления (алкен). Реагенты Гриньяра реагируют с карбонильными группами с образованием вторичных и третичных спиртов. Родственными реакциями являются реакция Барбье и реакция Нодзаки-Хиямы .
Сокращение [ править ]
Альдегиды или кетоны восстанавливают ( после боргидридом натрия или алюмогидридом лития кислотной обработки). Еще одним восстановлением с использованием изопропоксида алюминия является восстановление Меервейна-Понндорфа-Верли . Асимметричное гидрирование Нойори представляет собой асимметричное восстановление β-кетоэфиров.
Гидролиз [ править ]
Алкены вступают в реакцию гидратации, катализируемую кислотой , с использованием концентрированной серной кислоты в качестве катализатора, которая обычно дает вторичные или третичные спирты. образование вторичного спирта путем восстановления и гидратации алкена Показано :
В органическом синтезе более надежны процессы гидроборирования-окисления и оксимеркурации-восстановления алкенов. Алкены реагируют с N -бромсукцинимидом и водой в реакции образования галогенгидрина . Амины можно превратить в соли диазония , которые затем гидролизуются.
Реакция [ править ]
Депротонирование [ править ]
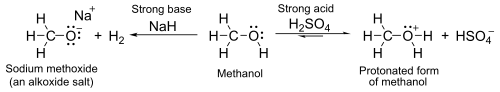
При значениях водного p K a около 16–19 спирты, как правило, являются несколько более слабыми кислотами, чем вода . С сильными основаниями, такими как гидрид натрия или натрий, они образуют соли. [а] называемые алкоксидами , с общей формулой РО − М + (где R представляет собой алкил , а M представляет собой металл ).
На кислотность спиртов сильно влияет сольватация . В газовой фазе спирты более кислые, чем в воде. [33] В ДМСО спирты (и вода) имеют ap K a около 29–32. Как следствие, алкоксиды (и гидроксиды) являются мощными основаниями и нуклеофилами (например, для синтеза эфира Вильямсона ) в этом растворителе. В частности, РО − или К − в ДМСО можно использовать для получения значительных равновесных концентраций ионов ацетилида путем депротонирования алкинов (см. Реакцию Фаворского ). [34] [35]
Нуклеофильное замещение [ править ]
Третичные спирты реагируют с соляной кислотой с образованием третичного алкилхлорида . Первичные и вторичные спирты переводят в соответствующие хлориды с помощью тионилхлорида и различных хлоридов фосфора. [36] 
Первичные и вторичные спирты аналогичным образом превращаются в алкилбромиды с помощью трибромида фосфора , например:
При дезоксигенации Бартона-МакКомби спирт дезоксигенируется до алкана с помощью гидрида трибутилолова или комплекса триметилборан -вода в реакции радикального замещения .
Обезвоживание [ править ]
Между тем, атом кислорода имеет неподеленные пары несвязанных электронов, которые делают его слабоосновным в присутствии сильных кислот, таких как серная кислота . Например, с метанолом:
При обработке сильными кислотами спирты подвергаются реакции элиминирования Е1 с образованием алкенов . Реакция в целом подчиняется правилу Зайцева , которое гласит, что образуется наиболее стабильный (обычно наиболее замещенный) алкен. Третичные спирты легко удаляются при температуре чуть выше комнатной, но первичные спирты требуют более высокой температуры.
Это схема кислотно-катализируемой дегидратации этанола с получением этилена :
Более контролируемая реакция элиминирования требует образования сложного эфира ксантогената .
Протонолиз [ править ]
Третичные спирты реагируют с сильными кислотами с образованием карбокатионов. Реакция связана с их дегидратацией, например, изобутилена из трет -бутилового спирта. Особый вид реакции дегидратации включает трифенилметанол и особенно его аминозамещенные производные. При обработке кислотой эти спирты теряют воду, образуя стабильные карбокатионы, являющиеся коммерческими красителями. [37]

Этерификация [ править ]
Спирт и карбоновые кислоты реагируют в ходе так называемой этерификации Фишера . Для реакции обычно требуется катализатор , например концентрированная серная кислота:
Другие типы сложных эфиров получают аналогичным способом, например, тозиловые (тозилатные) эфиры получают реакцией спирта с 4-толуолсульфонилхлоридом в пиридине .
Окисление [ править ]
Первичные спирты ( R-CH 2 OH ) может окисляться либо до альдегидов ( R-CHO ) или карбоновым кислотам ( R-CO 2 H ). Окисление вторичных спиртов ( Р 1 Р 2 CH-OH ) обычно оканчивается на кетоне ( Р 1 Р 2 C=O ) стадия. Третичные спирты ( Р 1 Р 2 Р 3 C-OH ) устойчивы к окислению.
Прямое окисление первичных спиртов до карбоновых кислот обычно протекает через соответствующий альдегид, который превращается через гидрат альдегида ( R-CH(OH) 2 ) по реакции с водой перед дальнейшим окислением до карбоновой кислоты.

Реагенты, полезные для превращения первичных спиртов в альдегиды, обычно также подходят для окисления вторичных спиртов в кетоны. К ним относятся реактив Коллинза и периодинан Десс-Мартина . Прямое окисление первичных спиртов до карбоновых кислот можно провести с помощью перманганата калия или реактива Джонса .
См. также [ править ]
Примечания [ править ]
- ^ Хотя алкоксиды щелочных металлов обычно называют «солями», на самом деле их лучше структурно описывать как олигомерные кластеры или полимерные цепи. Например, трет -бутоксид калия состоит из кубаноподобного тетрамера, [ t -BuOK] 4 , который сохраняется даже в полярных растворителях, таких как ТГФ.
Цитаты [ править ]
- ^ «спирты» . Золотая книга ИЮПАК . 2014. doi : 10.1351/goldbook.A00204 . Проверено 16 декабря 2013 г.
- ^ ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Интернет-исправленная версия: (2006–) « Спирты ». два : 10.1351/goldbook.A00204
- ^ Сол Патай, изд. (1971). Гидроксильная группа . Химия функциональных групп ПАТАИ. дои : 10.1002/9780470771259 . ISBN 978-0-470-77125-9 .
- ^ Бертло М. , Худас О.В. (1893). Химия в средние века . Полет. I–III. Париж: Национальная империя. полет. я, с. 137.
- ^ Бертло и Удас 1893 , том. я, стр. 138–139.
- ^ аль-Хасан А.Ю. (2009). «Алкоголь и перегонка вина в арабских источниках VIII века». Исследования аль-Кимья: критические проблемы латинской и арабской алхимии и химии . Хильдесхайм: Георг Олмс Верлаг. стр. 283–298. (тот же контент доступен и на сайте автора ).
- ^ аль-Хассан, 2009 г. (тот же контент также доступен на сайте автора ); ср. Бертло и Гудас 1893 , т. 1, с. I, стр. 141, 143. Иногда в вино добавляли также серу (см. Berthelot & Houdas 1893 , т. I, стр. 143).
- ^ Мультхауф Р.П. (1966). Истоки химии . Лондон: Олдборн. ISBN 978-2-88124-594-7 . стр. 204–206.
- ^ Холмьярд Э.Дж. (1957). Алхимия . Хармондсворт: Книги Пингвинов. ISBN 978-0-486-26298-7 . стр. 51–52.
- ^ Принсипи ЛМ (2013). Тайны алхимии . Чикаго: Издательство Чикагского университета. ISBN 978-0-226-10379-2 . стр. 69–71.
- ^ Харпер Д. «Алкоголь» . Этимонлин . МаонинТех . Проверено 17 мая 2018 г.
- ^ Циммерн, Генрих (1915) Аккадские иностранные слова как свидетельство вавилонского культурного влияния (на немецком языке), Лейпциг: А. Эдельманн, стр. 61
- ^ Лонингер Х. (21 декабря 2004 г.). «Этимология слова «алкоголь» » . Энциклопедия ВИАС . Проверено 17 мая 2018 г.
- ^ Чисхолм Х , изд. (1911). . Британская энциклопедия . Том. 1 (11-е изд.). Издательство Кембриджского университета. п. 525.
- ^ Jump up to: Перейти обратно: а б «алкоголь, сущ.». ОЭД онлайн . Издательство Оксфордского университета . 15 ноября 2016 г.
- ^ Джонсон В. (1652 г.). Лексикон Химикум .
- ^ Армстронг HE (8 июля 1892 г.). «Вклад в международную систему номенклатуры. Номенклатура циклоидов» . Учеб. хим. Соц. 8 (114): 128. дои : 10.1039/PL8920800127 .
Поскольку ol указывает на производное OH, кажется, нет причин, по которым простое слово «кислота» не должно означать карбоксил и почему al не должно означать COH; названия этанол-этанол и этановая кислота или просто этановая кислота тогда будут обозначать производные этана OH, COH и COOH.
- ^ Jump up to: Перейти обратно: а б Уильям Ройш. «Алкоголи» . Виртуальный текст органической химии . Архивировано из оригинала 19 сентября 2007 года . Проверено 14 сентября 2007 г.
- ^ Органическая химия Номенклатура ИЮПАК. Алкоголи Правило C-201 .
- ^ Правило номенклатуры органической химии C-203: Фенолы
- ^ «Как назвать органические соединения по правилам ИЮПАК» . www.chem.uiuc.edu . КАФЕДРА ХИМИИ УНИВЕРСИТЕТА ИЛЛИНОЙСА . Проверено 14 ноября 2016 г.
- ^ Ройш В. (2 октября 2013 г.). «Номенклатура спиртов» . chemwiki.ucdavis.edu/ . Проверено 17 марта 2015 г.
- ^ «Отчет о глобальном состоянии алкоголя в 2004 г.» (PDF) . Архивировано (PDF) из оригинала 9 октября 2022 года . Проверено 28 ноября 2010 г.
- ^ Jump up to: Перейти обратно: а б с д и Фальбе Дж., Бахрманн Х., Липпс В., Майер Д. «Алифатические спирты». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a01_279 . ISBN 978-3527306732 . .
- ^ Токсичность этанола
- ^ Шеп Л.Дж., Слотер Р.Дж., Вейл Дж.А., Бисли Д.М. (30 сентября 2009 г.). «Моряк со слепотой и растерянностью» . БМЖ . 339 : b3929. дои : 10.1136/bmj.b3929 . ПМИД 19793790 . S2CID 6367081 .
- ^ Циммерман Х.Э., Буркхарт К.К., Донован Дж.В. (1999). «Отравление этиленгликолем и метанолом: диагностика и лечение». Журнал неотложной медицинской помощи . 25 (2): 116–20. дои : 10.1016/S0099-1767(99)70156-X . ПМИД 10097201 .
- ^ Лоберт С. (2000). «Отравление этанолом, изопропанолом, метанолом и этиленгликолем». Медсестра интенсивной терапии . 20 (6): 41–7. дои : 10.4037/ccn2000.20.6.41 . ПМИД 11878258 .
- ^ Нимц Х.Х., Шмитт У., Шваб Э., Виттманн О., Вольф Ф. (2000). "Древесина". Энциклопедия промышленной химии Ульмана . дои : 10.1002/14356007.a28_305 . ISBN 978-3-527-30385-4 .
- ^ Лихтенталер ФВ (2010). «Углеводы как органическое сырье». Энциклопедия промышленной химии Ульмана . дои : 10.1002/14356007.n05_n07 . ISBN 978-3-527-30673-2 .
- ^ Лоджсдон Дж. Э. (1994). «Этанол». В Крошвице JI (ред.). Энциклопедия химической технологии . Том. 9 (4-е изд.). Нью-Йорк: Джон Уайли и сыновья. п. 820. ИСБН 978-0-471-52677-3 .
- ^ Зверлов В., Березина О., Великодворская Г.А., Шварц В.Х. (август 2006 г.). «Производство бактериального ацетона и бутанола методом промышленной ферментации в Советском Союзе: использование гидролизованных сельскохозяйственных отходов для биопереработки». Прикладная микробиология и биотехнология . 71 (5): 587–97. дои : 10.1007/s00253-006-0445-z . ПМИД 16685494 . S2CID 24074264 .
- ^ Смит, Майкл Б., Марч, Джерри (2007). Продвинутая органическая химия: реакции, механизмы и структура (6-е изд.). Нью-Йорк: Wiley-Interscience. ISBN 978-0-471-72091-1 .
- ^ Ахмед Дж., Суэйн А.К., Дас А., Говиндараджан Р., Бхуния М., Мандал С.К. (14 ноября 2019 г.). «K-арилацетилидный комплекс для каталитической функционализации концевых алкинов с использованием KOtBu в качестве предкатализатора» . Химические коммуникации . 55 (92): 13860–13863. дои : 10.1039/C9CC07833A . ISSN 1364-548X . ПМИД 31670328 . S2CID 204974842 .
- ^ WO1994012457A1 , Баблер, Джеймс Х., «Способ получения третичных алкинолов», выпущено 9 июня 1994 г.
- ^ Браун Г.В. (1971). «Замещение гидроксильных групп». Гидроксильная группа (1971) . Химия функциональных групп PATai. стр. 593–639. дои : 10.1002/9780470771259.ch11 . ISBN 978-0-470-77125-9 .
- ^ Гесснер Т., Майер У (2000). «Триарилметановые и диарилметановые красители». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a27_179 . ISBN 978-3527306732 .
Общие ссылки [ править ]
- Меткалф А.А. (1999). Мир в стольких словах . Хоутон Миффлин. ISBN 0-395-95920-9 .