Деоксигенация Бартона-МакКомби
| Деоксигенация Бартона-МакКомби | |
|---|---|
| Назван в честь | Дерек Гарольд Ричард Бартон Стюарт В. МакКомби |
| Тип реакции | Органическая окислительно-восстановительная реакция |
| Идентификаторы | |
| Портал органической химии | реакция Бартона-Маккомби |
| RSC Идентификатор онтологии | RXNO: 0000134 |
Деоксигенация Бартона -МакКомби представляет собой органическую реакцию , в которой гидроксильная функциональная группа в органическом соединении заменяется водородом с образованием алкильной группы . [1] [2] Он назван в честь британских химиков сэра Дерека Гарольда Ричарда Бартона и Стюарта В. МакКомби.

Эта реакция дезоксигенации представляет собой радикальное замещение . В родственном декарбоксилировании по Бартону реагентом является карбоновая кислота .
Механизм
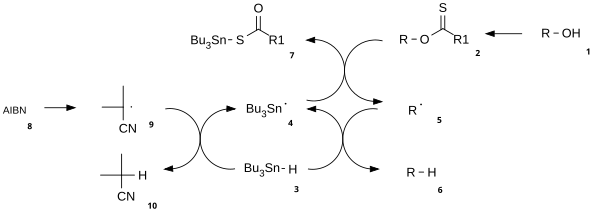
[ редактировать ]Механизм реакции состоит из стадии каталитического радикального инициирования и стадии распространения. [3] Спирт как ( 1 ) сначала преобразуется в реакционноспособный карбонтиоильный промежуточный продукт , такой тионоэфир или ксантогенат 2 . Нагревание AIBN приводит к его гомолитическому расщеплению с образованием двух 2-цианопроп-2-ильных радикалов 9 , каждый из которых отрывает протон от трибутилстаннана 3 с образованием трибутилстаннильных радикалов 4 и неактивных 10 . Радикал трибутилолова отрывает ксантогенатную группу от 2 путем атаки 4 по атому серы с одновременным гомолитическим разрывом π-связи CS. При этом остается углеродцентрированный радикал, который образует π-связь CO посредством гомолитического разрыва σ-связи RO, давая алкильный радикал 5 и ксантогенат трибутилолова 7 . Связь олово сера - в этом соединении очень стабильна и обеспечивает движущую силу этой реакции. Затем алкильный радикал 5 отрывает атом водорода от новой молекулы трибутилстаннана, образуя желаемый дезоксигенированный продукт ( 6 ) и новую разновидность радикала, готовую к размножению.
Вариации
[ редактировать ]Альтернативные источники водорода
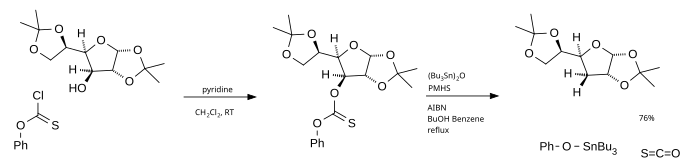
[ редактировать ]Основным недостатком этой реакции является использование трибутилстаннана, который токсичен, дорог и его трудно удалить из реакционной смеси. Одной из альтернатив является использование оксида трибутилолова в качестве источника радикалов и поли(метилгидридсилоксана) (ПМГС) в качестве источника водорода . [4] Фенилхлортионоформиат, используемый в качестве исходного материала, в конечном итоге образует карбонилсульфид .
Триалкилбораны
[ редактировать ]Еще более удобным донором водорода являются комплексы триалкилборан -вода. [5] такие как триметилборан, загрязненный небольшим количеством воды.
В этом каталитическом цикле реакция инициируется окислением триалкилборана 3 воздухом до метильного радикала 4 . Этот радикал реагирует с ксантогенатом 2 с образованием S-метил-S-метилдитиокарбоната 7 и интермедиата 5 . Комплекс (CH 3 ) 3 B.H 2 O 3 дает водород для рекомбинации с этим радикалом в алкан 6 с образованием диэтилбориновой кислоты и нового метильного радикала.
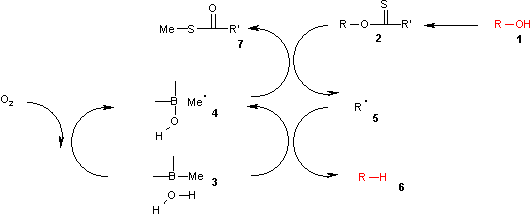
установлено Теоретическими расчетами ОН , что реакция гомолиза в комплексе боран-вода является эндотермической с энергией, аналогичной энергии реакции гомолиза в трибутилстаннане, но значительно меньшей, чем реакция гомолиза чистой воды.
Объем
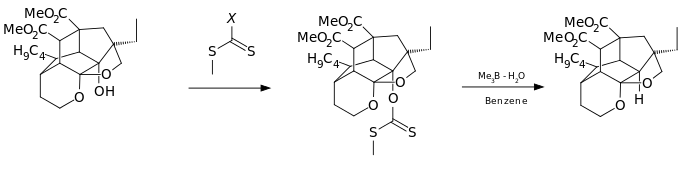
[ редактировать ]Вариант этой реакции был использован в качестве одного из этапов синтеза азадирахтина полного : [6]
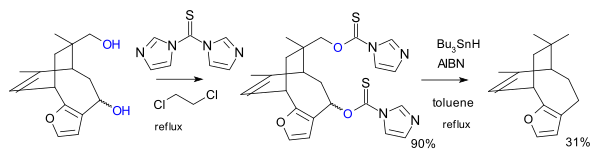
В другом варианте реагентом является имидазол- 1,1'-тиокарбонилдиимидазол (TCDI), например, при полном синтезе паллесцензина B. [7] TCDI особенно хорош для первичных спиртов, поскольку в ароматическом секстете не происходит резонансной стабилизации ксантогената, поскольку неподеленная пара азота участвует в ароматическом секстете. [ нужна ссылка ]
Реакция также применима к S -алкилксантогенатам. Благодаря триэтилборану как новому безметалловому реагенту необходимые атомы водорода отрываются от протонных растворителей, стенок реактора или даже (в строго безводных условиях) от самого борана. [8]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Бартон, DHR ; МакКомби, Юго-Запад (1975). «Новый метод деоксигенации вторичных спиртов». Дж. Хим. Soc., Перкин Транс. 1 . 16 (16): 1574–1585. дои : 10.1039/P19750001574 .
- ^ Крич, Д.; Кинтеро, Л. (1989). «Радикальная химия, связанная с тиокарбонильной группой». хим. Откр. 89 (7): 1413–1432. дои : 10.1021/cr00097a001 .
- ^ Форбс, Дж. Э.; Зард, С.З. (январь 1989 г.). «Новая радикальная цепная реакция ксантиновых ангидридов. Дальнейшие наблюдения о посредничестве алкокси-тиокарбонильных радикалов в реакции Бартона-МакКомби». Буквы тетраэдра . 30 (33): 4367–4370. дои : 10.1016/s0040-4039(00)99362-6 .
- ^ Тормо, Дж.; Фу, GC (2002). «α-D-рибо-гексофураноза, 3-дезокси-1,2:5,6-бис-О-(1-метилэтилиден)». Орг. Синтез . 78 : 239. дои : 10.15227/orgsyn.078.0239 .
- ^ Деоксигенация спиртов с использованием воды в качестве источника атомов водорода Дэвид А. Шпигель, Кеннет Б. Виберг , Лаура Н. Шачерер, Мэтью Р. Медейрос и Джон Л. Вуд Дж. Ам. хим. Соц. 2005 , 127 , 12513-12515. ( два : 10.1021/ja052185l )
- ^ Синтез азадирахтина: долгое, но успешное путешествие Джемма Э. Вейтч, Эдит Бекманн, Бренда Дж. Берк, Алистер Бойер, Сара Л. Маслен и Стивен В. Лей Энджью. хим. Межд. Эд. 2007 , два : 10.1002/anie.200703027
- ^ Первый полный синтез (±)-паллесцензина B Вен-Ченг Лю и Чун-Чен Ляо ChemComm , 1999 , 117–118 117 Статья
- ^ Часть 2. Механистические аспекты восстановления S -алкилтионокарбонатов в присутствии триэтилборана и воздуха Алле Ф., Бойвин Дж., Нгуен В. Бейльштейн J. Org. хим. , 2007 3:45 ( 12 декабря 2007 ) дои : 10.1186/1860-5397-3-46