Джулия олефинирование
| Джулия олефинирование | |
|---|---|
| Назван в честь | Марк Джулия |
| Тип реакции | Реакция сцепления |
| Идентификаторы | |
| Портал органической химии | Джулия-олефинирование |
| RSC Идентификатор онтологии | RXNO: 0000117 |
Олефинирование Джулии (также известное как олефинирование Джулии-Литго ) представляет собой химическую реакцию, в органической химии фенилсульфонов альдегидами используемую (1) с ( или кетонами ) с образованием алкенов (олефинов) (3) после функционализации спирта и восстановительного элиминирования с использованием натрия. амальгама [1] [2] или СМИ 2 . [3] Реакция названа в честь французского химика Марка Жюлиа .
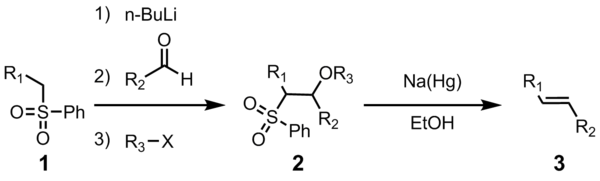
Полезность этой реакции соединительного олефинирования обусловлена ее универсальностью, толерантностью к широким функциональным группам и мягкими условиями реакции, в которых протекает реакция.
Все четыре стадии можно провести в одном реакционном сосуде, и использование R 3 X не является обязательным. Однако очистка сульфонового промежуточного продукта 2 приводит к более высокому выходу и чистоте. Чаще всего R 3 представляет собой ацетил или бензоил , при этом уксусный ангидрид или бензоилхлорид при получении 2 используют .
История
[ редактировать ]В 1973 году Марк Джулия и Жан-Марк Пэрис сообщили о новом синтезе олефинов, в котором β-ацилоксисульфоны восстанавливались до соответствующих ди-, три- или тетразамещенных алкенов. [4] Бэзил Литгоу и Филип Дж. Коценски исследовали масштабы и ограничения реакции, и сегодня это олефинирование официально известно как олефинирование Джулии-Литго. [5] Реакция включает присоединение сульфонилстабилизированного карбаниона к карбонильному соединению с последующим отщеплением с образованием алкена. В первоначальных вариантах реакций отщепление проводилось в восстановительных условиях. Совсем недавно была разработана модифицированная версия, позволяющая избежать этого шага. Первую версию иногда называют олефинированием Джулии-Литго, тогда как вторую называют олефинированием Джулии-Коценского. В восстановительном варианте аддукт обычно ацилируют, а затем обрабатывают восстановителем, например амальгамой натрия. [6] [7] или СМИ 2 . [8] Опубликовано несколько обзоров этих реакций. [9] [10]
Механизм реакции
[ редактировать ]Первые шаги просты. фенилсульфона Анион (2) реагирует с альдегидом с образованием алкоксида (3). Алкоксид функционализирован R 3 -X с образованием стабильного промежуточного соединения (4). Точный механизм восстановления амальгамы натрия неизвестен, но было показано, что он происходит за счет виниловых радикалов (5). [11] . Протонирование винилового радикала дает желаемый продукт (6).

Стереохимия алкена (6) не зависит от стереохимии промежуточного сульфона 4. Считается, что радикальные промежуточные соединения способны уравновешиваться, так что чаще всего образуется более термодинамически стабильный транс-олефин. Это превращение весьма благоприятствует образованию Е -алкена. [12]
Вариации
[ редактировать ]Модифицированное олефинирование Джулии
[ редактировать ]
Модифицированное олефинирование Джулии, также известное как олефинирование Джулии в одном сосуде, представляет собой модификацию классического олефинирования Джулия. Замена фенилсульфонов гетероарилсульфонами существенно меняет ход реакции. [13] Самый популярный пример — бензотиазолсульфон . [14] Реакция бензотиазолсульфона (1) с диизопропиламидом лития (LDA) дает металлированный бензотиазолилсульфон, который быстро реагирует с альдегидами (или кетонами) с образованием алкоксидного промежуточного соединения (2). В отличие от фенилсульфонов, этот промежуточный алкоксид (2) более реакционноспособен и подвергается перегруппировке Смайлса. [15] с получением сульфинатной соли (4). Сульфинат (4) самопроизвольно удаляет диоксид серы и бензотиазолон лития (5), образуя желаемый алкен (6).

Поскольку бензотиазоловый вариант олефинирования Джулии не включает уравновешивающие промежуточные соединения, стереохимический результат является результатом стереохимии первоначального карбонильного присоединения. В результате в этой реакции часто образуется смесь стереоизомеров алкенов.
Олефинирование Юлии-Коценского
[ редактировать ]| Олефинирование Юлии-Коценского | |
|---|---|
| Назван в честь | Марк Джулия Филип Джозеф Коценски |
| Тип реакции | Реакция сцепления |
| Идентификаторы | |
| Портал органической химии | модифицированное-Юлия-Коченски-олефинирование |
| RSC Идентификатор онтологии | RXNO: 0000304 |

Олефинирование Юлии-Коценского, дальнейшее усовершенствование модифицированного олефинирования Юлия, обеспечивает очень хорошую Е -селективность. В олефинировании Юлии-Коценского [16] представляет алкилирующий агент собой тетразол . Он протекает по тому же механизму, что и бензотиазолсульфон, описанный выше. Высокая Е -селективность олефинирования Юлии-Коценского является результатом кинетически контролируемого диастереоселективного присоединения металлированных 1-фенил-1Н-тетразол-5-ил (ПТ) сульфонов к несопряженным альдегидам. При этом образуются анти-β-алкоксисульфоны, которые стереоспецифично разлагаются до E -алкенов. [17] В одной адаптации [18] с трет-бутилтетразоилметилсульфоном условия реакции: либо бис(триметилсилил)амид натрия при -70 °C в тетрагидрофуране , либо карбонат цезия при +70 °C. Эта реакция названа в честь Филипа Дж. Коценски за его модификацию олефинирования Джулии.

Синтетические приложения
[ редактировать ]Реакция олефинирования Джулии, или модифицированная реакция Джулии, представляет собой мощное и универсальное синтетическое преобразование, широко используемое при создании сложных натуральных продуктов с превосходным контролем геометрической изомерии.
Птеростильбен
[ редактировать ]Птеростильбен — стильбеноид, химически родственный ресвератролу. Он принадлежит к группе фитоалексинов — средств, вырабатываемых растениями для борьбы с инфекциями. [19] Птеростильбен — природный диметиловый эфирный аналог ресвератрола. Считается, что соединение также обладает антидиабетическими свойствами, но по этому вопросу пока изучено очень мало.
По сравнению с реакциями Виттига , Виттига-Хорнера, Перкина или реакциями, катализируемыми переходными металлами, для синтеза птеростильбена, олефинирование Юлия предлагает простой и экономичный альтернативный метод получения птеростильбена. [20] [21]
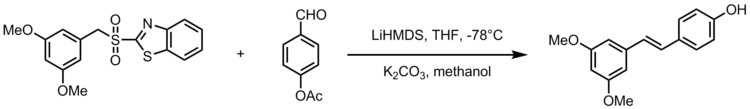
Ресвератрол
[ редактировать ]Одна из модификаций олефинирования Юлии-Коценского дает синтез стильбеноида ресвератрола , природного соединения, содержащегося в обычных продуктах питания, таких как виноград, вина и орехи. Ресвератрол – это биологически важный стильбеноид, который, как предполагается, имеет множество преимуществ для здоровья. Олефинирование Юлии-Коценски служит мощной реакцией при синтезе аналогов ресвератрола с 3,5-бис(трифторметил)фенилсульфонами. На следующей схеме представлена общая схема синтеза аналогов ресвератрола, где R 2 представляет собой арильную группу. [22]

(-)-Калистатин А
[ редактировать ]В асимметричном полном синтезе (-)-каллистатина А, проведенном Амосом Смитом , два отдельных олефинирования Джулии были использованы для присоединения двух E -алкеновых фрагментов. [23] (-)-каллистатин А является членом семейства антибиотиков лептомицина. На следующей схеме показано олефинирование по Юлии-Коценски, используемое для получения предшественника натурального продукта, на что указывает использование PT-сульфона.

См. также
[ редактировать ]- Реакция Хорнера-Уодсворта-Эммонса
- Реакция Джонсона-Кори-Чайковского
- олефинирование по Петерсону
- Реакция Виттига
Ссылки
[ редактировать ]- ^ Джулия, М.; Пэрис, Ж.-М. Тетраэдр Летт. 1973, 14 , 4833–4836. ( два : 10.1016/S0040-4039(01)87348-2 )
- ^ Коценски, П.Дж.; Литгоу, Б.; Растон, S.J. Chem. Soc., Перкин Транс. 1 1978, 829.
- ^ Кек, GE; Савин, Калифорния; Вегларц, Массачусетс J. Org. хим. 1995, 60 , 3194–3204. ( два : 10.1021/jo00115a041 )
- ^ Коценски, П.Дж. Фосфор и сера 1985, 24 , 97–127. (Обзор)
- ^ Келли, SE Комплексный органический синтез 1991, 1 , 792–806. (Обзор) ( два : 10.1016/B978-0-08-052349-1.00020-2 )
- ^ Блейкмор, PR J. Chem. Soc., Перкин Транс. 1 2002, 2563–2585. ( два : 10.1039/b208078h )
- ^ Боден, JB; Харо, Г.; Юлия, ЮАР; Рюэль, О. Tetrahedron Lett. 1991, 32 , 1175. ( два : 10.1016/S0040-4039(00)92037-9 )
- ^ Перемирие, МЫ; Крайдер, Э.М.; Бренд, WW Org. Реагировать. 1970, 18 , 99. (Обзор)
- ^ Пол Р. Блейкмор, Уильям Дж. Коул, Филип Дж. Коценски, Эндрю Морли Синлетт 1998, 26–28. ( два : 10.1055/с-1998-1570 )
- ^ Кристоф Айсса J. Org. хим. 2006, 71 , 360–63. ( дои : 10.1021/jo051693a )
- ^ Зайц Б. и Кумар Р. (2010). Синтез фторолефинов методом олефинирования по Юлии-Коценски. Синтез , 2010(11), 1822–1836.( два : 10.1055/s-0029-1218789 )
- ^ Лангкейк, П.; Прайс, Р.Дж. (1977). «Новый класс фитоалексинов виноградной лозы». Опыт 33 (2): 151–2. ( два : 10.1007/BF02124034 ) ПМИД 844529 .
- ^ Моро, А.В.; Кардозо, FSP; Коррейа, CRD Хек, арилирование стирола солями арендиазония: короткий, эффективный и стереоселективный синтез ресвератрола, DMU-212 и аналогов. Тетраэдр Летт. 2008, 49(39), 5668–5671.
- ^ Прабхакар Педдикотла, Амар Г. Читтибойина, Ихлас А. Хан, (2014) ChemInform Аннотация: Синтез птеростильбена Джулией Олефинирование. ХимИнформ 45, два : 10.1002/chin.201408101 .
- ^ Алонсо Д.А., Фуэнсанта М, Нахера С, Вареа MJ Org. хим. 2005 г.; 70:6404–6416. ПМИД 16050703 .
- ^ AB Smith, III и BM Brandt. Полный синтез (–)-каллистатина А. Орг. Летт. 2001, 3, 1685–1688.
- ^ Робиетт, Р.; Поспишил, Я. О происхождении E/Z-селективности в модифицированном олефинировании Юлия: важность этапа устранения; Евро. Дж. Орг. хим. 2013, 836–840.