Дигидроксилирование
Дигидроксилирование — это процесс, при котором алкен превращается в вицинальный диол . Хотя существует множество способов осуществления этого окисления с высокой степенью окисления , в наиболее распространенных и прямых процессах используется переходный металл (обычно осмий или марганец). Металл часто используется в качестве катализатора в сочетании с другим стехиометрическим окислителем. [1] Кроме того, для катализа реакции были разработаны и использованы другие методы с переходными и непереходными металлами.

Механизм
[ редактировать ]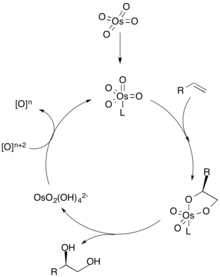
В механизме дигидроксилирования лиганд сначала координируется с металлическим катализатором (обозначенным как осмий), что определяет хиральную селективность олефина. Затем алкен координируется с металлом посредством (3+2)-циклоприсоединения, и лиганд диссоциирует от металлического катализатора. Затем гидролиз олефина дает вицинальный диол, а окисление катализатора стехиометрическим окислителем регенерирует металлический катализатор, повторяя цикл. [2] Концентрация олефина имеет решающее значение для энантиомерного избытка диола, поскольку более высокие концентрации алкена могут связываться с другим каталитическим центром с образованием другого энантиомера. [3]
Реакции, катализируемые осмием
[ редактировать ]Четырехокись осмия (OsO 4 ) является популярным окислителем, используемым при дигидроксилировании алкенов из-за его надежности и эффективности при получении син-диолов. Поскольку он дорог и токсичен, используют каталитические количества OsO 4 совместно со стехиометрическим окислителем. [2] [3] В реакциях гидроксилирования Миласа , дигидроксилирования Апджона и асимметричного дигидроксилирования Шарплесса в качестве катализатора используется осмий, а также различные вторичные окислители.
Милас
[ редактировать ]Дигидроксилирование по Миласу было введено в 1930 году, и в нем в качестве стехиометрического окислителя используется перекись водорода. [4] Хотя этот метод позволяет получать диолы, переокисление дикарбонильного соединения привело к трудностям при выделении вицинального диола. [4] Поэтому протокол Миласа был заменен асимметричным дигидроксилированием Апджона и Шарплесса.
Апджон
[ редактировать ]О дигидроксилировании Апджона сообщалось в 1973 году, и используется OsO 4 в нем в качестве активного катализатора в процедуре дигидроксилирования . Он также использует N-оксид N-метилморфолина (NMO) в качестве стехиометрического окислителя для регенерации осмиевого катализатора, что позволяет использовать каталитические количества осмия. [2] [5] Протокол Апджона обеспечивает высокую конверсию вицинального диола и переносит многие субстраты. Однако протокол не может дигидроксилировать тетразамещенные алкены. [2] Условия Апджона можно использовать для синтеза антидиолов из аллильных спиртов, как продемонстрировали Киши и его коллеги. [6]
Шарплесс асимметричный
[ редактировать ]Асимметричное дигидроксилирование Шарплесса [7] был разработан К. Барри Шарплессом для использования каталитических количеств OsO 4 вместе со стехиометрическим окислителем K 3 [Fe(CN) 6 ]. [1] [2] [8] Реакцию проводят в присутствии хирального вспомогательного вещества. Выбор дигидрохинидина (DHQD) или дигидрохинина (DHQ) в качестве хирального вспомогательного средства диктует лицевую селективность олефина, поскольку абсолютная конфигурация лигандов противоположна. [2] [8] [9] Катализатор, окислитель и хиральное вспомогательное вещество можно приобрести предварительно смешанными для селективного дигидроксилирования. AD-mix-α содержит хиральный вспомогательный компонент (DHQ) 2 PHAL, который позиционирует OsO 4 на альфа-грани олефина; AD-mix-β содержит (DHQD) 2 PHAL и доставляет гидроксильные группы к бета-лицу. [1] [10] Асимметричное дигидроксилирование Шарплесса имеет большие возможности для селективности субстрата за счет изменения хирального вспомогательного класса. [8]


Другие варианты
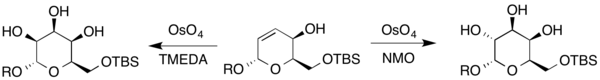
[ редактировать ]Как упоминалось выше, возможность синтеза антидиолов из аллильных спиртов может быть достигнута при использовании NMO в качестве стехиометрического окислителя. [6] Использование тетраметилендиамина (TMEDA) в качестве лиганда привело к образованию синдиолов с благоприятным диастереомерным соотношением по сравнению с протоколом Киши; однако используется стехиометрический осмий. Син-селективность обусловлена донорной способностью аллилового спирта к донору водородных связей и акцепторной способностью диамина. [11] [12] [13] С тех пор это было применено к гомоаллильным системам. [14] [15]
Другие методы дигидроксилирования
[ редактировать ]Поскольку четырехокись осмия дорогая и токсичная, для получения вицинальных диолов из олефинов использовались другие металлы. Другим популярным металлом, используемым при дигидроксилировании, является рутений. Несмотря на высокую окислительную способность, рутений использовался из-за его короткого времени реакции и экономической эффективности. [16] Обычно четырехокись рутения создается in situ из трихлорида рутения, а вторичный окислитель NaIO 4 для регенерации катализатора используется . Стадией реакции, лимитирующей оборот, является стадия гидролиза; поэтому для увеличения скорости этой стадии добавляют серную кислоту. [16] [17]
Марганец также используется при дигидроксилировании, и его часто выбирают, когда методы с тетроксидом осмия дают плохие результаты. [17] Как и в случае с рутением, окислительный потенциал марганца высок, что приводит к переокислению субстратов. Перманганат калия часто используется в качестве окислителя при дигидроксилировании; однако из-за его плохой растворимости в органическом растворителе также добавляют катализатор межфазного переноса (такой как хлорид бензилтриэтиламмония, TEBACl) для увеличения количества субстратов для дигидроксилирования. [17] Мягкие условия необходимы, чтобы избежать чрезмерного окисления. В частности, слишком теплый, кислый или концентрированный раствор приведет к расщеплению гликоля. [18]
Дигидроксилирование Прево и Вудворда
[ редактировать ]
В отличие от других описанных методов, в которых в качестве катализатора используются переходные металлы, в методах Прево и Вудворда используются йод и соль серебра. Однако добавление воды в реакцию направляет цис- и транс-присоединение гидроксильных групп. В реакции Прево обычно используется бензоат серебра для получения транс-диолов; В модификации Вудворда реакции Прево используется ацетат серебра для получения цис-диолов. И в реакциях Прево, и в реакциях Вудворда йод сначала добавляется к алкену, образуя циклический ион йода. Анион соответствующей соли серебра затем присоединяется путем нуклеофильного замещения к иону йода. [19]

В реакции Прево ион йода подвергается нуклеофильной атаке бензоат-аниона. Бензоат-анион снова действует как нуклеофил, замещая йодид посредством механизма участия соседних групп. Второй бензоат-анион реагирует с промежуточным соединением с образованием антизамещенного дибензоатного продукта, который затем может подвергаться гидролизу с образованием транс-диолов. [19]

Модификация Вудворда реакции Прево дает цис-диолы. Ацетат-анион реагирует с циклическим ионом йода с образованием промежуточного иона оксония. Затем он может легко реагировать с водой с образованием моноацетата, который затем гидролизуется с образованием цис-диола. [20]
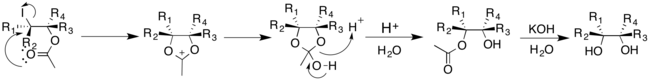
Чтобы исключить необходимость в солях серебра, Судалай и его коллеги модифицировали реакцию Прево-Вудворда; реакция катализируется LiBr, а в качестве окислителей используются NaIO 4 и PhI(OAc) 2 . [21] LiBr реагирует с NaIO 4 и уксусной кислотой с образованием ацетата лития, который затем может протекать по реакции, как упоминалось ранее. Протокол дал высокий Dr для соответствующего диола, в зависимости от выбранного окислителя.

Приложения
[ редактировать ]Синтез высокозамещенных и стереоспецифичных сахаров важен, поскольку полисахариды составляют большой класс соединений, встречающихся в природе. Одним из конкретных примеров является биологически активная молекула какелокелоза, которая, как было показано, обладает анти-ВИЧ-активностью. [22] Исследование, проведенное Harris et al. работали над энантиоспецифическим синтезом сахаров, относящихся к какелокелозе и другим сахарам, используя множество различных реакций дигидроксилирования с осмиевым катализатором. Винилфуран подвергали реакции в условиях Шарплесса с AD-mix-α с получением (R)-диола. Позже полученный дигидропиран подвергали реакции в условиях Апджона с получением сахара, маннозы (где R представляет собой либо H, либо защитную группу). [22]
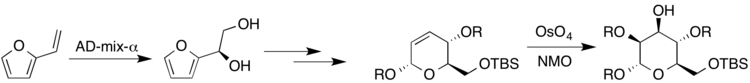
Кроме того, талоза и гулоза были также синтезированы из другого дигидропирана. Поскольку соединение содержит аллильный спирт, условия Апджона и модификация Апджона с использованием TMEDA в качестве вторичного окислителя для создания полученных сахаров (где R представляет собой либо H, либо защитную группу). [22]
Другое применение методов дигидроксилирования - синтез стероидов. Брассиностероиды — это класс стероидов, которые, как было показано, регулируют рост растений и обладают сельскохозяйственной активностью в качестве инсектицида. Этот класс стероидов содержит стандартную структуру стероидов в дополнение к четырем вицинальным диолам, имеющим свою собственную стереохимию. [23] Броза установил гидроксильные группы в стероиде, используя оба условия Вудворда, чтобы получить цис-диол в кольце А стероида. Затем алкеновую цепь в кольце D дигидроксилировали с получением второго цис-диола, используя OsO 4 и NMO в качестве стехиометрического окислителя. [24]

Ссылки
[ редактировать ]- ^ Jump up to: а б с Кэри, Фрэнсис А.; Сундберг, Ричард Дж. Продвинутая органическая химия, часть B: реакции и синтез (5-е изд.). Спрингер.
- ^ Jump up to: а б с д и ж Шредер, М. (1980). «Цис-гидроксилирование тетраоксида осмия ненасыщенных субстратов». хим. Преподобный . 80 (2): 187–213. дои : 10.1021/cr60324a003 .
- ^ Jump up to: а б Кольбе, ХК; ВанНьюванзе, М.С.; Шарплесс, КБ (1994). «Каталитическое асимметрическое дигидроксилирование». хим. Преподобный . 94 (8): 2483–2547. дои : 10.1021/cr00032a009 .
- ^ Jump up to: а б Милас, Н.А.; Сассман, С. (1936). «Гидроксилирование двойной связи 1». Дж. Ам. хим. Соц . 58 (7): 1302–4. дои : 10.1021/ja01298a065 .
- ^ Дюпо, П.; Эппл, Р.; Томас, А.А.; Фокин В.В.; Шарплесс, КБ (2002). «Катализируемое осмием дигидроксилирование олефинов в кислых средах: старый процесс, новые приемы». Адв. Синтез. Катал . 344 (3–4): 421–33. doi : 10.1002/1615-4169(200206)344:3/4<421::AID-ADSC421>3.0.CO;2-F .
- ^ Jump up to: а б Ча, Дж. К.; Христос, WJ; Киши, Ю. (1983). «1983». Тетраэдр Летт . 24 : 3943–6. дои : 10.1016/s0040-4039(00)88231-3 .
- ^ Муньис, изд. Каталитическое окисление в органическом синтезе . Штутгарт: Георг Тиме Верлаг. дои : 10.1055/sos-sd-225-00165 . ISBN 978-3-13-201231-8 .
- ^ Jump up to: а б с Морикава, К.; Парк, Дж.; Андерсон, PG; Хашияма, Т.; Шарплесс, КБ (1993). «Каталитическое асимметрическое дигидроксилирование тетразамещенных олефинов». Дж. Ам. хим. Соц . 115 (18): 8463–4. дои : 10.1021/ja00071a072 .
- ^ Кэри, ФА; Сундберг, Р.Дж. (2007). Продвинутая органическая химия. Часть A: Структура и механизмы . Спрингер. п. 202.
- ^ Сюй, DX; Криспино, Джорджия; Шарплесс, КБ (1992). «Селективное асимметрическое дигидроксилирование (АД) диенов». Дж. Ам. хим. Соц . 114 (19): 7570–1. дои : 10.1021/ja00045a043 .
- ^ Донохью, Ти Джей; Блейдс, К.; Мур, PR; Уоринг, MJ; Зима, JJG; Хелливелл, М.; Ньюкомб, Нью-Джерси; Стемп, Г. (2002). «Направленное дигидроксилирование циклических аллильных спиртов и трихлорацетамидов с использованием OsO4/TMEDA». Дж. Орг. Хим . 67 (23): 7946–56. дои : 10.1021/jo026161y . ПМИД 12423122 .
- ^ Донохью, Ти Джей; Мур, PR; Уоринг, MJ; Ньюкомб, Николас Дж. (1997). «Направленное дигидроксилирование аллильных спиртов». Тетраэдр Летт . 38 (28): 5027–30. дои : 10.1016/s0040-4039(97)01061-7 .
- ^ Донохью, Ти Джей (2002). «Развитие направленной реакции дигидроксилирования». Синлетт (8): 1223–32. дои : 10.1055/s-2002-32947 .
- ^ Донохью, Тимоти Дж.; Митчелл, Ли; Уоринг, Майкл Дж.; Хелливелл, Мадлен; Белл, Эндрю; Ньюкомб, Николас Дж. (10 июня 2003 г.). «Область направленного дигидроксилирования: применение к циклическим гомоаллильным спиртам и тригалоацетамидам» . Органическая и биомолекулярная химия . 1 (12): 2173–2186. дои : 10.1039/B303081D . ISSN 1477-0539 . ПМИД 12945911 .
- ^ Донохью, Тимоти Дж; Митчелл, Ли; Уоринг, Майкл Дж; Хелливелл, Мадлен; Белл, Эндрю; Ньюкомб, Николас Дж (17 декабря 2001 г.). «Гомаллиловые спирты и трихлорацетамиды как доноры водородных связей для направленного дигидроксилирования» . Буквы тетраэдра . 42 (51): 8951–8954. дои : 10.1016/S0040-4039(01)01999-2 . ISSN 0040-4039 .
- ^ Jump up to: а б Плиткер, Б.; Ниггеманн, М. (2003). «Улучшенный протокол дигидроксилирования олефинов, катализируемого RuO4». Орг. Летт . 5 (18): 3353–6. дои : 10.1021/ol035335a . ПМИД 12943425 .
- ^ Jump up to: а б с Батай, CJR; Донохью, Ти Джей (2011). «Безосмийное прямое синдигидроксилирование алкенов». хим. Соц. Преподобный . 40 (1): 114–28. дои : 10.1039/b923880h . ПМИД 21049111 .
- ^ Уэйд, LG (2013). Органическая химия (8-е изд.). Бостон: Пирсон. п. 367. ИСБН 978-0-321-76841-4 . OCLC 752068109 .
- ^ Jump up to: а б Курти, Л.; Чако, Б. (2005). Стратегическое применение названных реакций в органическом синтезе . Эльзевир. стр. 360–1.
- ^ Вудворд, РБ; Брютчер-младший, Ф.В. (1958). «Цис-гидроксилирование промежуточного синтетического стероида с йодом, ацетатом серебра и влажной уксусной кислотой». Дж. Ам. хим. Соц . 80 : 209–11. дои : 10.1021/ja01534a053 .
- ^ Эмманувель, Л.; Шейх, ТМА; Судалай, А. (2005). «NaIO4/Li Br -опосредованное диастереоселективное дигидроксилирование олефинов: каталитический подход к реакции Прево-Вудворда». Орг. Летт . 7 (22): 5071–4. дои : 10.1021/ol052080n . ПМИД 16235960 .
- ^ Jump up to: а б с Харрис, Дж. М.; Керанен, доктор медицинских наук; О'Доэрти, Джорджия (1999). «Синтез D- и L -маннозы, гулозы и талозы посредством диастереоселективных и энантиоселективных реакций дигидроксилирования». Дж. Орг. Хим . 64 (9): 2982–3. дои : 10.1021/jo990410 . ПМИД 11674384 .
- ^ Бишоп, Г.; Конц, Чаба (2002). «Брассиностероиды и передача сигналов растительных стероидных гормонов» . Растительная клетка . 14 (Приложение): S97–110. дои : 10.1105/tpc.001461 . ПМК 151250 . ПМИД 12045272 .
- ^ Броза, К.; Нусимович, С; Перакаула, Р. (1994). «Синтез новых брассиностероидов с потенциальной активностью антиэкдистероидов». Стероиды . 59 (8): 463–7. дои : 10.1016/0039-128x(94)90058-2 . ПМИД 7985206 . S2CID 45409677 .