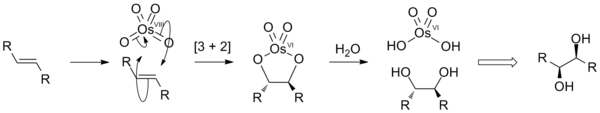Четырехокись осмия
| |||
 | |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название ИЮПАК Тетраоксид осмия | |||
| Систематическое название ИЮПАК Тетраоксоосмий | |||
| Другие имена Оксид осмия(VIII) | |||
| Идентификаторы | |||
3D model ( JSmol ) | |||
| ЧЭБИ | |||
| ХимическийПаук | |||
| Информационная карта ECHA | 100.040.038 | ||
| Номер ЕС |
| ||
| МеШ | Осмий+тетроксид | ||
ПабХим CID | |||
| номер РТЭКС |
| ||
| НЕКОТОРЫЙ | |||
| Число | И 2471 | ||
Панель управления CompTox ( EPA ) | |||
| Характеристики | |||
| ОсО 4 | |||
| Молярная масса | 254,23 г/моль | ||
| Появление | Белое летучее твердое вещество | ||
| Запах | Едкий, хлороподобный | ||
| Плотность | 4,9 г/см 3 [1] | ||
| Температура плавления | 40,25 ° С (104,45 ° F; 313,40 К) | ||
| Точка кипения | 129.7 [2] ° С (265,5 ° F; 402,8 К) | ||
| 5,70 г/100 мл (10 °С) 6,23 г/100 мл (25 °С) | |||
| Растворимость | Растворим в большинстве органических растворителей, гидроксиде аммония , оксихлориде фосфора. | ||
| Растворимость в CCl 4 | 375 г/100 мл | ||
| Давление пара | 7 мм рт.ст. (20 °С) [3] | ||
| Структура [4] | |||
| Моноклиника, мС20 | |||
| С2/с | |||
α = 90°, β = 116,58°, γ = 90° | |||
Объем решетки ( В ) | 326,8 Å 3 | ||
Формульные единицы ( Z ) | 4 | ||
| четырехгранный | |||
| Опасности | |||
| СГС Маркировка : | |||
  | |||
| Опасность | |||
| Х300 , Х310 , Х314 , Х330 | |||
| P260 , P262 , P264 , P270 , P271 , P280 , P284 , P301+P310 , P301+P330+P331 , P302+P350 , P303+P361+P353 , P304+P340 , P305+P351+P338 , П310 , П320 , П321 , П322 , П330 , П361 , П363 , П403+П233 , П405 , П501 | |||
| NFPA 704 (огненный алмаз) | |||
| Летальная доза или концентрация (LD, LC): | |||
LC Lo ( самый низкий из опубликованных ) | 1316 мг/м 3 (кролик, 30 мин) 423 мг/м 3 (крыса, 4 часа) 423 мг/м 3 (мышь, 4 часа) [5] | ||
| NIOSH (пределы воздействия на здоровье в США): | |||
МЕХ (Допускается) | СВВ 0,002 мг/м 3 [3] | ||
РЕЛ (рекомендуется) | СВВ 0,002 мг/м 3 (0,0002 ppm) ST 0,006 мг/м 3 (0,0006 частей на миллион) [3] | ||
IDLH (Непосредственная опасность) | 1 мг/м 3 [3] | ||
| Паспорт безопасности (SDS) | КМГС 0528 | ||
| Родственные соединения | |||
Другие катионы | Четырехокись рутения Четырехокись гассия | ||
| Оксид осмия(IV) | |||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Четырехокись осмия (также оксид осмия(VIII) ) представляет собой химическое соединение с формулой OsO 4 . Это соединение примечательно множеством применений, несмотря на его токсичность и редкость осмия . Он также обладает рядом необычных свойств, одно из которых заключается в том, что это твердое вещество летучее . Соединение бесцветно, но большинство образцов имеют желтый цвет. [6] Скорее всего, это связано с наличием примеси OsO 2 желто-коричневого цвета. [7] В биологии его свойство связываться с липидами сделало его широко используемым красителем в электронной микроскопии.
Физические свойства [ править ]

Оксид осмия(VIII) образует моноклинные кристаллы. [4] [8] Имеет характерный резкий запах, напоминающий хлор . Название элемента « осмий» происходит от слова «osme» , что по-гречески означает «запах» . OsO 4 летуч: он сублимирует при комнатной температуре . Он растворим в широком спектре органических растворителей. Умеренно растворим в воде, с которой обратимо реагирует с образованием осмиевой кислоты (см. ниже). [9] Чистый оксид осмия (VIII), вероятно, бесцветен; [10] Было высказано предположение, что его желтый оттенок обусловлен примесями диоксида осмия (OsO 2 ). [11] Молекула четырехокиси осмия тетраэдрическая и, следовательно, неполярная. Эта неполярность помогает OsO 4 проникать через заряженные клеточные мембраны.
и конфигурация электронная Структура
Осмий OsO 4 ; имеет степень окисления VIII однако металл не обладает соответствующим зарядом 8+, поскольку связь в соединении носит в основном ковалентный характер ( энергия ионизации, необходимая для образования формального заряда 8+, также намного превышает энергии, доступные в обычных химических реакциях). Атом осмия имеет двойные связи с четырьмя оксидными лигандами , в результате чего образуется 16-электронный комплекс . Он изоэлектронен ионам перманганата и хромата . [ нужна ссылка ]
Синтез [ править ]
OsO 4 образуется медленно, когда порошок осмия реагирует с O 2 при температуре окружающей среды. Реакция сыпучего вещества требует нагревания до 400 °С. [12]
Реакция [ править ]
Окисление алкенов [ править ]
Алкены присоединяются к OsO 4 с образованием диолатов , которые гидролизуются до цис -диолов. Конечный процесс называется дигидроксилированием. Это происходит через реакцию циклоприсоединения [3 + 2] между OsO 4 и алкеном с образованием промежуточного сложного эфира осмата, который быстро гидролизуется с образованием вицинального диола . Поскольку атомы кислорода добавляются согласованно, в результате получается цис -стереохимия .
OsO 4 дорог и очень токсичен, что делает его непривлекательным реагентом для использования в стехиометрических количествах. Однако его реакции становятся каталитическими за счет добавления реоксидантов для повторного окисления побочного продукта Os (VI) обратно в Os (VIII). Типичные реагенты включают H 2 O 2 ( гидроксилирование по Миласу ), N-оксид N-метилморфолина ( дигидроксилирование по Апджону ) и K 3 Fe(CN) 6 /вода. Эти реоксиданты сами по себе не реагируют с алкенами. В качестве катализаторов можно использовать и другие соединения осмия, в том числе соли осмата(VI) ([OsO 2 (OH) 4 )] 2− и гидрат трихлорида осмия (OsCl 3 · x H 2 O). Эти виды окисляются до осмия (VIII) в присутствии таких окислителей. [13]
Основания Льюиса, такие как третичные амины и пиридины, увеличивают скорость дигидроксилирования. Это «лигандное ускорение» возникает за счет образования аддукта OsO 4 L, который быстрее присоединяется к алкену. Если амин хиральный, то дигидроксилирование может протекать с энантиоселективностью (см. Асимметричное дигидроксилирование по Шарплессу ). [14] OsO 4 не реагирует с большинством углеводов. [15]
Процесс можно расширить, чтобы получить два альдегида при окислении Лемье-Джонсона , в котором периодат используется для расщепления диола и регенерации каталитической загрузки OsO 4 . Этот процесс эквивалентен озонолизу .
Координационная химия [ править ]

OsO 4 представляет собой кислоту Льюиса и мягкий окислитель. Он реагирует с водным раствором щелочи с образованием перосмат-аниона OsO.
4 (ОН) 2−
2 . [17] Этот вид легко восстанавливается до осмат -аниона OsO.
2 (О) 2−
4 .
Когда основание Льюиса представляет собой амин , также образуются аддукты. Таким образом, OsO 4 может храниться в виде осмета , в котором OsO 4 находится в комплексе с уротропином . Осмет можно растворить в тетрагидрофуране (ТГФ) и разбавить водным буферным раствором, чтобы получить разбавленный (0,25%) рабочий раствор OsO 4 . [18]
С трет-BuNH 2 имидопроизводное образуется :
- OsO 4 + Me 3 CNH 2 → OsO 3 (NCMe 3 ) + H 2 O
Аналогично с NH 3 получается нитридный комплекс :
- OsO 4 + NH 3 + КОН → K[Os(N)O 3 ] + 2 H 2 O
[Os(N)O 3 ] − анион изоэлектронен и изоструктурен OsO 4 .
OsO 4 хорошо растворим в трет-бутиловом спирте . В растворе он легко восстанавливается водородом до металлического осмия. Суспендированный металлический осмий можно использовать для катализа гидрирования широкого спектра органических химикатов, содержащих двойные или тройные связи.
- OsO 4 + 4 H 2 → Os + 4 H 2 O
OsO 4 подвергается «восстановительному карбонилированию» монооксидом углерода в метаноле при 400 К и 200 сбар с образованием треугольного кластера Os 3 (CO) 12 :
- 3 OsO 4 + 24 CO → Os 3 (CO) 12 + 12 CO 2 [12]
Оксофториды [ править ]
Осмий образует несколько оксофторидов, все из которых очень чувствительны к влаге.Фиолетовый цис -OsO 2 F 4 образуется при 77 К в безводном растворе HF : [19]
- OsO 4 + 2 KrF 2 → цис -OsO 2 F 4 + 2 Kr + O 2
OsO 4 также реагирует с F 2 с образованием желтого OsO 3 F 2 : [20]
- 2OsO4 2F2 2 → 2OsO3F2 F + O2 +
OsO 4 реагирует с одним эквивалентом [Me 4 N]F при 298 К и с 2 эквивалентами при 253 К: [12]
- OsO 4 + [Me 4 N]F → [Me 4 N][OsO 4 F]
- OsO 4 + 2 [Me 4 N]F → [Me 4 N] 2 [ цис -OsO 4 F 2 ]
Использует [ править ]
Органический синтез [ править ]
В органическом синтезе OsO 4 широко используется для окисления алкенов до вицинальных диолов путем присоединения двух гидроксильных групп с одной и той же стороны ( син-присоединение ). См. реакцию и механизм выше. Эту реакцию можно сделать как каталитической ( дигидроксилирование Апджона ), так и асимметричной ( асимметричное дигидроксилирование Шарплесса ).
Оксид осмия (VIII) также используется в каталитических количествах при оксиаминировании Шарплесса с получением вицинальных аминоспиртов.
В сочетании с периодатом натрия OsO 4 используется для окислительного расщепления алкенов ( окисление Лемье-Джонсона ), когда периодат служит как для расщепления диола, образующегося в результате дигидроксилирования, так и для повторного окисления OsO 3 обратно в OsO 4 . Чистая трансформация идентична трансформации, происходящей при озонолизе . Ниже приведен пример полного синтеза изостевиола. [21]
Биологическое окрашивание [ править ]
OsO 4 — широко используемый краситель , используемый в просвечивающей электронной микроскопии (ПЭМ) для обеспечения контрастности изображения. [22] Этот метод окрашивания также может быть известен в литературе как ОТО. [23] [24] (осмий-тиокарбогидразид-осмий) метод или пропитка осмием [25] техника или просто как окрашивание осмием. В качестве липидного пятна он также полезен в сканирующей электронной микроскопии (СЭМ) в качестве альтернативы напылению . Он внедряет тяжелый металл непосредственно в клеточные мембраны, создавая высокую скорость рассеяния электронов без необходимости покрытия мембраны слоем металла, который может скрыть детали клеточной мембраны. При окрашивании плазматической мембраны оксид осмия (VIII) связывает головные области фосфолипидов , создавая тем самым контраст с соседней протоплазмой (цитоплазмой). Кроме того, оксид осмия(VIII) также используется для фиксации биологических образцов в сочетании с HgCl 2 . Его способности к быстрому убийству используются для быстрого убийства живых особей, таких как простейшие. OsO 4 стабилизирует многие белки, превращая их в гели без разрушения структурных особенностей. Тканевые белки, стабилизированные OsO 4 , не коагулируются спиртами при дегидратации. [15] Оксид осмия (VIII) также используется в качестве красителя для липидов в оптической микроскопии. [26] OsO 4 также окрашивает роговицу человека (см. соображения безопасности ).

Полимерное окрашивание [ править ]
Его также преимущественно используют для окрашивания сополимеров , наиболее известным примером являются блок-сополимеры, где можно окрасить одну фазу, чтобы показать микроструктуру материала . Например, блок-сополимеры стирола и бутадиена имеют центральную полибутадиеновую цепь с полистироловыми концевыми концами. При обработке OsO 4 бутадиеновая матрица реагирует преимущественно и таким образом поглощает оксид. Присутствия тяжелого металла достаточно, чтобы заблокировать электронный луч, поэтому домены полистирола ясно видны в тонких пленках в ПЭМ .
Переработка осмиевой руды [ править ]
OsO 4 является промежуточным продуктом при извлечении осмия из руд. Осмийсодержащие остатки обрабатывают пероксидом натрия (Na 2 O 2 ) с образованием Na 2 [OsO 4 (OH) 2 растворимого ). При воздействии хлора эта соль дает OsO 4 . На заключительных стадиях переработки сырой OsO 4 растворяют в спиртовом NaOH с образованием Na 2 [OsO 2 (OH) 4 ), который при обработке NH 4 Cl дает (NH 4 ) 4 [OsO 2 Cl 2 ]. Эта соль восстанавливается под водородом с образованием осмия. [9]
Аддукт бакминстерфуллерена [ править ]
OsO 4 позволил подтвердить модель футбольного мяча бакминстерфуллерена , 60-атомного углерода аллотропа . Аддуктом ) , образовавшимся из производного OsO 4 , стал C 60 OsO 4 )(4 трет - бутилпиридин 2 ( - . Аддукт нарушил симметрию фуллерена, что позволило провести кристаллизацию и подтвердить структуру C 60 с помощью рентгеновской кристаллографии . [27]
Медицина [ править ]
Единственное известное клиническое применение тетраоксида осмия — для лечения артрита. [28] Отсутствие сообщений о долгосрочных побочных эффектах от местного применения тетроксида осмия (OsO 4 ) позволяет предположить, что осмий сам по себе может быть биосовместимым , хотя это зависит от вводимого соединения осмия.
безопасности Соображения

OsO 4 необратимо окрашивает роговицу человека , что может привести к слепоте. Допустимый предел воздействия оксида осмия(VIII) (средневзвешенное по времени за 8 часов) составляет 2 мкг/м. 3 . [8] Оксид осмия(VIII) может проникать через пластик и упаковку пищевых продуктов, поэтому его следует хранить в стеклянной упаковке в холодильнике. [15]
Ссылки [ править ]
- ^ «Тетроксид осмия ICSC: 0528» . Инхим.
- ^ Кода, Ёсио (1986). «Температуры кипения и идеальные растворы тетраоксидов рутения и осмия». Журнал Химического общества, Химические коммуникации . 1986 (17): 1347–1348. дои : 10.1039/C39860001347 .
- ↑ Перейти обратно: Перейти обратно: а б с д Карманный справочник NIOSH по химическим опасностям. «#0473» . Национальный институт безопасности и гигиены труда (NIOSH).
- ↑ Перейти обратно: Перейти обратно: а б с Кребс, Б.; Хассе, К.Д. (1976). «Уточнения кристаллических структур KTcO 4 , KReO 4 и OsO 4 . Длины связей в тетраэдрических оксо-анионах и оксидах d 0 Переходные металлы». Acta Crystallographica B. 32 ( 5): 1334–1337. Bibcode : 1976AcCrB..32.1334K . doi : 10.1107/S056774087600530X .
- ^ «Тетроксид осмия (как Os)» . Непосредственно опасные для жизни и здоровья концентрации (IDLH) . Национальный институт безопасности и гигиены труда (NIOSH).
- ^ Джиролами, Грегори (2012). «Осмий весит» . Природная химия . 4 (11): 954. Бибкод : 2012НатЧ...4..954Г . дои : 10.1038/nchem.1479 . ПМИД 23089872 .
- ^ Коттон и Уилкинсон, Передовая неорганическая химия, стр.1002.
- ↑ Перейти обратно: Перейти обратно: а б «Тетроксид осмия (как Os)» . Документация по концентрациям, непосредственно опасным для жизни или здоровья (IDLH) . Центры по контролю заболеваний. 2 ноября 2018 г.
- ↑ Перейти обратно: Перейти обратно: а б Томпсон, М. «Тетроксид осмия (OsO 4 )» . Бристольский университет . Проверено 7 апреля 2012 г.
- ^ Батлер, И.С.; Харрод, Дж. Ф. (1989). Неорганическая химия: принципы и приложения . Бенджамин/Каммингс. п. 343. ИСБН 978-0-8053-0247-9 . Проверено 7 апреля 2012 г.
- ^ Коттон, ФА (2007). Продвинутая неорганическая химия (6-е изд.). Нью-Дели, Индия: Дж. Уайли. п. 1002. ИСБН 978-81-265-1338-3 .
- ↑ Перейти обратно: Перейти обратно: а б с Хаускрофт, CE; Шарп, АГ (2004). Неорганическая химия (2-е изд.). Прентис Холл. стр. 671–673, 710. ISBN. 978-0-13-039913-7 .
- ^ Огино, Ю.; Чен, Х.; Квонг, Х.-Л.; Шарплесс, КБ (1991). «О сроках гидролиза/реокисления при катализируемом осмием асимметричном дигидроксилировании олефинов с использованием феррицианида калия в качестве реокислителя». Буквы тетраэдра . 32 (32): 3965–3968. дои : 10.1016/0040-4039(91)80601-2 .
- ^ Беррисфорд, диджей; Болм, К.; Шарплесс, КБ (1995). «Лиганд-ускоренный катализ». Angewandte Chemie, международное издание . 34 (10): 1059–1070. дои : 10.1002/anie.199510591 .
- ↑ Перейти обратно: Перейти обратно: а б с Хаят, Массачусетс (2000). Принципы и методы электронной микроскопии: биологические приложения . Издательство Кембриджского университета. стр. 45–61. ISBN 0-521-63287-0 .
- ^ Брайан С. Макгиллиган; Джон Арнольд; Джеффри Уилкинсон; Билкис Хусейн-Бейтс; Майкл Б. Херстхаус (1990). «Реакции димезитилдиоксо-осмия(VI) с донорными лигандами. Реакции MO 2 (2,4,6-Me 3 C 6 H 2 ) 2 , M = Os или Re, с оксидами азота. Рентгеновские кристаллические структуры [ 2,4,6-Me 3 C 6 H 2 N 2 ] + [OsO 2 (ONO 2 ) 2 (2,4,6-Me 3 C 6 H 2 )] – , OsO(NBu т )(2,4,6-Me 3 C 6 H 2 ) 2 , OsO 3 (NBu т ) и ReO 3 [N(2,4,6-Me 3 C 6 H 2 ) 2 ]». J. Chem. Soc., Dalton Trans. (8): 2465–2475. doi : 10.1039/DT9900002465 .
- ^ Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8 .
- ^ Кирнан, Дж. А. «Re: «Утилизация» «отходов» тетраоксида осмия » . Кафедра анатомии и клеточной биологии Университета Западного Онтарио.
- ^ Кристе, КО; Диксон, Д.А.; Мак, Х.Г.; Оберхаммер, Х.; Пажлот, А.; Сандерс, JCP; Шробильген, Г.Дж. (1993). «Диоксид тетрафторида осмия, цис -OsO 2 F 4 ». Журнал Американского химического общества . 115 (24): 11279–11284. дои : 10.1021/ja00077a029 .
- ^ Коттон, ЮАР (1997). Химия драгоценных металлов . Лондон: Чепмен и Холл. ISBN 0-7514-0413-6 .
- ^ Снайдер, Б.Б.; Кисельгоф, Ю.Я.; Фоксман, Б.М. (1998). «Полный синтез (±)-изостевиола и (±)-Бейера-15-ен-3β,19-диола путем окислительной четырехкратной свободнорадикальной циклизации на основе марганца (III)». Журнал органической химии . 63 (22): 7945–7952. дои : 10.1021/jo981238x .
- ^ Боззола, Джей-Джей; Рассел, Л.Д. (1999). «Подготовка образцов к просвечивающей электронной микроскопии» . Электронная микроскопия: принципы и методы для биологов . Садбери, Массачусетс: Джонс и Бартлетт. стр. 21–31. ISBN 978-0-7637-0192-5 .
- ^ Селигман, Арнольд М.; Вассеркруг, Ханна Л.; Хэнкер, Джейкоб С. (1 августа 1966 г.). «Новый метод окрашивания (ОТО) для усиления контрастности липидсодержащих мембран и капель в ткани, фиксированной тетроксидом осмия осмиофильным тиокарбогидразидом (ТСН)» . Журнал клеточной биологии . 30 (2): 424–432. дои : 10.1083/jcb.30.2.424 . ISSN 0021-9525 . ПМК 2106998 . ПМИД 4165523 .
- ^ Унгер, Анн-Катрин; Нойяр, Ральф; Хоуз, Крис; Хаммел, Эрик (2020), Вакер, Ирен; Хаммел, Эрик; Бургольд, Штеффен; Шредер, Расмус (ред.), «Улучшение серийной блочной SEM с помощью компенсации фокусного заряда», Объемная микроскопия: многомасштабная визуализация с фотонами, электронами и ионами , Neuromethods, vol. 155, Нью-Йорк, штат Нью-Йорк: Springer US, стр. 165–178, doi : 10.1007/978-1-0716-0691-9_9 , ISBN. 978-1-0716-0691-9 , S2CID 226563386
- ^ Тапиа, Хуан К.; Кастури, Нараянан; Хейворт, Кеннет; Шалек, Ричард; Лихтман, Джефф В.; Смит, Стивен Дж; Бьюкенен, Джоэнн (12 января 2012 г.). «Высококонтрастное блочное окрашивание нейрональной ткани для автоэмиссионной сканирующей электронной микроскопии» . Протоколы природы . 7 (2): 193–206. дои : 10.1038/nprot.2011.439 . ISSN 1754-2189 . ПМК 3701260 . ПМИД 22240582 .
- ^ Ди Сципион, Ф.; Раймондо, С.; Тос, П.; Геуна, С. (2008). «Простой протокол окрашивания залитой в парафин миелиновой оболочки оксидом осмия (VIII) для наблюдения под световым микроскопом». Микроскопические исследования и техника . 71 (7): 497–502. дои : 10.1002/jemt.20577 . ПМИД 18320578 . S2CID 9404999 .
- ^ Хокинс, Дж. М.; Мейер, А.; Льюис, штат Калифорния; Лорен, С.; Холландер, Ф.Дж. (1991). «Кристаллическая структура осмилированного C 60 : подтверждение каркаса футбольного мяча». Наука . 252 (5003): 312–313. Бибкод : 1991Sci...252..312H . дои : 10.1126/science.252.5003.312 . ПМИД 17769278 . S2CID 36255748 .
- ^ Шеппард, Х.; Диджей Уорд (1980). «Внутрисуставная осмиевая кислота при ревматоидном артрите: пятилетний опыт». Ревматология . 19 (1): 25–29. дои : 10.1093/ревматология/19.1.25 . ПМИД 7361025 .
Внешние ссылки [ править ]
- Международная карта химической безопасности 0528
- Карманный справочник NIOSH по химическим опасностям
- CDC — Тетроксид осмия — Тема NIOSH по безопасности и гигиене труда на рабочем месте
- Репортаж BBC о заговоре с взрывом
- Статья BBC «Что такое тетраоксид осмия»
- Тетроксид осмия: молекула месяца
- Химические реакции
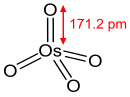


![{\displaystyle {\ce {Os + 2O2 ->[\Delta T] OsO4}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8d2c2ac06e64cd164869ed5506f13c3cfa320d70)