Радий
 | ||||||||||||||||||||||||||||||||||||
| Радий | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Произношение | / ˈ r eɪ d i ə m / | |||||||||||||||||||||||||||||||||||
| Появление | серебристо-белый металлик | |||||||||||||||||||||||||||||||||||
| Массовое число | [226] | |||||||||||||||||||||||||||||||||||
| Радий в таблице Менделеева | ||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||
| Атомный номер ( Z ) | 88 | |||||||||||||||||||||||||||||||||||
| Группа | группа 2 (щелочноземельные металлы) | |||||||||||||||||||||||||||||||||||
| Период | период 7 | |||||||||||||||||||||||||||||||||||
| Блокировать | S-блок | |||||||||||||||||||||||||||||||||||
| Электронная конфигурация | [ Рн ] 7 с 2 | |||||||||||||||||||||||||||||||||||
| Электроны на оболочку | 2, 8, 18, 32, 18, 8, 2 | |||||||||||||||||||||||||||||||||||
| Физические свойства | ||||||||||||||||||||||||||||||||||||
| Фаза в СТП | твердый | |||||||||||||||||||||||||||||||||||
| Температура плавления | 973 К (700 ° C, 1292 ° F) (оспаривается) | |||||||||||||||||||||||||||||||||||
| Точка кипения | 2010 К (1737 °С, 3159 °F) | |||||||||||||||||||||||||||||||||||
| Плотность (около комнатной температуры ) | 5,5 г/см 3 | |||||||||||||||||||||||||||||||||||
| Теплота плавления | 8,5 кДж/моль | |||||||||||||||||||||||||||||||||||
| Теплота испарения | 113 кДж/моль | |||||||||||||||||||||||||||||||||||
Давление пара
| ||||||||||||||||||||||||||||||||||||
| Атомные свойства | ||||||||||||||||||||||||||||||||||||
| Стадии окисления | +2 (ожидается, что это будет сильноосновный оксид ) | |||||||||||||||||||||||||||||||||||
| Электроотрицательность | Шкала Полинга: 0,9 | |||||||||||||||||||||||||||||||||||
| Энергии ионизации |
| |||||||||||||||||||||||||||||||||||
| Ковалентный радиус | 221±14: 00 | |||||||||||||||||||||||||||||||||||
| Радиус Ван-дер-Ваальса | 283 вечера | |||||||||||||||||||||||||||||||||||
| Другие объекты недвижимости | ||||||||||||||||||||||||||||||||||||
| Естественное явление | от распада | |||||||||||||||||||||||||||||||||||
| Кристаллическая структура | объемноцентрированная кубическая (bcc) ( cF4 ) | |||||||||||||||||||||||||||||||||||
| Постоянная решетки | а = 17:14,8 (около RT ) [1] | |||||||||||||||||||||||||||||||||||
| Теплопроводность | 18,6 Вт/(м⋅К) | |||||||||||||||||||||||||||||||||||
| Электрическое сопротивление | 1 мкОм⋅м (при 20 °C) | |||||||||||||||||||||||||||||||||||
| Магнитный заказ | немагнитный | |||||||||||||||||||||||||||||||||||
| Номер CAS | 7440-14-4 | |||||||||||||||||||||||||||||||||||
| История | ||||||||||||||||||||||||||||||||||||
| Открытие | Пьер и Мария Кюри (1898 г.) | |||||||||||||||||||||||||||||||||||
| Первая изоляция | Мария Кюри (1910) | |||||||||||||||||||||||||||||||||||
| Изотопы радия | ||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||

Активность 3300 Бк (3,3 кБк)
Радий — химический элемент ; он имеет символ Ra и атомный номер 88. Это шестой элемент во второй группе периодической таблицы , также известный как щелочноземельные металлы . Чистый радий имеет серебристо-белый цвет, но на воздухе он легко вступает в реакцию с азотом (а не с кислородом), образуя черный поверхностный слой нитрида радия (Ra 3 N 2 ). Все изотопы радия радиоактивны , наиболее стабильным изотопом является радий-226 с периодом полураспада 1600 лет. Когда радий распадается, он испускает ионизирующее излучение в качестве побочного продукта, которое может возбуждать флуоресцентные химические вещества и вызывать радиолюминесценцию .
Радий в форме хлорида радия был обнаружен Марией в 1898 году из руды , и Пьером Кюри добытой в Яхимове . Они извлекли соединение радия из уранинита и пять дней спустя опубликовали свое открытие во Французской академии наук . Радий был выделен в металлическом состоянии Марией Кюри и Андре-Луи Дебьерном путем электролиза хлорида радия в 1911 году. [3]
В природе радий встречается в урановых и (в меньшей степени) ториевых рудах в следовых количествах — всего лишь седьмую часть грамма на тонну уранинита. Радий не является необходимым для живых организмов , а его радиоактивность и химическая реактивность делают вероятными неблагоприятные последствия для здоровья, когда он включается в биохимические процессы из-за его химического сходства с кальцием . По состоянию на 2014 год [update], other than its use in nuclear medicine, radium has no commercial applications. Formerly, from the 1910s to the 1970s, it was used as a radioactive source for radioluminescent devices and also in radioactive quackery for its supposed curative power. These applications have become obsolete owing to radium's toxicity; as of 2020[update]Вместо этого в радиолюминесцентных устройствах используются менее опасные изотопы (других элементов).
Массовые свойства
Радий — самый тяжелый из известных щелочноземельных металлов и единственный радиоактивный член своей группы. Его физические и химические свойства наиболее близки к его более легкому родственнику - барию . [4] (стр. 112)
Чистый радий — летучий серебристо-белый металл, хотя его более легкие родственники кальций , стронций и барий имеют легкий желтый оттенок. [4] (стр. 112) Этот оттенок быстро исчезает на воздухе, образуя черный слой, вероятно, нитрида радия (Ra 3 N 2 ). [5] (стр. 4) Его температура плавления составляет 700 ° C (1292 ° F) или 960 ° C (1760 ° F). [а] а его температура кипения составляет 1737 ° C (3159 ° F); однако это не совсем установлено. [6] Оба эти значения немного ниже, чем у бария, что подтверждает периодические тенденции к снижению элементов группы 2. [7] Подобно барию и щелочным металлам , радий кристаллизуется в объемно-центрированной кубической структуре при стандартной температуре и давлении : расстояние связи радий-радий составляет 514,8 пикометров . [8] Радий имеет плотность 5,5 г/см. 3 , выше, чем у бария, что еще раз подтверждает периодические тенденции; соотношение плотностей радия и бария сравнимо с отношением атомных масс радия и бария, [9] из-за схожей кристаллической структуры двух элементов. [9] [10]
изотопы
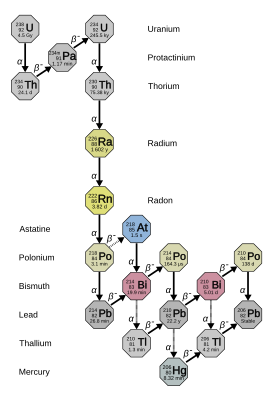
Радий имеет 33 известных изотопа с массовыми числами от 202 до 234: все они радиоактивны . [2] Четыре из них – 223 Ра ( период полураспада 11,4 дня), 224 Ра (3,64 дня), 226 Ра (1600 лет) и 228 Ra (5,75 лет) – встречаются в природе в цепочках распада первичного тория-232 , урана-235 и урана-238 ( 223 Ра из урана-235, 226 Ra из урана-238, а два других из тория-232). Тем не менее, эти изотопы все еще имеют период полураспада, слишком короткий, чтобы быть первичными радионуклидами , и существуют в природе только в результате этих цепочек распада. [5] (стр. 3) Вместе с преимущественно искусственными 225 Ra (15 d), который встречается в природе только как продукт распада мельчайших следов нептуния-237 , [11] это пять наиболее стабильных изотопов радия. [2] Все остальные 27 известных изотопов радия имеют период полураспада менее двух часов, а у большинства - менее минуты. [2] Из них 221 Ra (период полураспада 28 с) также встречается в виде 237 Нп дочь, и 220 Ра и 222 Ра будет производиться в результате до сих пор ненаблюдаемого двойного бета-распада природных изотопов радона. [12] как минимум о 12 ядерных изомерах Сообщалось ; наиболее стабильным из них является радий-205m с периодом полураспада 130–230 миллисекунд; это все еще короче, чем двадцать четыре изотопа радия в основном состоянии . [2]
На заре изучения радиоактивности различным природным изотопам радия давали разные названия. В этой схеме 223 Ра был назван актинием X (AcX), 224 Ра торий X (ThX), 226 Ра радий (Ra) и 228 Ra мезоторий 1 (MsTh 1 ). [5] (стр. 3) Когда стало понятно, что все это изотопы одного и того же элемента, многие из этих названий вышли из употребления, и слово «радий» стало обозначать все изотопы, а не только 226 Ра. Некоторые продукты распада радия-226 получили исторические названия, включая «радий», от радия А до радия G , причем буква примерно указывает, насколько далеко они находились по цепочке от своего родителя. 226 Ra: Эманация радия = 222 Rn, Ra А = 218 Ночь, Ра Б = 214 Pb, Ra C = 214 Би, Ра С 1 = 214 Ночь, Ра C 2 = 210 Тл, Ра Д = 210 Pb, Ra E = 210 Би, Ра F = 210 Po и Ra G = 206 Пб. [13]
226 Ra — наиболее стабильный изотоп радия и последний изотоп в цепи распада (4 n + 2) урана-238 с периодом полураспада более тысячелетия: он составляет почти весь природный радий. Его непосредственным продуктом распада является плотный радиоактивный благородный газ радон (в частности, изотоп 222 Rn ), который несет ответственность за большую часть опасности радия для окружающей среды. [14] Он в 2,7 миллиона раз более радиоактивен, чем такое же молярное количество природного урана (в основном урана-238), из-за его пропорционально более короткого периода полураспада. [15] [16]
Образец металлического радия поддерживает более высокую температуру, чем окружающая его среда, из-за испускаемого им излучения — альфа-частиц , бета-частиц и гамма-лучей . Точнее, природный радий (который в основном представляет собой 226 Ra) испускает в основном альфа-частицы, но другие ступени его цепочки распада ( ряды урана или радия ) испускают альфа- или бета-частицы, причем почти все выбросы частиц сопровождаются гамма-лучами. [17]
Экспериментальные исследования ядерной физики показали, что ядра некоторых изотопов радия, таких как 222 Солнце, 224 Ра и 226 Ра имеют отражательно-асимметричную («грушевидную») форму. [18] В частности, эта экспериментальная информация по радию-224был получен в ISOLDE , CERN, с использованием метода, называемого кулоновским возбуждением . [19] [20]
Химия
Радий, как и барий, является высокореактивным металлом и всегда имеет степень группового окисления +2. [5] (стр. 4) Образует бесцветный Ра. 2+ катион в водном растворе , который является высокоосновным и с трудом образует комплексы . [5] (стр. 4) Таким образом, большинство соединений радия представляют собой простые ионные соединения. [5] (стр. 4) хотя участие электронов 6s и 6p (в дополнение к валентным электронам 7s) ожидается из-за релятивистских эффектов и усилит ковалентный характер соединений радия, таких как Ra F 2 и Ra At 2 . [21] По этой причине стандартный электродный потенциал полуреакции Ra 2+ (вод) + 2е − → Ra (s) составляет -2,916 В , что даже немного ниже значения -2,92 В для бария, тогда как ранее значения плавно увеличивались вниз по группе (Ca: -2,84 В; Sr: -2,89 В; Ba: -2,92 В). ). [4] (стр. 111) Значения бария и радия почти такие же, как и для более тяжелых щелочных металлов калия , рубидия и цезия . [4] (стр. 111)
Соединения
Твердые соединения радия имеют белый цвет, поскольку ионы радия не дают специфической окраски, но они постепенно желтеют, а затем темнеют со временем из-за саморадиолиза в результате альфа радия -распада . [5] (стр. 4) Нерастворимые соединения радия соосаждаются со всеми соединениями бария, большинства стронция и большинства соединений свинца . [5] (стр. 8)
Оксид радия (RaO) не был охарактеризован задолго до его существования, несмотря на то, что оксиды являются обычными соединениями для других щелочноземельных металлов. Гидроксид радия (Ra(OH) 2 ) наиболее легко растворим среди гидроксидов щелочноземельных металлов и является более сильным основанием, чем его родственник бария, гидроксид бария . [5] (стр. 4–8) Он также более растворим, чем гидроксид актиния и гидроксид тория : эти три соседних гидроксида можно разделить, осаждая их аммиаком . [5] (стр. 4–8)
Хлорид радия (RaCl 2 ) — бесцветное светящееся соединение. Через некоторое время он становится желтым из-за самоповреждения альфа-излучением, выделяемым радием при его распаде. Небольшие количества примесей бария придают соединению розовый цвет. [5] (стр. 4–8) Он растворим в воде, хотя и в меньшей степени, чем хлорид бария , и его растворимость снижается с увеличением концентрации соляной кислоты . Кристаллизация из водного раствора дает дигидрат RaCl 2 ·2H 2 O, изоморфный своему бариевому аналогу. [5] (стр. 4–8)
Бромид радия (RaBr 2 ) также представляет собой бесцветное светящееся соединение. [5] (стр. 4–8) В воде он более растворим, чем хлорид радия. Как и хлорид радия, при кристаллизации из водного раствора образуется дигидрат RaBr 2 ·2H 2 O, изоморфный своему бариевому аналогу. Ионизирующее излучение, испускаемое бромидом радия, возбуждает молекулы азота в воздухе, заставляя его светиться. Альфа -частицы, испускаемые радием, быстро приобретают два электрона и становятся нейтральным гелием , который накапливается внутри и ослабляет кристаллы бромида радия. Этот эффект иногда приводит к тому, что кристаллы ломаются или даже взрываются. [5] (стр. 4–8)
Нитрат радия (Ra(NO 3 ) 2 ) представляет собой белое соединение, которое можно получить растворением карбоната радия в азотной кислоте . С увеличением концентрации азотной кислоты снижается растворимость нитрата радия, что является важным свойством химической очистки радия. [5] (стр. 4–8)
Радий образует почти те же нерастворимые соли, что и его более легкий родственник барий: он образует нерастворимый сульфат (RaSO 4 , наиболее нерастворимый из известных сульфатов), хромат (RaCrO 4 ), карбонат (RaCO 3 ), иодат (Ra(IO 3 ) 2 ). , тетрафторбериллат (RaBeF 4 ) и нитрат (Ra(NO 3 ) 2 ). За исключением карбоната, все они менее растворимы в воде, чем соответствующие соли бария, но все они изоструктурны своим аналогам бария. Кроме того, фосфат радия , оксалат и сульфит , вероятно, также нерастворимы, поскольку они соосаждаются с соответствующими нерастворимыми солями бария. [5] (стр. 8–9) Большая нерастворимость сульфата радия (при 20 °C только 2,1 мг воды растворяется в 1 кг ) означает, что это одно из наименее биологически опасных соединений радия. [5] (стр. 12) Большой ионный радиус Ra 2+ (148 часов вечера) приводит к слабому комплексообразованию и плохой экстракции радия из водных растворов, если pH не высок. [22]
Возникновение
Период полураспада всех изотопов радия намного короче возраста Земли , так что любой первичный радий давно бы распался. Тем не менее радий все еще встречается в окружающей среде , поскольку его изотопы 223 Солнце, 224 Солнце, 226 Ра и 228 Ra являются частью цепочек распада природных изотопов тория и урана; поскольку торий и уран имеют очень длительный период полураспада, эти дочерние элементы постоянно регенерируются в результате своего распада. [5] (стр. 3) Из этих четырех изотопов самый долгоживущий — 226 Ра (период полураспада 1600 лет), продукт распада природного урана. Благодаря своей относительной долговечности, 226 Ra — наиболее распространенный изотоп элемента, составляющий около одной части на триллион земной коры; практически весь природный радий 226 Солнце. [4] (стр. 109–110) Так, радий в ничтожных количествах содержится в урановой руде, уранинете и различных других урановых минералах , а еще в меньших количествах — в ториевых минералах. Одна тонна настурана обычно дает около одной седьмой грамма радия. [23] В одном килограмме земной коры содержится около 900 пикограммов радия, а в одном литре морской воды — около 89 фемтограммов радия. [24]
История


Радий был открыт Марией Склодовской-Кюри и ее мужем Пьером Кюри 21 декабря 1898 года в образце уранинита (натурала) из Яхимова . [25] Ранее, изучая минерал, Кюри удалили из него уран и обнаружили, что оставшийся материал все еще радиоактивен. В июле 1898 года, изучая настуран, они выделили элемент, аналогичный висмуту , которым оказался полоний . Затем они выделили радиоактивную смесь, состоящую из двух компонентов: соединений бария , которые давали ярко-зеленый цвет пламени, и неизвестных радиоактивных соединений, которые давали карминные спектральные линии , которые ранее никогда не были документированы. Кюри обнаружили, что радиоактивные соединения очень похожи на соединения бария, за исключением того, что они менее растворимы. Это открытие позволило семье Кюри выделить радиоактивные соединения и открыть в них новый элемент. Семья Кюри объявила о своем открытии Французской академии наук 26 декабря 1898 года. [26] [27] Название радия датируется примерно 1899 годом, от французского слова radium , образованного в современной латыни от радиуса ( луч ): это было признание способности радия излучать энергию в виде лучей. [28] [29] [30]
В сентябре 1910 года Мария Кюри и Андре-Луи Дебьерн объявили, что они выделили радий в виде чистого металла посредством электролиза чистого раствора хлорида радия (RaCl 2 ) с использованием ртутного катода , получив амальгаму радия и ртути . [31] Затем эту амальгаму нагревали в атмосфере газообразного водорода , чтобы удалить ртуть, оставив чистый металлический радий. [32] Позже в том же году Э. Эолер выделил радий путем термического разложения его азида Ra(N 3 ) 2 . [5] (стр. 3) Металлический радий был впервые промышленно произведен в начале 20-го века компанией Biraco , дочерней компанией Union Minière du Haut Katanga (UMHK) на ее заводе в Олене в Бельгии. [33]
Общая историческая единица радиоактивности — кюри — основана на радиоактивности 226 Ra: первоначально его определяли как радиоактивность одного грамма радия-226. [34] но позже это определение было немного уточнено и стало 3,7 × 10. 10 распада в секунду .
Исторические приложения
Люминесцентная краска

Раньше радий использовался в самосветящихся красках для часов, ядерных панелей, переключателей самолетов, часов и циферблатов приборов. Типичные самосветящиеся часы, в которых используется радиевая краска, содержат около 1 микрограмма радия. [35] В середине 1920-х годов против Радиевой корпорации США был подан иск пятью умирающими « Радиевыми девушками » — малярами по циферблатам, которые наносили люминесцентную краску на основе радия на циферблаты часов. Художникам по циферблату было приказано облизывать кисти, чтобы придать им остроту, тем самым проглатывая радий. [36] Воздействие радия вызвало серьезные последствия для здоровья, включая язвы, анемию и рак костей . [14]
В ходе судебного разбирательства было установлено, что ученые и руководство компании приняли значительные меры предосторожности, чтобы защитить себя от воздействия радиации, но, судя по всему, это не защитило их сотрудников. Кроме того, в течение нескольких лет компании пытались скрыть последствия и избежать ответственности, настаивая на том, что «Радиевые девушки» вместо этого страдали от сифилиса . Это полное игнорирование благосостояния работников оказало существенное влияние на формулировку о профессиональных заболеваниях трудового законодательства . [37]
В результате судебного процесса о вредном воздействии радиоактивности стало широко известно, а маляры, работающие с радиевыми циферблатами, были проинструктированы о надлежащих мерах предосторожности и обеспечены защитным снаряжением. В частности, художники по циферблату больше не облизывали кисти, чтобы придать им форму (что приводило к проглатыванию солей радия). Радий все еще использовался в циферблатах даже в 1960-х годах, но художники по циферблату больше не получали травм. Это подчеркнуло, что вреда «Радиевым девочкам» можно было легко избежать. [38]
С 1960-х годов использование радиевой краски было прекращено. Во многих случаях светящиеся циферблаты изготавливались из нерадиоактивных флуоресцентных материалов, возбуждаемых светом; такие устройства светятся в темноте после воздействия света, но свечение тускнеет. [14] Там, где требовалось длительное самосветление в темноте, применялась более безопасная радиоактивная краска прометия -147 (период полураспада 2,6 года) или трития (период полураспада 12 лет); оба продолжают использоваться с 2004 года. [39] Их дополнительное преимущество заключалось в том, что люминофор не разрушался с течением времени, в отличие от радия. [40] очень низкой энергии Тритий излучает бета-излучение (даже более низкой энергии, чем бета-излучение, испускаемое прометием). [41] которые не могут проникнуть через кожу, [42] а не проникающее гамма-излучение радия, и считается более безопасным. [43]
Часы, часы и инструменты первой половины 20-го века, часто использовавшиеся в военных целях, возможно, были окрашены радиоактивной люминесцентной краской. Обычно они больше не светятся; однако это происходит не из-за радиоактивного распада радия (период полураспада которого составляет 1600 лет), а из-за флуоресценции флуоресцентной среды из сульфида цинка, изнашиваемой излучением радия. [44] Появление часто толстого слоя зеленой или желтовато-коричневой краски на устройствах этого периода предполагает радиоактивную опасность. Доза радиации от неповрежденного устройства относительно невелика и обычно не представляет серьезного риска; но краска опасна при попадании в организм, вдыхании или проглатывании. [6] [45]
Коммерческое использование
Радий когда-то был добавкой в таких продуктах, как зубная паста, кремы для волос и даже продукты питания, из-за его предполагаемых лечебных свойств. [46] Такие продукты вскоре вышли из моды и были запрещены властями многих стран после того, как было обнаружено, что они могут иметь серьезные неблагоприятные последствия для здоровья. (См., например, типы Radithor или Revigator для «радиевой воды» или «Стандартного питьевого раствора радия».) [44] Курорты с водой, богатой радием, до сих пор иногда рекламируются как полезные, например, в Мисасе, Тоттори , Япония. В США с конца 1940-х по начало 1970-х годов детям также проводилось назальное облучение радием для предотвращения проблем среднего уха или увеличения миндалин. [47]
Медицинское использование

Радий (обычно в форме хлорида или бромида радия ) использовался в медицине для производства газообразного радона, который, в свою очередь, использовался для лечения рака ; например, несколько из этих источников радона использовались в Канаде в 1920-х и 1930-х годах. [6] [48] Однако многие методы лечения, которые использовались в начале 1900-х годов, больше не используются из-за вредных последствий воздействия бромида радия. Некоторыми примерами этих эффектов являются анемия , рак и генетические мутации . [49] По состоянию на 2011 год [update], более безопасные гамма-излучатели, такие как 60 Co , который дешевле и доступен в больших количествах, обычно используется для замены традиционно используемого радия в этом применении. [22]
В начале 1900-х годов биологи использовали радий для индукции мутаций и изучения генетики . Еще в 1904 году Дэниел Макдугал использовал радий, пытаясь определить, может ли он спровоцировать внезапные крупные мутации и вызвать серьезные эволюционные сдвиги. Томас Хант Морган использовал радий, чтобы вызвать изменения, приводящие к появлению белоглазых плодовых мух.Лауреат Нобелевской премии по биологии Герман Мюллер кратко изучил влияние радия на мутации плодовых мух, прежде чем перейти к более доступным рентгеновским экспериментам. [50]
Говард Этвуд Келли , один из врачей-основателей больницы Джонса Хопкинса , был крупным пионером в медицинском использовании радия для лечения рака. [51] Его первым пациентом стала его собственная тетя в 1904 году, которая умерла вскоре после операции. [52] Известно, что Келли использовал чрезмерное количество радия для лечения различных видов рака и опухолей. В результате некоторые из его пациентов умерли от воздействия радия. [53] Его метод применения радия заключался в введении капсулы с радием рядом с пораженным участком, а затем пришивании радиевых «точек» непосредственно к опухоли . [53] Это был тот же метод, который использовался для лечения Лакс , хозяина оригинальных клеток HeLa Генриетты рака шейки матки . [54] С 2015 года вместо них используются более безопасные и доступные радиоизотопы. [14]
Производство

В конце 19 века уран не имел крупномасштабного применения, и поэтому не существовало крупных урановых рудников. Вначале единственным крупным источником урановой руды были серебряные рудники в Яхимове , Австро-Венгрия (ныне Чехия ). [25] Урановая руда была лишь побочным продуктом горнодобывающей деятельности. [55]
При первом извлечении радия Кюри использовал остатки после извлечения урана из настурана. Уран извлекли растворением в серной кислоте , в результате чего остался сульфат радия, аналогичный сульфату бария , но еще менее растворимый в остатках. Остатки также содержали довольно значительные количества сульфата бария, который, таким образом, выступал в качестве носителя сульфата радия. Первые этапы процесса экстракции радия включали кипячение с гидроксидом натрия с последующей обработкой соляной кислотой для минимизации примесей других соединений. Оставшийся остаток затем обрабатывали карбонатом натрия, чтобы превратить сульфат бария в карбонат бария (несущий радий), что сделало его растворимым в соляной кислоте. После растворения барий и радий переосаждались в виде сульфатов; затем это повторяли для дальнейшей очистки смешанного сульфата. Некоторые примеси, образующие нерастворимые сульфиды, удаляли обработкой раствора хлорида сероводородом с последующим фильтрованием. Когда смешанные сульфаты стали достаточно чистыми, их снова превратили в смешанные хлориды; после этого барий и радий разделяли фракционная кристаллизация при контроле за ходом с помощью спектроскопа (радий дает характерные красные линии в отличие от зеленых линий бария) и электроскопа . [56]
После выделения радия Марией и Пьером Кюри из урановой руды Яхимова несколько ученых начали выделять радий в небольших количествах. Позже небольшие компании приобрели хвосты яхимовских рудников и начали выделять радий. В 1904 году австрийское правительство национализировало рудники и прекратило экспорт сырой руды. До 1912 года, когда производство радия увеличилось, доступность радия была низкой. [55]
Образование австрийской монополии и сильное стремление других стран получить доступ к радию привели к поиску урановых руд по всему миру. Соединенные Штаты стали ведущим производителем в начале 1910-х годов. Карнотитовые на северо - пески в Колорадо обеспечивают некоторую часть этого элемента, но более богатые руды встречаются в Конго и в районе Большого Медвежьего и Большого Невольничьего озер западе Канады. Ни одно из месторождений не занимается добычей радия, но содержание урана делает добычу прибыльной. [25] [57]
Процесс Кюри все еще использовался для промышленного извлечения радия в 1940 году, но затем для фракционирования использовались смешанные бромиды. Если содержание бария в урановой руде недостаточно велико, легко добавить его для переноса радия. Эти процессы применялись к высокосортным урановым рудам, но могут неэффективно работать с низкосортными рудами. [58]
Небольшие количества радия все еще извлекались из урановой руды этим методом смешанного осаждения и ионного обмена даже в 1990-х годах. [4] (стр. 109–110) но по состоянию на 2011 год их извлекают только из отработанного ядерного топлива. [44] (стр. 437) В 1954 году общий мировой запас очищенного радия составил около 5 фунтов (2,3 кг). [35] и в 2015 году оно все еще находится в этом диапазоне, тогда как годовое производство чистых соединений радия по состоянию на 1984 год составляет всего около 100 г. [4] (стр. 109–110) Основными странами-производителями радия являются Бельгия, Канада, Чехия, Словакия, Великобритания и Россия. [4] (стр. 109–110) Количества произведенного радия были и всегда остаются относительно небольшими; например, в 1918 году в США было произведено 13,6 г радия. [59] Металл выделяют восстановлением оксида радия металлическим алюминием в вакууме при температуре 1200 °С. [22]
Современные приложения
Радий находит все более широкое применение в области атомной, молекулярной и оптической физики . Масштаб разрушающих сил симметрии пропорционален [60] [61] что делает радий, самый тяжелый щелочноземельный элемент, хорошо подходящим для ограничения новой физики за пределами стандартной модели . Некоторые изотопы радия, такие как радий-225, имеют октупольно- деформированные дублеты четности, которые повышают чувствительность к зарядовой четности, нарушая новую физику, на два-три порядка по сравнению с изотопами радия. 199 рт. ст. [62] [63] [64]
Радий также является многообещающим кандидатом в качестве оптических часов с захваченными ионами . Ион радия имеет два перехода субгерцовой ширины линии от основное состояние, которое могло бы служить тактовым переходом в оптических часах. [65] А 226 Атомные часы с захваченными ионами Ra+ были продемонстрированы на к переход. [66] Кроме того, радий особенно хорошо подходит для портативных оптических часов, поскольку все переходы, необходимые для работы часов, могут быть решены с помощью диодных лазеров прямого действия на обычных длинах волн.
Некоторые из немногих практических применений радия обусловлены его радиоактивными свойствами. Недавно обнаруженные радиоизотопы , такие как кобальт-60 и цезий-137 , заменяют радий даже в этих ограниченных применениях, поскольку некоторые из этих изотопов являются более мощными излучателями, с ними безопаснее обращаться и они доступны в более концентрированной форме. [67] [68]
Изотоп 223 Ра (хлорид имеет торговое название Ксофиго ) [69] США был одобрен Управлением по контролю за продуктами и лекарствами в 2013 году для использования в медицине для лечения рака с метастазами в кости . [70] [71] Основным показанием к лечению Ксофиго является терапия костных метастазов кастрационно-резистентного рака предстательной железы в связи с благоприятными характеристиками этого радиофармпрепарата с альфа-излучателем. [72] 225 Ra также использовался в экспериментах по терапевтическому облучению, поскольку это единственный достаточно долгоживущий изотоп радия, одним из дочерних элементов которого является радон. [73]
В 2007 году радий до сих пор используется в качестве источника излучения в некоторых промышленных рентгенографических устройствах для проверки наличия дефектов в металлических деталях, аналогично рентгеновским изображениям . [14] В смеси с бериллием радий действует как источник нейтронов . [44] [74] По состоянию на 2004 год [update], до сих пор иногда используются радий-бериллиевые источники нейтронов, [14] [75] но более распространены другие материалы, такие как полоний ежегодно используется около 1500 полоний-бериллиевых источников нейтронов с индивидуальной активностью 1850 Ки (68 ТБк) : в России . Эти источники нейтронов на основе RaBeF 4 (α, n) устарели, несмотря на большое количество испускаемых ими нейтронов (1,84×10 6 нейтронов в секунду) в пользу 241 Am –Be. Источники [22] По состоянию на 2011 год [update], изотоп 226 Ра в основном используется для образования 227 Ac при нейтронном облучении в ядерном реакторе. [22]
Опасности
Радий очень радиоактивен, как и его непосредственный продукт распада — газ радон . При попадании в организм 80% поступившего радия покидает организм через фекалии , а остальные 20% попадают в кровоток , накапливаясь в основном в костях. Это происходит потому, что организм воспринимает радий как кальций и откладывает его в костях , где радиоактивность разрушает костный мозг и может мутировать костные клетки . Воздействие радия, внутреннее или внешнее, может вызвать рак и другие заболевания, поскольку радий и радон испускают альфа- и гамма-лучи , которые убивают и мутируют клетки. при своем распаде [14] Во время Манхэттенского проекта в 1944 году «толерантная доза» для рабочих была установлена на уровне 0,1 микрограмма принятого радия. [76] [77]
Некоторые из биологических эффектов радия включают первый случай «радиевого дерматита», зарегистрированный в 1900 году, через два года после открытия этого элемента. Французский физик Антуан Беккерель шесть часов носил в кармане жилета небольшую ампулу радия и сообщил, что на его коже появились язвы . Пьер и Мария Кюри были настолько заинтригованы радиацией, что пожертвовали своим здоровьем, чтобы узнать о ней больше. Пьер Кюри прикрепил к своей руке трубку, наполненную радием, на десять часов, что привело к появлению повреждения кожи, что позволяет предположить использование радия для поражения раковых тканей так же, как он поражал здоровые ткани. [78] обвиняют обращение с радием В смерти Марии Кюри от апластической анемии . Значительная часть опасности радия исходит от его дочернего радона: будучи газом, он может проникать в организм гораздо легче, чем его родительский радий. [14]
По состоянию на 2015 год [update], 226 Ра считается наиболее токсичным из всех радиоэлементов, и с ним необходимо обращаться в герметичных перчаточных боксах со значительной циркуляцией воздушного потока, который затем обрабатывают, чтобы избежать утечки его дочернего элемента. 222 Rn в окружающую среду. Старые ампулы, содержащие растворы радия, следует открывать с осторожностью, поскольку радиолитическое разложение воды может привести к избыточному давлению газообразных водорода и кислорода. [22] Самая большая в мире концентрация 226 Ра хранится во временной конструкции для хранения отходов , примерно в 9,6 миль (15,4 км) к северу от Ниагарского водопада, штат Нью-Йорк . [79] Максимальный уровень загрязнения (MCL) радия составляет 5 пКи/л для питьевой воды, однако OSHA не устанавливает предел воздействия, поскольку уже установлен предел радиации. [80]
См. также
Примечания
Ссылки
- ^ Арбластер, Джон В. (2018). Некоторые значения кристаллографических свойств элементов . Парк материалов, Огайо: ASM International. ISBN 978-1-62708-155-9 .
- ^ Jump up to: Перейти обратно: а б с д и Кондев, ФГ; Ван, М.; Хуанг, WJ; Наими, С.; Ауди, Г. (2021). «Оценка ядерных свойств NUBASE2020» (PDF) . Китайская физика C . 45 (3): 030001. doi : 10.1088/1674-1137/abddae .
- ^ «Радий» . Элементы / Таблица Менделеева. rsc.org . Королевское химическое общество . Архивировано из оригинала 24 марта 2016 года . Проверено 5 июля 2016 г.
- ^ Jump up to: Перейти обратно: а б с д и ж г час
Гринвуд, Нью-Йорк ; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн. ISBN 978-0-08-037941-8 . - ^ Jump up to: Перейти обратно: а б с д и ж г час я дж к л м н тот п д р с т
Кирби, Х.В. и Салуцкий, Мюррелл Л. (декабрь 1964b). Радиохимия радия (Доклад). кредитование библиотек UNT, Департамент правительственных документов – через Университет Северного Техаса , Цифровую библиотеку UNT.- альтернативный источник
- ^ Jump up to: Перейти обратно: а б с «Радий» . Британская энциклопедия . Архивировано из оригинала 15 июня 2013 года.
- ^ Лиде, ДР; и др., ред. (2004). Справочник CRC по химии и физике (84-е изд.). Бока-Ратон, Флорида: CRC Press. ISBN 978-0-8493-0484-2 .
- ^ Вейгель, Ф.; Тринкль, А. (1968). «Zur Kristallchemie des Radiums» [О химической кристаллографии радия]. Радиохим. Акта (на немецком языке). 10 (1–2): 78. doi : 10.1524/ract.1968.10.12.78 . S2CID 100313675 .
- ^ Jump up to: Перейти обратно: а б Янг, Дэвид А. (1991). «Радий» . Фазовые диаграммы элементов . Издательство Калифорнийского университета. п. 85. ИСБН 978-0-520-91148-2 .
- ^ «Кристаллические структуры химических элементов при давлении 1 бар» . uni-bielefeld.de . Архивировано из оригинала 26 августа 2014 года.
- ^ Пеппард, Д.Ф.; Мейсон, GW; Грей, PR; Мех, Дж. Ф. (1952). «Возникновение ряда (4 n + 1) в природе» . Журнал Американского химического общества . 74 (23): 6081–6084. дои : 10.1021/ja01143a074 . Архивировано из оригинала 28 июля 2019 года . Проверено 6 июля 2019 г.
- ^ Третьяк, В.И.; Здесенко, Ю.Г. (2002). «Таблицы данных двойного бета-распада — обновление». В. Данные Нукл. Таблицы данных . 80 (1): 83–116. Бибкод : 2002ADNDT..80...83T . дои : 10.1006/доп.2001.0873 .
- ^ Кун, В. (1929). «LXVIII. Рассеяние тория C , γ-излучения радием G и обычным свинцом». The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science . 8 (52): 628. doi : 10.1080/14786441108564923 . ISSN 1941-5982. .
- ^ Jump up to: Перейти обратно: а б с д и ж г час
Радиационная защита . Радий. epa.gov (отчет). Радиация / Радионуклиды. Агентство по охране окружающей среды США . Архивировано из оригинала 11 февраля 2015 года. - ^ Содди, Фредерик (25 августа 2004 г.). Интерпретация радия . Курьерская корпорация. п. 139 и далее. ISBN 978-0-486-43877-1 . Архивировано из оригинала 5 сентября 2015 года . Проверено 27 июня 2015 г. - через Google Книги.
- ^ Мэлли, Марджори К. (2011). Радиоактивность . Издательство Оксфордского университета. п. 115 и далее . ISBN 978-0-19-983178-4 . Проверено 27 июня 2015 г. - из Интернет-архива (archive.org).
- ^ Стратт, Р.Дж. (7 сентября 2004 г.). Лучи Беккереля и свойства радия . Курьерская корпорация. п. 133. ИСБН 978-0-486-43875-7 . Архивировано из оригинала 5 сентября 2015 года . Проверено 27 июня 2015 г.
- ^ Батлер, Пенсильвания (2020). «Атомные ядра грушевидной формы» . Труды Королевского общества А. 476 (2239): 20200202. Бибкод : 2020RSPSA.47600202B . дои : 10.1098/rspa.2020.0202 . ПМЦ 7426035 . ПМИД 32821242 . .
- ^ «Первые наблюдения короткоживущих атомных ядер грушевидной формы – ЦЕРН» . дом.церн . Архивировано из оригинала 12 июня 2018 года . Проверено 8 июня 2018 г.
- ^ Гаффни, LP; Батлер, Пенсильвания; Шек, М.; и др. (2013). «Исследование грушевидных ядер с помощью ускоренных радиоактивных пучков» . Природа . 497 (7448): 199–204. Бибкод : 2013Natur.497..199G . дои : 10.1038/nature12073 . ПМИД 23657348 . S2CID 4380776 .
- ^ Тайер, Джон С. (2010). «Релятивистские эффекты и химия более тяжелых элементов основной группы». Релятивистские методы для химиков . Проблемы и достижения в области вычислительной химии и физики. Том. 10. с. 81. дои : 10.1007/978-1-4020-9975-5_2 . ISBN 978-1-4020-9974-8 .
- ^ Jump up to: Перейти обратно: а б с д и ж
Келлер, Корнелиус; Вольф, Уолтер; Шани, Джашовам. «Радионуклиды. 2. Радиоактивные элементы и искусственные радионуклиды». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. стр. 97–98. дои : 10.1002/14356007.o22_o15 . ISBN 978-3527306732 . - ^ «Радий». Архивировано 15 ноября 2012 года в Wayback Machine , Национальная лаборатория Лос-Аламоса. Проверено 5 августа 2009 г.
- ^ Раздел 14, Геофизика, астрономия и акустика; Изобилие элементов в земной коре и в море, Лиде, Дэвид Р. (редактор), Справочник CRC по химии и физике , 85-е издание . ЦРК Пресс. Бока-Ратон, Флорида (2005 г.).
- ^ Jump up to: Перейти обратно: а б с Хаммонд, ЦР «Радий» в Хейнс, Уильям М., изд. (2011). Справочник CRC по химии и физике (92-е изд.). Бока-Ратон, Флорида: CRC Press . ISBN 1-4398-5511-0 .
- ^ Кюри, Пьер; Кюри, Мари и Бемон, Гюстав (1898). «О новом сильнорадиоактивном веществе, содержащемся в настуране» . Отчеты . 127 : 1215–1217. Архивировано из оригинала 6 августа 2009 года . Проверено 1 августа 2009 г.
- ^ Уикс, Мария Эльвира (1933). «Открытие элементов. XIX. Радиоактивные элементы». Журнал химического образования . 10 (2): 79. Бибкод : 1933ЖЧЭд..10...79Вт . дои : 10.1021/ed010p79 .
- ^ Болл, Дэвид В. (1985). «Элементарная этимология: что в имени?». Журнал химического образования . 62 (9): 787–788. Бибкод : 1985JChEd..62..787B . дои : 10.1021/ed062p787 .
- ^ Карвалью, Фернандо П. (2011). «Мария Кюри и открытие радия». Новый бум добычи урана . Спрингер Геология. стр. 3–13. дои : 10.1007/978-3-642-22122-4_1 . ISBN 978-3-642-22121-7 .
- ^ Уикс, Мария Эльвира (1933). «Открытие элементов. XIX. Радиоактивные элементы». Журнал химического образования . 10 (2): 79. Бибкод : 1933ЖЧЭд..10...79Вт . дои : 10.1021/ed010p79 .
- ^ Фрэнк Мур Колби; Аллен Леон Черчилль (1911). Новый международный ежегодник: сборник мирового прогресса . Додд, Мид и Ко. с. 152 и далее .
- ^ Кюри, Мари и Дебьерн, Андре (1910). «Sur le radium métallique» [О металлическом радие]. Comptes Rendus (на французском языке). 151 : 523–525. Архивировано из оригинала 20 июля 2011 года . Проверено 1 августа 2009 г.
- ^ Ронно, К.; Бичаева, О. (1997). Биотехнология для управления отходами и восстановления территорий: технологические, образовательные, деловые и политические аспекты . Отдел по научным вопросам Организации Североатлантического договора. п. 206. ИСБН 978-0-7923-4769-9 . Архивировано из оригинала 5 сентября 2015 года . Проверено 27 июня 2015 г.
- ^ Фрейм, Пол В. (октябрь – ноябрь 1996 г.). «Как появилась Кюри» . Информационный бюллетень Общества физики здоровья . Архивировано из оригинала 20 марта 2012 года . Проверено 9 мая 2023 г. - через Объединенные университеты Ок-Риджа (orau.org).
{{cite magazine}}: CS1 maint: неподходящий URL ( ссылка ) - ^ Jump up to: Перейти обратно: а б Террилл, Дж. Г. младший; Ингрэм, Южная Каролина, 2-й; Мёллер, Д.В. (1954). «Радий в целительстве и промышленности: радиационное воздействие в Соединенных Штатах» . Отчеты общественного здравоохранения . 69 (3): 255–262. дои : 10.2307/4588736 . JSTOR 4588736 . ПМК 2024184 . ПМИД 13134440 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) CS1 maint: числовые имена: список авторов ( ссылка ) - ^ Фрейм, Пол (1999). «Радиолюминесцентная краска» . Музей радиации и радиоактивности . Ассоциированные университеты Ок-Риджа . Архивировано из оригинала 31 июля 2014 года.
- ^ «Хронология экологической истории - Радиевые девушки» . 20 июля 2012 г. Архивировано из оригинала 2 сентября 2018 г. Проверено 1 сентября 2018 г.
- ^ Роуленд, Р.Э. (1995) Радий в организме человека: обзор исследований в США. Архивировано 9 ноября 2011 г. в Wayback Machine . Аргоннская национальная лаборатория. п. 22
- ^ Тыква, Ричард; Берг, Дитер (2004). Техногенная и естественная радиоактивность в загрязнении окружающей среды и радиохронология . Спрингер. п. 78. ИСБН 978-1-4020-1860-2 .
- ^ Lavrukhina, Avgusta Konstantinovna; Pozdnyakov, Aleksandr Aleksandrovich (1966). Аналитическая химия технеция, прометия, астатина и франция [ Аналитическая химия технеция, прометия, астата и франция ] (на русском языке). Наука . п. 118.
- ^
Ауди, Г.; Кондев, ФГ; Ван, М.; Хуанг, WJ; Наими, С. (2017). «Оценка ядерных свойств NUBASE2016» (PDF) . Китайская физика C . 41 (3): 030001. Бибкод : 2017ChPhC..41c0001A . дои : 10.1088/1674-1137/41/3/030001 . - ^ Водород-3 (PDF) (Отчет). Паспорт безопасности нуклидов. Управление охраны окружающей среды и безопасности, Университет Эмори . Архивировано из оригинала (PDF) 20 мая 2013 г. – на сайте ehso.emory.edu.
- ^ Зерриффи, Хишам (январь 1996 г.). «Тритий: экологические, медицинские, бюджетные и стратегические последствия решения Министерства энергетики о производстве трития» . Институт энергетических и экологических исследований . Архивировано из оригинала 13 июля 2010 года . Проверено 15 сентября 2010 г.
- ^ Jump up to: Перейти обратно: а б с д
Эмсли, Джон (2003). Строительные блоки природы: путеводитель по элементам от Аризоны . Издательство Оксфордского университета. п. 351 и далее . ISBN 978-0-19-850340-8 . Проверено 27 июня 2015 г. - ^ «Светящаяся радиевая краска» . vintagewatchstraps.com . Архивировано из оригинала 4 марта 2013 года.
- ^ «Французский веб-сайт, на котором представлены продукты (лекарства, минеральная вода и даже нижнее белье), содержащие радий» . Архивировано из оригинала 15 марта 2011 года . Проверено 1 августа 2009 г.
- ^ Шербонье, Алиса (1 октября 1997 г.). «Назальное облучение детей радием имеет последствия для здоровья» . Балтиморская хроника . Архивировано из оригинала 28 сентября 2011 года . Проверено 1 августа 2009 г.
- ^ Хейтер, Чарльз (2005). «Политика радоновой терапии в 1930-е годы» . Элемент надежды: радий и борьба с раком в Канаде, 1900–1940 гг . McGill-Queen's Press. ISBN 978-0-7735-2869-7 – через Google Книги.
- ^ Харви, Дэвид И. (1999). «Радиевый век». Стараться . 23 (3): 100–105. дои : 10.1016/S0160-9327(99)01201-6 . ПМИД 10589294 .
- ^ Гамильтон, Вивьен (2016). «Тайны жизни: историк Луис Кампос возрождает роль радия в ранних генетических исследованиях» . Дистилляции . 2 (2): 44–45. Архивировано из оригинала 23 марта 2018 года . Проверено 22 марта 2018 г.
- ^ «Четыре врача-основателя» . О проекте / История. Медицина Хопкинса (hopkinsmedicine.org) . Медицинская школа Джонса Хопкинса , Университет Джонса Хопкинса . Архивировано из оригинала 10 марта 2015 года . Проверено 10 апреля 2013 г.
- ^ Дастур, Ади Э.; Танк, П.Д. (2011). «Говард Этвуд Келли: Гораздо больше, чем стежок» . Журнал акушерства и гинекологии Индии . 60 (5): 392–394. дои : 10.1007/s13224-010-0064-6 . ПМК 3394615 .
- ^ Jump up to: Перейти обратно: а б Ароновиц, Джесси Н.; Робисон, Роджер Ф. (2010). «Говард Келли устанавливает гинекологическую брахитерапию в Соединенных Штатах». Брахитерапия . 9 (2): 178–184. дои : 10.1016/j.brachy.2009.10.001 . ПМИД 20022564 .
- ^ Склот, Ребекка (2 февраля 2010 г.). Бессмертная жизнь Генриетты Лакс . Случайный дом в цифровом формате. ISBN 978-0-307-58938-5 . Архивировано из оригинала 17 июня 2013 года . Проверено 8 апреля 2013 г.
- ^ Jump up to: Перейти обратно: а б Черански, Беате (2008). «Бартерная экономика, экономика репутации, бюрократия» . Журнал NTM по истории науки, технологий и медицины . 16 (4): 413–443. дои : 10.1007/s00048-008-0308-z .
- ^ «Боковая наука». Архивировано 2 апреля 2015 г. в Wayback Machine . Lateralscience.blogspot.se . ноябрь 2012 г.
- ^ Просто, Эван; Суэйн, Филип В. и Керр, Уильям А. (1952). «Мирное воздействие атомной энергии». Журнал финансовых аналитиков . 8 (1): 85–93. дои : 10.2469/faj.v8.n1.85 . JSTOR 40796935 .
- ^ Кюбель, А. (1940). «Извлечение радия из канадской настуранки». Журнал химического образования . 17 (9): 417. Бибкод : 1940ЖЧЭд..17..417К . дои : 10.1021/ed017p417 .
- ^ Виол, CH (1919). «Радиевое производство» . Наука . 49 (1262): 227–228. Бибкод : 1919Sci....49..227В . дои : 10.1126/science.49.1262.227 . ПМИД 17809659 .
- ^ Бушиа, Мари-Анн; Бушиа, Клод (28 ноября 1997 г.). «Нарушение четности в атомах». Отчеты о прогрессе в физике . 60 (11): 1351–1396. Бибкод : 1997РПФ...60.1351Б . дои : 10.1088/0034-4885/60/11/004 . S2CID 250910046 – через Институт физики.
- ^ Комминс, Юджин Д.; Джексон, доктор медицинских наук; Демилль, Дэвид П. (10 мая 2007 г.). «Электрический дипольный момент электрона: интуитивное объяснение уклонения от теоремы Шиффа» . Американский журнал физики . 75 (6): 532–536. Бибкод : 2007AmJPh..75..532C . doi : 10.1119/1.2710486 – через aapt.scitation.org (Atypon).
- ^ Добачевски Дж.; Энгель, Дж. (13 июня 2005 г.). «Ядерное нарушение обращения времени и момент Шиффа $^{225}\mathrm{Ra}$» . Письма о физических отзывах . 94 (23): 232502. arXiv : nucl-th/0503057 . doi : 10.1103/PhysRevLett.94.232502 . ПМИД 16090465 . S2CID 328830 – через APS.org.
- ^ Гранер, Б.; Чен, Ю.; Линдал, Э.Г.; Хекель, БР (18 апреля 2016 г.). «Снижен предел постоянного электрического дипольного момента 199 Hg " . Physical Review Letters . 116 (16): 161601. arXiv : 1601.04339 . doi : 10.1103/PhysRevLett.116.161601 . PMID 27152789. . S2CID 2230011 — через APS.org
- ^ Паркер, Р.Х.; Дитрих, MR; Калита, г-н; Лемке, Северная Дакота; Бейли, КГ; Бишоф, М.; и др. (9 июня 2015 г.). «Первое измерение атомного электрического дипольного момента 225 Ra " . Physical Review Letters . 114 (23): 233002. arXiv : 1504.07477 . doi : 10.1103/PhysRevLett.114.233002 PMID 26196797. S2CID 41982867 — . через APS.org.
- ^ Нуньес Портела, М.; Дейк, Э.А.; Моханти, А.; Беккер, Х.; ван ден Берг, JE; Гири, Г.С.; и др. (1 января 2014 г.). «Захват ионов Ra+: к измерению нарушения атомной четности и оптическим часам». Прикладная физика Б . 114 (1): 173–182. Бибкод : 2014ApPhB.114..173N . дои : 10.1007/s00340-013-5603-2 . S2CID 119948902 — через Springer Link.
- ^ Холлиман, Калифорния; Фан, М.; Подрядчик, А.; Брюэр, С.М.; Джайич, AM (20 января 2022 г.). «Радиионно-оптические часы» . Письма о физических отзывах . 128 (3): 033202. arXiv : 2201.07330 . Бибкод : 2022PhRvL.128c3202H . doi : 10.1103/PhysRevLett.128.033202 . ПМИД 35119894 . S2CID 246035333 – через APS.
- ^ Использование и замена источников излучения: Сокращенная версия (Отчет). Комитет по использованию и замене источников радиации / Совет по ядерным и радиационным исследованиям. Вашингтон, округ Колумбия: Национальный исследовательский совет США / Издательство национальных академий. Январь 2008. с. 24. ISBN 978-0-309-11014-3 . Архивировано из оригинала 5 сентября 2015 года . Проверено 27 июня 2015 г. - через Google Книги.
- ^ Бентель, Гунилла Карлесон (1996). Планирование лучевой терапии . МакГроу Хилл Профессионал. п. 8. ISBN 978-0-07-005115-7 . Архивировано из оригинала 5 сентября 2015 года . Проверено 27 июня 2015 г. - через Google Книги.
- ^ «Патент США Xofigo» . Ксофиго . Проверено 28 сентября 2022 г.
- ^ «Одобрения FDA определили препарат радиационного лечения рака простаты Xofigo от Bayer, Алгета» . Архивировано из оригинала 28 июня 2013 года . Проверено 1 октября 2014 г.
- ^ «FDA одобряет Ксофиго для лечения распространенного рака простаты» . сайт рака . 15 мая 2013 г. Архивировано из оригинала 6 июля 2013 г.
- ^ Маффиоли, Л.; Флоримонте, Л.; Коста, округ Колумбия; Коррейя Кастанейра, судья; Грана, К.; Ластер, М.; и др. (2015). «Новые радиофармацевтические средства для лечения кастрационно-резистентного рака предстательной железы» . QJ Nucl Med Mol Imaging . 59 (4): 420–438. ПМИД 26222274 .
- ^ Столл, Вольфганг (2005). «Торий и ториевые соединения». Энциклопедия промышленной химии Ульмана . Вайли-ВЧ . п. 717. дои : 10.1002/14356007.a27_001 . ISBN 978-3-527-31097-5 .
- ^ Л'Аннунциата, Майкл Ф. (2007). «Ядерные реакции, вызванные альфа-частицами» . Радиоактивность: Введение и история . Эльзевир. стр. 260–261. ISBN 978-0-444-52715-8 .
- ^ Холден, штат Небраска; Рецинелло, Р.Н.; Ху, Япония; Рорер, Дэвид К. (2004). «Радиационная дозиметрия радий-бериллиевого источника с графитовым замедлителем» (PDF) . Физика здоровья . 86 (5 дополнений): S110–S112. Бибкод : 2003rdtc.conf..484H . дои : 10.1142/9789812705563_0060 . ПМИД 15069300 . Архивировано (PDF) из оригинала 23 июля 2018 года . Проверено 25 октября 2017 г.
- ^ Вейсгалл, Джонатан М. (1994). Операция «Перекресток»: атомные испытания на атолле Бикини . Издательство Военно-морского института. п. 238 . ISBN 978-1-55750-919-2 . Проверено 20 августа 2011 г.
- ^ Фрай, Ширли А. (1998). «Приложение: открытие радия мадам Кюри (1898 г.): память женщин, занимающихся радиационными науками». Радиационные исследования . 150 (5): С21–С29. Бибкод : 1998RadR..150S..21F . дои : 10.2307/3579805 . JSTOR 3579805 . ПМИД 9806606 .
- ^ Реднисс, Лорен (2011). Радиоактивность: Мария и Пьер Кюри: История любви и неудачи . Нью-Йорк, штат Нью-Йорк: HarperCollins. п. 70. ИСБН 978-0-06-135132-7 .
- ^ Дженкс, Эндрю (июль 2002 г.). «Модельный город США: экологическая цена победы во Второй мировой войне и холодной войне» . Экологическая история . 12 (77): 552–577. дои : 10.1093/envhis/12.3.552 . (требуется подписка)
- ^ Факты Агентства по охране окружающей среды о радии (PDF) . semspub.epa.gov (Отчет). США Агентство по охране окружающей среды . Проверено 6 марта 2023 г.
Библиография
- Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8 .
Дальнейшее чтение
- Ствертка, Альберт (1998). Путеводитель по элементам (переработанная редакция). Издательство Оксфордского университета. ISBN 978-0-19-508083-4 .
- Грейди, Дениз (6 октября 1998 г.). «Свечение в темноте и урок научной опасности» . Нью-Йорк Таймс . Проверено 25 декабря 2007 г.
- Няня Фреман (1 декабря 1996 г.). «Мария и Пьер Кюри и открытие полония и радия» . Нобелевский фонд . Проверено 25 декабря 2007 г.
- Маклис, Р.М. (1993). «Великий радиевый скандал». Научный американец . Том. 269, нет. 2. С. 94–99. Бибкод : 1993SciAm.269b..94M . doi : 10.1038/scientificamerican0893-94 . ПМИД 8351514 .
- Кларк, Клаудия (1987). Радиевые девушки: женщины и реформа промышленного здравоохранения, 1910–1935 гг . Издательство Университета Северной Каролины. ISBN 978-0-8078-4640-7 .
- Мария Кюри (1921), Открытие радия: Выступление мадам М. Кюри в колледже Вассар 14 мая 1921 года (1-е изд.), Покипси: Колледж Вассар , Викиданные Q22920166
- Сантос, Люси Джейн (2020). Период полураспада: маловероятная история радия . Иконные книги. ISBN 9781785786082 . OCLC 1158229829 .
Внешние ссылки
- «Открытие радия» . Латеральная наука . Великобритания. 8 июля 2012 года. Архивировано из оригинала 9 марта 2016 года . Проверено 13 мая 2017 г.
- Радиевая водяная баня в Оклахоме . markwshead.com (фотографические изображения).
- «Радий радиоактивный» . Банк данных по опасным веществам NLM . США Национальные институты здравоохранения .
- «Аннотированная библиография по радию» . Цифровая библиотека Алсос по ядерным вопросам . Лексингтон, Вирджиния: Университет Вашингтона и Ли . Архивировано из оригинала 25 июня 2019 года.
- «Радий» . Периодическая таблица видео . Университет Ноттингема .




