Кобальт
 | ||||||||||||||||||||||||||||||||||||
| Кобальт | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Произношение | / ˈ k oʊ b ɒ l t / [1] | |||||||||||||||||||||||||||||||||||
| Появление | твердый блестящий голубовато-серый металл | |||||||||||||||||||||||||||||||||||
| Стандартный атомный вес А р °(Со) | ||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||
| Кобальт в таблице Менделеева | ||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||
| Atomic number (Z) | 27 | |||||||||||||||||||||||||||||||||||
| Group | group 9 | |||||||||||||||||||||||||||||||||||
| Period | period 4 | |||||||||||||||||||||||||||||||||||
| Block | d-block | |||||||||||||||||||||||||||||||||||
| Electron configuration | [Ar] 3d7 4s2 | |||||||||||||||||||||||||||||||||||
| Electrons per shell | 2, 8, 15, 2 | |||||||||||||||||||||||||||||||||||
| Physical properties | ||||||||||||||||||||||||||||||||||||
| Phase at STP | solid | |||||||||||||||||||||||||||||||||||
| Melting point | 1768 K (1495 °C, 2723 °F) | |||||||||||||||||||||||||||||||||||
| Boiling point | 3200 K (2927 °C, 5301 °F) | |||||||||||||||||||||||||||||||||||
| Density (at 20° C) | 8.834 g/cm3 [4] | |||||||||||||||||||||||||||||||||||
| when liquid (at m.p.) | 7.75 g/cm3 | |||||||||||||||||||||||||||||||||||
| Heat of fusion | 16.06 kJ/mol | |||||||||||||||||||||||||||||||||||
| Heat of vaporization | 377 kJ/mol | |||||||||||||||||||||||||||||||||||
| Molar heat capacity | 24.81 J/(mol·K) | |||||||||||||||||||||||||||||||||||
Vapor pressure
| ||||||||||||||||||||||||||||||||||||
| Atomic properties | ||||||||||||||||||||||||||||||||||||
| Oxidation states | −3, −1, 0, +1, +2, +3, +4, +5[5] (an amphoteric oxide) | |||||||||||||||||||||||||||||||||||
| Electronegativity | Pauling scale: 1.88 | |||||||||||||||||||||||||||||||||||
| Ionization energies |
| |||||||||||||||||||||||||||||||||||
| Atomic radius | empirical: 125 pm | |||||||||||||||||||||||||||||||||||
| Covalent radius | Low spin: 126±3 pm High spin: 150±7 pm | |||||||||||||||||||||||||||||||||||
| Other properties | ||||||||||||||||||||||||||||||||||||
| Natural occurrence | primordial | |||||||||||||||||||||||||||||||||||
| Crystal structure | hexagonal close-packed (hcp) (hP2) | |||||||||||||||||||||||||||||||||||
| Lattice constants | a = 250.71 pm c = 407.00 pm (at 20 °C)[4] | |||||||||||||||||||||||||||||||||||
| Thermal expansion | 12.9×10−6/K (at 20 °C)[a] | |||||||||||||||||||||||||||||||||||
| Thermal conductivity | 100 W/(m⋅K) | |||||||||||||||||||||||||||||||||||
| Electrical resistivity | 62.4 nΩ⋅m (at 20 °C) | |||||||||||||||||||||||||||||||||||
| Magnetic ordering | ferromagnetic | |||||||||||||||||||||||||||||||||||
| Young's modulus | 209 GPa | |||||||||||||||||||||||||||||||||||
| Shear modulus | 75 GPa | |||||||||||||||||||||||||||||||||||
| Bulk modulus | 180 GPa | |||||||||||||||||||||||||||||||||||
| Speed of sound thin rod | 4720 m/s (at 20 °C) | |||||||||||||||||||||||||||||||||||
| Poisson ratio | 0.31 | |||||||||||||||||||||||||||||||||||
| Mohs hardness | 5.0 | |||||||||||||||||||||||||||||||||||
| Vickers hardness | 1043 MPa | |||||||||||||||||||||||||||||||||||
| Brinell hardness | 470–3000 MPa | |||||||||||||||||||||||||||||||||||
| CAS Number | 7440-48-4 | |||||||||||||||||||||||||||||||||||
| History | ||||||||||||||||||||||||||||||||||||
| Discovery and first isolation | Georg Brandt (1735) | |||||||||||||||||||||||||||||||||||
| Isotopes of cobalt | ||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||
Кобальт — химический элемент ; он имеет символ Co и атомный номер 27. Как и никель , кобальт встречается в земной коре только в химически связанной форме, за исключением небольших месторождений, обнаруженных в сплавах природного метеорного железа . , Свободный элемент получаемый восстановительной плавкой , представляет собой твердый, блестящий, несколько хрупкий металл серого цвета .
Синие пигменты на основе кобальта ( синий кобальт ) использовались с древности для изготовления ювелирных изделий и красок, а также для придания стеклу характерного синего оттенка. Долгое время считалось, что этот цвет обусловлен металлом висмутом . Шахтеры издавна использовали название «кобольдская руда» ( по-немецки « руда гоблинов» ) для некоторых минералов, производящих синий пигмент . Они были названы так потому, что были бедны известными металлами и при плавке выделяли ядовитые пары, содержащие мышьяк . [7] В 1735 году было обнаружено, что такие руды восстанавливаются до нового металла (первого открытого с древних времен), который в конечном итоге был назван в честь кобольда .
Today, some cobalt is produced specifically from one of a number of metallic-lustered ores, such as cobaltite (CoAsS). The element is more usually produced as a by-product of copper and nickel mining. The Copperbelt in the Democratic Republic of the Congo (DRC) and Zambia yields most of the global cobalt production. World production in 2016 was 116,000 tonnes (114,000 long tons; 128,000 short tons) (according to Natural Resources Canada), and the DRC alone accounted for more than 50%.[8]
Cobalt is primarily used in lithium-ion batteries, and in the manufacture of magnetic, wear-resistant and high-strength alloys. The compounds cobalt silicate and cobalt(II) aluminate (CoAl2O4, cobalt blue) give a distinctive deep blue color to glass, ceramics, inks, paints and varnishes. Cobalt occurs naturally as only one stable isotope, cobalt-59. Cobalt-60 is a commercially important radioisotope, used as a radioactive tracer and for the production of high-energy gamma rays. Cobalt is also used in the petroleum industry as a catalyst when refining crude oil. This is to purge it of sulfur, which is very polluting when burned and causes acid rain.[9]
Cobalt is the active center of a group of coenzymes called cobalamins. Vitamin B12, the best-known example of the type, is an essential vitamin for all animals. Cobalt in inorganic form is also a micronutrient for bacteria, algae, and fungi.
Characteristics
[edit]
Cobalt is a ferromagnetic metal with a specific gravity of 8.9. The Curie temperature is 1,115 °C (2,039 °F)[10] and the magnetic moment is 1.6–1.7 Bohr magnetons per atom.[11] Cobalt has a relative permeability two-thirds that of iron.[12] Metallic cobalt occurs as two crystallographic structures: hcp and fcc. The ideal transition temperature between the hcp and fcc structures is 450 °C (842 °F), but in practice the energy difference between them is so small that random intergrowth of the two is common.[13][14][15]
Cobalt is a weakly reducing metal that is protected from oxidation by a passivating oxide film. It is attacked by halogens and sulfur. Heating in oxygen produces Co3O4 which loses oxygen at 900 °C (1,650 °F) to give the monoxide CoO.[16] The metal reacts with fluorine (F2) at 520 K to give CoF3; with chlorine (Cl2), bromine (Br2) and iodine (I2), producing equivalent binary halides. It does not react with hydrogen gas (H2) or nitrogen gas (N2) even when heated, but it does react with boron, carbon, phosphorus, arsenic and sulfur.[17] At ordinary temperatures, it reacts slowly with mineral acids, and very slowly with moist, but not dry, air.[citation needed]
Compounds
[edit]Common oxidation states of cobalt include +2 and +3, although compounds with oxidation states ranging from −3 to +5 are also known. A common oxidation state for simple compounds is +2 (cobalt(II)). These salts form the pink-colored metal aquo complex [Co(H
2O)
6]2+
in water. Addition of chloride gives the intensely blue [CoCl
4]2−
.[5] In a borax bead flame test, cobalt shows deep blue in both oxidizing and reducing flames.[18]
Oxygen and chalcogen compounds
[edit]Several oxides of cobalt are known. Green cobalt(II) oxide (CoO) has rocksalt structure. It is readily oxidized with water and oxygen to brown cobalt(III) hydroxide (Co(OH)3). At temperatures of 600–700 °C, CoO oxidizes to the blue cobalt(II,III) oxide (Co3O4), which has a spinel structure.[5] Black cobalt(III) oxide (Co2O3) is also known.[19] Cobalt oxides are antiferromagnetic at low temperature: CoO (Néel temperature 291 K) and Co3O4 (Néel temperature: 40 K), which is analogous to magnetite (Fe3O4), with a mixture of +2 and +3 oxidation states.[20]
The principal chalcogenides of cobalt are the black cobalt(II) sulfides, CoS2 (pyrite structure), Co2S3 (spinel structure), and CoS (nickel arsenide structure).[5]: 1118
Halides
[edit]
Four dihalides of cobalt(II) are known: cobalt(II) fluoride (CoF2, pink), cobalt(II) chloride (CoCl2, blue), cobalt(II) bromide (CoBr2, green), cobalt(II) iodide (CoI2, blue-black). These halides exist in anhydrous and hydrated forms. Whereas the anhydrous dichloride is blue, the hydrate is red.[21]
The reduction potential for the reaction Co3+
+ e− → Co2+
is +1.92 V, beyond that for chlorine to chloride, +1.36 V. Consequently, cobalt(III) chloride would spontaneously reduce to cobalt(II) chloride and chlorine. Because the reduction potential for fluorine to fluoride is so high, +2.87 V, cobalt(III) fluoride is one of the few simple stable cobalt(III) compounds. Cobalt(III) fluoride, which is used in some fluorination reactions, reacts vigorously with water.[16]
Coordination compounds
[edit]The inventory of complexes is very large. Starting with higher oxidation states, complexes of Co(IV) and Co(V) are rare. Examples are found in caesium hexafluorocobaltate(IV) (Cs2CoF6) and potassium percobaltate (K3CoO4).[16]
Cobalt(III) forms a wide variety of coordination complexes with ammonia and amines, which are called ammine complexes. Examples include [Co(NH3)6]3+, [Co(NH3)5Cl]2+ (chloropentamminecobalt(III)), and cis- and trans-[Co(NH3)4Cl2]+. The corresponding ethylenediamine complexes are also well known. Analogues are known where the halides are replaced by nitrite, hydroxide, carbonate, etc. Alfred Werner worked extensively on these complexes in his Nobel-prize winning work.[22] The robustness of these complexes is demonstrated by the optical resolution of tris(ethylenediamine)cobalt(III) ([Co(en)
3]3+
).[23]
Cobalt(II) forms a wide variety complexes, but mainly with weakly basic ligands. The pink-colored cation hexaaquocobalt(II) [Co(H2O)6]2+ is found in several routine cobalt salts such as the nitrate and sulfate. Upon addition of excess chloride, solutions of the hexaaquo complex converts to the deep blue CoCl2−4, which is tetrahedral.
Softer ligands like triphenylphosphine form complexes with Co(II) and Co(I), examples being bis- and tris(triphenylphosphine)cobalt(I) chloride, CoCl2(PPh3)2 and CoCl(PPh3)3. These Co(I) and Co(II) complexes represent a link to the organometallic complexes described below.
Organometallic compounds
[edit]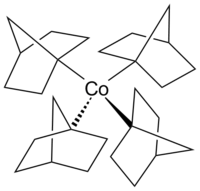
Cobaltocene is a structural analog to ferrocene, with cobalt in place of iron. Cobaltocene is much more sensitive to oxidation than ferrocene.[24] Cobalt carbonyl (Co2(CO)8) is a catalyst in carbonylation and hydrosilylation reactions.[25] Vitamin B12 (see below) is an organometallic compound found in nature and is the only vitamin that contains a metal atom.[26] An example of an alkylcobalt complex in the otherwise uncommon +4 oxidation state of cobalt is the homoleptic complex tetrakis(1-norbornyl)cobalt(IV) (Co(1-norb)4), a transition metal-alkyl complex that is notable for its resistance to β-hydrogen elimination,[27] in accord with Bredt's rule. The cobalt(III) and cobalt(V) complexes [Li(THF)
4]+
[Co(1-norb)
4]−
and [Co(1-norb)
4]+
[BF
4]−
are also known.[28]
Isotopes
[edit]59Co is the only stable cobalt isotope and the only isotope that exists naturally on Earth. Twenty-two radioisotopes have been characterized: the most stable, 60Co, has a half-life of 5.2714 years; 57Co has a half-life of 271.8 days; 56Co has a half-life of 77.27 days; and 58Co has a half-life of 70.86 days. All the other radioactive isotopes of cobalt have half-lives shorter than 18 hours, and in most cases shorter than 1 second. This element also has 4 meta states, all of which have half-lives shorter than 15 minutes.[29]
The isotopes of cobalt range in atomic weight from 50 u (50Co) to 73 u (73Co). The primary decay mode for isotopes with atomic mass unit values less than that of the only stable isotope, 59Co, is electron capture and the primary mode of decay in isotopes with atomic mass greater than 59 atomic mass units is beta decay. The primary decay products below 59Co are element 26 (iron) isotopes; above that the decay products are element 28 (nickel) isotopes.[29]
History
[edit]
Cobalt compounds have been used for centuries to impart a rich blue color to glass, glazes, and ceramics. Cobalt has been detected in Egyptian sculpture, Persian jewelry from the third millennium BC, in the ruins of Pompeii, destroyed in 79 AD, and in China, dating from the Tang dynasty (618–907 AD) and the Ming dynasty (1368–1644 AD).[30]
Cobalt has been used to color glass since the Bronze Age. The excavation of the Uluburun shipwreck yielded an ingot of blue glass, cast during the 14th century BC.[31][32] Blue glass from Egypt was either colored with copper, iron, or cobalt. The oldest cobalt-colored glass is from the eighteenth dynasty of Egypt (1550–1292 BC). The source for the cobalt the Egyptians used is not known.[33]
The word cobalt is derived from the German kobalt, from kobold meaning "goblin", a superstitious term used for the ore of cobalt by miners. The first attempts to smelt those ores for copper or silver failed, yielding simply powder (cobalt(II) oxide) instead. Because the primary ores of cobalt always contain arsenic, smelting the ore oxidized the arsenic into the highly toxic and volatile arsenic oxide, adding to the notoriety of the ore.[34] Paracelsus, Georgius Agricola, and Basil Valentine all referred to such silicates as "cobalt".[35]
Swedish chemist Georg Brandt (1694–1768) is credited with discovering cobalt c. 1735, showing it to be a previously unknown element, distinct from bismuth and other traditional metals. Brandt called it a new "semi-metal".[36][37] He showed that compounds of cobalt metal were the source of the blue color in glass, which previously had been attributed to the bismuth found with cobalt. Cobalt became the first metal to be discovered since the pre-historical period. All previously known metals (iron, copper, silver, gold, zinc, mercury, tin, lead and bismuth) had no recorded discoverers.[38]
During the 19th century, a significant part of the world's production of cobalt blue (a pigment made with cobalt compounds and alumina) and smalt (cobalt glass powdered for use for pigment purposes in ceramics and painting) was carried out at the Norwegian Blaafarveværket.[39][40] The first mines for the production of smalt in the 16th century were located in Norway, Sweden, Saxony and Hungary. With the discovery of cobalt ore in New Caledonia in 1864, the mining of cobalt in Europe declined. With the discovery of ore deposits in Ontario, Canada, in 1904 and the discovery of even larger deposits in the Katanga Province in the Congo in 1914, mining operations shifted again.[34] When the Shaba conflict started in 1978, the copper mines of Katanga Province nearly stopped production.[41][42] The impact on the world cobalt economy from this conflict was smaller than expected: cobalt is a rare metal, the pigment is highly toxic, and the industry had already established effective ways for recycling cobalt materials. In some cases, industry was able to change to cobalt-free alternatives.[41][42]
In 1938, John Livingood and Glenn T. Seaborg discovered the radioisotope cobalt-60.[43] This isotope was famously used at Columbia University in the 1950s to establish parity violation in radioactive beta decay.[44][45]
After World War II, the US wanted to guarantee the supply of cobalt ore for military uses (as the Germans had been doing) and prospected for cobalt within the US. High purity cobalt was highly sought after for its use in jet engines and gas turbines.[46] An adequate supply of the ore was found in Idaho near Blackbird canyon. Calera Mining Company started production at the site.[47]
Cobalt demand has further accelerated in the 21st century as an essential constituent of materials used in rechargeable batteries, superalloys, and catalysts.[46] It has been argued that cobalt will be one of the main objects of geopolitical competition in a world running on renewable energy and dependent on batteries, but this perspective has also been criticised for underestimating the power of economic incentives for expanded production.[48]
Occurrence
[edit]The stable form of cobalt is produced in supernovae through the r-process.[49] It comprises 0.0029% of the Earth's crust. Except as recently delivered in meteoric iron, free cobalt (the native metal) is not found on Earth's surface because of its tendency to react with oxygen in the atmosphere. Small amounts of cobalt compounds are found in most rocks, soils, plants, and animals.[50] In the ocean cobalt typically reacts with chlorine.
In nature, cobalt is frequently associated with nickel. Both are characteristic components of meteoric iron, though cobalt is much less abundant in iron meteorites than nickel. As with nickel, cobalt in meteoric iron alloys may have been well enough protected from oxygen and moisture to remain as the free (but alloyed) metal.[51]
Cobalt in compound form occurs in copper and nickel minerals. It is the major metallic component that combines with sulfur and arsenic in the sulfidic cobaltite (CoAsS), safflorite (CoAs2), glaucodot ((Co,Fe)AsS), and skutterudite (CoAs3) minerals.[16] The mineral cattierite is similar to pyrite and occurs together with vaesite in the copper deposits of Katanga Province.[52] When it reaches the atmosphere, weathering occurs; the sulfide minerals oxidize and form pink erythrite ("cobalt glance": Co3(AsO4)2·8H2O) and spherocobaltite (CoCO3).[53][54]
Cobalt is also a constituent of tobacco smoke.[55] The tobacco plant readily absorbs and accumulates heavy metals like cobalt from the surrounding soil in its leaves. These are subsequently inhaled during tobacco smoking.[56]
Production
[edit]
| Country | Production | Reserves |
|---|---|---|
| 130,000 | 4,000,000 | |
| 10,000 | 600,000 | |
| 8,900 | 250,000 | |
| 5,900 | 1,500,000 | |
| 3,900 | 220,000 | |
| 3,800 | 500,000 | |
| 3,800 | 260,000 | |
| 3,000 | 100,000 | |
| 3,000 | 47,000 | |
| 2,700 | 36,000 | |
| 2,300 | 13,000 | |
| 2,200 | 140,000 | |
| 800 | 69,000 | |
| Other countries | 5,200 | 610,000 |
| World total | 190,000 | 8,300,000 |
The main ores of cobalt are cobaltite, erythrite, glaucodot and skutterudite (see above), but most cobalt is obtained by reducing the cobalt by-products of nickel and copper mining and smelting.[58][59]
Since cobalt is generally produced as a by-product, the supply of cobalt depends to a great extent on the economic feasibility of copper and nickel mining in a given market. Demand for cobalt was projected to grow 6% in 2017.[60]
Primary cobalt deposits are rare, such as those occurring in hydrothermal deposits, associated with ultramafic rocks, typified by the Bou-Azzer district of Morocco. At such locations, cobalt ores are mined exclusively, albeit at a lower concentration, and thus require more downstream processing for cobalt extraction.[61][62]
Several methods exist to separate cobalt from copper and nickel, depending on the concentration of cobalt and the exact composition of the used ore. One method is froth flotation, in which surfactants bind to ore components, leading to an enrichment of cobalt ores. Subsequent roasting converts the ores to cobalt sulfate, and the copper and the iron are oxidized to the oxide. Leaching with water extracts the sulfate together with the arsenates. The residues are further leached with sulfuric acid, yielding a solution of copper sulfate. Cobalt can also be leached from the slag of copper smelting.[63]
The products of the above-mentioned processes are transformed into the cobalt oxide (Co3O4). This oxide is reduced to metal by the aluminothermic reaction or reduction with carbon in a blast furnace.[16]

Extraction
[edit]
The United States Geological Survey estimates world reserves of cobalt at 7,100,000 metric tons.[64] The Democratic Republic of the Congo (DRC) currently produces 63% of the world's cobalt. This market share may reach 73% by 2025 if planned expansions by mining producers like Glencore Plc take place as expected. Bloomberg New Energy Finance has estimated that by 2030, global demand for cobalt could be 47 times more than it was in 2017.[65]
Изменения, внесенные Конго в законы о горнодобывающей промышленности в 2002 году, привлекли новые инвестиции в конголезские проекты по добыче меди и кобальта. компании Glencore В 2016 году рудник Мутанда отгрузил 24 500 тонн кобальта, что составляет 40% добычи Конго ДРК и почти четверть мирового производства. В конце 2019 года из-за переизбытка предложения Glencore закрыла Mutanda на два года. [66] [67] По данным Glencore, проект Glencore Katanga Mining также возобновляется и к 2019 году должен произвести 300 000 тонн меди и 20 000 тонн кобальта. [60]
Демократическая Республика Конго
[ редактировать ]
В 2005 году крупнейшим производителем кобальта были месторождения меди в Демократической Республики Конго провинции Катанга . в этой области, бывшей провинции Шаба, располагалось почти 40% мировых запасов. По данным Британской геологической службы в 2009 году, [68]
Кустарная добыча обеспечивала от 17% до 40% продукции ДРК. [69] Около 100 000 шахтеров кобальта в Конго (ДРК) используют ручные инструменты, чтобы выкопать сотни футов, практически не планируя и не принимая мер безопасности, говорят рабочие, представители правительства и НПО, а также наблюдения репортеров The Washington Post во время посещения изолированных шахт. Отсутствие мер предосторожности часто приводит к травмам или смерти. [70] По словам представителей здравоохранения, горнодобывающая промышленность загрязняет окрестности и подвергает местную дикую природу и коренные общины воздействию токсичных металлов, которые, как считается, вызывают врожденные дефекты и проблемы с дыханием. [71]
Детский труд используется при добыче кобальта на африканских кустарных рудниках . [69] [72] Правозащитники подчеркнули это, и журналистские расследования подтвердили это. [73] [74] Это открытие побудило производителя сотовых телефонов Apple Inc. 3 марта 2017 года прекратить закупку руды у таких поставщиков, как Zhejiang Huayou Cobalt , добывающих руду на кустарных рудниках в ДРК, и начать использовать только тех поставщиков, которые проверены на соответствие ее стандартам на рабочих местах. [75] [76]
и крупные производители автомобилей (OEM) настаивают на Во всем мире ЕС том, чтобы глобальное производство кобальта осуществлялось устойчиво, ответственно и с возможностью отслеживания цепочки поставок. Горнодобывающие компании принимают и реализуют инициативы ESG в соответствии с рекомендациями ОЭСР и создают доказательства деятельности с нулевым или низким углеродным следом в цепочке поставок производства литий-ионных аккумуляторов . Эти инициативы уже реализуются с крупными горнодобывающими компаниями, кустарными и мелкими горнодобывающими компаниями (ASM). Производители автомобилей и цепочки поставок производителей аккумуляторов: Tesla, VW, BMW, BASF и Glencore участвуют в нескольких инициативах, таких как Инициатива «Ответственный кобальт» и исследование «Кобальт для развития». В 2018 году BMW Group в партнерстве с BASF, Samsung SDI и Samsung Electronics запустила в ДРК пилотный проект на одной пилотной шахте, чтобы улучшить условия и решить проблемы для старателей и близлежащих сообществ.
Политическая и этническая динамика региона в прошлом приводила к вспышкам насилия и многолетним вооруженным конфликтам, а также к перемещению населения. Эта нестабильность повлияла на цену кобальта, а также создала у участников Первой и Второй войн в Конго порочные стимулы к продолжению боевых действий, поскольку доступ к алмазным рудникам и другим ценным ресурсам помогал финансировать их военные цели, которые часто сводились к геноциду, и обогатило и самих бойцов. Хотя в 2010-х годах ДР Конго не подвергалась в последнее время вторжению соседних вооруженных сил, некоторые из самых богатых месторождений полезных ископаемых соседствуют с районами, где до сих пор часто происходят столкновения тутси и хуту, беспорядки продолжаются, хотя и в меньших масштабах, а беженцы по-прежнему бегут от вспышек насилия. [77]
Кобальт, добытый на небольших кустарных горнодобывающих предприятиях Конго, в 2007 году поставлялся единственной китайской компании Congo DongFang International Mining. Конго DongFang, дочерняя компания Zhejiang Huayou Cobalt, одного из крупнейших в мире производителей кобальта, поставляла кобальт некоторым крупнейшим мировым производителям аккумуляторов, которые производили аккумуляторы для повсеместно распространенных продуктов, таких как Apple iPhone . Из-за обвинений в трудовых нарушениях и экологических опасений компания LG Chem впоследствии провела аудит Congo DongFang в соответствии с руководящими принципами ОЭСР. LG Chem, которая также производит материалы для аккумуляторов для автомобильных компаний, ввела кодекс поведения для всех поставщиков, которых она проверяет. [78]
Проект горы Мукондо , которым управляет Центральноафриканская горнодобывающая и геологоразведочная компания (CAMEC) в провинции Катанга, может быть самым богатым запасом кобальта в мире. В 2008 году здесь было произведено около трети общего мирового производства кобальта. [79] В июле 2009 года CAMEC объявила о долгосрочном соглашении о поставке всего годового производства кобальтового концентрата с горы Мукондо китайской компании Zhejiang Galico Cobalt & Nickel Materials. [80]
В 2016 году доля Китая в производстве кобальта в Конго оценивалась в более чем 10% мировых поставок кобальта, что составляет ключевой вклад в китайскую промышленность по переработке кобальта и дает Китаю существенное влияние на глобальную цепочку поставок кобальта. [81] Контроль Китая над конголезским кобальтом вызвал обеспокоенность западных стран, которые стремились уменьшить зависимость цепочки поставок от Китая и выразили обеспокоенность по поводу нарушений трудовых прав и прав человека на кобальтовых рудниках в ДРК. [82] [83]
В феврале 2018 года глобальная компания по управлению активами AllianceBernstein определила ДРК как экономически « Саудовскую Аравию эпохи электромобилей» из-за ее ресурсов кобальта, который необходим для литий-ионных батарей, используемых в электромобилях . [84]
9 марта 2018 года президент Джозеф Кабила обновил Кодекс горнодобывающей промышленности 2002 года, увеличив размер роялти и объявив кобальт и колтан «стратегическими металлами». [85] [86] Кодекс майнинга 2002 года был эффективно обновлен 4 декабря 2018 года. [87]
В декабре 2019 года правозащитная неправительственная организация International Rights Advocates подала знаковый иск против Apple, Tesla , Dell , Microsoft и Google компании Alphabet за «сознательное получение выгоды, содействие и подстрекательство к жестокому и зверскому использованию маленьких детей» при добыче кобальта. . [88] Компании, о которых идет речь, отрицают свою причастность к детскому труду . [89]
Канада
[ редактировать ]В 2017 году некоторые геологоразведочные компании планировали обследовать старые серебряные и кобальтовые рудники в районе Кобальта, Онтарио , где, как предполагается, находятся значительные месторождения. [90]
Куба
[ редактировать ]Канадская компания Sherritt International перерабатывает кобальтовые руды на никелевых месторождениях на рудниках Моа на Кубе , а на острове есть еще несколько рудников в Майари , Камагуэй и Пинар-дель-Рио . Продолжающиеся инвестиции Sherritt International в кубинское производство никеля и кобальта при приобретении прав на добычу на 17–20 лет сделали коммунистическую страну третьей по запасам кобальта в 2019 году, опередив саму Канаду. [91]
Индонезия
[ редактировать ]Начиная с меньших объемов в 2021 году, Индонезия начала производить кобальт как побочный продукт производства никеля . К 2022 году страна стала вторым по величине производителем кобальта в мире, а компания Benchmark Mineral Intelligence прогнозирует, что добыча в Индонезии к 2030 году составит 20 процентов мирового производства. [92]
Приложения
[ редактировать ]В 2016 году было использовано 116 000 тонн (128 000 коротких тонн) кобальта. [8] Кобальт используется в производстве высокоэффективных сплавов. [58] [59] Он также используется в некоторых аккумуляторных батареях.
Сплавы
[ редактировать ]на основе кобальта Суперсплавы исторически потребляли большую часть производимого кобальта. [58] [59] Температурная стабильность этих сплавов делает их пригодными для изготовления лопаток газовых турбин и авиационных реактивных двигателей сплавы на основе никеля превосходят их. монокристаллические , хотя по эксплуатационным характеристикам [93] Сплавы на основе кобальта также устойчивы к коррозии и износу, что делает их, как и титан , полезными для изготовления ортопедических имплантатов , которые не изнашиваются с течением времени. Разработка износостойких кобальтовых сплавов началась в первом десятилетии ХХ века со сплавов стеллита , содержащих хром с различным количеством вольфрама и углерода. Сплавы с хрома и карбидами вольфрама очень тверды и износостойки. [94] Специальные кобальт-хром- молибден сплавы , такие как виталлий, используются для изготовления деталей протеза (замены бедра и колена). [95] Сплавы кобальта также используются для зубного протезирования в качестве полезной замены никеля, который может быть аллергенным. [96] Некоторые быстрорежущие стали также содержат кобальт для повышения термостойкости и износостойкости. специальные сплавы алюминия, никеля, кобальта и железа, известные как алнико , а также самария и кобальта ( самарий-кобальтовый магнит используются В постоянных магнитах ) . [97] Он также легирован на 95% платиной для ювелирных изделий, в результате чего получается сплав, подходящий для тонкого литья, который также является слегка магнитным. [98]
Батареи
[ редактировать ]Оксид лития-кобальта (LiCoO 2 ) широко используется в катодах литий-ионных аккумуляторов . Материал состоит из слоев оксида кобальта с интеркалированным литием . Во время разрядки ( т. е . когда аккумулятор не заряжается активно) литий высвобождается в виде ионов лития. [99] Никель-кадмий [100] (NiCd) и никель-металлогидрид [101] (NiMH) аккумуляторы также содержат кобальт для улучшения окисления никеля в аккумуляторе. [100] Исследование Transparency Market Research оценило мировой рынок литий-ионных аккумуляторов в 30 миллиардов долларов в 2015 году и прогнозирует рост до более чем 75 миллиардов долларов США к 2024 году. [102]
Хотя в 2018 году большая часть кобальта в батареях использовалась в мобильных устройствах, [103] более недавнее применение кобальта — это аккумуляторные батареи для электромобилей. Спрос на кобальт в этой отрасли увеличился в пять раз, что делает актуальным поиск нового сырья в более стабильных регионах мира. [104] Ожидается, что спрос сохранится или увеличится по мере увеличения распространенности электромобилей. [105] Разведка в 2016–2017 годах включала территорию вокруг Кобальта, Онтарио, где многие серебряные рудники прекратили работу несколько десятилетий назад. [104] Производство кобальта для электромобилей выросло на 81% по сравнению с первой половиной 2018 года до 7200 тонн в первой половине 2019 года при емкости аккумулятора 46,3 ГВтч. [106] [107]
Поскольку неоднократно сообщалось о детском и рабском труде при добыче кобальта, в первую очередь на кустарных рудниках ДР Конго, технологические компании, стремящиеся к этической цепочке поставок, столкнулись с нехваткой этого сырья и [108] Цена на металлический кобальт достигла девятилетнего максимума в октябре 2017 года и составила более 30 долларов США за фунт по сравнению с 10 долларами США в конце 2015 года. [109] После переизбытка предложения цена упала до более нормальных 15 долларов в 2019 году. [110] [111] В ответ на проблемы с кустарной добычей кобальта в ДР Конго ряд поставщиков кобальта и их клиенты сформировали Fair Cobalt Alliance (FCA), целью которого является прекращение использования детского труда и улучшение условий труда при добыче и переработке кобальта. в ДР Конго. Членами FCA являются Zhejiang Huayou Cobalt , Sono Motors , Responsible Cobalt Initiative, Fairphone , Glencore и Tesla, Inc. [112] [113]
Европейский Союз проводит исследования возможности устранения требований к кобальту при производстве литий-ионных аккумуляторов. [114] [115] По состоянию на август 2020 года производители аккумуляторов постепенно снизили содержание кобальта в катоде с 1/3 ( NMC 111) до 1/5 (NMC 442) до нынешних 1/10 (NMC 811), а также ввели из литий-железо-фосфата, в состав катоды не содержащие кобальта. аккумуляторные блоки электромобилей, таких как Tesla Model 3 . [116] [117] В сентябре 2020 года Tesla объявила о своих планах по производству собственных аккумуляторных элементов, не содержащих кобальт. [118]
Литий-железо-фосфатные батареи официально превзошли тройные кобальтовые батареи в 2021 году с 52% установленной емкости. По оценкам аналитиков, в 2024 году ее доля рынка превысит 60%. [119]
Катализаторы
[ редактировать ]Некоторые соединения кобальта являются катализаторами окисления . Ацетат кобальта используется для преобразования ксилола в терефталевую кислоту , предшественник объемного полимера полиэтилентерефталата . кобальта Типичными катализаторами являются карбоксилаты (известные как кобальтовые мыла). Они также используются в красках, лаках и чернилах в качестве «высыхающих агентов» посредством окисления олифы . [120] [99] Однако их использование постепенно прекращается из-за опасений токсичности. [121] Те же карбоксилаты используются для улучшения сцепления между сталью и резиной в радиальных шинах со стальным кордом. Кроме того, они используются в качестве ускорителей в полиэфирных смол . системах [122] [123] [124]
Катализаторы на основе кобальта используются в реакциях с участием оксида углерода . Кобальт также является катализатором процесса Фишера-Тропша окиси гидрирования углерода в жидкое топливо. [125] гидроформилировании алкенов При часто используется октакарбонил кобальта . в качестве катализатора [126]
нефти При гидрообессеривании используется . катализатор, полученный из кобальта и молибдена Этот процесс помогает очистить нефть от примесей серы, мешающих переработке жидкого топлива. [99]
Пигменты и красители
[ редактировать ]

До 19 века кобальт преимущественно использовался в качестве пигмента. Со времен Средневековья его использовали для изготовления смальты — стекла синего цвета. Смальту производят путем плавления смеси обожженного минерала смальтита , кварца и карбоната калия , в результате чего получается темно-синее силикатное стекло, которое после производства тонко измельчается. [127] Смальту широко использовали для окраски стекла и в качестве пигмента для картин. [128] В 1780 году Свен Ринман открыл зеленый кобальт , а в 1802 году Луи-Жак Тенар открыл синий кобальт . [129] Кобальтовые пигменты, такие как кобальтовый синий (алюминат кобальта), лазурный синий (станнат кобальта (II), различные оттенки кобальтового зеленого (смесь оксида кобальта (II) и оксида цинка ) и кобальтовый фиолетовый ( фосфат кобальта ) используются в качестве пигменты художника из-за их превосходной хроматической стабильности. [130] [131]
Радиоизотопы
[ редактировать ]Кобальт-60 (Co-60 или 60 Co) полезен в качестве источника гамма-излучения, поскольку его можно производить в предсказуемых количествах с высокой активностью путем бомбардировки кобальта нейтронами . Он производит гамма-лучи с энергиями 1,17 и 1,33 МэВ . [29] [132]
Кобальт используется при дистанционной лучевой терапии , стерилизации предметов медицинского назначения и медицинских отходов, лучевой обработке пищевых продуктов для стерилизации (холодная пастеризация ), [133] промышленная радиография (например, рентгенограммы целостности сварных швов), измерения плотности (например, измерения плотности бетона) и датчики высоты заполнения резервуаров. Металл имеет досадное свойство образовывать мелкую пыль, что вызывает проблемы с радиационной защитой . Кобальт из аппаратов лучевой терапии представлял собой серьезную опасность, если его не утилизировать должным образом, и одна из самых серьезных аварий с радиационным загрязнением в Северной Америке произошла в 1984 году, когда выброшенный аппарат радиотерапии, содержащий кобальт-60, был по ошибке разобран на свалке в Хуаресе, Мексика. [134] [135]
Кобальт-60 имеет период радиоактивного полураспада 5,27 года. Потеря эффективности требует периодической замены источника при лучевой терапии и является одной из причин, по которой в современной лучевой терапии кобальтовые аппараты в значительной степени были заменены линейными ускорителями . [136] Кобальт-57 (Co-57 или 57 Co) представляет собой радиоизотоп кобальта, наиболее часто используемый в медицинских тестах, в качестве радиометки для поглощения витамина B 12 и для теста Шиллинга . Кобальт-57 используется в качестве источника в мессбауэровской спектроскопии и является одним из нескольких возможных источников в рентгеновских флуоресцентных устройствах. [137] [138]
Проекты ядерного оружия могут намеренно включать 59 Co, часть которого будет активирована при ядерном взрыве для производства 60 Ко. 60 Co, рассеянный в виде ядерных осадков , иногда называют кобальтовой бомбой . [139]
Магнитные материалы
[ редактировать ]Благодаря ферромагнитным свойствам кобальта его используют в производстве различных магнитных материалов. [141] Он используется при создании постоянных магнитов, таких как магниты Alnico , известные своими сильными магнитными свойствами, используемые в электродвигателях , датчиках и аппаратах МРТ . [142] [143] Он также используется в производстве магнитных сплавов, таких как кобальтовая сталь , широко используемых в носителях магнитной записи, таких как жесткие диски и ленты . [144]
Способность кобальта сохранять магнитные свойства при высоких температурах делает его ценным в приложениях магнитной записи, обеспечивая надежные устройства хранения данных . [145] Кобальт также способствует созданию специализированных магнитов, таких как самарий-кобальтовые и неодим-железо-борные магниты, которые жизненно важны в электронике для таких компонентов, как датчики и исполнительные механизмы . [146]
Другое использование
[ редактировать ]- Кобальт используется в гальванике из- за его привлекательного внешнего вида, твердости и устойчивости к окислению. [147]
- Он также используется в качестве грунтовки для фарфоровых эмалей . [148]
Биологическая роль
[ редактировать ]Кобальт необходим для обмена веществ всех животных. Это ключевой компонент кобаламина , также известного как витамин B12 , основного биологического резервуара кобальта как ультра-микроэлемента . [149] [150] Бактерии в желудке жвачных животных превращают соли кобальта в витамин B 12 , соединение, которое могут производить только бактерии или археи . Таким образом, минимальное присутствие кобальта в почве заметно улучшает здоровье пасущихся животных, и рекомендуется его потребление в дозе 0,20 мг/кг в день, поскольку у них нет другого источника витамина B 12 . [151]
Белки на основе кобаламина используют коррин для удержания кобальта. Коэнзим B 12 имеет реакционноспособную связь C-Co, которая участвует в реакциях. [152] У человека B 12 имеет два типа алкильных лигандов : метил и аденозил. MeB 12 способствует переносу метильной (-CH 3 ) группы. Аденозильный вариант B 12 катализирует перегруппировки, при которых атом водорода непосредственно переносится между двумя соседними атомами с сопутствующей заменой второго заместителя X, который может представлять собой атом углерода с заместителями, атом кислорода спирта или амина. Метилмалонил-коэнзим А-мутаза (MUT) превращает MML-CoA в Su-CoA , что является важным этапом извлечения энергии из белков и жиров. [153]
Хотя они гораздо менее распространены, чем другие металлопротеины известны и другие кобальтопротеины (например, цинка и железа), помимо B 12 . Эти белки включают метионинаминопептидазу 2 , фермент, который встречается у людей и других млекопитающих и не использует корриновое кольцо B 12 , но напрямую связывает кобальт. Другим некорриновым кобальтовым ферментом является нитрилгидратаза , фермент бактерий, который метаболизирует нитрилы . [154]
Дефицит кобальта
[ редактировать ]У человека потребление кобальтсодержащего витамина B 12 удовлетворяет все потребности в кобальте. Для крупного рогатого скота и овец, которые удовлетворяют потребности в витамине B12 за счет синтеза резидентными бактериями в рубце, существует функция неорганического кобальта. В начале 20 века, во время развития земледелия на вулканическом плато Северного острова в Новой Зеландии, крупный рогатый скот страдал от так называемой «кустарниковой болезни». Было обнаружено, что в вулканических почвах отсутствуют соли кобальта, необходимые для пищевой цепи крупного рогатого скота. [155] [156] Было обнаружено, что «береговая болезнь» овец в пустыне Девяносто миль на юго-востоке Южной Австралии в 1930-х годах возникла из-за недостатка в питании микроэлементов кобальта и меди. животного Дефицит кобальта был преодолен за счет разработки «кобальтовых пуль» — плотных гранул оксида кобальта, смешанных с глиной, которые вводились перорально и попадали в рубец . [ нужны разъяснения ] [157] [156] [158]
- Овцы с дефицитом кобальта
Проблемы со здоровьем
[ редактировать ]| Опасности | |
|---|---|
| СГС Маркировка : [159] | |
  | |
| Опасность | |
| Х302 , Х317 , Х319 , Х334 , Х341 , Х350 , Х360Ф , Х412 | |
| P273 , P280 , P301+P312 , P302+P352 , P305+P351+P338 , P308+P313 | |
| NFPA 704 (огненный алмаз) | |
По оценкам, значение LD для растворимых солей кобальта 50 составляет от 150 до 500 мг/кг. [160] В США Управление по охране труда (OSHA) установило допустимый предел воздействия (PEL) на рабочем месте как средневзвешенное по времени значение (TWA) 0,1 мг/м. 3 . Национальный институт охраны труда (NIOSH) установил рекомендуемый предел воздействия (REL) 0,05 мг/м. 3 , средневзвешенное по времени. ( Значение IDLH непосредственно опасно для жизни и здоровья) составляет 20 мг/м. 3 . [161]
Однако хроническое употребление кобальта в дозах, намного меньших смертельной, вызывает серьезные проблемы со здоровьем. В 1966 году добавление соединений кобальта для стабилизации пивной пены в Канаде привело к своеобразной форме токсин-индуцированной кардиомиопатии , которая стала известна как кардиомиопатия любителя пива . [162] [163]
металлический кобальт подозревается в вызывании рака (т.е., возможно, канцерогенном , группа 2B IARC ). Кроме того, согласно монографиям Международного агентства по исследованию рака (IARC), [164]
При вдыхании вызывает проблемы с дыханием. [165] При прикосновении он также вызывает проблемы с кожей; После никеля и хрома кобальт является основной причиной контактного дерматита . [166]
Примечания
[ редактировать ]- ^ Тепловое расширение кобальта анизотропно : коэффициенты для каждой оси кристалла составляют (при 20 ° C): α a = 10,9 × 10. −6 /К, α с = 17,9 × 10 −6 /K, а α среднее = α V /3 = 12,9 × 10. −6 /К.
Ссылки
[ редактировать ]- ^ «кобальт». Оксфордский словарь английского языка (2-е изд.). Издательство Оксфордского университета . 1989.
- ^ «Стандартные атомные массы: кобальт» . ЦИАВ . 2017.
- ^ Прохаска, Томас; Ирргехер, Йоханна; Бенефилд, Жаклин; Бёлке, Джон К.; Чессон, Лесли А.; Коплен, Тайлер Б.; Дин, Типинг; Данн, Филип Дж. Х.; Грёнинг, Манфред; Холден, Норман Э.; Мейер, Харро Эй Джей (4 мая 2022 г.). «Стандартные атомные массы элементов 2021 (Технический отчет ИЮПАК)» . Чистая и прикладная химия . дои : 10.1515/pac-2019-0603 . ISSN 1365-3075 .
- ^ Перейти обратно: а б Арбластер, Джон В. (2018). Некоторые значения кристаллографических свойств элементов . Парк материалов, Огайо: ASM International. ISBN 978-1-62708-155-9 .
- ^ Перейти обратно: а б с д Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . стр. 1117–1119. ISBN 978-0-08-037941-8 .
- ^ Кондев, ФГ; Ван, М.; Хуанг, WJ; Наими, С.; Ауди, Г. (2021). «Оценка ядерных свойств NUBASE2020» (PDF) . Китайская физика C . 45 (3): 030001. doi : 10.1088/1674-1137/abddae .
- ^ «кобальт». Оксфордский словарь английского языка (2-е изд.). Издательство Оксфордского университета . 1989.
- ^ Перейти обратно: а б Даниэль Бохове (1 ноября 2017 г.). «Будущее электромобилей стимулирует ажиотаж кобальта: растущий спрос на продукт вдохнул новую жизнь в небольшой городок Онтарио» . Ванкувер Сан . Блумберг. Архивировано из оригинала 28 июля 2019 года.
- ^ «Катализаторы» . Институт Кобальта . Архивировано из оригинала 16 августа 2023 года . Проверено 15 августа 2023 г.
- ^ Энхаг, Пер (2004). «Кобальт» . Энциклопедия элементов: технические данные, история, обработка, применение . Уайли. п. 667. ИСБН 978-3-527-30666-4 .
- ^ Мурти, VS R (2003). «Магнитные свойства материалов» . Структура и свойства конструкционных материалов . McGraw-Hill Education (India) Pvt Limited. п. 381. ИСБН 978-0-07-048287-6 .
- ^ Челоцци, Сальваторе; Аранео, Родольфо; Ловат, Джампьеро (1 мая 2008 г.). Электромагнитное экранирование . Уайли. п. 27. ISBN 978-0-470-05536-6 .
- ^ Ли, Б.; Альсенц, Р.; Игнатьев А.; Ван Хов, М.; Ван Хов, Массачусетс (1978). «Поверхностные структуры двух аллотропных фаз кобальта». Физический обзор B . 17 (4): 1510–1520. Бибкод : 1978PhRvB..17.1510L . дои : 10.1103/PhysRevB.17.1510 .
- ^ «Свойства и факты кобальта» . Американские элементы . Архивировано из оригинала 2 октября 2008 года . Проверено 19 сентября 2008 г.
- ^ Кобальт . Брюссель: Информационный центр кобальта. 1966. с. 45.
- ^ Перейти обратно: а б с д и Холлеман, AF; Виберг, Э.; Виберг, Н. (2007). «Кобальт». Учебник неорганической химии (на немецком языке) (102-е изд.). де Грюйтер. стр. 1146–1152. ISBN 978-3-11-017770-1 .
- ^ Хаускрофт, CE; Шарп, AG (2008). Неорганическая химия (3-е изд.). Прентис Холл. п. 722. ИСБН 978-0-13-175553-6 .
- ^ Ратли, Фрэнк (6 декабря 2012 г.). «Элементы минералогии» Ратли . Springer Science & Business Media. п. 40. ИСБН 978-94-011-9769-4 .
- ^ Кребс, Роберт Э. (2006). История и использование химических элементов нашей Земли: Справочник (2-е изд.). Издательская группа Гринвуд. п. 107. ИСБН 0-313-33438-2 .
- ^ Петитто, Сара С.; Марш, Эрин М.; Карсон, Грегори А.; Лангелл, Марджори А. (2008). «Химия поверхности оксида кобальта: взаимодействие CoO(100), Co3O4(110) и Co3O4(111) с кислородом и водой» . Журнал молекулярного катализа A: Химический . 281 (1–2): 49–58. doi : 10.1016/j.molcata.2007.08.023 . S2CID 28393408 .
- ^ Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . стр. 1119–1120. ISBN 978-0-08-037941-8 .
- ^ Вернер, А. (1912). «О познании несимметричного атома кобальта. В» . Химические отчеты . 45 : 121-130. дои : 10.1002/cber.19120450116 .
- ^ Гисперт, Жоан Рибас (2008). «Ранние теории координационной химии» . Координационная химия . Уайли. стр. 31–33. ISBN 978-3-527-31802-5 . Архивировано из оригинала 5 мая 2016 года . Проверено 27 июня 2015 г.
- ^ Джеймс Э. Хаус (2008). Неорганическая химия . Академическая пресса. стр. 767–. ISBN 978-0-12-356786-4 . Проверено 16 мая 2011 г.
- ^ Чарльз М. Старкс; Чарльз Леонард Лиотта; Марк Халперн (1994). Фазовый катализ: основы, применение и промышленные перспективы . Спрингер. стр. 600–. ISBN 978-0-412-04071-9 . Проверено 16 мая 2011 г.
- ^ Сигел, Астрид; Сигель, Хельмут; Сигел, Роланд, ред. (2010). Металлоорганические соединения в окружающей среде и токсикологии (ионы металлов в науках о жизни) . Кембридж , Великобритания : Издательство Королевского химического общества . п. 75. ИСБН 978-1-84755-177-1 .
- ^ Бирн, Эрин К.; Ричесон, Дэррин С.; Теопольд, Клаус Х. (1 января 1986 г.). «Тетракис (1-норборнил) кобальт, низкоспиновый тетраэдрический комплекс переходного металла первого ряда». Журнал Химического общества, Chemical Communications (19): 1491. doi : 10.1039/C39860001491 . ISSN 0022-4936 .
- ^ Бирн, Эрин К.; Теопольд, Клаус Х. (1 февраля 1987 г.). «Окислительно-восстановительная химия тетракис (1-норборнил) кобальта. Синтез и характеристика алкила кобальта (V) и скорость самообмена пары Co (III) / Co (IV)». Журнал Американского химического общества . 109 (4): 1282–1283. дои : 10.1021/ja00238a066 . ISSN 0002-7863 .
- ^ Перейти обратно: а б с Ауди, Жорж; Берсильон, Оливье; Блашо, Жан; Вапстра, Аалдерт Хендрик (2003), « Оценка NUBASE свойств ядра и распада» , Nuclear Physics A , 729 : 3–128, Бибкод : 2003NuPhA.729....3A , doi : 10.1016/j.nuclphysa.2003.11 .001
- ^ Кобальт , Британская энциклопедия Интернет.
- ^ Пулак, Джемаль (1998). «Кораблекрушение Улубурун: обзор». Международный журнал морской археологии . 27 (3): 188–224. дои : 10.1111/j.1095-9270.1998.tb00803.x .
- ^ Хендерсон, Джулиан (2000). "Стекло". Наука и археология материалов: исследование неорганических материалов . Рутледж. п. 60. ИСБН 978-0-415-19933-9 .
- ^ Ререн, Т. (2003). «Аспекты производства кобальтово-синего стекла в Египте». Археометрия . 43 (4): 483–489. дои : 10.1111/1475-4754.00031 .
- ^ Перейти обратно: а б Деннис, WH (2010). «Кобальт» . Металлургия: 1863–1963 гг . AldineTransaction. стр. 254–256. ISBN 978-0-202-36361-5 .
- ^ «Обзоры тарифной информации по статьям параграфа 1 Закона о тарифах 1913 года… и соответствующим статьям в других параграфах» . 17 августа 2023 г.
- ^ Георг Брандт впервые показал, что кобальт является новым металлом в: Г. Брандт (1735) «Dissertatio de semimetallis» (Диссертация о полуметаллах), Acta Literaria et Scientiarum Sveciae (Журнал шведской литературы и науки), vol. 4, страницы 1–10.
См. также: (1) Г. Брандт (1746) «Rön och anmärkningar angäende en Synnerlig färg—cobolt» (Наблюдения и замечания относительно необычного пигмента — кобальта), Kongliga Svenska vetenskapsakademiens Handingar (Труды Шведской королевской академии наук), том. 7, стр. 119–130; (2) Г. Брандт (1748) «Cobalti nova specinata et descripta» (Кобальт, новый элемент, исследованный и описанный), Acta Regiae Societatis Scientiarum Upsaliensis (Журнал Королевского научного общества Уппсалы), 1-я серия, том. 3, стр. 33–41; (3) Джеймс Л. Маршалл и Вирджиния Р. Маршалл (весна 2003 г.) «Повторное открытие элементов: Риддархиттан, Швеция» . The Hexagon (официальный журнал Альфа-Хи-Сигма химиков ), том. 94, нет. 1, страницы 3–8. - ^ Ван, Шицзе (2006). «Кобальт — его восстановление, переработка и применение». Журнал Общества минералов, металлов и материалов . 58 (10): 47–50. Бибкод : 2006JOM....58j..47W . дои : 10.1007/s11837-006-0201-y . S2CID 137613322 .
- ^ Уикс, Мария Эльвира (1932). «Открытие элементов. III. Некоторые металлы восемнадцатого века». Журнал химического образования . 9 (1): 22. Бибкод : 1932ЖЧЭд...9...22Вт . дои : 10.1021/ed009p22 .
- ^ Рамберг, Ивар Б. (2008). Создание земли: геология Норвегии . Геологическое общество. стр. 98–. ISBN 978-82-92394-42-7 . Проверено 30 апреля 2011 г.
- ^ К. Томлинсон, изд. (1852). «Кобальт» . Циклопедия полезных искусств и производств . стр. 400–403.
- ^ Перейти обратно: а б Веллмер, Фридрих-Вильгельм; Беккер-Платен, Йенс Дитер. «Глобальные нетопливные минеральные ресурсы и устойчивое развитие» . Геологическая служба США.
- ^ Перейти обратно: а б Вестинг, Артур Х; Стокгольмский международный институт исследования проблем мира (1986). «кобальт» . Глобальные ресурсы и международный конфликт: экологические факторы в стратегической политике и действиях . Издательство Оксфордского университета. стр. 75–78. ISBN 978-0-19-829104-6 .
- ^ Ливингуд, Дж.; Сиборг, Гленн Т. (1938). «Долгоживущие радиоизотопы кобальта». Физический обзор . 53 (10): 847–848. Бибкод : 1938PhRv...53..847L . дои : 10.1103/PhysRev.53.847 .
- ^ Ву, CS (1957). «Экспериментальная проверка сохранения четности при бета-распаде» . Физический обзор . 105 (4): 1413–1415. Бибкод : 1957PhRv..105.1413W . дои : 10.1103/PhysRev.105.1413 .
- ^ Врублевский, АК (2008). «Падение паритета - революция, произошедшая пятьдесят лет назад». Акта Физика Полоника Б. 39 (2): 251. Бибкод : 2008AcPPB..39..251W . S2CID 34854662 .
- ^ Перейти обратно: а б Робертс, Стивен; Ганн, Гас (6 января 2014 г.), Ганн, Гас (редактор), «Кобальт» , Справочник по критическим металлам (1-е изд.), Wiley, стр. 122–149, doi : 10.1002/9781118755341.ch6 , ISBN 978-0-470-67171-9 , получено 1 декабря 2023 г.
- ^ «Самая богатая дыра в горе» . Популярная механика : 65–69. 1952.
- ^ Оверленд, Индра (1 марта 2019 г.). «Геополитика возобновляемой энергетики: развенчание четырех возникающих мифов» . Энергетические исследования и социальные науки . 49 : 36–40. Бибкод : 2019ERSS...49...36O . дои : 10.1016/j.erss.2018.10.018 . HDL : 11250/2579292 . ISSN 2214-6296 .
- ^ Птицын Д.А.; Чечеткин, В.М. (1980). «Создание элементов группы железа при взрыве сверхновой». Советские астрономические письма . 6 : 61–64. Бибкод : 1980СвАЛ....6...61П .
- ^ Доминго, Хосе Л. (1989), «Кобальт в окружающей среде и его токсикологические последствия» , в Уэр, Джордж У. (ред.), Обзоры загрязнения окружающей среды и токсикологии , том. 108, Нью-Йорк: Springer, стр. 105–132, номер документа : 10.1007/978-1-4613-8850-0_3 , ISBN. 978-1-4613-8850-0 , PMID 2646660 , получено 30 ноября 2023 г.
- ^ Нуччо, Паскуале Марио; Валенца, Мариано (1979). «Определение металлического железа, никеля и кобальта в метеоритах» (PDF) . Отчеты Итальянского общества минералогии и петрографии . 35 (1): 355–360.
- ^ Керр, Пол Ф. (1945). «Каттьерит и ваэсит: новые Co-Ni минералы из Бельгийского Конго» (PDF) . Американский минералог . 30 : 483–492.
- ^ Бакли, АН (1987). «Поверхностное окисление кобальтита». Австралийский химический журнал . 40 (2): 231. doi : 10.1071/CH9870231 .
- ^ Янг, Р. (1957). «Геохимия кобальта». Geochimica et Cosmochimica Acta . 13 (1): 28–41. Бибкод : 1957GeCoA..13...28Y . дои : 10.1016/0016-7037(57)90056-X .
- ^ Тальхаут, Рейнске; Шульц, Томас; Флорек, Ева; Ван Бентем, Ян; Вестер, Пит; Опперхейзен, Антон (2011). «Опасные соединения в табачном дыме» . Международный журнал экологических исследований и общественного здравоохранения . 8 (12): 613–628. дои : 10.3390/ijerph8020613 . ISSN 1660-4601 . ПМК 3084482 . ПМИД 21556207 .
- ^ Пурхаббаз, А; Пурхаббаз, Х (2012). «Исследование токсичных металлов в табаке различных марок иранских сигарет и связанных с этим проблем со здоровьем» . Иранский журнал фундаментальных медицинских наук . 15 (1): 636–644. ПМЦ 3586865 . ПМИД 23493960 .
- ^ Статистика и информация о кобальте (PDF) , Геологическая служба США, 2023 г.
- ^ Перейти обратно: а б с Шедд, Ким Б. «Ежегодник минералов 2006: Кобальт» (PDF) . Геологическая служба США . Проверено 26 октября 2008 г.
- ^ Перейти обратно: а б с Шедд, Ким Б. «Отчет о сырьевых товарах за 2008 год: кобальт» (PDF) . Геологическая служба США . Проверено 26 октября 2008 г.
- ^ Перейти обратно: а б Генри Сандерсон (14 марта 2017 г.). «Безумный взлет кобальта находится под угрозой из-за Катанги в Конго» . Файнэншл Таймс.
- ^ Мюррей В. Хитцман, Артур А. Букстром, Джон Ф. Слэк и Майкл Л. Зиентек (2017). «Кобальт — виды месторождений и поиск первичных месторождений» . Геологическая служба США . Проверено 17 апреля 2021 г.
- ^ «Цена на кобальт: BMW избегает загадки Конго – пока» . Майнинг.com . Проверено 17 апреля 2021 г.
- ^ Дэвис, Джозеф Р. (2000). Справочник по специальности АСМ: никель, кобальт и их сплавы . АСМ Интернешнл. п. 347. ИСБН 0-87170-685-7 .
- ^ «Кобальт» (PDF) . Геологическая служба США, Обзоры полезных ископаемых. Январь 2016. стр. 52–53.
- ^ Уилсон, Томас (26 октября 2017 г.). «Мы все будем полагаться на Конго в производстве электромобилей» . Блумберг . Проверено 25 марта 2023 г.
- ^ «Избыток запасов кобальта у Glencore сдерживает цены, несмотря на приостановку добычи» . Рейтер . 8 августа 2019 г.
- ^ «Glencore закрывает рудник Мутанда, 20% мировых поставок кобальта прекращается» . Эталонный минеральный интеллект . 28 ноября 2019 г.
шахта будет поставлена на уход и техническое обслуживание сроком не менее двух лет.
- ^ «Производство полезных ископаемых в Африке» (PDF) . Британская геологическая служба . Проверено 6 июня 2009 г.
- ^ Перейти обратно: а б Франкель, Тодд К. (30 сентября 2016 г.). «Добыча кобальта для производства литий-ионных аккумуляторов сопряжена с высокими человеческими затратами» . Вашингтон Пост . Проверено 18 октября 2016 г.
- ^ Муха, Лена; Садоф, Карли Домб; Франкель, Тодд К. (28 февраля 2018 г.). «Перспектива – Скрытые затраты на добычу кобальта» . Вашингтон Пост . ISSN 0190-8286 . Проверено 7 марта 2018 г.
- ^ Тодд К. Франкель (30 сентября 2016 г.). «КОБАЛЬТОВЫЙ ТРУБОПРОВОД: путь от смертоносных вырытых вручную мин в Конго к телефонам и ноутбукам потребителей» . Вашингтон Пост .
- ^ Детский труд в производстве аккумуляторов для смартфонов и электромобилей . Amnesty International (19 января 2016 г.). Проверено 7 января 2018 г.
- ^ Кроуфорд, Алекс. Познакомьтесь с 8-летним Дорсеном, который добывает кобальт, чтобы заставить работать ваш смартфон . Sky News Великобритания . Проверено 7 января 2018 г.
- ^ Вы сейчас держите в руках продукт детского труда? (Видео) . Sky News UK (28 февраля 2017 г.). Проверено 7 января 2018 г.
- ^ Райзингер, Дон. (2017-03-03) Разоблачение детского труда побуждает Apple изменить политику поставщиков . Удача . Проверено 7 января 2018 г.
- ^ Франкель, Тодд К. (03.03.2017) Apple продолжает принимать жесткие меры в отношении поставщика кобальта в Конго, поскольку детский труд сохраняется . Вашингтон Пост . Проверено 7 января 2018 г.
- ^ Веллмер, Фридрих-Вильгельм; Беккер-Платен, Йенс Дитер. «Глобальные нетопливные минеральные ресурсы и устойчивое развитие» . Проверено 16 мая 2009 г.
- ^ Аудиторский отчет Congo Dongfang International Mining sarl . DNV-GL Проверено 18 апреля 2021 г.
- ^ «CAMEC – Чемпион по кобальту» (PDF) . Международная горнодобывающая промышленность. Июль 2008 года . Проверено 18 ноября 2011 г.
- ^ Эми Уизерден (6 июля 2009 г.). «Ежедневный подкаст – 6 июля 2009 г.» . Майнинг еженедельно . Проверено 15 ноября 2011 г.
- ^ Галли, Эндрю; Маккалоу, Эрин; Шедд, Ким (август 2019 г.). «Внутреннее и внешнее влияние Китая в глобальной цепочке поставок кобальта» . Ресурсная политика . 62 : 317–323. Бибкод : 2019РеПол..62..317Г . doi : 10.1016/j.resourpol.2019.03.015 .
- ^ «От кобальта к автомобилям: как Китай эксплуатирует детский и принудительный труд в Конго | Исполнительная комиссия Конгресса по Китаю» . www.cecc.gov . 14 ноября 2023 г.
- ^ Домой, Энди (19 февраля 2024 г.). «Запад бросает вызов важнейшим запасам полезных ископаемых Китая в Африке» . Рейтер .
- ↑ Mining Journal «Инвесторы отката [Айвенго] ждали», Aspermont Ltd., Лондон, Великобритания, 22 февраля 2018 г. Проверено 21 ноября 2018 г.
- ↑ Шабалала, Занди «Кобальт будет объявлен стратегическим минералом в Конго», Reuters, 14 марта 2018 г. Получено 3 октября 2018 г.]
- ^ Reuters , « Кабила в Конго подписывает новый кодекс горнодобывающей промышленности », 14 марта 2018 г. Проверено 3 октября 2018 г.
- ^ «ДРК объявляет кобальт «стратегическим » » , Mining Journal , 4 декабря 2018 г. Проверено 7 октября 2020 г.
- ^ «Иск США по кобальту привлекает внимание к «устойчивым» технологиям» . Времена устойчивого развития . 17 декабря 2019 года . Проверено 16 сентября 2020 г.
- ^ «Apple и Google борются с обвинением в детском труде на кобальтовых рудниках – Law360» . www.law360.com . Проверено 16 сентября 2020 г.
- ^ Канадский город-призрак, который Тесла возвращает к жизни . Блумберг (31 октября 2017 г.). Проверено 7 января 2018 г.
- ^ «Производство никеля на Кубе превышает 50 000 метрических тонн » . Деловой отчет Кубы. Проверено 18 апреля 2021 г.
- ^ «Крупнейшим источником кобальта за пределами Африки сейчас является Индонезия» . Новости Блумберга . 8 февраля 2023 г. . Проверено 10 мая 2023 г.
- ^ Доначи, Мэтью Дж. (2002). Суперсплавы: Техническое руководство . АСМ Интернешнл. ISBN 978-0-87170-749-9 .
- ^ Кэмпбелл, Флейк С. (30 июня 2008 г.). «Кобальт и кобальтовые сплавы» . Элементы металлургии и конструкционные сплавы . АСМ Интернешнл. стр. 557–558. ISBN 978-0-87170-867-0 .
- ^ Мишель, Р.; Нольте, М.; Райх М.; Лёр, Ф. (1991). «Системные эффекты имплантированных протезов из кобальт-хромовых сплавов». Архив ортопедической и травматологической хирургии . 110 (2): 61–74. дои : 10.1007/BF00393876 . ПМИД 2015136 . S2CID 28903564 .
- ^ Дисеги, Джон А. (1999). Сплавы на основе кобальта для биомедицинских применений . АСТМ Интернешнл. п. 34. ISBN 0-8031-2608-5 .
- ^ Люборский, ИП; Мендельсон, Л.И.; Пейн, Т.О. (1957). «Воспроизведение свойств сплавов постоянных магнитов Alnico с удлиненными однодоменными частицами кобальта и железа». Журнал прикладной физики . 28 (344): 344. Бибкод : 1957JAP....28..344L . дои : 10.1063/1.1722744 .
- ^ Биггс, Т.; Тейлор, СС; Ван дер Линген, Э. (2005). «Упрочнение платиновых сплавов для потенциального применения в ювелирных изделиях» . Обзор платиновых металлов . 49 : 2–15. дои : 10.1595/147106705X24409 .
- ^ Перейти обратно: а б с Хокинс, М. (2001). «Зачем нам кобальт». Прикладная наука о Земле . 110 (2): 66–71. Бибкод : 2001ApEaS.110...66H . дои : 10.1179/aes.2001.110.2.66 . S2CID 137529349 .
- ^ Перейти обратно: а б Армстронг, доктор медицинских наук; Бриггс, GWD; Чарльз, Э.А. (1988). «Некоторые эффекты добавления кобальта в электрод из гидроксида никеля». Журнал прикладной электрохимии . 18 (2): 215–219. дои : 10.1007/BF01009266 . S2CID 97073898 .
- ^ Чжан, П.; Ёкояма, Тосиро; Итабаши, Осаму; Вакуи, Ёсито; Сузуки, Тосисиге М.; Иноуэ, Кацутоши (1999). «Восстановление металлических ценностей из отработанных никель-металлогидридных аккумуляторных батарей». Журнал источников энергии . 77 (2): 116–122. Бибкод : 1999JPS....77..116Z . дои : 10.1016/S0378-7753(98)00182-7 .
- ^ Уэст, Карл (29 июля 2017 г.). «Электрические мечты автопроизводителей зависят от поставок редких минералов» . Хранитель . eISSN 1756-3224 . ISSN 0261-3077 . OCLC 60623878 . Архивировано из оригинала 6 июня 2022 года . Проверено 29 июня 2022 г.
- ^ Кастеллано, Роберт (13 октября 2017 г.). «Как минимизировать риск цепочки поставок кобальта Tesla» . В поисках Альфа . Архивировано из оригинала 4 апреля 2022 года . Проверено 29 июня 2022 г.
- ^ Перейти обратно: а б «Поскольку поставки кобальта сокращаются, LiCo Energy Metals объявляет о открытии двух новых кобальтовых рудников» . Cleantechnica.com . 28 ноября 2017 г. Проверено 7 января 2018 г.
- ^ Шиллинг, Эрик (31 октября 2017 г.). «У нас может не хватить полезных ископаемых даже для удовлетворения спроса на электромобили» . Ялопник . Архивировано из оригинала 1 апреля 2022 года . Проверено 29 июня 2022 г.
- ^ «Состояние заряда: электромобили, аккумуляторы и материалы для аккумуляторов (бесплатный отчет от @AdamasIntel)» . Адамас Интеллект . 20 сентября 2019 года. Архивировано из оригинала 20 октября 2019 года . Проверено 20 октября 2019 г.
- ^ «Маскмобили сбивают соперников с дороги» . МАЙНИНГ.КОМ . 26 сентября 2019 г. Архивировано из оригинала 30 сентября 2019 г.
- ^ Гермес, Дженнифер. (2017-05-31) Tesla и GE сталкиваются с серьезной нехваткой кобальта, полученного этическим путем . Экологический лидер.com. Проверено 7 января 2018 г.
- ^ Электромобилям еще предстоит превратить рынок кобальта в золотую жилу - Норникель . MINING.com (30 октября 2017 г.). Проверено 7 января 2018 г.
- ^ «Почему упали цены на кобальт» . Международный банкир . 31 июля 2019 г. Архивировано из оригинала 30 ноября 2019 г.
- ^ «Цены на кобальт и графики цен на кобальт — InvestmentMine» . www.infomine.com .
- ^ «Tesla присоединяется к «Fair Cobalt Alliance» для улучшения кустарной добычи полезных ископаемых в ДРК» . Mining-Technology.com . 8 сентября 2020 г. Проверено 26 сентября 2020 г.
- ^ Клендер, Джоуи (8 сентября 2020 г.). «Tesla присоединяется к Fair Cobalt Alliance в поддержку усилий по добыче полезных ископаемых» . teslarati.com . Проверено 26 сентября 2020 г.
- ^ Веб-сайт «Безкобальтовые аккумуляторы для автомобильной техники FutuRe»
- ^ Проект COBRA в Европейском Союзе
- ^ Ю Чхоль, Ким (14 августа 2020 г.). «Стратегия Tesla в области аккумуляторов, последствия для LG и Samsung» . «Корея Таймс» . Проверено 26 сентября 2020 г.
- ^ Шахан, Закари (31 августа 2020 г.). «Литий, никель и Тесла, о боже!» . Cleantechnica.com . Проверено 26 сентября 2020 г.
- ^ Кальма, Жюстин (22 сентября 2020 г.). «Tesla будет производить катоды для аккумуляторов электромобилей без кобальта» . theverge.com . Проверено 26 сентября 2020 г.
- ^ «Литий-железо-фосфатный аккумулятор EV наносит ответный удар» . Energytrend.com . 25 мая 2022 г.
- ^ «Кобальтовый сиккатив для красок | Cobalt Cem-All®» . Борчерс . Проверено 15 мая 2021 г.
- ^ Холстед, Джошуа (апрель 2023 г.). «Расширенное применение и повышение долговечности алкидных покрытий с использованием высокоэффективных катализаторов» . ПокрытияТех . 20 (3): 45–55 – через Американскую ассоциацию покрытий.
- ^ Уэзерхед, Р.Г. (1980), Уэзерхед, Р.Г. (редактор), «Катализаторы, ускорители и ингибиторы для ненасыщенных полиэфирных смол», Технология FRP: Системы смол, армированных волокном , Дордрехт: Springer Нидерланды, стр. 204–239, doi : 10.1007/ 978-94-009-8721-0_10 , ISBN 978-94-009-8721-0
- ^ «Выбор продукта | AOC» . aocresins.com . Проверено 15 мая 2021 г.
- ^ «Comar Chemicals – Ускорение полиэфиров» . www.comarchemicals.com . Архивировано из оригинала 15 мая 2021 года . Проверено 15 мая 2021 г.
- ^ Ходаков Андрей Юрьевич; Чу, Вэй и Фонгарланд, Паскаль (2007). «Достижения в разработке новых кобальтовых катализаторов Фишера-Тропша для синтеза длинноцепочечных углеводородов и чистого топлива». Химические обзоры . 107 (5): 1692–1744. дои : 10.1021/cr050972v . ПМИД 17488058 .
- ^ Эбрар, Фредерик и Кальк, Филипп (2009). «Кобальт-катализируемое гидроформилирование алкенов: генерация и переработка карбонильных форм и каталитический цикл». Химические обзоры . 109 (9): 4272–4282. дои : 10.1021/cr8002533 . ПМИД 19572688 .
- ^ Оверман, Фредерик (1852). Трактат о металлургии . Д. Эпплтон и компания. стр. 631–637 .
- ^ Мюлеталер, Бруно; Тиссен, Жан; Мюлеталер, Бруно (1969). «Смальта». Исследования в области консервации . 14 (2): 47–61. дои : 10.2307/1505347 . JSTOR 1505347 .
- ^ Гелен, А. Ф. (1803 г.). «О приготовлении синего цвета из кобальта, столь же красивого, как ультрамарин. Гражданин Тенар» . Новый общий химический журнал, том 2 . Х. Фрелих. (Немецкий перевод из LJ Thénard; Journal des Mines; 12 брюмера 1802 г.; стр. 128–136)
- ^ Виттевен, HJ; Фарнау, Э.Ф. (1921). «Цвета, создаваемые оксидами кобальта» . Промышленная и инженерная химия . 13 (11): 1061–1066. дои : 10.1021/ie50143a048 .
- ^ Венецкий, С. (1970). «Заряд оружия мира». Металлург . 14 (5): 334–336. дои : 10.1007/BF00739447 . S2CID 137225608 .
- ^ Мандевиль, К.; Фулбрайт, Х. (1943). «Энергии γ-лучей от Sb 122 , компакт-диск 115 , и 192 , Мн 54 , Зн 65 и Ко 60 ". Physical Review . 64 (9–10): 265–267. Бибкод : 1943PhRv...64..265M . doi : 10.1103/PhysRev.64.265 .
- ^ Уилкинсон, В.М.; Гулд, Дж. (1998). Облучение пищевых продуктов: справочное руководство . Вудхед. п. 53. ИСБН 978-1-85573-359-6 .
- ^ Блейксли, Сандра (1 мая 1984 г.). «Авария в Хуаресе» . Нью-Йорк Таймс . Проверено 6 июня 2009 г.
- ^ «Рассеяние бесхозных источников в Сьюдад-Хуаресе, 1983 год» . Вм. Роберт Джонстон. 23 ноября 2005 года . Проверено 24 октября 2009 г.
- ^ Национальный исследовательский совет (США). Комитет по использованию и замене источников радиации; Национальный исследовательский совет (США). Совет по ядерным и радиационным исследованиям (январь 2008 г.). Использование и замена источников излучения: сокращенная версия . Пресса национальных академий. стр. 35–. ISBN 978-0-309-11014-3 . Проверено 29 апреля 2011 г.
- ^ Мейер, Тереза (30 ноября 2001 г.). Обзор обследования физиотерапевта . Компания СЛАК. п. 368. ИСБН 978-1-55642-588-2 .
- ^ Кальницкий, Д.; Сингхви, Р. (2001). «Полевой портативный РФА-анализ проб окружающей среды» . Журнал опасных материалов . 83 (1–2): 93–122. Бибкод : 2001JГцМ...83...93К . дои : 10.1016/S0304-3894(00)00330-7 . ПМИД 11267748 .
- ^ Пейн, ЛР (1977). «Опасности кобальта». Профессиональная медицина . 27 (1): 20–25. дои : 10.1093/ocmed/27.1.20 . ПМИД 834025 .
- ^ Пури-Мирза, Амна (2020). «Марокко Кобальт Производство» . Статистика .
- ^ Тренто, Чин (14 апреля 2024 г.). «Для чего используется кобальт в повседневной жизни» . Стэнфордские продвинутые материалы . Проверено 24 июня 2024 г.
- ^ Хорват, Джон; Ормерод, Джон, ред. (2022). «Глава 11: Покрытия из постоянных магнитов и процедуры испытаний» . Современные постоянные магниты . Издательство Вудхед. стр. 371–402. ISBN 9780323886581 . Проверено 24 июня 2024 г.
- ^ «Магниты алнико: более пристальный взгляд на их историю, свойства и применение» . Радиальный магнит . Проверено 24 июня 2024 г.
- ^ Мохапатра, Джеотиканта; Син, Мэйин (2020). «Магнитные и полужесткие материалы на основе кобальта и кобальтовых сплавов». Журнал сплавов и соединений . 824 . дои : 10.1016/j.jallcom.2020.153874 .
- ^ Юсуф, реабилитационный центр; Махмуд, Наглаа (2021). «Электрические и магнитные свойства металлоорганических комплексов кобальта, меди и никеля для молекулярных проводов» . Инженерный журнал Айн-Шамс . 12 (2): 2135–2144. дои : 10.1016/j.asej.2020.12.002 .
- ^ «Самарий-кобальт против неодимовых магнитов» . Идеальные магнитные решения . Проверено 24 июня 2024 г.
- ^ Дэвис, Джозеф Р.; Справочный комитет ASM International (1 мая 2000 г.). «Кобальт» . Никель, кобальт и их сплавы . АСМ Интернешнл. п. 354. ИСБН 978-0-87170-685-0 .
- ^ Комитет по технологическим альтернативам сохранения кобальта, Национальный исследовательский совет (США); Национальный консультативный совет по материалам, Национальный исследовательский совет (США) (1983). «Грунтовая фритта» . Сохранение кобальта посредством технологических альтернатив . п. 129.
- ^ Ямада, Казухиро (2013). «Глава 9. Кобальт: его роль в здоровье и заболеваниях». В Астрид Сигел; Хельмут Сигель; Роланд К.О. Сигел (ред.). Взаимосвязь между ионами незаменимых металлов и заболеваниями человека . Ионы металлов в науках о жизни. Том. 13. Спрингер. стр. 295–320. дои : 10.1007/978-94-007-7500-8_9 . ISBN 978-94-007-7499-5 . ПМИД 24470095 .
- ^ Кракан, Валентин; Банерджи, Рума (2013). «Глава 10 Транспорт и биохимия кобальта и корриноидов». В Банки, Люсия (ред.). Металломика и клетка . Ионы металлов в науках о жизни. Том. 12. Спрингер. стр. 333–374. дои : 10.1007/978-94-007-5561-1_10 . ISBN 978-94-007-5560-4 . ПМИД 23595677 . электронная книга ISBN 978-94-007-5561-1 ISSN 1559-0836 электронный- ISSN 1868-0402 .
- ^ Шварц, Ф.Дж.; Кирхгесснер, М.; Штангл, Г.И. (2000). «Потребность мясного скота в кобальте – потребление корма и рост при различных уровнях обеспечения кобальтом». Журнал физиологии животных и питания животных . 83 (3): 121–131. дои : 10.1046/j.1439-0396.2000.00258.x .
- ^ Фут, Джудит Г.; Воэт, Дональд (1995). Биохимия . Нью-Йорк: Дж. Уайли и сыновья. п. 675 . ISBN 0-471-58651-Х . ОСЛК 31819701 .
- ^ Смит, Дэвид М.; Голдинг, Бернард Т.; Радом, Лео (1999). «Понимание механизма B12-зависимой метилмалонил-КоА-мутазы: частичный перенос протона в действии». Журнал Американского химического общества . 121 (40): 9388–9399. дои : 10.1021/ja991649a .
- ^ Кобаяши, Мичихико; Симидзу, Сакаю (1999). «Кобальтовые белки». Европейский журнал биохимии . 261 (1): 1–9. дои : 10.1046/j.1432-1327.1999.00186.x . ПМИД 10103026 .
- ^ «Почвы» . Университет Вайкато. Архивировано из оригинала 25 января 2012 года . Проверено 16 января 2012 г.
- ^ Перейти обратно: а б Макдауэлл, Ли Рассел (2008). Витамины в питании животных и человека (2-е изд.). Хобокен: Джон Уайли и сыновья. п. 525. ИСБН 978-0-470-37668-3 .
- ^ Австралийская академия наук > Умершие научные сотрудники > Хедли Ральф Марстон 1900–1965, по состоянию на 12 мая 2013 г.
- ^ Снук, Лоуренс К. (1962). «Кобальт: его использование для борьбы с истощающими болезнями» . Журнал Министерства сельского хозяйства Западной Австралии . 4. 3 (11): 844–852.
- ^ «Кобальт 356891» . Сигма-Олдрич . 14 октября 2021 г. . Проверено 22 декабря 2021 г.
- ^ Дональдсон, Джон Д. и Бейерсманн, Детмар (2005) «Кобальт и соединения кобальта» в Энциклопедии промышленной химии Ульмана , Wiley-VCH, Вайнхайм. два : 10.1002/14356007.a07_281.pub2
- ^ Карманный справочник NIOSH по химическим опасностям. «#0146» . Национальный институт охраны труда и здоровья (NIOSH).
- ^ Морен Ю; Тету А; Мерсье Дж. (1969). «Кардиомиопатия любителей пива из Квебека: клинические и гемодинамические аспекты». Анналы Нью-Йоркской академии наук . 156 (1): 566–576. Бибкод : 1969NYASA.156..566M . дои : 10.1111/j.1749-6632.1969.tb16751.x . ПМИД 5291148 . S2CID 7422045 .
- ^ Барселу, Дональд Г. и Барселу, Дональд (1999). «Кобальт». Клиническая токсикология . 37 (2): 201–216. дои : 10.1081/CLT-100102420 . ПМИД 10382556 .
- ^ [PDF]
- ^ Эльбагир, Нима; ван Херден, Доминик; Макинтош, Элиза (май 2018 г.). «Грязная энергия» . CNN . Проверено 30 мая 2018 г.
- ^ Баскеттер, Дэвид А.; Анджелини, Джанни; Ингбер, Арье; Керн, Петра С.; Менне, Торкил (2003). «Никель, хром и кобальт в потребительских товарах: пересмотр безопасных уровней в новом тысячелетии» . Контактный дерматит . 49 (1): 1–7. дои : 10.1111/j.0105-1873.2003.00149.x . ПМИД 14641113 . S2CID 24562378 .
Дальнейшее чтение
[ редактировать ]- Харпер, Э.М.; Кавлак, Г.; Гредель, Т.Э. (2012). «Отслеживание металла гоблинов: цикл использования кобальта». Экологические науки и технологии . 46 (2): 1079–86. Бибкод : 2012EnST...46.1079H . дои : 10.1021/es201874e . ПМИД 22142288 . S2CID 206948482 .
- Нарендрула, Р.; Нконголо, КК; Беккет, П. (2012). «Сравнительный анализ металлов почвы в Садбери (Онтарио, Канада) и Лубумбаши (Катанга, ДР-Конго)». Бюллетень загрязнения окружающей среды и токсикологии . 88 (2): 187–92. Бибкод : 2012BuECT..88..187N . дои : 10.1007/s00128-011-0485-7 . ПМИД 22139330 . S2CID 34070357 .
- Пауэлс, Х.; Петтенати, М.; Греффи, К. (2010). «Совместное влияние заброшенных шахт и сельского хозяйства на химический состав подземных вод». Журнал загрязняющей гидрологии . 115 (1–4): 64–78. Бибкод : 2010JCHyd.115...64P . дои : 10.1016/j.jconhyd.2010.04.003 . ПМИД 20466452 .
- Булут, Г. (2006). «Восстановление меди и кобальта из древних шлаков». Управление отходами и исследования . 24 (2): 118–24. Бибкод : 2006WMR....24..118B . дои : 10.1177/0734242X06063350 . ПМИД 16634226 . S2CID 24931095 .
- Джефферсон, Дж.А.; Эскудеро, Э.; Уртадо, Мэн; Пандо, Дж.; Тапиа, Р.; Свенсон, скорая помощь; Прчал, Дж.; Шрайнер, Г.Ф.; Шене, РБ; Уртадо, А.; Джонсон, Р.Дж. (2002). «Чрезмерный эритроцитоз, хроническая горная болезнь и уровень кобальта в сыворотке». Ланцет . 359 (9304): 407–8. дои : 10.1016/s0140-6736(02)07594-3 . ПМИД 11844517 . S2CID 12319751 .
- Лёвольд, ТВ; Хаугсбо, Л. (1999). «Кобальтовый горный завод - диагнозы 1822-32». Журнал Норвежской медицинской ассоциации . 119 (30): 4544–6. ПМИД 10827501 .
- Бёрд, Джорджия; Хесслейн, Р.Х.; Миллс, КХ; Шварц, WJ; Тернер, Массачусетс (1998). «Биоаккумуляция радионуклидов в удобренных бассейнах озер Канадского щита». Наука об общей окружающей среде . 218 (1): 67–83. Бибкод : 1998ScTEn.218...67B . дои : 10.1016/s0048-9697(98)00179-x . ПМИД 9718743 .
- Немери, Б. (1990). «Токсичность металлов и дыхательные пути» . Европейский респираторный журнал . 3 (2): 202–19. дои : 10.1183/09031936.93.03020202 . ПМИД 2178966 .
- Казанцис, Г. (1981). «Роль кобальта, железа, свинца, марганца, ртути, платины, селена и титана в канцерогенезе» . Перспективы гигиены окружающей среды . 40 : 143–61. дои : 10.1289/ehp.8140143 . ПМЦ 1568837 . ПМИД 7023929 .
- Керфут, Э.Дж.; Фредрик, WG; Домейер, Э. (1975). «Исследования вдыхания металлического кобальта на миниатюрных свиньях». Журнал Американской ассоциации промышленной гигиены . 36 (1): 17–25. дои : 10.1080/0002889758507202 . ПМИД 1111264 .
Внешние ссылки
[ редактировать ]- » энциклопедия Британская Том. VI (9-е изд.). 1878. стр. 100-1. 81–83.
- Кобальт в Периодической таблице видео (Ноттингемский университет)
- Центры заболеваний и профилактики - Кобальт
- Кобальт
- Химические элементы
- Переходные металлы
- Диетические минералы
- Ферромагнитные материалы
- Канцерогены группы МАИР 2B
- Детский труд
- Добыча кобальта
- Неформальная экономика в Африке
- Ресурсная экономика
- Горнодобывающие сообщества в Африке
- Инициатива прозрачности добывающих отраслей
- Химические элементы с гексагональной плотноупакованной структурой
- Минералы самородных элементов