Бериллий
 | |||||||||||||||||||||||||||||||
| Бериллий | |||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Произношение | / bə ˈ r ɪ l i ə m / | ||||||||||||||||||||||||||||||
| Появление | бело-серый металлик | ||||||||||||||||||||||||||||||
| Стандартный атомный вес А р °(Бе) | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| Бериллий в таблице Менделеева | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| Атомный номер ( Z ) | 4 | ||||||||||||||||||||||||||||||
| Группа | группа 2 (щелочноземельные металлы) | ||||||||||||||||||||||||||||||
| Период | период 2 | ||||||||||||||||||||||||||||||
| Блокировать | S-блок | ||||||||||||||||||||||||||||||
| Электронная конфигурация | [ Он ] 2с 2 | ||||||||||||||||||||||||||||||
| Электроны на оболочку | 2, 2 | ||||||||||||||||||||||||||||||
| Физические свойства | |||||||||||||||||||||||||||||||
| Фаза в СТП | твердый | ||||||||||||||||||||||||||||||
| Температура плавления | 1560 К (1287 °С, 2349 °F) | ||||||||||||||||||||||||||||||
| Точка кипения | 2742 К (2469 °С, 4476 °F) | ||||||||||||||||||||||||||||||
| Плотность (при 20°С) | 1,845 г/см 3 [3] | ||||||||||||||||||||||||||||||
| в жидком состоянии (при температуре плавления ) | 1,690 г/см 3 | ||||||||||||||||||||||||||||||
| Критическая точка | 5205 К, МПа (экстраполировано) | ||||||||||||||||||||||||||||||
| Теплота плавления | 12,2 кДж/моль | ||||||||||||||||||||||||||||||
| Теплота испарения | 292 кДж/моль | ||||||||||||||||||||||||||||||
| Молярная теплоемкость | 16,443 Дж/(моль·К) | ||||||||||||||||||||||||||||||
Давление пара
| |||||||||||||||||||||||||||||||
| Атомные свойства | |||||||||||||||||||||||||||||||
| Стадии окисления | 0, [4] +1, [5] +2 ( амфотерный оксид) | ||||||||||||||||||||||||||||||
| Электроотрицательность | Шкала Полинга: 1,57. | ||||||||||||||||||||||||||||||
| Энергии ионизации |
| ||||||||||||||||||||||||||||||
| Атомный радиус | эмпирический: 112 вечера | ||||||||||||||||||||||||||||||
| Ковалентный радиус | 96±15 часов | ||||||||||||||||||||||||||||||
| Радиус Ван-дер-Ваальса | 153 вечера | ||||||||||||||||||||||||||||||
| Другие объекты недвижимости | |||||||||||||||||||||||||||||||
| Естественное явление | первобытный | ||||||||||||||||||||||||||||||
| Кристаллическая структура | гексагональная плотноупакованная (ГПУ) ( hP2 ) | ||||||||||||||||||||||||||||||
| Константы решетки | а = 228,60 вечера c = 358,42 вечера (при 20 ° C) [3] | ||||||||||||||||||||||||||||||
| Тепловое расширение | 10.98 × 10 −6 /К (при 20 °С) [3] [а] | ||||||||||||||||||||||||||||||
| Теплопроводность | 200 Вт/(м⋅К) | ||||||||||||||||||||||||||||||
| Электрическое сопротивление | 36 нОм⋅м (при 20 °C) | ||||||||||||||||||||||||||||||
| Магнитный заказ | диамагнитный | ||||||||||||||||||||||||||||||
| Молярная магнитная восприимчивость | −9.0 × 10 −6 см 3 /моль [6] | ||||||||||||||||||||||||||||||
| Модуль Юнга | 287 ГПа | ||||||||||||||||||||||||||||||
| Модуль сдвига | 132 ГПа | ||||||||||||||||||||||||||||||
| Объемный модуль | 130 ГПа | ||||||||||||||||||||||||||||||
| Скорость звука тонкого стержня | 12890 м/с (при комнатной температуре ) [7] | ||||||||||||||||||||||||||||||
| коэффициент Пуассона | 0.032 | ||||||||||||||||||||||||||||||
| Твердость по шкале Мооса | 5.5 | ||||||||||||||||||||||||||||||
| Твердость по Виккерсу | 1670 МПа | ||||||||||||||||||||||||||||||
| Твердость по Бринеллю | 590–1320 МПа | ||||||||||||||||||||||||||||||
| Номер CAS | 7440-41-7 | ||||||||||||||||||||||||||||||
| История | |||||||||||||||||||||||||||||||
| Открытие | Луи Николя Воклен (1798) | ||||||||||||||||||||||||||||||
| Первая изоляция | Фридрих Вёлер и Антуан Бюсси (1828) | ||||||||||||||||||||||||||||||
| Изотопы бериллия | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
Бериллий — химический элемент ; имеет символ Be и атомный номер 4. Это стально-серый, прочный, легкий и хрупкий щелочноземельный металл . Это двухвалентный элемент, который встречается в природе только в сочетании с другими элементами с образованием минералов. Драгоценные камни с высоким содержанием бериллия включают берилл ( аквамарин , изумруд , красный берилл ) и хризоберилл . Это относительно редкий элемент во Вселенной , обычно образующийся в результате расщепления более крупных атомных ядер, столкнувшихся с космическими лучами . В ядрах звезд бериллий обедняется, поскольку он превращается в более тяжелые элементы. Бериллий составляет около 0,0004 процента массы земной коры. Ежегодный объем производства бериллия в мире, составляющий 220 тонн, обычно производится путем экстракции из минерала берилла . Это сложный процесс, поскольку бериллий прочно связывается с кислородом .
В конструкционных применениях сочетание высокой жесткости на изгиб , термической стабильности , теплопроводности и низкой плотности (в 1,85 раза выше, чем у воды) делает металлический бериллий желательным аэрокосмическим материалом для компонентов самолетов, ракет , космических кораблей и спутников . [9] Из-за своей низкой плотности и атомной массы бериллий относительно прозрачен для рентгеновских лучей и других форм ионизирующего излучения ; следовательно, это наиболее распространенный материал окон для рентгеновского оборудования и компонентов детекторов частиц . [9] При добавлении в качестве легирующего элемента к алюминию , меди (особенно сплаву бериллия с медью ), железу или никелю бериллий улучшает многие физические свойства. [9] Например, инструменты и компоненты из -бериллиевых сплавов прочны тверды и медно и не создают искр при ударе о стальную поверхность. На воздухе поверхность бериллия при комнатной температуре легко окисляется с образованием пассивационного слоя толщиной 1–10 нм, защищающего его от дальнейшего окисления и коррозии. [10] Металл окисляется в объеме (за пределами пассивационного слоя) при нагревании выше 500 ° C (932 ° F). [11] и блестяще горит при нагревании примерно до 2500 ° C (4530 ° F). [12]
Коммерческое использование бериллия требует постоянного использования соответствующего оборудования для борьбы с пылью и промышленного контроля из-за токсичности вдыхаемой бериллийсодержащей пыли, которая может вызвать у некоторых людей хроническое опасное для жизни аллергическое заболевание - бериллиоз . [13] Бериллиоз вызывает пневмонию и другие сопутствующие респираторные заболевания.
Характеристики [ править ]
Физические свойства [ править ]
стального цвета Бериллий представляет собой твердый металл , хрупкий при комнатной температуре и имеющий плотноупакованную гексагональную кристаллическую структуру . [9] Он обладает исключительной жесткостью ( модуль Юнга 287 ГПа) и температурой плавления 1287 °C. Модуль упругости бериллия примерно на 35% больше, чем у стали. Сочетание этого модуля и относительно низкой плотности приводит к необычайно высокой скорости звукопроводимости в бериллии — около 12,9 км/с в условиях окружающей среды . Другими важными свойствами являются высокая удельная теплоемкость ( 1925 Дж·кг −1 ·К −1 ) и теплопроводность ( 216 Вт·м −1 ·К −1 ), которые делают бериллий металлом с лучшими характеристиками рассеивания тепла на единицу веса. В сочетании с относительно низким коэффициентом линейного теплового расширения (11,4×10 −6 К −1 ), эти характеристики обеспечивают уникальную стабильность в условиях термической нагрузки. [14]
Ядерные свойства [ править ]
Встречающийся в природе бериллий, за исключением небольшого загрязнения космогенными радиоизотопами , представляет собой изотопно чистый бериллий-9, имеющий ядерный спин 3/2 . Бериллий имеет большое сечение рассеяния нейтронов высоких энергий, около 6 барнов для энергий выше примерно 10 кэВ. Следовательно, он работает как отражатель нейтронов и замедлитель нейтронов , эффективно замедляя нейтроны до диапазона тепловой энергии ниже 0,03 эВ, где полное сечение как минимум на порядок ниже; точное значение сильно зависит от чистоты и размера кристаллитов материала.
Единственный первичный изотоп бериллия 9 Be также подвергается нейтронной реакции (n,2n) с энергией нейтронов около 1,9 МэВ, в результате чего образуется 8 Be , который почти сразу распадается на две альфа-частицы. Таким образом, для нейтронов высоких энергий бериллий является умножителем нейтронов, выделяя больше нейтронов, чем поглощая. Эта ядерная реакция: [15]
- 9
4 Будь
+ п → 2 4
2 Он
+ 2 н
Нейтроны высвобождаются при ядер столкновении бериллия с энергичными альфа-частицами. [14] производя ядерную реакцию
- 9
4 Будь
+ 4
2 Он
→ 12
6 С
+ н
где 4
2 Он
является альфа-частицей и 12
6 С
представляет собой ядро углерода-12 . [15] Бериллий также выделяет нейтроны при бомбардировке гамма-лучами. Таким образом, природный бериллий, бомбардируемый альфа- или гамма-излучением подходящего радиоизотопа, является ключевым компонентом большинства ядерных реакций источников нейтронов с использованием радиоизотопов для лабораторного производства свободных нейтронов.
Небольшие количества трития выделяются при 9
4 Будь
ядра поглощают нейтроны низкой энергии в трехступенчатой ядерной реакции
- 9
4 Будь
+ н → 4
2 Он
+ 6
2 Он
, 6
2 Он
→ 6
3 Ли
+ б − , 6
3 Ли
+ н → 4
2 Он
+ 3
1 час
6
2 Он
имеет период полураспада всего 0,8 секунды, β − представляет собой электрон, а 6
3 Ли
имеет высокое сечение поглощения нейтронов. Тритий является вызывающим озабоченность радиоизотопом в потоках отходов ядерных реакторов. [16]
Оптические свойства [ править ]
Как металл, бериллий прозрачен или полупрозрачен для большинства длин волн рентгеновских лучей и гамма-лучей , что делает его полезным для выходных окон рентгеновских трубок и других подобных устройств. [17]
Изотопы и нуклеосинтез [ править ]
В звездах создаются как стабильные, так и нестабильные изотопы бериллия, но радиоизотопы сохраняются недолго. Считается, что большая часть стабильного бериллия во Вселенной изначально возникла в межзвездной среде, когда космические лучи вызвали деление более тяжелых элементов, обнаруженных в межзвездном газе и пыли. [18] Первичный бериллий содержит только один стабильный изотоп: 9 Be и, следовательно, бериллий является единственным среди всех стабильных элементов с четным атомным номером моноизотопным и мононуклидным элементом .

Радиоактивный космогенный 10 Be образуется в атмосфере Земли в результате лучами расщепления кислорода космическими . [19] 10 Be накапливается на поверхности почвы , где его относительно длительный период полураспада (1,36 миллиона лет) обеспечивает длительное время пребывания перед распадом до бора -10. Таким образом, 10 Be и его дочерние продукты используются для изучения естественной эрозии почвы , почвообразования и развития латеритных почв , а также в качестве показателя для измерения изменений солнечной активности и возраста ледяных кернов . [20] Производство 10 Be обратно пропорционален солнечной активности, поскольку усиление солнечного ветра в периоды высокой солнечной активности уменьшает поток галактических космических лучей , достигающих Земли. [19] Ядерные взрывы также образуют 10 Быть за счет реакции быстрых нейтронов с 13 C в углекислом газе в воздухе. Это один из показателей прошлой активности на полигонах ядерного оружия . [21] Изотоп 7 Be (период полураспада 53 дня) также космогенен и демонстрирует обилие атмосферы, связанное с солнечными пятнами, как и 10 Быть.
8 Be имеет очень короткий период полураспада около 8 × 10. −17 Это способствует его значительной космологической роли, поскольку элементы тяжелее бериллия не могли быть произведены в результате ядерного синтеза во время Большого взрыва . [22] Это связано с отсутствием достаточного времени во время фазы нуклеосинтеза Большого взрыва для производства углерода путем слияния 4 Ядра He и очень низкие концентрации доступного бериллия-8. Британский астроном сэр Фред Хойл впервые показал, что энергетические уровни 8 Будь и 12 C позволяет производить углерод с помощью так называемого процесса тройного альфа в звездах, питаемых гелием, где доступно больше времени нуклеосинтеза. Этот процесс позволяет производить углерод в звездах, но не в результате Большого взрыва. Созданный звездами углерод (основа углеродной жизни ), таким образом, является компонентом элементов газа и пыли, выбрасываемых звездами AGB и сверхновыми (см. Также нуклеосинтез Большого взрыва ), а также созданием всех других элементов с помощью атомных числа больше, чем у углерода. [23]
2s-электроны бериллия могут способствовать образованию химической связи. Поэтому, когда 7 Be распадается путем захвата L-электронов , забирая электроны со своих атомных орбиталей , которые могут участвовать в связывании. Это делает скорость его распада в измеримой степени зависимой от химического окружения – редкое явление при ядерном распаде. [24]
Самый короткоживущий известный изотоп бериллия — 16 Be, который распадается за счет нейтронного излучения с периодом полураспада 6,5 × 10 −22 с . [25] Экзотические изотопы 11 Будь и 14 Известно, что он обладает ядерным ореолом . [26] Это явление можно понимать как ядро 11 Будь и 14 У Be соответственно 1 и 4 нейтрона, вращающихся по орбитам существенно за пределами классической фермиевской модели ядра «капля воды».
Происшествие [ править ]


На Солнце концентрация составляет 0,1 части на миллиард (ppb). бериллия [27] Бериллий имеет концентрацию от 2 до 6 частей на миллион (ppm) в земной коре. Это 47-й по распространенности элемент в земной коре. [28] Наибольшая концентрация в почвах – 6 ppm. [29] Следовые количества 9 Встречаются в атмосфере Земли. [29] Концентрация бериллия в морской воде составляет 0,2–0,6 частей на триллион . [29] [30] Однако в речной воде бериллий более распространен с концентрацией 0,1 частей на миллиард. [31]
Бериллий содержится более чем в 100 минералах. [32] но большинство из них необычны или редки. Наиболее распространенные бериллийсодержащие минералы включают: бертрандит (Be 4 Si 2 O 7 (OH) 2 ), берилл (Al 2 Be 3 Si 6 O 18 ), хризоберилл (Al 2 BeO 4 ) и фенакит (Be 2 SiO 4 ). Драгоценными формами берилла являются аквамарин , красный берилл и изумруд . [14] [33] [34] Зеленый цвет бериллов ювелирного качества обусловлен различным количеством хрома (около 2% для изумруда). [35]
Две основные руды бериллия, берилл и бертрандит, находятся в Аргентине, Бразилии, Индии, Мадагаскаре, России и США. [35] Общие мировые запасы бериллиевой руды превышают 400 000 тонн. [35]
Производство [ править ]
Извлечение бериллия из его соединений — сложный процесс из-за его высокого сродства к кислороду при повышенных температурах и способности восстанавливать воду при удалении оксидной пленки. В настоящее время США, Китай и Казахстан являются единственными тремя странами, занимающимися добычей бериллия в промышленных масштабах. [36] Казахстан производит бериллий из концентрата, накопленного до распада Советского Союза примерно в 1991 году. К середине 2010-х годов этот ресурс был практически исчерпан. [37]
Производство бериллия в России было остановлено в 1997 году, его планируется возобновить в 2020-х годах. [38] [39]
Бериллий чаще всего добывается из минерала берилла , который либо спекается с использованием экстрагента, либо плавится в растворимую смесь. Процесс спекания включает смешивание берилла с фторосиликатом натрия и содой при температуре 770 ° C (1420 ° F) с образованием фторбериллата натрия , оксида алюминия и диоксида кремния . [9] Гидроксид бериллия осаждают из раствора фторбериллата натрия и гидроксида натрия в воде. Добыча бериллия методом расплава включает измельчение берилла в порошок и нагревание его до 1650 °C (3000 °F). [9] Расплав быстро охлаждают водой, а затем повторно нагревают от 250 до 300 ° C (от 482 до 572 ° F) в концентрированной серной кислоте , в основном с получением сульфата бериллия и сульфата алюминия . [9] Затем водный аммиак используется для удаления алюминия и серы, оставляя гидроксид бериллия.
Гидроксид бериллия, полученный методом агломерации или расплава, затем преобразуется во фторид бериллия или хлорид бериллия . Для образования фторида водный фторид аммония добавляют к гидроксиду бериллия с образованием осадка тетрафторбериллата аммония, который нагревают до 1000 ° C (1830 ° F) с образованием фторида бериллия. [9] Нагревание фторида до 900 °C (1650 °F) с магнием образует мелкодисперсный бериллий, а дополнительный нагрев до 1300 °C (2370 °F) создает компактный металл. [9] При нагревании гидроксида бериллия образуется оксид, который при соединении с углеродом и хлором становится хлоридом бериллия. электролиз расплавленного хлорида бериллия. Затем для получения металла используют [9]
Химические свойства [ править ]
Атом бериллия имеет электронную конфигурацию [He] 2s 2 . Преобладающая степень окисления бериллия +2; атом бериллия потерял оба своих валентных электрона. Комплексы низших степеней окисления бериллия чрезвычайно редки. Например, сообщалось о соединениях бис (карбена), которые, как предполагается, содержат бериллий в состояниях окисления 0 и +1, хотя эти утверждения оказались противоречивыми. [40] [41] Описан устойчивый комплекс со связью Be-Be, формально характеризующий бериллий в степени окисления +1. [42] Химическое поведение бериллия во многом обусловлено его малым атомным и ионным радиусом. Таким образом, он имеет очень высокие потенциалы ионизации и сильную поляризацию, когда он связан с другими атомами, поэтому все его соединения являются ковалентными . Его химический состав имеет сходство с химическим составом алюминия, что является примером диагонального взаимодействия .
При комнатной температуре на поверхности бериллия образуется оксидный пассивирующий слой толщиной 1–10 нм, который предотвращает дальнейшие реакции с воздухом, за исключением постепенного утолщения оксида примерно до 25 нм. При нагреве выше примерно 500 °C окисление в объеме металла происходит вдоль границ зерен. [11] Когда металл воспламеняется на воздухе при нагревании выше температуры плавления оксида около 2500 °C, бериллий ярко горит. [12] образуя смесь оксида бериллия и нитрида бериллия . Бериллий легко растворяется в неокисляющих кислотах , таких как HCl и разбавленная H 2 SO 4 , но не в азотной кислоте или воде, поскольку при этом образуется оксид. Это поведение похоже на поведение алюминия. Бериллий растворяется также в растворах щелочей. [9] [43]
Бинарные соединения бериллия(II) полимерны в твердом состоянии. BeF 2 имеет структуру, подобную кремнезему разделенными по вершинам , с тетраэдрами BeF 4, . BeCl 2 и BeBr 2 имеют цепочечную структуру с тетраэдрами, разделенными по краям. Оксид бериллия BeO представляет собой белое тугоплавкое твердое вещество, имеющее кристаллическую структуру вюрцита и теплопроводность, такую же высокую, как у некоторых металлов. BeO амфотерен . бериллия сульфид , селенид и теллурид Известны , имеющие структуру цинковой обманки . [44] Нитрид бериллия Be 3 N 2 представляет собой тугоплавкое соединение, легко гидролизующееся. азид бериллия BeN 6 Известен , а фосфид бериллия Be 3 P 2 имеет структуру, аналогичную Be 3 N 2 . ряд боридов Известен бериллия, таких как Be 5 B, Be 4 B, Be 2 B, BeB 2 , BeB 6 и BeB 12 . Карбид бериллия Be 2 C — тугоплавкое соединение кирпично-красного цвета, которое в реакции с водой дает метан . [44] бериллия не Силицид обнаружен. [43]
Галогениды BeX 2 (X = F, Cl, Br, I) имеют линейное мономерное молекулярное строение в газовой фазе. [43] Комплексы галогенидов образуются с одним или несколькими лигандами, отдающими в общей сложности две пары электронов. Такие соединения подчиняются правилу октетов . Другие 4-координационные комплексы, такие как акваион [Be(H 2 O) 4 ] 2+ также подчиняются правилу октетов.
Водные растворы [ править ]
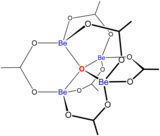
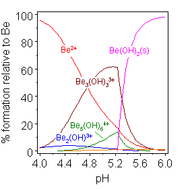
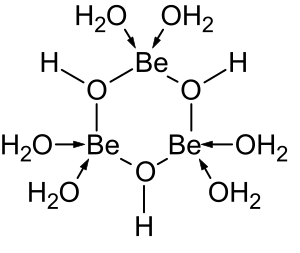
Растворы солей бериллия, таких как сульфат бериллия и нитрат бериллия , являются кислыми из-за гидролиза [Be(H 2 O) 4 ] 2+ ион. Концентрация первого продукта гидролиза, [Be(H 2 O) 3 (OH)] + , составляет менее 1% от концентрации бериллия. Наиболее стабильным продуктом гидролиза является тримерный ион [Be 3 (OH) 3 (H 2 O) 6 ] 3+ . Гидроксид бериллия Be(OH) 2 нерастворим в воде при pH 5 и более. Следовательно, соединения бериллия обычно нерастворимы при биологическом pH. Из-за этого вдыхание человеком пыли металлического бериллия приводит к развитию смертельного состояния бериллиоза . Be(OH) 2 растворяется в сильнощелочных растворах . [45]
Бериллий(II) образует мало комплексов с монодентатными лигандами, поскольку молекулы воды в аква-ионе [Be(H 2 O) 4 ] 2+ очень прочно связаны с ионом бериллия. Заметным исключением является ряд водорастворимых комплексов с фторид -ионом: [46]
Бериллий (II) образует множество комплексов с бидентатными лигандами, содержащими атомы донора кислорода. [45] Вид [Be 3 O(H 2 PO 4 ) 6 ] 2- примечателен наличием в центре трехкоординационного оксидного иона. Основной ацетат бериллия Be 4 O(OAc) 6 имеет оксидный ион, окруженный тетраэдром атомов бериллия.
С органическими лигандами, такими как малонат -ион, кислота депротонирует при образовании комплекса. Донорными атомами являются два атома кислорода. Образование комплекса конкурирует с реакцией гидролиза ионов металлов, также образуются смешанные комплексы как с анионом, так и с гидроксид-ионом. Например, известны производные циклического тримера, в которых бидентатный лиганд заменяет одну или несколько пар молекул воды. [47]
Алифатические гидроксикарбоновые кислоты, такие как гликолевая кислота, образуют в растворе довольно слабые монодентатные комплексы, в которых гидроксильная группа остается неповрежденной. В твердом состоянии гидроксильная группа может депротонироваться: гексамер, , был изолирован давно. [47] [48] Ароматические гидроксилиганды (т.е. фенолы ) образуют относительно прочные комплексы. Например, log K 1 и log K 2 , были зарегистрированы значения для комплексов с тироном равные 12,2 и 9,3 . [47] [49]
Бериллий обычно имеет довольно плохое сродство к амминным лигандам. [47] [50] Лиганды, такие как ЭДТА, ведут себя как дикарбоновые кислоты. [ нужна ссылка ] Существует много ранних сообщений о комплексах с аминокислотами, но, к сожалению, они ненадежны, поскольку на момент публикации не были понятны сопутствующие реакции гидролиза. Значения log β ок. Сообщается о 6-7 случаях. Степень образования невелика из-за конкуренции с реакциями гидролиза. [47] [50]
Органическая химия [ править ]
Бериллийорганическая химия ограничивается академическими исследованиями из-за стоимости и токсичности бериллия, производных бериллия и реагентов, необходимых для введения бериллия, таких как хлорид бериллия . Известно, что металлоорганические соединения бериллия обладают высокой реакционной способностью. [51] Примерами известных бериллийорганических соединений являются динеопентилбериллий , [52] бериллоцен (Cp 2 Be), [53] [54] [55] [56] диаллилбериллий (по реакции обмена диэтилбериллия на триаллилбор), [57] бис(1,3-триметилсилилаллил)бериллий, [58] Будь(мес) 2 , [51] и (комплекс бериллия(I)) дибериллоцен . [42] Лиганды также могут быть арилами. [59] и алкинилы. [60]
История [ править ]
Минерал берилл , содержащий бериллий, использовался, по крайней мере, со времен династии Птолемеев в Египте. [61] В первом веке нашей эры римский натуралист Плиний Старший упомянул в своей энциклопедии « Естественная история» , что берилл и изумруд («смарагдус») похожи. [62] Папирус Graecus Holmiensis , написанный в третьем или четвертом веке нашей эры, содержит заметки о том, как приготовить искусственный изумруд и берилл. [62]

Ранние анализы изумрудов и бериллов, проведенные Мартином Генрихом Клапротом , Торберном Улофом Бергманом , Францем Карлом Ахардом и Иоганном Якобом Биндхаймом, всегда давали схожие элементы, что приводило к ошибочному выводу, что оба вещества представляют собой алюмосиликаты . [63] Минералог Рене Жюст Аюи обнаружил, что оба кристалла геометрически идентичны, и попросил химика Луи-Николя Воклена провести химический анализ. [61]
В статье 1798 года, прочитанной в Институте Франции , Воклен сообщил, что он нашел новую «землю», растворив гидроксид алюминия из изумруда и берилла в дополнительной щелочи . [64] Редакторы журнала Annales de Chimie et de Physique назвали новую землю «глюцином» из-за сладкого вкуса некоторых ее соединений. [65] Клапрот предпочел название «бериллина» из-за того, что иттрий также образует сладкие соли. [66] [67] Название «бериллий» впервые было использовано Вёлером в 1828 году. [68]

Фридрих Вёлер [69] и Антуан Бюсси [70] независимо выделил бериллий в 1828 году химической реакцией металлического калия с хлоридом бериллия следующим образом:
- BeCl 2 + 2 К → 2 KCl + Be
Используя спиртовку, Вёлер нагрел чередующиеся слои хлорида бериллия и калия в платиновом тигле с проволочной заглушкой. Вышеуказанная реакция произошла немедленно и привела к тому, что тигель нагрелся добела. Охладив и промыв полученный серо-черный порошок, он увидел, что он состоит из мелких частиц с темным металлическим блеском. [71] Высокореактивный калий был получен электролизом его соединений — процессом, открытым 21 годом ранее. Химический метод с использованием калия давал лишь мелкие зерна бериллия, из которых невозможно было отлить или отковать слиток металла.
В результате прямого электролиза расплавленной смеси фторида бериллия и фторида натрия , проведенного Полем Лебо в 1898 году, были получены первые чистые (от 99,5 до 99,8%) образцы бериллия. [71] Однако промышленное производство началось только после Первой мировой войны. Первоначальное промышленное участие включало дочерние компании и ученых, связанных с Union Carbide and Carbon Corporation в Кливленде, штат Огайо, и Siemens & Halske AG в Берлине. В США процессом руководил Хью С. Купер, директор компании Kemet Laboratories. В Германии первый коммерчески успешный процесс производства бериллия был разработан в 1921 году Альфредом Штоком и Гансом Гольдшмидтом . [72]
Образец бериллия подвергся бомбардировке альфа-лучами распада радия в ходе эксперимента Джеймса Чедвика 1932 года , который открыл существование нейтрона . [35] Этот же метод используется в одном классе лабораторных источников нейтронов на основе радиоизотопов , которые производят 30 нейтронов на каждый миллион α-частиц. [28]
Производство бериллия резко возросло во время Второй мировой войны из-за растущего спроса на твердые сплавы бериллия и меди и люминофоры для люминесцентных ламп . В большинстве ранних люминесцентных ламп использовался ортосиликат цинка с различным содержанием бериллия, излучающий зеленоватый свет. магния Небольшие добавки вольфрамата улучшили синюю часть спектра и позволили получить приемлемый белый свет. Люминофоры на основе галофосфатов заменили люминофоры на основе бериллия после того, как бериллий оказался токсичным. [73]
Электролиз смеси фторида бериллия и фторида натрия использовался для выделения бериллия в 19 веке. Высокая температура плавления металла делает этот процесс более энергозатратным, чем соответствующие процессы, используемые для щелочных металлов . В начале 20 века производство бериллия путем термического разложения йодида бериллия было исследовано после успеха аналогичного процесса производства циркония , но этот процесс оказался неэкономичным для массового производства. [74]
Чистый металлический бериллий стал доступен только в 1957 году, хотя гораздо раньше он использовался в качестве легирующего металла для упрочнения меди. [35] Бериллий можно получить путем восстановления соединений бериллия, таких как хлорид бериллия, металлическим калием или натрием. В настоящее время большая часть бериллия производится восстановлением фторида бериллия магнием . [75] Цена на американском рынке слитков бериллия, отлитого в вакууме, в 2001 году составляла около 338 долларов за фунт (745 долларов за килограмм). [76]
В период с 1998 по 2008 год мировое производство бериллия снизилось с 343 до примерно 200 тонн . Затем к 2018 году он увеличился до 230 метрических тонн, из которых 170 тонн поступило из США. [77] [78]
Этимология [ править ]
Бериллий получил свое название в честь полудрагоценного минерала берилла , из которого он был впервые выделен. [79] [80] [81]
Приложения [ править ]
Радиационные окна [ править ]


Из-за его низкого атомного номера и очень низкого поглощения рентгеновских лучей старейшим и до сих пор одним из наиболее важных применений бериллия является изготовление радиационных окон для рентгеновских трубок . [35] К чистоте и чистоте бериллия предъявляются высокие требования, чтобы избежать появления артефактов на рентгеновских изображениях. Тонкая бериллиевая фольга используется в качестве радиационных окон для детекторов рентгеновского излучения, а ее чрезвычайно низкое поглощение сводит к минимуму эффекты нагрева, вызываемые высокоинтенсивными рентгеновскими лучами низкой энергии, типичными для синхротронного излучения. Вакуумонепроницаемые окна и пучковые трубки для радиационных экспериментов на синхротронах изготавливаются исключительно из бериллия. В научных установках для различных исследований рентгеновской эмиссии (например, энергодисперсионной рентгеновской спектроскопии ) держатель образца обычно изготавливается из бериллия, поскольку испускаемые им рентгеновские лучи имеют гораздо меньшую энергию (≈100 эВ), чем рентгеновские лучи от большинства изученные материалы. [14]
Низкий атомный номер также делает бериллий относительно прозрачным для энергичных частиц . Поэтому он используется для построения лучевой трубы вокруг области столкновения в установках физики элементарных частиц , таких как все четыре эксперимента с основными детекторами на Большом адронном коллайдере ( ALICE , ATLAS , CMS , LHCb ), [82] Тэватрон и SLAC . Низкая плотность бериллия позволяет продуктам столкновения достигать окружающих детекторов без значительного взаимодействия, его жесткость позволяет создавать мощный вакуум внутри трубы для минимизации взаимодействия с газами, его термическая стабильность позволяет ему правильно функционировать при температуре всего в несколько градусов. выше абсолютного нуля , и его диамагнитная природа не позволяет ему мешать сложным мультипольным магнитным системам, используемым для управления и фокусировки частиц пучков . [83]
Механические приложения [ править ]
Благодаря своей жесткости, легкому весу и стабильности размеров в широком диапазоне температур металлический бериллий используется для изготовления легких конструкционных компонентов в оборонной и аэрокосмической промышленности, в высокоскоростных самолетах , управляемых ракетах , космических кораблях и спутниках , включая космический телескоп Джеймса Уэбба. . В нескольких ракетах на жидком топливе использовались сопла из чистого бериллия. [84] [85] Порошок бериллия сам по себе изучался как ракетное топливо , но его применение так и не было осуществлено. [35] высшего класса Небольшое количество велосипедных рам было изготовлено из бериллия. [86] С 1998 по 2000 год команда McLaren Формулы-1 использовала Mercedes-Benz двигатели с поршнями из бериллий-алюминиевого сплава . [87] Использование бериллиевых компонентов двигателя было запрещено после протеста Scuderia Ferrari . [88]
При смешивании около 2,0% бериллия с медью образуется сплав, называемый бериллиевой медью , который в шесть раз прочнее меди в отдельности. [89] Сплавы бериллия используются во многих областях применения благодаря сочетанию эластичности, высокой электропроводности и теплопроводности , высокой прочности и твердости , немагнитных свойств, а также хорошей к коррозии и стойкости усталости . [35] [9] Эти области применения включают в себя неискрящие инструменты, которые используются рядом с горючими газами ( бериллий-никель ) в пружинах и мембранах (бериллий-никель и бериллий-железо ), используемых в хирургических инструментах и высокотемпературных устройствах. [35] [9] Всего лишь 50 частей на миллион бериллия, легированного жидким магнием, приводит к значительному увеличению стойкости к окислению и снижению воспламеняемости. [9]

Высокая упругая жесткость бериллия привела к его широкому использованию в точном приборостроении, например, в инерциальных системах наведения и в опорных механизмах оптических систем. [14] Сплавы бериллия и меди применялись также в качестве отвердителя в « пистолетах Джейсона », которыми снимали краску с корпусов кораблей. [90]
Бериллий также использовался для изготовления кантилеверов в высокопроизводительных иглах картриджей фонографов, где его чрезвычайная жесткость и низкая плотность позволили уменьшить отслеживающий вес до 1 грамма, сохраняя при этом отслеживание высокочастотных отрывков с минимальными искажениями. [91]
Ранее бериллий широко применялся в тормозах военных самолетов из-за его твердости, высокой температуры плавления и исключительной способности рассеивать тепло . Экологические соображения привели к замене другими материалами. [14]
Для снижения затрат бериллий можно легировать значительным количеством алюминия , в результате чего получается сплав AlBeMet (торговое название). Эта смесь дешевле чистого бериллия, но при этом сохраняет многие полезные свойства.
Зеркала [ править ]
бериллиевые зеркала Особый интерес представляют . Зеркала большой площади, часто с сотовой опорной конструкцией , используются, например, в метеорологических спутниках , где малый вес и долговременная стабильность размеров имеют решающее значение. Бериллиевые зеркала меньшего размера используются в оптических системах наведения и системах управления огнем немецкого производства Leopard 1 и Leopard 2 , например, в основных боевых танках . В этих системах требуется очень быстрое перемещение зеркала, что опять-таки диктует малую массу и высокую жесткость. Обычно бериллиевое зеркало покрыто твердым химическим никелированием , которое легче полировать до более тонкого оптического качества, чем бериллий. Однако в некоторых случаях бериллиевую заготовку полируют без какого-либо покрытия. Это особенно применимо к криогенным операциям, где несоответствие температурного расширения может привести к короблению покрытия. [14]
Космический телескоп Джеймса Уэбба имеет 18 шестиугольных бериллиевых секций зеркал, каждое из которых покрыто тонким слоем золота. [92] Поскольку JWST будет работать при температуре 33 К, зеркало изготовлено из позолоченного бериллия, который способен выдерживать экстремальные холода лучше, чем стекло. Бериллий сжимается и деформируется меньше, чем стекло, и остается более однородным – при таких температурах. [93] По той же причине оптика космического телескопа «Спитцер» полностью изготовлена из металлического бериллия. [94]
Магнитные приложения [ править ]

Бериллий немагнитен. Поэтому инструменты, изготовленные из материалов на основе бериллия, используются военно-морскими или военными группами по обезвреживанию боеприпасов или вблизи них для работы на морских минах , поскольку эти мины обычно имеют магнитные взрыватели . [96] Они также встречаются в ремонтных и строительных материалах рядом с аппаратами магнитно-резонансной томографии (МРТ) из-за генерируемых сильных магнитных полей. [97] В области радиосвязи и мощных (обычно военных) радаров ручные инструменты из бериллия используются для настройки сильномагнитных клистронов , магнетронов , ламп бегущей волны и т. д., которые используются для генерации высоких уровней микроволновой мощности в передатчиках. . [ нужна ссылка ]
применения Ядерные
Тонкие пластины или фольга из бериллия иногда используются в конструкциях ядерного оружия в качестве самого внешнего слоя плутониевых ям на начальных стадиях термоядерных бомб , расположенных вокруг делящегося материала. Эти слои бериллия являются хорошими «толкателями» для взрыва плутония -239 и хорошими отражателями нейтронов , как и в ядерных реакторах с бериллиевым замедлителем . [98]
Бериллий также широко используется в некоторых источниках нейтронов в лабораторных устройствах, в которых требуется относительно мало нейтронов (вместо использования ядерного реактора или от ускорителя частиц с питанием генератора нейтронов ). Для этой цели мишень из бериллия-9 бомбардируется энергичными альфа-частицами радиоизотопа, такого как полоний -210, радий -226, плутоний -238 или америций -241. В ходе происходящей ядерной реакции ядро бериллия преобразуется в углерод-12 и испускается один свободный нейтрон, движущийся примерно в том же направлении, в котором двигалась альфа-частица. Такие альфа-распадом источники нейтронов бериллия, управляемые , называемые «ежовыми» нейтронными инициаторами, использовались в некоторых ранних атомных бомбах . [98] Источники нейтронов, в которых бериллий бомбардируется гамма-лучами радиоизотопа гамма-распада , также используются для производства лабораторных нейтронов. [99]

Бериллий также используется при производстве топлива для реакторов CANDU . Топливные элементы имеют небольшие придатки, которые припаиваются к оболочке твэла методом индукционной пайки с использованием бериллия в качестве припоя. Подушки подшипников припаяны для предотвращения контакта топливного пучка с содержащей его напорной трубкой, а также межэлементные проставки для предотвращения контакта элементов с элементами.
Бериллий также используется в Торус» Объединенной европейской исследовательской лаборатории ядерного синтеза « и будет использоваться в более совершенном ИТЭР для подготовки компонентов, контактирующих с плазмой. [100] Бериллий также был предложен в качестве оболочки материала ядерных топливных стержней из-за его хорошего сочетания механических, химических и ядерных свойств. [14] Фторид бериллия является одной из составляющих солей эвтектической смеси солей FLiBe , которая используется в качестве растворителя, замедлителя и теплоносителя во многих гипотетических конструкциях реакторов с расплавленными солями , включая реактор с жидким фторидом тория (LFTR). [101]
Акустика [ править ]
Малый вес и высокая жесткость бериллия делают его полезным в качестве материала для высокочастотных динамиков . Поскольку бериллий дорог (во много раз дороже титана ), его трудно поддавать форме из-за его хрупкости и он токсичен при неправильном обращении, бериллиевые твитеры используются только в домах высокого класса. [102] [103] [104] профессиональное аудио и приложения для громкой связи . [105] [106] Некоторые высококачественные продукты обманным путем утверждаются как изготовленные из этого материала. [107]
В некоторых высококачественных картриджах для фонографов использовались бериллиевые кантилеверы для улучшения отслеживания за счет уменьшения массы. [108]
Электронный [ править ]
Бериллий является p-типа легирующей примесью в полупроводниках соединений III-V . Он широко используется в таких материалах, как GaAs , AlGaAs , InGaAs и InAlAs, выращенных методом молекулярно-лучевой эпитаксии (МЛЭ). [109] Лист бериллия, прокатанный поперечно, является отличной структурной опорой для печатных плат в технологии поверхностного монтажа . В критически важных электронных приложениях бериллий является одновременно структурной опорой и теплоотводом . Для применения также требуется коэффициент теплового расширения , хорошо соответствующий подложкам из оксида алюминия и стекла полиимидного . оксид бериллия-бериллия Композитный « E-Materials » был специально разработан для этих электронных приложений и имеет дополнительное преимущество, заключающееся в том, что коэффициент теплового расширения может быть адаптирован для соответствия различным материалам подложки. [14]
Оксид бериллия полезен во многих случаях, когда требуется сочетание свойств электрического изолятора и превосходного проводника тепла, высокой прочности и твердости, а также очень высокой температуры плавления. Оксид бериллия часто используется в качестве изоляционной опорной пластины в транзисторах радиочастотных мощных передатчиков для телекоммуникаций. Оксид бериллия также изучается на предмет использования для увеличения теплопроводности таблеток из диоксида урана ядерного топлива . [110] Соединения бериллия использовались в люминесцентных осветительных трубках, но это использование было прекращено из-за заболевания бериллиоза , развившегося у рабочих, производивших лампы. [111]
Здравоохранение [ править ]
Бериллий входит в состав ряда стоматологических сплавов . [112] [113]
и Токсичность безопасность
| Опасности | |
|---|---|
| СГС Маркировка : [114] | |
  | |
| Опасность | |
| Х301 , Х315 , Х317 , Х319 , Х330 , Х335 , Х350и , Х372 | |
| P201 , P202 , P280 , P302 , P304 , P305+P351+P338 , P310 , P340 , P352 | |
| NFPA 704 (огненный алмаз) | |
эффекты Биологические
В среднем человеческом организме содержится около 35 микрограммов бериллия, и это количество не считается вредным. [115] Бериллий химически подобен магнию и поэтому может вытеснять его из ферментов , что приводит к их сбоям. [115] Потому что будь 2+ Это высокозаряженный и небольшой ион, он может легко проникать во многие ткани и клетки, где специфически поражает ядра клеток, ингибируя многие ферменты, в том числе те, которые используются для синтеза ДНК. Его токсичность усугубляется тем фактом, что у организма нет средств для контроля уровня бериллия, и, попав в организм, бериллий не может быть удален. [116]
Вдыхание [ править ]
Хроническая бериллиевая болезнь (ХББ), или бериллиоз , — легочное и системное гранулематозное заболевание, вызываемое вдыханием пыли или паров, загрязненных бериллием; К этому недугу могут привести либо большие количества в течение короткого времени, либо небольшие количества в течение длительного времени. Для развития симптомов заболевания может потребоваться до пяти лет; около трети пациентов с ним умирают, а выжившие остаются инвалидами. [115] Международное агентство по изучению рака (IARC) относит бериллий и его соединения к канцерогенам первой категории . [117]
Профессиональное воздействие [ править ]
В США Управление по охране труда (OSHA) установило допустимый предел воздействия (PEL) для бериллия и его соединений на уровне 0,2 мкг/м. 3 как средневзвешенное по времени время (TWA) за 8 часов и 2,0 мкг/м 3 как предел кратковременного воздействия в течение периода отбора проб в 15 минут. Национальный институт охраны труда (NIOSH) установил рекомендуемого предела воздействия (REL) 0,5 мкг/м. верхний предел 3 . Значение IDLH ( непосредственно опасно для жизни и здоровья) составляет 4 мг/м. 3 . [118] Токсичность бериллия находится на одном уровне с другими токсичными металлоидами/металлами, такими как мышьяк и ртуть . [119] [120]
Воздействие бериллия на рабочем месте может привести к сенсибилизированной иммунной реакции и со временем к развитию бериллиоза. [121] Национальный институт охраны труда (NIOSH) в США исследует эти эффекты в сотрудничестве с крупным производителем бериллиевой продукции. NIOSH также проводит генетические исследования сенсибилизации и КБД, независимо от этого сотрудничества. [121]
Острая бериллиевая болезнь в форме химического пневмонита впервые была зарегистрирована в Европе в 1933 году и в США в 1943 году. Исследование показало, что около 5% рабочих заводов по производству люминесцентных ламп в 1949 году в США страдали заболеваниями легких, связанными с бериллием. . [122] Хронический бериллиоз напоминает саркоидоз во многом , и дифференциальный диагноз часто затруднен. Он убил некоторых первых исследователей ядерного оружия, таких как Герберт Л. Андерсон . [123]
Бериллий можно найти в угольных шлаках. Когда шлак используется в качестве абразивного агента для удаления краски и ржавчины с твердых поверхностей, бериллий может попасть в воздух и стать источником воздействия. [124]
Хотя использование соединений бериллия в люминесцентных осветительных трубках было прекращено в 1949 году, потенциал воздействия бериллия существует в атомной и аэрокосмической промышленности, при очистке металлического бериллия и плавке бериллийсодержащих сплавов, при производстве электронных устройств, и при обращении с другими бериллийсодержащими материалами. [125]
Обнаружение [ править ]
Ранние исследователи предприняли весьма опасную практику определения бериллия и его различных соединений по сладкому вкусу. Современный тест на содержание бериллия в воздухе и на поверхностях был разработан и опубликован в качестве международного добровольного консенсусного стандарта ASTM D7202. В процедуре используется разбавленный бифторид аммония для обнаружения растворения и флуоресценции бериллия, связанного с сульфонированным гидроксибензохинолином, что обеспечивает до 100 раз более чувствительное обнаружение, чем рекомендуемый предел концентрации бериллия на рабочем месте. Флуоресценция увеличивается с увеличением концентрации бериллия. Новая процедура была успешно протестирована на различных поверхностях и эффективна для растворения и обнаружения тугоплавкого оксида бериллия и кремнистого бериллия в минимальных концентрациях (ASTM D7458). [126] [127] Руководство NIOSH по аналитическим методам содержит методы измерения профессионального воздействия бериллия. [128]
Примечания [ править ]
- ^ Тепловое расширение анизотропно : параметры (при 20 ° C) для каждой оси кристалла составляют α a = 12,03 × 10. −6 /К, α с = 8,88 × 10 −6 /K, а α среднее = α V /3 = 10,98 × 10. −6 /К.
Ссылки [ править ]
- ^ «Стандартные атомные массы: бериллий» . ЦИАВ . 2013.
- ^ Прохаска, Томас; Ирргехер, Йоханна; Бенефилд, Жаклин; Бёлке, Джон К.; Чессон, Лесли А.; Коплен, Тайлер Б.; Дин, Типинг; Данн, Филип Дж. Х.; Грёнинг, Манфред; Холден, Норман Э.; Мейер, Харро Эй Джей (4 мая 2022 г.). «Стандартные атомные веса элементов 2021 (Технический отчет ИЮПАК)» . Чистая и прикладная химия . дои : 10.1515/pac-2019-0603 . ISSN 1365-3075 .
- ^ Перейти обратно: а б с Арбластер, Джон В. (2018). Некоторые значения кристаллографических свойств элементов . Парк материалов, Огайо: ASM International. ISBN 978-1-62708-155-9 .
- ^ Be(0) наблюдался; видеть «Обнаружен комплекс бериллия (0)» . Химия Европы . 13 июня 2016 г.
- ^ «Бериллий: данные о соединениях гидрида бериллия (I)» (PDF) . bernath.uwaterloo.ca . Проверено 10 декабря 2007 г.
- ^ Уэст, Роберт (1984). CRC, Справочник по химии и физике . Бока-Ратон, Флорида: Издательство компании Chemical Rubber Company. стр. E110. ISBN 0-8493-0464-4 .
- ^ Хейнс, Уильям М., изд. (2011). Справочник CRC по химии и физике (92-е изд.). Бока-Ратон, Флорида: CRC Press . п. 14.48. ISBN 1-4398-5511-0 .
- ^ Кондев, ФГ; Ван, М.; Хуанг, WJ; Наими, С.; Ауди, Г. (2021). «Оценка ядерных свойств NUBASE2020» (PDF) . Китайская физика C . 45 (3): 030001. doi : 10.1088/1674-1137/abddae .
- ^ Перейти обратно: а б с д и ж г час я дж к л м н Якубке, Ганс Дитер; Йешкейт, Ганс, ред. (1994). Краткая энциклопедия химии . пер. обр. Иглсон, Мэри. Берлин: Вальтер де Грюйтер.
- ^ Гувер, Марк Д.; Касторина, Брайан Т.; Финч, Грегори Л.; Ротенберг, Саймон Дж. (октябрь 1989 г.). «Определение толщины оксидного слоя на частицах металлического бериллия» . Журнал Американской ассоциации промышленной гигиены . 50 (10): 550–553. дои : 10.1080/15298668991375146 . ISSN 0002-8894 .
- ^ Перейти обратно: а б Томастик, К.; Вернер, В.; Стори, Х. (2005). «Окисление бериллия — сканирующее оже-исследование» . Нукл. Слияние . 45 (9): 1061. Бибкод : 2005NucFu..45.1061T . дои : 10.1088/0029-5515/45/9/005 . S2CID 111381179 .
- ^ Перейти обратно: а б Мачек, Андрей; Маккензи Семпл, Дж. «Экспериментальные скорости горения и механизмы горения одиночных частиц бериллия» . Симпозиум (международный) по горению . 12 (1): 71–81. дои : 10.1016/S0082-0784(69)80393-0 .
- ^ Пухта, Ральф (2011). «Более яркий бериллий» . Природная химия . 3 (5): 416. Бибкод : 2011НатЧ...3..416П . дои : 10.1038/nchem.1033 . ПМИД 21505503 .
- ^ Перейти обратно: а б с д и ж г час я Беренс, В. (2003). «11 Бериллий». В Бейсс, П. (ред.). Ландольт-Бёрнштайн – Передовые материалы и технологии VIII группы: данные порошковой металлургии. Огнеупорные, твердые и интерметаллические материалы . Ландольт-Бёрнштайн - Группа VIII Передовые материалы и технологии. Том. 2А1. Берлин: Шпрингер. стр. 667–677. дои : 10.1007/10689123_36 . ISBN 978-3-540-42942-5 .
- ^ Перейти обратно: а б Хауснер, Генри Х. (1965). «Ядерные свойства» . Бериллий, его металлургия и свойства . Издательство Калифорнийского университета. п. 239. Архивировано из оригинала 27 июля 2020 года . Проверено 30 октября 2021 г.
- ^ Томберлин, Т.А. (15 ноября 2004 г.). «Бериллий – уникальный материал для ядерных применений» (PDF) . Национальная лаборатория Айдахо . Национальная инженерно-экологическая лаборатория Айдахо. Архивировано из оригинала (PDF) 22 декабря 2015 года.
- ^ «О бериллии» . Министерство энергетики США. Архивировано из оригинала 22 декабря 2021 года . Проверено 22 декабря 2021 г.
- ^ Экспонг, Г. (1992). Физика: 1981–1990 гг . Всемирная научная. стр. 172 и далее. ISBN 978-981-02-0729-8 . Архивировано из оригинала 27 июля 2020 года . Проверено 30 октября 2021 г.
- ^ Перейти обратно: а б Эмсли 2001 , с. 56.
- ^ «Бериллий: изотопы и гидрология» . Университет Аризоны, Тусон. Архивировано из оригинала 26 мая 2013 года . Проверено 10 апреля 2011 г.
- ^ Уайтхед, Н.; Эндо, С; Танака, К; Такацудзи, Т; Хоши, М; Фукутани, С; Дитчберн, Родригес; Зондерван, А. (февраль 2008 г.). «Предварительное исследование по использованию (10)Be в судебно-радиоэкологии мест ядерных взрывов». Журнал радиоактивности окружающей среды . 99 (2): 260–70. дои : 10.1016/j.jenvrad.2007.07.016 . ПМИД 17904707 .
- ^ Бойд, Р.Н.; Каджино, Т. (1989). «Может ли Бе-9 стать проверкой космологических теорий?». Астрофизический журнал . 336 : Л55. Бибкод : 1989ApJ...336L..55B . дои : 10.1086/185360 .
- ^ Арнетт, Дэвид (1996). Сверхновые и нуклеосинтез . Издательство Принстонского университета. п. 223. ИСБН 978-0-691-01147-9 . Архивировано из оригинала 27 июля 2020 года . Проверено 30 октября 2021 г.
- ^ Джонсон, Билл (1993). «Как изменить скорость ядерного распада» . Калифорнийский университет, Риверсайд. Архивировано из оригинала 29 июня 2013 года . Проверено 30 марта 2008 г.
- ^ Хаммонд, CR "Элементы" в Лиде, Д.Р., изд. (2005). Справочник CRC по химии и физике (86-е изд.). Бока-Ратон (Флорида): CRC Press. ISBN 0-8493-0486-5 .
- ^ Хансен, П.Г.; Дженсен, А.С.; Джонсон, Б. (1995). «Ядерные ореолы» . Ежегодный обзор ядерной науки и науки о элементарных частицах . 45 (45): 591–634. Бибкод : 1995ARNPS..45..591H . дои : 10.1146/annurev.ns.45.120195.003111 .
- ^ «Изобилие на солнце» . Марк Винтер, Университет Шеффилда и WebElements Ltd, Великобритания . ВебЭлементы. Архивировано из оригинала 27 августа 2011 года . Проверено 6 августа 2011 г.
- ^ Перейти обратно: а б О'Нил, Мэридейл Дж.; Хекельман, Патрисия Э.; Роман, Чери Б., ред. (2006). Индекс Merck: Энциклопедия химических веществ, лекарств и биологических препаратов (14-е изд.). Станция Уайтхаус, Нью-Джерси, США: Merck Research Laboratories, Merck & Co., Inc. ISBN 978-0-911910-00-1 .
- ^ Перейти обратно: а б с Эмсли 2001 , с. 59.
- ^ «Изобилие в океанах» . Марк Винтер, Университет Шеффилда и WebElements Ltd, Великобритания . ВебЭлементы. Архивировано из оригинала 5 августа 2011 года . Проверено 6 августа 2011 г.
- ^ «Изобилие в речной воде» . Марк Винтер, Университет Шеффилда и WebElements Ltd, Великобритания . ВебЭлементы. Архивировано из оригинала 4 августа 2011 года . Проверено 6 августа 2011 г.
- ^ «Поиск минералов по химии» . www.mindat.org . Архивировано из оригинала 6 августа 2021 года . Проверено 30 октября 2021 г.
- ^ Уолш, Кеннет А. (2009). «Источники бериллия» . Химия и обработка бериллия . АСМ Интернешнл. стр. 20–26. ISBN 978-0-87170-721-5 . Архивировано из оригинала 13 мая 2016 года . Проверено 5 января 2016 г.
- ^ Филипп Саби (5 марта 2006 г.). «Распределение крупных месторождений» . В Джессике Эльзи Когель; Никхил К. Триведи; Джеймс М. Баркер; Стэнли Т. Круковски (ред.). Промышленные минералы и горные породы: товары, рынки и использование . стр. 265–269. ISBN 978-0-87335-233-8 . Проверено 5 января 2016 г.
- ^ Перейти обратно: а б с д и ж г час я Эмсли 2001 , с. 58.
- ^ «Источники бериллия» . Корпорация Материон. Архивировано из оригинала 24 декабря 2016 года . Проверено 23 декабря 2016 г.
- ^ «Бериллим» . Архивировано 3 июля 2021 года в Wayback Machine в Ежегоднике минералов за 2016 год . Геологическая служба США (сентябрь 2018 г.).
- ^ Уральский производитель изумрудов планирует выпускать стратегический металл бериллий Archived 11 October 2021 at the Wayback Machine . TASS.ru (15 May 2019)
- ^ «Россия возобновляет производство бериллия спустя 20 лет» . Евразийский бизнес-брифинг. 20 февраля 2015 года. Архивировано из оригинала 31 июля 2017 года . Проверено 22 февраля 2018 г.
- ^ Эроусмит, Мерл; Брауншвейг, Хольгер; Челик, Мехмет Али; Деллерманн, Тереза; Дьюхерст, Райан Д.; Юинг, Уильям К.; Хаммонд, Кай; Крамер, Томас; Крумменахер, Иво (2016). «Нейтральные нульвалентные s-блок-комплексы с прочными кратными связями». Природная химия . 8 (9): 890–894. Бибкод : 2016НатЧ...8..890А . дои : 10.1038/nchem.2542 . ПМИД 27334631 .
- ^ Гимферрер, Марти; Датский, Сержи; Ты, Ева; Йылдыз, Джем Б.; Коррал, Инес; Яна, Анукул; Сальвадор, Питер; Андрада, Диего М. (7 июня 2022 г.). «Статус окисления в соединениях низковалентного бериллия и магния» . Химическая наука . 13 (22): 6583–6591. дои : 10.1039/D2SC01401G . ISSN 2041-6539 . ПМЦ 9172369 . ПМИД 35756523 .
- ^ Перейти обратно: а б Боронски, Йозеф Т.; Крамптон, Агамемнон Э.; Уэльс, Льюис Л.; Олдридж, Саймон (16 июня 2023 г.). «Дибериллоцен, стабильное соединение Be(I) со связью Be-Be» . Наука . 380 (6650): 1147–1149. Бибкод : 2023Sci...380.1147B . дои : 10.1126/science.adh4419 . ISSN 0036-8075 . ПМИД 37319227 . S2CID 259166086 .
- ^ Перейти обратно: а б с Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8 .
- ^ Перейти обратно: а б Виберг, Эгон; Холлеман, Арнольд Фредерик (2001). Неорганическая химия . Эльзевир. ISBN 978-0-12-352651-9 .
- ^ Перейти обратно: а б Альдерги, Люсия; Ганс, Питер; Мидоллини, Стефано; Вакка, Альберто (2000). Сайкс, АГ; Коули, Алан Х. (ред.). «Химия водных растворов бериллия». Достижения неорганической химии . 50 . Сан-Диего: Academic Press: 109–172. дои : 10.1016/S0898-8838(00)50003-8 . ISBN 978-0-12-023650-3 .
- ^ Белл, Н.А. (1972). Достижения неорганической химии и радиохимии . Том. 14. Нью-Йорк: Академик Пресс. стр. 256–277. дои : 10.1016/S0065-2792(08)60008-4 . ISBN 978-0-12-023614-5 .
- ^ Перейти обратно: а б с д и Кумбергер, Отто; Шмидбаур, Хуберт (декабрь 1993 г.). «Почему бериллий так токсичен?» . Химия в наше время (на немецком языке). 27 (6): 310–316. дои : 10.1002/ciuz.19930270611 . ISSN 0009-2851 .
- ^ Розенхайм, Артур; Леманн, Фриц (1924). «О внутрикомплексных берилатах». Анна Либиха. Хим . 440 : 153–166. дои : 10.1002/jlac.19244400115 .
- ^ Шмидт, М.; Бауэр, А.; Шир, А.; Шмидтбауэр, Х (1997). «Хелирование бериллия дикарбоновыми кислотами в водном растворе». Неорганическая химия . 53б (10): 2040–2043 гг. дои : 10.1021/ic961410k . ПМИД 11669821 .
- ^ Перейти обратно: а б Медерос, А.; Домингес, С.; Чинея, Э.; Брито, Ф.; Миддолини, С.; Вакка, А. (1997). «Новейшие аспекты координационной химии очень токсичного катиона бериллия (II): поиск изолирующих агентов». Бол. Соц. Чил. Ким . 42 : 281.
- ^ Перейти обратно: а б Наглав Д.; Бюхнер, MR; Бендт, Г.; Краус, Ф.; Шульц, С. (2016). «С проторенных дорог - Путеводитель по химии бериллия для путешествующих автостопом». Энджью. хим. Межд. Эд . 55 (36): 10562–10576. дои : 10.1002/anie.201601809 . ПМИД 27364901 .
- ^ Коутс, GE; Фрэнсис, БР (1971). «Получение безосновных алкилов бериллия из триалкилборанов. Динеопентилбериллий, бис((триметилсилил)метил)бериллий и гидрид этилбериллия». Журнал Химического общества A: Неорганическое, физическое, теоретическое : 1308. doi : 10.1039/J19710001308 .
- ^ Фишер, Эрнст Отто; Хофманн, Герман П. (1959). «Об ароматических комплексах металлов, XXV. Дициклопентадиенилбериллий». Химические отчеты . 92 (2): 482. doi : 10.1002/cber.19590920233 .
- ^ Ньюджент, КВ; Битти, Дж. К.; Хэмбли, ТВ; Сноу, MR (1984). «Точная низкотемпературная кристаллическая структура бис (циклопентадиенил) бериллия». Австралийский химический журнал . 37 (8): 1601. doi : 10.1071/CH9841601 . S2CID 94408686 .
- ^ Альменнинген, А.; Хааланд, Арне; Луштик, Януш (1979). «Молекулярная структура бериллоцена (C 5 H 5 ) 2 Be. Повторное исследование методом газовой дифракции электронов». Журнал металлоорганической химии . 170 (3): 271. doi : 10.1016/S0022-328X(00)92065-5 .
- ^ Вонг, CH; Ли, Тайвань; Чао, Кей Джей; Ли, С. (1972). «Кристаллическая структура бис (циклопентадиенил) бериллия при -120 ° C». Acta Crystallographica Раздел B. 28 (6): 1662. Бибкод : 1972AcCrB..28.1662W . дои : 10.1107/S0567740872004820 .
- ^ Виганд, Г.; Тиле, К.-Х. (1974). «Вклад в существование соединений аллилбериллия и аллилалюминия». Журнал неорганической и общей химии (на немецком языке). 405 : 101-108. дои : 10.1002/zaac.19744050111 .
- ^ Чмели, Стивен С.; Хануса, Тимоти П.; Бреннессел, Уильям В. (2010). «Бис(1,3-триметилсилилаллил)бериллий». Angewandte Chemie, международное издание . 49 (34): 5870–5874. дои : 10.1002/anie.201001866 . ПМИД 20575128 .
- ^ Руландт-Зенге, Карин; Бартлетт, Рут А.; Олмстед, Мэрилин М.; Пауэр, Филип П. (1993). «Синтез и структурная характеристика соединений бериллия [Be(2,4,6-Me 3 C 6 H 2 ) 2 (OEt 2 )], [Be{O(2,4,6-трет-Bu 3 C 6 H 2 )} 2 (OEt 2 )] и [Be{S(2,4,6-трет-Bu 3 C 6 H 2 )} 2 (THF)]⋅PhMe и определение структуры [BeCl 2 (OEt 2 ) 2 ]». Неорганическая химия . 32 (9): 1724–1728. дои : 10.1021/ic00061a031 .
- ^ Моросин Б.; Ховатсон, Дж. (1971). «Кристаллическая структура димерного метил-1-пропинилбериллийтриметиламина». Журнал металлоорганической химии . 29 : 7–14. дои : 10.1016/S0022-328X(00)87485-9 .
- ^ Перейти обратно: а б Уикс 1968 , с. 535.
- ^ Перейти обратно: а б Уикс 1968 , с. 536.
- ^ Уикс 1968 , с. 537.
- ^ Воклен, Луи-Николя (1798). «Аквамарин, или Берилл; и открытие новой земли в этом камне» [Аквамарин или берилл; и открытие новой земли в этом камне]. Анналы химии . 26 : 155–169. Архивировано из оригинала 27 апреля 2016 года . Проверено 5 января 2016 г.
- ^ В сноске на странице 169. Архивировано 23 июня 2016 года в Wayback Machine (Воклен, 1798 г.) редакторы пишут: «(1) Наиболее характерным свойством этой земли, подтвержденным последними экспериментами нашего коллеги, является образование солей. со сладким вкусом, мы предлагаем назвать его глюцином , от γλυκυς, сладкий , γλυκύ, сладкое вино , γλυκαιτω, делать сладким … Примечание редакции ». ((1) Наиболее характерным свойством этой земли, подтвержденным недавними опытами нашего коллеги [Воклена], является образование солей со сладким вкусом, мы предлагаем называть ее глюцином от γλυκυς, сладкое , γλυκύ, сладкое вино , γλυκαιτω. , чтобы сделать сладкое ... Примечание редакции .)
- ^ Клапрот, Мартин Генрих, Вклад в химические знания минеральных веществ, том. 3, (Берлин, (Германия): Генрих Август Роттманн, 1802 г.), страницы 78–79. Архивировано 26 апреля 2016 г. в Wayback Machine : «Как Воклен, он добавил сладкие средние соли в новую землю, которую он обнаружил в берилле и изумруде, потому что их свойств Форма, название глицин , сладкая земля, он, вероятно, не ожидал, что вскоре после этого будет найдена другая земля, которая могла бы претендовать на это имя на совершенно равных правах, так что ее не спутали бы с иттерной землей. желательно отказаться от названия «Глицин» и заменить его на «Бериловая земля» ( Beryllina ), изменение названия которого уже было рекомендовано профессором Линком, поскольку род растений «Глицин уже существует ». (Когда Воклен дал – из-за его свойства образовывать сладкие соли – название глицин , сладкоземля , на новой земле, найденной им в берилле и смарагде, он, конечно, не ожидал, что вскоре после этого будет найдена другая земля, которая с совершенно равным правом могла бы претендовать на это имя. Поэтому, во избежание смешения его с иттриземлем, возможно, было бы целесообразно отказаться от этого названия глицин и заменить его бериллземельем ( бериллином ); изменение названия было также рекомендовано профессором Линком, и по той причине, что уже существует род растений Glycine .)
- ^ Уикс 1968 , с. 538.
- ^ Вёлер, Ф. (1828). «О бериллии и иттрии» . Анналы физики и химии . 13 (89): 577–582. Бибкод : 1828АнП....89..577Вт . дои : 10.1002/andp.18280890805 . Архивировано из оригинала 26 апреля 2016 года . Проверено 5 января 2016 г.
- ^ Вёлер, Фридрих (1828). «О бериллии и иттрии» . Анналы физики и химии . 89 (8): 577–582. Бибкод : 1828АнП....89..577Вт . дои : 10.1002/andp.18280890805 . Архивировано из оригинала 27 мая 2016 года . Проверено 5 января 2016 г.
- ^ Бюсси, Антуан (1828). «С работы он взялся на глюцинии» . Журнал медицинской химии (4): 456–457. Архивировано из оригинала 22 мая 2016 года . Проверено 5 января 2016 г.
- ^ Перейти обратно: а б Уикс 1968 , с. 539.
- ^ Бойя, Иоганн (27 августа 2016 г.). От сырья к стратегическим сплавам. Случай международной бериллиевой промышленности (1919–1939) . 1-й Всемирный конгресс по истории бизнеса, Берген, Норвегия. дои : 10.13140/rg.2.2.35545.11363 . Архивировано из оригинала 30 октября 2021 года . Проверено 30 октября 2021 г.
- ^ Кейн, Раймонд; Селл, Хайнц (2001). «Обзор ранних неорганических фосфоров» . Революция в лампах: хроника 50-летнего прогресса . Фэрмонт Пресс. п. 98. ИСБН 978-0-88173-378-5 . Архивировано из оригинала 7 мая 2016 года . Проверено 5 января 2016 г.
- ^ Бабу, РС; Гупта, СК (1988). «Добыча бериллия – Обзор». Обзор переработки полезных ископаемых и добывающей металлургии . 4 : 39–94. дои : 10.1080/08827508808952633 .
- ^ Хаммонд, ЧР (2003). «Элементы». Справочник CRC по химии и физике (84-е изд.). Бока-Ратон, Флорида: CRC Press. стр. 4–5. ISBN 978-0-8493-0595-5 . Архивировано из оригинала 13 марта 2020 года . Проверено 18 июля 2019 г.
- ^ «Статистика и информация по бериллию» . Геологическая служба США. Архивировано из оригинала 16 сентября 2008 года . Проверено 18 сентября 2008 г.
- ^ «Товарная сводка: Бериллий» (PDF) . Геологическая служба США. Архивировано (PDF) из оригинала 1 июня 2010 года . Проверено 16 мая 2010 г.
- ^ «Товарный обзор 2000 г.: Бериллий» (PDF) . Геологическая служба США. Архивировано (PDF) из оригинала 16 июля 2010 года . Проверено 16 мая 2010 г.
- ^ «Этимология онлайн» . Архивировано из оригинала 30 октября 2020 года . Проверено 30 октября 2021 г.
- ^ «Британская энциклопедия» . Архивировано из оригинала 23 октября 2021 года . Проверено 30 октября 2021 г.
- ^ «Элементарная материя» . Архивировано из оригинала 29 ноября 2020 года . Проверено 30 октября 2021 г.
- ^ Венесс, Р.; Рамос, Д.; Лепель, П.; Росси, А.; Шнайдер, Г.; Бланшар, С. «Монтаж и ввод в эксплуатацию вакуумных систем для детекторов частиц БАК» (PDF) . ЦЕРН. Архивировано (PDF) из оригинала 14 ноября 2011 года . Проверено 13 января 2012 г.
- ^ Виман, Х; Бизер, Ф.; Кляйнфельдер, С.; Матис, ХС; Невский П.; Рай, Г.; Смирнов Н. (2001). «Новый внутренний вершинный детектор для STAR» (PDF) . Ядерные приборы и методы в физических исследованиях . Секция А. 473 (1–2): 205. Бибкод : 2001NIMPA.473..205W . дои : 10.1016/S0168-9002(01)01149-4 . S2CID 39909027 . Архивировано (PDF) из оригинала 17 октября 2020 г. Проверено 30 октября 2021 г.
- ^ Дэвис, Джозеф Р. (1998). «Бериллий» . Справочник по металлам . АСМ Интернешнл. стр. 690–691. ISBN 978-0-87170-654-6 . Архивировано из оригинала 27 июля 2020 года . Проверено 30 октября 2021 г.
- ^ Шварц, Мел М. (2002). Энциклопедия материалов, деталей и отделки . ЦРК Пресс. п. 62. ИСБН 978-1-56676-661-6 . Архивировано из оригинала 27 июля 2020 года . Проверено 30 октября 2021 г.
- ^ «Музей искусства и технологий горных велосипедов: американское производство велосипедов» . Архивировано из оригинала 20 июля 2011 года . Проверено 26 сентября 2011 г.
- ^ Уорд, Уэйн. «Алюминий-Бериллий» . Рет-Монитор. Архивировано из оригинала 1 августа 2010 года . Проверено 18 июля 2012 г.
- ^ Коллантайн, Кейт (8 февраля 2007 г.). «Запрещено! – Бериллий» . Архивировано из оригинала 21 июля 2012 года . Проверено 18 июля 2012 г.
- ^ Геллер, Элизабет, изд. (2004). Краткая энциклопедия химии . Нью-Йорк: МакГроу-Хилл. ISBN 978-0-07-143953-4 .
- ^ «Силы обороны сталкиваются с риском воздействия редких токсичных металлов» . Сидней Морнинг Геральд . 1 февраля 2005 г. Архивировано из оригинала 30 декабря 2007 г. Проверено 8 августа 2009 г.
- ^ Руководство пользователя Shure V15VxMR, страница 2
- ^ «Космический телескоп Уэбба перепишет космическую историю. Если он сработает» . Журнал Кванта. 3 декабря 2021 года. Архивировано из оригинала 5 декабря 2021 года . Проверено 5 декабря 2021 г.
- ^ Гарднер, Джонатан П. (2007). «Космический телескоп Джеймса Уэбба» (PDF) . Proceedings of Science : 5. Bibcode : 2007mru..confE...5G . дои : 10.22323/1.052.0005 . S2CID 261976160 . Архивировано (PDF) из оригинала 4 июня 2016 года . Проверено 15 января 2009 г.
- ^ Вернер, МВт; Руллиг, ТЛ; Лоу, Ф.Дж.; Рике, Г.Х.; Рике, М.; Хоффманн, ВФ; Янг, Э.; Хоук, младший; и др. (2004). «Миссия космического телескопа Спитцер». Приложение к астрофизическому журналу . 154 (1): 1–9. arXiv : astro-ph/0406223 . Бибкод : 2004ApJS..154....1W . дои : 10.1086/422992 . S2CID 119379934 .
- ^ Грей, Теодор . Гироскопическая сфера. Пример элемента бериллий. Архивировано 14 апреля 2021 года в Wayback Machine . periodtable.com
- ^ Койола, Кеннет; Лурье, Уильям (9 августа 1961 г.). «Выбор маломагнитных сплавов для инструментов ЭОД» . Завод по производству военно-морского оружия в Вашингтоне. Архивировано из оригинала 23 августа 2011 года . Проверено 28 февраля 2010 г.
- ^ Дорш, Джерри А. и Дорш, Сьюзан Э. (2007). Понимание анестезиологического оборудования . Липпинкотт Уильямс и Уилкинс. п. 891. ИСБН 978-0-7817-7603-5 . Архивировано из оригинала 27 июля 2020 года . Проверено 30 октября 2021 г.
- ^ Перейти обратно: а б Барнаби, Фрэнк (1993). Как распространяется ядерное оружие . Рутледж. п. 35. ISBN 978-0-415-07674-6 . Архивировано из оригинала 27 июля 2020 года . Проверено 30 октября 2021 г.
- ^ Бирн, Дж. Нейтроны, ядра и материя , Dover Publications, Минеола, Нью-Йорк, 2011, ISBN 0-486-48238-3 , стр. 32–33.
- ^ Кларк, REH; Райтер, Д. (2005). Исследования ядерного синтеза . Спрингер. п. 15. ISBN 978-3-540-23038-0 . Архивировано из оригинала 27 июля 2020 года . Проверено 30 октября 2021 г.
- ^ Петти, Д.; Смолик Г.; Симпсон, М.; Шарп, Дж.; Андерл, Р.; Фукада, С.; Хатано, Ю.; Хара, М.; и др. (2006). «Исследование расплавленной соли ЮПИТЕР-II Flibe: обновленная информация об экспериментах по тритию, мобилизации и окислительно-восстановительной химии» . Термоядерная инженерия и дизайн . 81 (8–14): 1439. doi : 10.1016/j.fusengdes.2005.08.101 . ОСТИ 911741 . Архивировано из оригинала 26 апреля 2021 года . Проверено 30 октября 2021 г.
- ^ «Scan Speak предлагает высокочастотные динамики OEM-производителям и домашним мастерам» (PDF) . Сканировать «Говори». Май 2010 г. Архивировано из оригинала (PDF) 3 марта 2016 г.
- ^ Джонсон, Джон Э. младший (12 ноября 2007 г.). «Полочные колонки Usher Be-718 с бериллиевыми твитерами» . Архивировано из оригинала 13 июня 2011 года . Проверено 18 сентября 2008 г.
- ^ «Студийный монитор Exposé E8B» . КРК Системс. Архивировано из оригинала 10 апреля 2011 года . Проверено 12 февраля 2009 г.
- ^ «Использование бериллия в профессиональных аудиоколонках Focal» . Архивировано из оригинала 31 декабря 2012 года.
- ^ «VUE Audio объявляет об использовании громкоговорителей Be in Pro Audio» . ВУЭ Аудиотехника . Архивировано из оригинала 10 мая 2012 года . Проверено 21 мая 2012 г.
- ^ Свилар, Марк (8 января 2004 г.). «Анализ купола и диффузора динамика из «бериллия», полученных из Китая» . Архивировано из оригинала 17 мая 2013 года . Проверено 13 февраля 2009 г.
- ^ «Руководство пользователя Shure V15 VXmR» (PDF) . Архивировано из оригинала (PDF) 10 января 2017 года . Проверено 31 мая 2017 г.
- ^ Диль, Роланд (2000). Мощные диодные лазеры . Спрингер. п. 104. ИСБН 978-3-540-66693-6 . Архивировано из оригинала 27 июля 2020 года . Проверено 30 октября 2021 г.
- ^ «Инженеры Purdue создают более безопасное и эффективное ядерное топливо, моделируют его характеристики» . Университет Пердью. 27 сентября 2005 г. Архивировано из оригинала 27 мая 2012 г. Проверено 18 сентября 2008 г.
- ^ Бреслин Эй Джей (1966). «Глава 3. Воздействие и характер заболеваний в бериллиевой промышленности». В Стокинджере, HE (ред.). Бериллий: аспекты промышленной гигиены . Академик Пресс, Нью-Йорк. стр. 30–33. ISBN 978-0-12-671850-8 .
- ^ Информационный бюллетень OSHA об опасностях HIB 02-04-19 (ред. 05-14-02) Предотвращение неблагоприятных последствий для здоровья от воздействия бериллия в стоматологических лабораториях
- ^ Эльшахави, В.; Ватанабэ, И. (2014). «Биосовместимость стоматологических сплавов, используемых в несъемном зубном протезировании» . Танта Стоматологический журнал . 11 (2): 150–159. дои : 10.1016/j.tdj.2014.07.005 .
- ^ «Бериллий 265063» . Сигма-Олдрич. 24 июля 2021 года. Архивировано из оригинала 11 апреля 2021 года . Проверено 21 декабря 2021 г.
- ^ Перейти обратно: а б с Эмсли 2001 , с. 57.
- ^ Венугопал, Б. (14 марта 2013 г.). Физиолого-химические основы токсичности металлов . Спрингер. стр. 167–8. ISBN 978-1-4684-2952-7 .
- ^ «Бериллий и соединения бериллия» . Монография МАИР . Том. 58. Международное агентство по изучению рака. 1993. Архивировано из оригинала 26 мая 2024 года . Проверено 18 сентября 2008 г.
- ^ Карманный справочник NIOSH по химическим опасностям. «#0054» . Национальный институт охраны труда и здоровья (NIOSH).
- ^ «CDC - Карманный справочник NIOSH по химическим опасностям - Мышьяк (неорганические соединения, такие как As)» . Архивировано из оригинала 11 мая 2017 года . Проверено 30 октября 2021 г.
- ^ Карманный справочник NIOSH по химическим опасностям - Соединения ртути . Национальный институт охраны труда и здоровья (NIOSH). Архивировано 7 мая 2021 года в Wayback Machine.
- ^ Перейти обратно: а б «CDC – Исследования бериллия – Тема безопасности и гигиены труда NIOSH» . www.cdc.gov . Архивировано из оригинала 8 марта 2013 года . Проверено 30 января 2017 г.
- ^ Эмсли 2001 , с. 5.
- ^ «Фотография ученых из Чикаго, 1946 год» . Управление по связям с общественностью Аргоннской национальной лаборатории. 19 июня 2006 г. Архивировано из оригинала 11 декабря 2008 г. Проверено 18 сентября 2008 г.
- ↑ Рабочие судостроения Ньюпорт-Ньюс сталкиваются со скрытым токсином. Архивировано 13 января 2014 г. в Wayback Machine , Daily Press (Вирджиния) , Майкл Уэллс Шапиро, 31 августа 2013 г.
- ^ Международная программа по химической безопасности (1990 г.). «Бериллий: КРИТЕРИИ ЗДОРОВЬЯ ОКРУЖАЮЩЕЙ СРЕДЫ 106» . Всемирная организация здравоохранения. Архивировано из оригинала 9 июня 2011 года . Проверено 10 апреля 2011 г.
- ^ «ASTM D7458-08» . Американское общество испытаний и материалов. Архивировано из оригинала 12 июля 2010 года . Проверено 8 августа 2009 г.
- ^ Миноуг, ЕМ; Элер, Д.С.; Баррелл, АК; Макклески, ТМ; Тейлор, Т.П. (2005). «Разработка нового флуоресцентного метода обнаружения бериллия на поверхностях». Журнал ASTM International . 2 (9): 13168. дои : 10.1520/JAI13168 .
- ^ «CDC – Публикации и продукты NIOSH – Руководство NIOSH по аналитическим методам (2003–154) – Альфа-список B» . www.cdc.gov . Архивировано из оригинала 16 декабря 2016 года . Проверено 30 января 2017 г.
Цитированные источники [ править ]
- Эмсли, Джон (2001). Строительные блоки природы: Путеводитель по элементам от А до Я. Оксфорд, Англия, Великобритания: Издательство Оксфордского университета. ISBN 978-0-19-850340-8 .
- Маккей, Кеннет Малкольм; Маккей, Розмари Энн; Хендерсон, В. (2002). Введение в современную неорганическую химию (6-е изд.). ЦРК Пресс. ISBN 978-0-7487-6420-4 .
- Уикс, Мэри Эльвира ; Лечестер, Генри М. (1968). Открытие элементов . Истон, Пенсильвания: Журнал химического образования. LCCCN 68-15217.
Дальнейшее чтение [ править ]
- Ньюман Л.С. (2003). «Бериллий». Новости химии и техники . 81 (36): 38. doi : 10.1021/cen-v081n036.p038 .
- Мроз М.М., Балкиссун Р. и Ньюман Л.С. «Бериллий». В: Бингэм Э., Корссен Б., Пауэлл С. (ред.) Токсикология Пэтти , пятое издание. Нью-Йорк: Джон Вили и сыновья, 2001, 177–220.
- Уолш, К.А., Химия и переработка бериллия . Видаль, Э.Э. и др. Ред. 2009, Парк материалов, Огайо: ASM International.
- Тестирование пролиферации бериллиевых лимфоцитов (BeLPT). Спецификация Министерства энергетики США 1142–2001. Вашингтон, округ Колумбия: Министерство энергетики США, 2001.
- 2007, Эрик Шерри, Таблица Менделеева: ее история и значение, Oxford University Press, Нью-Йорк, ISBN 978-0-19-530573-9
Внешние ссылки [ править ]
- Тематические исследования ATSDR в экологической медицине: токсичность бериллия США Министерство здравоохранения и социальных служб
- Это элементарно – Бериллий
- Паспорт безопасности : ESPI Металлы
- Бериллий в Периодической таблице видео (Ноттингемский университет)
- Национальный институт охраны труда и здоровья - Бериллиевая страница
- Национальная дополнительная программа скрининга (ассоциированные университеты Ок-Риджа)
- Историческая цена бериллия в США

![{\displaystyle {\ce {[Be(H2O)4]^{2}+{}+{\mathit {n}}\,F^{-}<=>Be[(H2O)_{2\!- {\mathit {n}}}F_{\mathit {n}}]^{2\!-{\mathit {n}}}{}+{\mathit {n}}\,H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9b4cabb9c4f8dd2cd76b67ae2b7338b0df72eab6)
![{\displaystyle {\ce {H2A + [Be(H2O)4]^2+ <=> [BeA(H2O)2] + 2H+ + 2H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7cfee182a6f6d66479ed4ea44f318b60bc531733)
![{\displaystyle {\ce {H2A + [BeA(H2O)2] <=> [BeA2]^2- + 2H+ + 2H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4e584fca5d0eed9a46d5cdcb9b3540ff77d40af2)
![{\displaystyle {\ce {Na_4[Be_6(OCH_2(O)O)_6]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/eb11d9d4fdbfc6972b29c3f0da2932c7af31f59a)
