Марганец
 Кубик чистого марганца и чипсы окисленного марганца. | |||||||||||||||||||||||||||||||||||
| Марганец | |||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Произношение | / ˈ m æ ŋ ɡ n ə iː z / | ||||||||||||||||||||||||||||||||||
| Появление | серебристый металлик | ||||||||||||||||||||||||||||||||||
| Стандартный атомный вес А р °(Мн) | |||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
| Марганец в таблице Менделеева | |||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
| Атомный номер ( Z ) | 25 | ||||||||||||||||||||||||||||||||||
| Группа | группа 7 | ||||||||||||||||||||||||||||||||||
| Период | период 4 | ||||||||||||||||||||||||||||||||||
| Блокировать | d-блок | ||||||||||||||||||||||||||||||||||
| Электронная конфигурация | [ Ар ] 3d 5 4 с 2 | ||||||||||||||||||||||||||||||||||
| Электроны на оболочку | 2, 8, 13, 2 | ||||||||||||||||||||||||||||||||||
| Физические свойства | |||||||||||||||||||||||||||||||||||
| Фаза в СТП | твердый | ||||||||||||||||||||||||||||||||||
| Температура плавления | 1519 К (1246 °С, 2275 °F) | ||||||||||||||||||||||||||||||||||
| Точка кипения | 2334 К (2061 °С, 3742 °F) | ||||||||||||||||||||||||||||||||||
| Плотность (при 20°С) | 7,476 г/см 3 [3] | ||||||||||||||||||||||||||||||||||
| в жидком состоянии (при температуре плавления ) | 5,95 г/см 3 | ||||||||||||||||||||||||||||||||||
| Теплота плавления | 12,91 кДж/моль | ||||||||||||||||||||||||||||||||||
| Теплота испарения | 221 кДж/моль | ||||||||||||||||||||||||||||||||||
| Молярная теплоемкость | 26,32 Дж/(моль·К) | ||||||||||||||||||||||||||||||||||
Давление пара
| |||||||||||||||||||||||||||||||||||
| Атомные свойства | |||||||||||||||||||||||||||||||||||
| Стадии окисления | −3, −1, 0, +1, +2 , +3 , +4 , +5, +6 , +7 (в зависимости от степени окисления кислотный, основной или амфотерный оксид) | ||||||||||||||||||||||||||||||||||
| Электроотрицательность | Шкала Полинга: 1,55. | ||||||||||||||||||||||||||||||||||
| Энергии ионизации |
| ||||||||||||||||||||||||||||||||||
| Атомный радиус | эмпирический: 127 вечера | ||||||||||||||||||||||||||||||||||
| Ковалентный радиус | Низкое вращение: 139 ± 17:00. Высокое вращение: 161±8 часов вечера | ||||||||||||||||||||||||||||||||||
| Другие объекты недвижимости | |||||||||||||||||||||||||||||||||||
| Естественное явление | первобытный | ||||||||||||||||||||||||||||||||||
| Кристаллическая структура | α-Mn: объемноцентрированная кубическая (ОЦК) ( cI58 ) | ||||||||||||||||||||||||||||||||||
| Постоянная решетки | а = 891,16 вечера (при 20 ° C) [3] | ||||||||||||||||||||||||||||||||||
| Тепловое расширение | 23.61 × 10 −6 /К (при 20 °С) [3] | ||||||||||||||||||||||||||||||||||
| Теплопроводность | 7,81 Вт/(м⋅К) | ||||||||||||||||||||||||||||||||||
| Электрическое сопротивление | 1,44 мкОм⋅м (при 20 °C) | ||||||||||||||||||||||||||||||||||
| Магнитный заказ | парамагнитный | ||||||||||||||||||||||||||||||||||
| Молярная магнитная восприимчивость | (а) +529,0 × 10 −6 см 3 /моль (293 К) [4] | ||||||||||||||||||||||||||||||||||
| Модуль Юнга | 198 ГПа | ||||||||||||||||||||||||||||||||||
| Объемный модуль | 120 ГПа | ||||||||||||||||||||||||||||||||||
| Скорость звука тонкого стержня | 5150 м/с (при 20 °C) | ||||||||||||||||||||||||||||||||||
| Твердость по шкале Мооса | 6.0 | ||||||||||||||||||||||||||||||||||
| Твердость по Бринеллю | 196 МПа | ||||||||||||||||||||||||||||||||||
| Номер CAS | 7439-96-5 | ||||||||||||||||||||||||||||||||||
| История | |||||||||||||||||||||||||||||||||||
| Открытие | Карл Вильгельм Шееле (1774) | ||||||||||||||||||||||||||||||||||
| Первая изоляция | Иоганн Готлиб Ган (1774) | ||||||||||||||||||||||||||||||||||
| Изотопы марганца | |||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
Марганец — химический элемент ; он имеет символ Mn и атомный номер 25. Это твердый, хрупкий, серебристый металл, часто встречающийся в минералах в сочетании с железом . Марганец был впервые выделен в 1770-х годах. Марганец — это переходный металл , который широко используется в промышленных сплавах , особенно в нержавеющих сталях . Повышает прочность, работоспособность и устойчивость к износу. В качестве окислителя используется оксид марганца; в качестве резиновой добавки; а также в производстве стекла, удобрений и керамики. Сульфат марганца можно использовать в качестве фунгицида.
Марганец также является важным элементом питания человека, играющим важную роль в метаболизме макронутриентов, формировании костей и от свободных радикалов системах защиты . Это важнейший компонент десятков белков и ферментов. [6] Он содержится в основном в костях, а также в печени, почках и мозге. [7] В человеческом мозге марганец связан с металлопротеинами марганца , особенно с глутаминсинтетазой в астроцитах .
В лаборатории он известен в виде темно-фиолетовой соли перманганата калия . Это происходит в активных центрах некоторых ферментов . [8] Особый интерес представляет использование кластера Mn-O — кислородвыделяющего комплекса — в производстве кислорода растениями.
Характеристики
[ редактировать ]Физические свойства
[ редактировать ]Марганец — серебристо-серый металл , напоминающий железо. Он тверд и очень хрупок, его трудно плавить, но легко окислить. [9] Металлический марганец и его общие ионы парамагнитны . [10] Марганец медленно тускнеет на воздухе и окисляется («ржавеет»), как железо в воде, содержащей растворенный кислород. [11]
изотопы
[ редактировать ]Встречающийся в природе марганец состоит из одного стабильного изотопа . 55 Мн. несколько радиоизотопов Было выделено и описано с атомной массой от 46 ед . 46 Мн) до 72 ед ( 72 Мн). Наиболее стабильными являются 53 Mn с периодом полураспада 3,7 млн лет, 54 Mn с периодом полураспада 312,2 дня и 52 Mn с периодом полураспада 5,591 дней. Все остальные радиоактивные изотопы имеют период полураспада менее трёх часов, а большинство — менее одной минуты. Первичный режим распада изотопов, более легких, чем наиболее распространенный стабильный изотоп, 55 Mn — это захват электронов , а основной модой более тяжелых изотопов является бета-распад . [12] Марганец также имеет три метасостояния . [12]
Марганец входит в группу элементов железа , которые, как полагают, синтезируются в крупных звездах незадолго до взрыва сверхновой . [13] 53 Mn распадается на 53 Cr с периодом полураспада 3,7 миллиона лет. Из-за относительно короткого периода полураспада 53 Mn сравнительно редок, образуется в результате воздействия космических лучей на железо . [14] Содержание изотопов марганца обычно сочетается с содержанием изотопов хрома и нашло применение в изотопной геологии и радиометрическом датировании . Изотопные отношения Mn–Cr подтверждают данные 26 Эл и 107 Pd по ранней истории Солнечной системы . Вариации в 53 Кр/ 52 Соотношения Cr и Mn/Cr в нескольких метеоритах предполагают первоначальное 53 Мн/ 55 Отношение Mn, которое указывает на то, что изотопный состав Mn–Cr должен быть результатом in situ распада 53 Mn в дифференцированных планетных телах. Следовательно, 53 Mn является дополнительным свидетельством нуклеосинтетических процессов непосредственно перед слиянием Солнечной системы. [15] [16] [17] [18]
Аллотропы
[ редактировать ] | 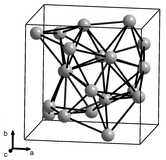 |
четыре аллотропа Известны (структурные формы) твердого марганца, обозначенные α, β, γ и δ и встречающиеся при последовательно более высоких температурах. Все они металлические, стабильны при стандартном давлении и имеют кубическую кристаллическую решетку, но их атомная структура сильно различается. [19] [20] [21]
Альфа-марганец (α-Mn) является равновесной фазой при комнатной температуре. Он имеет объемно-центрированную кубическую решетку и необычен среди элементарных металлов тем, что имеет очень сложную элементарную ячейку с 58 атомами на ячейку (29 атомов на примитивную элементарную ячейку) в четырех различных типах узлов. [22] [19] Он парамагнитен при комнатной температуре и антиферромагнитен при температуре ниже 95 К (-178 ° C). [23]

Бета-марганец (β-Mn) образуется при нагревании выше температуры перехода 973 К (700 ° C; 1290 ° F). Он имеет примитивную кубическую структуру с 20 атомами на элементарную ячейку в двух типах узлов, которая столь же сложна, как и структура любого другого элементарного металла. [24] Его легко получить в виде метастабильной фазы при комнатной температуре путем быстрой закалки. Он не демонстрирует магнитного упорядочения и остается парамагнитным вплоть до самой низкой измеренной температуры (1,1 К). [24] [25] [26]
Гамма-марганец (γ-Mn) образуется при нагревании выше 1370 К (1100 ° C; 2010 ° F). Он имеет простую гранецентрированную кубическую структуру (четыре атома на элементарную ячейку). При закалке до комнатной температуры он превращается в β-Mn, но его можно стабилизировать при комнатной температуре, легируя его не менее чем с 5 процентами других элементов (таких как C, Fe, Ni, Cu, Pd или Au), и эти растворенные вещества -стабилизированные сплавы искажаются, образуя гранецентрированную тетрагональную структуру. [27] [26]
Дельта-марганец (δ-Mn) образуется при нагревании выше 1406 К (1130 °C; 2070 °F) и стабилен до температуры плавления марганца 1519 К (1250 °C; 2270 °F). Он имеет объемноцентрированную кубическую структуру (два атома на кубическую элементарную ячейку). [20] [26]
Химические соединения
[ редактировать ]
Обычные степени окисления марганца +2, +3, +4, +6 и +7, хотя наблюдались все степени окисления от -3 до +7, кроме -2. Марганец в степени окисления +7 представлен солями перманганат-аниона интенсивно фиолетового цвета. МnО - 4 . Перманганат калия является широко используемым лабораторным реагентом из-за его окислительных свойств; применяется как местное лекарственное средство (например, при лечении болезней рыб). Растворы перманганата калия были одними из первых красителей и фиксаторов, которые стали использовать при подготовке биологических клеток и тканей к электронной микроскопии. [29]
Помимо различных перманганатных солей, Mn(VII) представлен нестабильным летучим производным Mn 2 O 7 . Оксигалогениды (MnO 3 F и MnO 3 Cl) являются мощными окислителями . [9] Наиболее ярким примером Mn в степени окисления +6 является зеленый анион- манганат [MnO 4 ]. 2− . Манганатные соли являются полупродуктами при извлечении марганца из руд. Соединения со степенью окисления +5 несколько неуловимы, и их часто обнаруживают в сочетании с оксидом ( O 2− ) или нитрид (N 3− ) лиганд. [30] [31] Одним из примеров является синий анион гипоманганат [MnO 4 ]. 3− .
Mn(IV) несколько загадочный, поскольку он широко распространен в природе, но гораздо реже встречается в синтетической химии. Самая распространенная марганцевая руда — пиролюзит — MnO2 . Это темно-коричневый пигмент многих наскальных рисунков , но он также является распространенным ингредиентом сухих батарей. Комплексы Mn(IV) хорошо известны, но они требуют сложных лигандов. Комплексы Mn(IV)-OH являются промежуточными соединениями в некоторых ферментах , включая центр выделения кислорода (OEC) в растениях. [32]
Простые производные Mn 3+ встречаются редко, но могут быть стабилизированы подходящим основным лигандом. Ацетат марганца(III) — окислитель, используемый в органическом синтезе . Твердые соединения марганца (III) характеризуются сильным пурпурно-красным цветом и предпочтением искаженной октаэдрической координации в результате эффекта Яна-Теллера . [ нужна ссылка ]

Наиболее распространенная степень окисления марганца в водном растворе составляет +2, который имеет бледно-розовый цвет. Известны многие соединения марганца(II), такие как аквакомплексы, полученные из сульфата марганца(II) (MnSO 4 ) и хлорида марганца(II) (MnCl 2 ). Эта степень окисления также наблюдается в минерале родохрозите ( карбонате марганца (II) ). Марганец (II) обычно существует с высоким спином, основным состоянием S = 5/2 из-за высокой энергии спаривания марганца (II). В марганце (II) нет разрешенных по спину d – d-переходов, что объясняет его слабый цвет. [33]
| Степени окисления марганца [34] | |
|---|---|
| −3 | Mn(CO)(NO) 3 |
| −1 | HMn(CO) 5 |
| 0 | Мин. 2 (КО) 10 |
| +1 | МНК 55Ч 16:00 3 (КО) 3 |
| +2 | MnCl 2 , МнСО 3 , МnО |
| +3 | МнФ 3 , Мн(ОАс) 3 , Мн 22О 3 |
| +4 | MnO 2 |
| +5 | К 33MnO 4 |
| +6 | К 2 МnО 4 |
| +7 | КМнО 4 , Мн 22О 7 |
| Общие степени окисления выделены жирным шрифтом. | |
Марганцевоорганические соединения
[ редактировать ]Марганец образует большое разнообразие металлоорганических производных, т. е. соединений со связями Mn-C. Металлоорганические производные включают многочисленные примеры Mn в его низших степенях окисления, т.е. от Mn(-III) до Mn(I). Эта область металлоорганической химии привлекательна тем, что марганец недорог и относительно малотоксичен. [35]
Наибольший коммерческий интерес представляет «ММТ», метилциклопентадиенилтрикарбонил марганца , который в некоторых странах используется в качестве антидетонационного соединения, добавляемого в бензин (бензин). Он содержит Mn(I). В соответствии с другими аспектами химии Mn (II), манганоцен ( Mn(C 5 H 5 ) 2 ) является высокоспиновым. Напротив, соседнее с ним металлическое железо образует устойчивое на воздухе низкоспиновое производное в форме ферроцена ( Fe(C 5 H 5 ) 2 ). в атмосфере монооксида углерода Восстановление солей Mn(II) дает декакарбонил димарганца. Mn 2 (CO) 10 , летучее твердое вещество оранжевого цвета. Устойчивость этого соединения Mn(0) (и его многих производных) на воздухе отражает мощные электроноакцепторные свойства монооксида углерода. Многие алкеновые и алкиновые комплексы образуются из Мн 2 (СО) 10 . [ нужна ссылка ]
В Mn(CH 3 ) 2 (dmpe) 2 Mn(II) имеет низкий спин, что контрастирует с высокоспиновым характером его предшественника MnBr 2 (dmpe) 2 ( dmpe = (CH 3 ) 2 PCH 2 CH 2 P (СН 3 ) 2 ). [36] Полиалкильные и полиарильные производные марганца часто существуют в более высоких степенях окисления, что отражает свойства высвобождения электронов алкильных и арильных лигандов. Одним из примеров является [Mn(CH 3 ) 6 ] 2− . [ нужна ссылка ]
История
[ редактировать ]Происхождение названия марганец сложное. В древние времена в регионах Магнетес были идентифицированы два черных минерала ( либо Магнезия , расположенная на территории современной Греции, либо Магнезия-ад-Сипилум , расположенная на территории современной Турции). [37] их обоих называли магнами По месту происхождения , но считалось, что они различаются по полу. Мужские магнесы притягивали железо и представляли собой железную руду, теперь известную как магнит или магнетит , которая, вероятно, и дала нам термин «магнит» . Женская магнетическая руда не притягивала железо, но использовалась для обесцвечивания стекла. Этот женский магнез позже был назван магнезией , а в наше время известен как пиролюзит или диоксид марганца . [38] Ни этот минерал, ни элементарный марганец не являются магнитными. В 16 веке стеклодувы называли диоксид марганца марганцем (обратите внимание на две буквы N вместо одной), возможно, как искажение и объединение двух слов, поскольку алхимикам и стекольщикам в конечном итоге пришлось отличать магнезию черную (черную руду) от магнезии. alba (белая руда, также из магнезии, также используемая в производстве стекла). Микеле Меркати назвал магнезию нигра марганцем , а наконец выделенный из нее металл стал называться марганцем ( нем . Mangan ). Название «магнезия» в конечном итоге стало использоваться только для обозначения белой магнезии (оксида магния), что дало название «магний» свободному элементу, когда он был выделен гораздо позже. [39]

Диоксид марганца, которого много в природе, издавна использовался в качестве пигмента. Наскальные рисунки в Гаргасе возрастом от 30 000 до 24 000 лет выполнены из минеральной формы пигментов MnO 2 . [41]
Соединения марганца использовались египетскими и римскими стеклодувами для придания или удаления цвета стекла. [42] Использование его в качестве «мыла для стеклоделов» продолжалось в Средние века до наших дней, и это заметно по стеклу 14-го века из Венеции . [43]

Поскольку диоксид марганца использовался в производстве стекла, он был доступен для экспериментов алхимикам, первым химикам. Игнатий Готфрид Каим (1770 г.) и Иоганн Глаубер (17 век) обнаружили, что диоксид марганца можно превратить в перманганат — полезный лабораторный реагент. [44] Каим также мог восстановить диоксид марганца, чтобы изолировать металл, но это сомнительно. [45] К середине 18 века шведский химик Карл Вильгельм Шееле использовал диоксид марганца для производства хлора . Сначала соляная кислота или смесь разбавленной серной кислоты и хлорида натрия подвергалась реакции с диоксидом марганца, а позже была использована соляная кислота из процесса Леблана , а диоксид марганца был переработан по процессу Уэлдона . производство хлорных и гипохлоритных отбеливателей . Крупным потребителем марганцевых руд было [ нужна ссылка ]
Шееле и другие знали, что пиролюзит (минеральная форма диоксида марганца) содержит новый элемент. Йохан Готлиб Ган в 1774 году выделил нечистый образец металлического марганца, восстановив его диоксид углеродом . [46]
Содержание марганца в некоторых железных рудах, используемых в Греции, привело к предположениям, что сталь, произведенная из этой руды, содержит дополнительный марганец, что делает спартанскую сталь исключительно твердой. [47] Примерно в начале 19 века марганец использовался в производстве стали, и на него было получено несколько патентов. В 1816 году было документально подтверждено, что железо, легированное марганцем, тверже, но не более хрупко. В 1837 году британский академик Джеймс Купер отметил связь между тяжелым воздействием марганца на шахтеров и формой болезни Паркинсона . [48] В 1912 году в США были выданы патенты на защиту огнестрельного оружия от ржавчины и коррозии с помощью электрохимических конверсионных покрытий из фосфата марганца, и с тех пор этот процесс получил широкое распространение. [49]
Изобретение элемента Лекланше в 1866 году и последующее усовершенствование батарей, содержащих диоксид марганца в качестве катодного деполяризатора, увеличили спрос на диоксид марганца. До разработки никель-кадмиевых и литиевых батарей большинство батарей содержало марганец. В цинк -углеродных батареях и щелочных батареях обычно используется диоксид марганца промышленного производства, поскольку природный диоксид марганца содержит примеси. В XX веке диоксид марганца широко использовался в качестве катода для коммерческих одноразовых сухих батарей как стандартного (цинко-угольного), так и щелочного типа. [50]
Марганец необходим для производства железа и стали благодаря своим серофиксирующим , раскисляющим и легирующим свойствам. [51] Это применение было впервые признано британским металлургом Робертом Форестером Мушетом (1811–1891), который в 1856 году представил этот элемент в форме Spiegeleisen .
возникновение
[ редактировать ]Марганец составляет около 1000 ppm (0,1%) земной коры и является 12-м по распространенности элементом. [7] Почва содержит 7–9000 частей на миллион марганца, в среднем 440 частей на миллион. [7] В атмосфере содержится 0,01 мкг/м 3 . [7] Manganese occurs principally as pyrolusite ( MnO 2 ), braunite (Mn 2+ Мин. 3+ 6 )SiO 12 ), [52] псиломелан (Ba,H 2 O) 2 Mn 5 O 10 и в меньшей степени родохрозит ( MnCO 3 ).
 |  |  |  |  |
| Марганцевая руда | Псиломелан (марганцевая руда) | Spiegeleisen — это сплав железа с содержанием марганца около 15%. | Дендриты оксида марганца на известняке из Зольнхофена , Германия — разновидность псевдоископаемого . Масштаб в мм | Минерал родохрозит ( карбонат марганца(II) ) |

Наиболее важной марганцевой рудой является пиролюзит ( MnO 2 ). Другие экономически важные марганцевые руды обычно имеют близкое пространственное отношение к железным рудам, например сфалерит . [9] [53] Ресурсы суши велики, но распределены неравномерно. Около 80% известных мировых ресурсов марганца находятся в Южной Африке; другие важные месторождения марганца находятся в Украине, Австралии, Индии, Китае, Габоне и Бразилии. [51] По оценкам 1978 года, на дне океана находится 500 миллиардов тонн марганцевых конкреций . [54] Попытки найти экономически выгодные методы добычи марганцевых конкреций были прекращены в 1970-х годах. [55]
В Южной Африке большинство выявленных месторождений расположены недалеко от Хотазеля в Северо-Капской провинции ( марганцевые месторождения Калахари ), их запасы на 2011 год оцениваются в 15 миллиардов тонн. В 2011 году Южная Африка произвела 3,4 миллиона тонн, превзойдя все другие страны. [56]
Марганец в основном добывают в Южной Африке, Австралии, Китае, Габоне, Бразилии, Индии, Казахстане, Гане, Украине и Малайзии. [57]
Производство
[ редактировать ]Для производства ферромарганца марганцевую руду смешивают с железной рудой и углеродом, а затем восстанавливают либо в доменной печи, либо в электродуговой печи. [58] Полученный ферромарганец имеет содержание марганца 30–80%. [9] Чистый марганец, используемый для производства безжелезистых сплавов, получают путем выщелачивания марганцевой руды серной кислотой и последующего процесса электровыделения . [59]

Более прогрессивный процесс добычи включает прямое восстановление (низкосортной) марганцевой руды путем кучного выщелачивания . Это делается путем просачивания природного газа через дно кучи; природный газ обеспечивает тепло (должно быть не менее 850 °C) и восстановитель (окись углерода). Это превращает всю марганцевую руду в оксид марганца (MnO), который является выщелачиваемой формой. Затем руда проходит через контур измельчения , чтобы уменьшить размер частиц руды до 150–250 мкм, увеличивая площадь поверхности и способствуя выщелачиванию. Затем руду добавляют в резервуар для выщелачивания серной кислоты и двухвалентного железа (Fe 2+ ) в соотношении 1,6:1. Железо реагирует с диоксидом марганца (MnO 2 ) с образованием гидроксида железа (FeO(OH)) и элементарного марганца (Mn). [ нужна ссылка ]
Этот процесс дает около 92% извлечения марганца. Для дальнейшей очистки марганец затем можно отправить на установку электролиза . [60]
Океаническая среда
[ редактировать ]В 1972 году ЦРУ « проект Азориан » через миллиардера Говарда Хьюза заказал судно «Хьюз Гломар Эксплорер» под предлогом добычи марганцевых конкреций со дна моря. [61] Это вызвало всплеск активности по сбору марганцевых конкреций, что на самом деле было непрактично. Настоящая миссия Hughes Glomar Explorer заключалась в подъеме затонувшей советской подводной лодки К-129 с целью восстановления советских кодовых книг. [62]
Богатый ресурс марганца в виде марганцевых конкреций, обнаруженных на дне океана. [63] Эти узелки, состоящие на 29% из марганца, [64] расположены вдоль дна океана . на окружающую среду . Представляет интерес воздействие сбора конкреций [65] [66]
Растворенный марганец (dMn) встречается во всем Мировом океане, 90% которого поступает из гидротермальных источников. [67] Частицы Mn образуются в виде плавучих шлейфов над активным источником жерла, в то время как dMn ведет себя консервативно. [68] Концентрации Mn варьируются в зависимости от толщи воды океана. На поверхности уровень dMn повышается из-за поступления внешних источников, таких как реки, пыль и шельфовые отложения. Прибрежные отложения обычно имеют более низкие концентрации Mn, но могут увеличиваться из-за антропогенных выбросов таких отраслей, как горнодобывающая и сталелитейная промышленность, которые попадают в океан с речными стоками. Концентрации dMn на поверхности также могут повышаться биологически за счет фотосинтеза и физически за счет прибрежного апвеллинга и ветровых поверхностных течений. Внутренний цикл, такой как фотовосстановление от УФ-излучения, также может повысить уровни за счет ускорения растворения оксидов Mn и окислительного удаления, предотвращая попадание Mn в более глубокие воды. [69] Повышенные уровни на средних глубинах могут возникать вблизи срединно-океанических хребтов и гидротермальных жерл. Гидротермальные источники выбрасывают в воду жидкость, обогащенную dMn. Затем dMn может путешествовать на расстояние до 4000 км благодаря присутствующим микробным капсулам, предотвращающим обмен частицами и снижающим скорость погружения. Концентрации растворенного Mn еще выше при низком уровне кислорода. В целом, концентрации dMn обычно выше в прибрежных регионах и снижаются при перемещении к морю. [69]
Почвы
[ редактировать ]Марганец встречается в почвах в трех степенях окисления: двухвалентный катион Mn. 2+ а также коричневато-черные оксиды и гидроксиды, содержащие Mn (III,IV), такие как MnOOH и MnO 2 . рН почвы и окислительно-восстановительные условия влияют на то, какая из этих трех форм Mn является доминирующей в данной почве. При значениях рН менее 6 или в анаэробных условиях преобладает Mn(II), а в более щелочных и аэробных условиях преобладают оксиды и гидроксиды Mn(III,IV). Это влияние кислотности почвы и состояния аэрации на форму Mn можно модифицировать или контролировать с помощью микробной активности. Микробное дыхание может вызывать как окисление Mn, так и окисление Mn. 2+ к оксидам, и это может привести к восстановлению оксидов до двухвалентного катиона. [70]
Оксиды Mn(III,IV) присутствуют в виде коричневато-черных пятен и мелких узелков на частицах песка, ила и глины. Эти поверхностные покрытия на других частицах почвы имеют большую площадь поверхности и несут отрицательный заряд. Заряженные центры способны адсорбировать и удерживать различные катионы, особенно тяжелые металлы (например, Cr 3+ , С 2+ , Зн 2+ и Pb 2+ ). Кроме того, оксиды способны адсорбировать органические кислоты и другие соединения. Адсорбция металлов и органических соединений может затем привести к их окислению, в то время как оксиды Mn(III,IV) восстанавливаются до Mn. 2+ (например, Кр 3+ до Cr(VI) и от бесцветного гидрохинона полимеров чайного цвета до хиноновых ). [71]
Приложения
[ редактировать ]Сталь
[ редактировать ]
Марганец необходим для производства железа и стали благодаря своим серофиксирующим , раскисляющим и легирующим свойствам. Марганец не имеет удовлетворительной замены в металлургии. [51] Сталелитейное производство , [72] включая компонент производства железа, на него приходится большая часть спроса на марганец, который в настоящее время составляет от 85% до 90% от общего спроса. [59] Марганец является ключевым компонентом недорогой нержавеющей стали . [73] [74] Часто ферромарганец (обычно около 80% марганца) является промежуточным продуктом в современных процессах.
Небольшие количества марганца улучшают обрабатываемость стали при высоких температурах за счет образования тугоплавкого сульфида и предотвращения образования жидкого сульфида железа на границах зерен. Если содержание марганца достигает 4 %, охрупчивание стали становится доминирующим признаком. Охрупчивание уменьшается при более высоких концентрациях марганца и достигает приемлемого уровня при 8%. Сталь, содержащая от 8 до 15% марганца, имеет высокую прочность на разрыв — до 863 МПа. [75] [76] Сталь с 12% марганца была открыта в 1882 году Робертом Хэдфилдом и до сих пор известна как сталь Гадфилда (мангаллой) . Он использовался для стальных шлемов британской армии , а затем и в армии США. [77]
Алюминиевые сплавы
[ редактировать ]Марганец используется при производстве сплавов с алюминием. Алюминий с содержанием марганца примерно 1,5% обладает повышенной устойчивостью к коррозии благодаря зернам, которые поглощают примеси, которые могут привести к гальванической коррозии . [78] коррозионностойкие алюминиевые сплавы используются Для изготовления большинства банок для напитков 3004 и 3104 (содержание марганца от 0,8 до 1,5%) . [79] До 2000 года было использовано более 1,6 миллиона тонн этих сплавов; при 1% марганца на это было потрачено 16 000 тонн марганца. [ не удалось пройти проверку ] [79]
Батареи
[ редактировать ]Оксид марганца (IV) использовался в оригинальном типе сухих батарей в качестве акцептора электронов от цинка и является черноватым материалом в элементах фонарика углеродно-цинкового типа. Диоксид марганца при разрядке восстанавливается до оксида-гидроксида марганца MnO(OH), предотвращая образование водорода на аноде аккумулятора. [80]
- MnO 2 + H 2 O + е − → MnO(OH) + OH −
Тот же материал действует и в новых щелочных батареях (обычно в аккумуляторных элементах), в которых используется та же основная реакция, но другая смесь электролитов. В 2002 году для этой цели было использовано более 230 тысяч тонн диоксида марганца. [50] [80]

Резисторы
[ редактировать ]Медные сплавы марганца, такие как марганин , обычно встречаются в шунтирующих резисторах с металлическими элементами , используемых для измерения относительно больших величин тока. Эти сплавы имеют очень низкий температурный коэффициент сопротивления и устойчивы к сере. Это делает сплавы особенно полезными в суровых автомобильных и промышленных условиях. [81]
Удобрения и кормовые добавки
[ редактировать ]Оксид и сульфат марганца входят в состав удобрений. В 2000 году только в США в удобрениях было использовано около 20 000 тонн этих соединений. Сопоставимое количество соединений Mn также использовалось в кормах для животных. [82]
Ниша
[ редактировать ]Метилциклопентадиенилтрикарбонил марганца является добавкой в некоторые неэтилированные бензины для повышения октанового числа и уменьшения детонации двигателя . [83]
Оксид марганца(IV) (диоксид марганца, MnO 2 ) применяется в качестве реагента в органической химии для окисления бензиловых спиртов (где гидроксильная группа соседствует с ароматическим кольцом ). Диоксид марганца использовался с древности для окисления и нейтрализации зеленоватого оттенка стекла из-за следовых количеств загрязнения железом. [43] MnO 2 также используется при производстве кислорода и хлора и при сушке черных красок. В некоторых препаратах это коричневый пигмент для красок , входящий в состав натуральной умбры . [84]
Четырехвалентный марганец используется в качестве активатора красного свечения в люминофорах . Хотя известно множество соединений, которые проявляют люминесценцию , [85] большинство из них не используются в коммерческом применении из-за низкой эффективности или темно-красного излучения. [86] [87] Однако несколько Mn 4+ Сообщалось, что активированные фториды являются потенциальными люминофорами красного свечения для светодиодов теплого белого цвета. [88] [89] Но по сей день только K 2 SiF 6 :Mn 4+ коммерчески доступен для использования в светодиодах теплого белого цвета . [90]
Металл иногда используется в монетах; до 2000 года единственной монетой США, в которой использовался марганец, был никель «военного времени» с 1942 по 1945 год. [91] Для производства никелевых монет традиционно использовался сплав 75% меди и 25% никеля. Однако из-за нехватки металлического никеля во время войны он был заменен более доступными серебром и марганцем, в результате чего получился сплав, состоящий из 56% меди, 35% серебра и 9% марганца. С 2000 года долларовые монеты , например доллар Сакагавеа и президентские монеты достоинством 1 доллар , изготавливаются из латуни, содержащей 7% марганца, с сердечником из чистой меди. [92] Как в случае с никелем, так и в случае с долларом, использование марганца в монете должно было дублировать электромагнитные свойства предыдущей монеты идентичного размера и стоимости в механизмах торговых автоматов. В случае более поздних долларовых монет США марганцевый сплав должен был дублировать свойства медно-никелевого сплава, использованного в предыдущем долларе Сьюзан Б. Энтони .
Соединения марганца использовались в качестве пигментов и для окраски керамики и стекла. Коричневый цвет керамики иногда является результатом соединений марганца. [93] В стекольной промышленности соединения марганца используются для достижения двух эффектов. Марганец(III) реагирует с железом(II), уменьшая ярко-зеленый цвет стекла, образуя менее окрашенное железо(III) и слегка розовый марганец(II), компенсируя остаточный цвет железа(III). [43] Большие количества марганца используются для производства стекла розового цвета. В 2009 году Мас Субраманиан и его коллеги из Университета штата Орегон обнаружили, что марганец можно объединить с иттрием и индием с образованием интенсивно синего , нетоксичного, инертного, устойчивого к выцветанию пигмента YInMn Blue . [94] первый новый синий пигмент, открытый за 200 лет. [95]
Биохимия
[ редактировать ]
Многие классы ферментов содержат кофакторы марганца, включая оксидоредуктазы , трансферазы , гидролазы , лиазы , изомеразы и лигазы . Другими ферментами, содержащими марганец, являются аргиназа и Mn-содержащая супероксиддисмутаза ( Mn-SOD ). Некоторые обратные транскриптазы многих ретровирусов (но не лентивирусов, таких как ВИЧ ) содержат марганец. Марганецсодержащие полипептиды — это дифтерийный токсин , лектины и интегрины . [96]
Кислородвыделяющий комплекс (ОКЭ), содержащий четыре атома марганца, входит в состав фотосистемы II, содержащейся в тилакоидных мембранах хлоропластов. ОЭК отвечает за терминальное фотоокисление воды во время реакций фотосинтеза световых , т. е. является катализатором выработки О 2 растениями. [97] [98]
Здоровье и питание человека
[ редактировать ]Марганец является важным элементом питания человека и присутствует в качестве кофермента в нескольких биологических процессах, включая метаболизм макронутриентов, формирование костей и системы защиты от свободных радикалов . Марганец является важным компонентом десятков белков и ферментов. [6] В организме человека содержится около 12 мг марганца, преимущественно в костях. Остальная часть мягких тканей сосредоточена в печени и почках. [7] В человеческом мозге марганец связан с металлопротеинами марганца , особенно с глутаминсинтетазой в астроцитах . [99]
| Мужчины | Женщины | ||
|---|---|---|---|
| Возраст | ИИ (мг/день) | Возраст | ИИ (мг/день) |
| 1–3 | 1.2 | 1–3 | 1.2 |
| 4–8 | 1.5 | 4–8 | 1.5 |
| 9–13 | 1.9 | 9–13 | 1.6 |
| 14–18 | 2.2 | 14–18 | 1.6 |
| 19+ | 2.3 | 19+ | 1.8 |
| беременна: 2 | |||
| кормящие: 2,6 | |||
Регулирование
[ редактировать ]Институт медицины США (МОМ) обновил расчетные средние потребности (EAR) и рекомендуемые диетические нормы (RDA) для минералов в 2001 году. По марганцу не было достаточной информации для установления EAR и RDA, поэтому потребности описываются как оценки адекватного потребления ( ИИ). Что касается безопасности, МОМ устанавливает допустимые верхние уровни потребления (UL) для витаминов и минералов, когда есть достаточные доказательства. В случае марганца допустимая норма для взрослых установлена на уровне 11 мг/день. В совокупности EAR, RDA, AI и UL называются эталонными диетическими нормами потребления (DRI). [100] Дефицит марганца встречается редко. [101]
Европейское управление по безопасности пищевых продуктов (EFSA) называет совокупный набор информации эталонными диетическими значениями, с эталонным потреблением для населения (PRI) вместо RDA и средней потребностью вместо EAR. AI и UL определены так же, как и в США. Для людей в возрасте 15 лет и старше ИИ устанавливается на уровне 3,0 мг/день. ИИ при беременности и лактации составляет 3,0 мг/день. Для детей в возрасте 1–14 лет доза ИА увеличивается с возрастом от 0,5 до 2,0 мг/день. ИИ для взрослых выше, чем RDA в США. [102] EFSA рассмотрело тот же вопрос безопасности и решило, что информации недостаточно для установления UL. [103]
Для целей маркировки пищевых продуктов и пищевых добавок в США количество в порции выражается в процентах от дневной нормы (% ДВ). Для целей маркировки марганца 100% дневной нормы составляло 2,0 мг, но по состоянию на 27 мая 2016 года она была пересмотрена до 2,3 мг, чтобы привести ее в соответствие с RDA. [104] [105] Таблица старых и новых дневных норм для взрослых представлена в разделе «Справочная суточная норма» .
Чрезмерное воздействие или потребление может привести к состоянию, известному как марганизм , нейродегенеративному заболеванию, которое вызывает гибель дофаминергических нейронов и симптомы, похожие на болезнь Паркинсона . [7] [106]
Дефицит
[ редактировать ]Дефицит марганца у человека, который встречается редко, приводит к ряду медицинских проблем. Дефицит марганца вызывает деформацию скелета у животных и подавляет выработку коллагена при заживлении ран. [107]
Контакт
[ редактировать ]В воде
[ редактировать ]Переносимый водой марганец имеет большую биодоступность , чем пищевой марганец. По результатам исследования 2010 года, [108] более высокие уровни воздействия марганца в питьевой воде связаны с увеличением умственных нарушений и снижением коэффициентов интеллекта у детей школьного возраста. Предполагается, что долгосрочное воздействие из-за вдыхания марганца, встречающегося в природе в воде для душа, подвергает риску до 8,7 миллионов американцев. [109] Однако данные показывают, что организм человека может оправиться от некоторых неблагоприятных последствий чрезмерного воздействия марганца, если прекратить воздействие и очистить организм от излишков. [110]
Уровни Mn могут повышаться в морской воде при возникновении периодов гипоксии. [111] С 1990 года поступали сообщения о накоплении Mn в морских организмах, включая рыб, ракообразных, моллюсков и иглокожих. У разных видов мишенью являются определенные ткани, включая жабры, мозг, кровь, почки и печень/ гепатопанкреас . Сообщалось о физиологических эффектах у этих видов. Марганец может влиять на обновление иммуноцитов и их функциональность, например, на фагоцитоз и активацию профенолоксидазы , подавляя иммунную систему организма. Это делает микроорганизмы более восприимчивыми к инфекциям. По мере изменения климата распространение патогенов увеличивается, и для того, чтобы организмы могли выжить и защитить себя от этих патогенов, им необходима здоровая и сильная иммунная система. Если их системы будут нарушены из-за высокого уровня Mn, они не смогут бороться с этими патогенами и умрут. [67]
Бензин
[ редактировать ]
Метилциклопентадиенилтрикарбонил марганца (ММТ) — присадка, разработанная для замены соединений свинца в бензинах с целью повышения октанового числа . ММТ используется лишь в нескольких странах. Топливо, содержащее марганец, имеет тенденцию образовывать карбиды марганца, которые повреждают выпускные клапаны .
Воздух
[ редактировать ]По сравнению с 1953 годом уровень марганца в воздухе снизился. [112] Как правило, воздействие концентраций окружающего воздуха Mn, превышающих 5 мкг Mn/м 3 может привести к симптомам, вызванным Mn. Повышенная экспрессия белка ферропортина в клетках эмбриональной почки человека (HEK293) связана со снижением внутриклеточной концентрации Mn и ослаблением цитотоксичности , характеризующейся обратным снижением поглощения глутамата с помощью Mn и уменьшением утечки лактатдегидрогеназы . [113]
Регулирование
[ редактировать ]Воздействие марганца в США регулируется Управлением по охране труда (OSHA). [114] Люди могут подвергнуться воздействию марганца на рабочем месте, вдыхая его или проглатывая. OSHA установило законный предел ( допустимый предел воздействия ) для воздействия марганца на рабочем месте на уровне 5 мг/м. 3 более 8-часового рабочего дня. Национальный институт охраны труда (NIOSH) установил рекомендуемый предел воздействия (REL) 1 мг/м. 3 в течение 8-часового рабочего дня и краткосрочного ограничения 3 мг/м 3 . На уровне 500 мг/м 3 , марганец сразу опасен для жизни и здоровья . [115]
Здоровье и безопасность
[ редактировать ]Марганец необходим для здоровья человека, хотя и в миллиграммовых количествах.
Текущая максимальная безопасная концентрация согласно правилам Агентства по охране окружающей среды США составляет 50 мкг Mn/л. [116]
Марганец
[ редактировать ]Чрезмерное воздействие марганца чаще всего связано с марганцем — редким неврологическим расстройством, связанным с чрезмерным употреблением или вдыханием марганца. Исторически сложилось так, что лица, занятые в производстве или переработке марганцевых сплавов [117] [118] подвергались риску развития манганизма; однако правила охраны труда и техники безопасности защищают работников в развитых странах. [114] Заболевание было впервые описано в 1837 году британским академиком Джоном Купером, который изучал двух пациентов, которые измельчали марганец. [48]
Манганизм – это двухфазное заболевание. На ранних стадиях опьяненный человек может испытывать депрессию, перепады настроения, компульсивное поведение и психоз. Ранние неврологические симптомы сменяются поздней стадией манганизма, напоминающей болезнь Паркинсона . Симптомы включают слабость, монотонность и замедленность речи, невыразительное лицо, тремор, походку с наклоном вперед, неспособность идти назад, не падая, ригидность и общие проблемы с ловкостью, походкой и равновесием. [48] [119] В отличие от болезни Паркинсона , манганизм не связан с потерей обоняния, и пациенты обычно не реагируют на лечение L-ДОФА . [120] Симптомы поздней стадии марганца со временем становятся более серьезными, даже если источник воздействия удален и уровень марганца в мозге возвращается к норме. [119]
Было показано, что хроническое воздействие марганца приводит к заболеванию, подобному паркинсонизму, характеризующемуся нарушениями движений. [121] Это состояние не реагирует на типичные методы лечения, используемые при лечении БП , что указывает на альтернативный путь, отличный от типичной потери дофаминергических веществ в черной субстанции . [121] Марганец может накапливаться в базальных ганглиях , что приводит к аномальным движениям. [122] Мутация гена SLC30A10, переносчика оттока марганца, необходимого для снижения внутриклеточного Mn, была связана с развитием этого заболевания, подобного паркинсонизму. [123] Тельца Леви, типичные для БП, не наблюдаются при Mn-индуцированном паркинсонизме. [122]
Эксперименты на животных дали возможность изучить последствия чрезмерного воздействия марганца в контролируемых условиях. У (неагрессивных) крыс марганец вызывает поведение, убивающее мышей. [124]
Токсичность
[ редактировать ]| Опасности | |
|---|---|
| СГС Маркировка : | |
| H401 | |
| П273 , П501 [125] | |
| NFPA 704 (огненный алмаз) | |
Соединения марганца менее токсичны, чем соединения других распространенных металлов, таких как никель и медь . [126] Однако воздействие марганцевой пыли и паров не должно превышать предельное значение в 5 мг/м. 3 даже на короткие периоды времени из-за уровня его токсичности. [127] Отравление марганцем связано с нарушением двигательных навыков и когнитивными расстройствами . [128]
Нейродегенеративные заболевания
[ редактировать ]Белок под названием DMT1 является основным транспортером при всасывании марганца из кишечника и может быть основным переносчиком марганца через гематоэнцефалический барьер . DMT1 также переносит вдыхаемый марганец через носовой эпителий . Предполагаемый механизм токсичности марганца заключается в том, что нарушение регуляции приводит к окислительному стрессу , митохондриальной дисфункции , глутамат-опосредованной эксайтотоксичности и агрегации белков. [129]
См. также
[ редактировать ]- Экспортер марганца , мембранный транспортный белок
- Список стран по производству марганца
- Парковка
Ссылки
[ редактировать ]- ^ «Стандартные атомные массы: марганец» . ЦИАВ . 2017.
- ^ Прохаска, Томас; Ирргехер, Йоханна; Бенефилд, Жаклин; Бёлке, Джон К.; Чессон, Лесли А.; Коплен, Тайлер Б.; Дин, Типинг; Данн, Филип Дж. Х.; Грёнинг, Манфред; Холден, Норман Э.; Мейер, Харро Эй Джей (4 мая 2022 г.). «Стандартные атомные веса элементов 2021 (Технический отчет ИЮПАК)» . Чистая и прикладная химия . дои : 10.1515/pac-2019-0603 . ISSN 1365-3075 .
- ^ Перейти обратно: а б с Арбластер, Джон В. (2018). Некоторые значения кристаллографических свойств элементов . Парк материалов, Огайо: ASM International. ISBN 978-1-62708-155-9 .
- ^ Уэст, Роберт (1984). CRC, Справочник по химии и физике . Бока-Ратон, Флорида: Издательство компании Chemical Rubber Company. стр. E110. ISBN 0-8493-0464-4 .
- ^ Кондев, ФГ; Ван, М.; Хуанг, WJ; Наими, С.; Ауди, Г. (2021). «Оценка ядерных свойств NUBASE2020» (PDF) . Китайская физика C . 45 (3): 030001. doi : 10.1088/1674-1137/abddae .
- ^ Перейти обратно: а б Эриксон, Кейт М.; Ашер, Майкл (2019). «Глава 10. Марганец: его роль в заболеваниях и здоровье». В Сигеле, Астрид; Фрейзингер, Ева; Сигел, Роланд, нокаут; Карвер, Пегги Л. (ред.). Незаменимые металлы в медицине: терапевтическое использование и токсичность ионов металлов в клинике . Том. 19. Берлин: де Грюйтер ГмбХ. стр. 253–266. дои : 10.1515/9783110527872-016 . ISBN 978-3-11-052691-2 . ПМИД 30855111 . S2CID 73725546 .
{{cite book}}:|journal=игнорируется ( помогите ) - ^ Перейти обратно: а б с д и ж Эмсли, Джон (2001). «Марганец» . Строительные блоки природы: Путеводитель по элементам от Аризоны . Оксфорд, Великобритания: Издательство Оксфордского университета. стр. 249–253 . ISBN 978-0-19-850340-8 .
- ^ Рот, Джером; Понцони, Сильвия; Ашнер, Майкл (2013). «Гомеостаз и транспорт марганца». В Банки, Люсия (ред.). Металломика и клетка . Ионы металлов в науках о жизни. Том. 12. Спрингер. стр. 169–201. дои : 10.1007/978-94-007-5561-1_6 . ISBN 978-94-007-5560-4 . ПМК 6542352 . ПМИД 23595673 . Электронная книга ISBN 978-94-007-5561-1 .
- ^ Перейти обратно: а б с д Холлеман, Арнольд Ф.; Виберг, Эгон; Виберг, Нильс (1985). «Марганец». Учебник неорганической химии (на немецком языке) (91–100 изд.). Вальтер де Грютер. стр. 1110–1117. ISBN 978-3-11-007511-3 .
- ^ Лиде, Дэвид Р. (2004). Магнитная восприимчивость элементов и неорганических соединений, в Справочнике по химии и физике . ЦРК Пресс. ISBN 978-0-8493-0485-9 . Архивировано из оригинала 17 декабря 2019 года . Проверено 7 сентября 2019 г.
- ^ Марганец в Британской энциклопедии
- ^ Перейти обратно: а б Ауди, Г.; Кондев, ФГ; Ван, М.; Хуанг, WJ; Наими, С. (2017). «Оценка ядерных свойств NUBASE2016» (PDF) . Китайская физика C . 41 (3): 030001. Бибкод : 2017ChPhC..41c0001A . дои : 10.1088/1674-1137/41/3/030001 .
- ^ Клери, Дэниел (4 июня 2020 г.). «Самые яркие взрывы в галактике становятся ядерными с неожиданным поводом: парами мертвых звезд» . Наука . Проверено 26 июля 2021 г.
- ^ Шефер, Йорг; Фастерманн, Томас; Херцог, Грегори Ф.; Кни, Клаус; Коршинек, Гюнтер; Масарик, Йозеф; Мейер, Астрид; Путивцев Михаил; Ругель, Георг; Шлюхтер, Кристиан; Серифиддин, Фериде; Винклер, Гизела (2006). «Земной марганец-53 – новый монитор процессов на поверхности Земли». Письма о Земле и планетологии . 251 (3–4): 334–345. Бибкод : 2006E&PSL.251..334S . дои : 10.1016/j.epsl.2006.09.016 .
- ^ Бирк, Дж.; Ротару, М.; Аллегре, К. (1999). «Эволюция 53Mn-53Cr ранней Солнечной системы». Geochimica et Cosmochimica Acta . 63 (23–24): 4111–4117. Бибкод : 1999GeCoA..63.4111B . дои : 10.1016/S0016-7037(99)00312-9 .
- ^ Лугмайр, Г.; Шуколюков, А. (1998). «Временные шкалы ранней Солнечной системы согласно систематике 53Mn-53Cr». Geochimica et Cosmochimica Acta . 62 (16): 2863–2886. Бибкод : 1998GeCoA..62.2863L . дои : 10.1016/S0016-7037(98)00189-6 .
- ^ Шуколюков Александр; Лугмайр, Гюнтер В. (2000). «О неоднородности 53Mn в ранней Солнечной системе». Обзоры космической науки . 92 : 225–236. Бибкод : 2000ССРв...92..225С . дои : 10.1023/А:1005243228503 .
- ^ Тринкье, А.; Бирк, Дж.; Аллегре, К.; Гепель, К.; Ульфбек, Д. (2008). «Возвращение к систематике 53Mn – 53Cr ранней Солнечной системы». Geochimica et Cosmochimica Acta . 72 (20): 5146–5163. Бибкод : 2008GeCoA..72.5146T . дои : 10.1016/j.gca.2008.03.023 .
- ^ Перейти обратно: а б с Янг, Д.А. (1975). «Фазовые диаграммы элементов» . Международная система ядерной информации . ЛНЛ: 15 . Проверено 30 января 2023 г.
- ^ Перейти обратно: а б Дхананджаян, Н.; Банерджи, Т. (1969). Кристаллографические модификации марганца и особенности их превращения. Глава 1: Структура электроосажденного марганца . ЦСИР-НМЛ. стр. 3–28.
- ^ Кеммитт, RDW; Пикок, РД (1973). Химия марганца, технеция и рения. Пергамские тексты в неорганической химии . Сент-Луис: Elsevier Science. п. 778. ИСБН 978-1-4831-3806-0 . OCLC 961064866 .
- ^ Брэдли, Эй Джей; Тьюлис, Дж. (1927). «Кристаллическая структура α-марганца» . Труды Лондонского королевского общества, серия A. 115 (771): 456–471. Бибкод : 1927RSPSA.115..456B . дои : 10.1098/rspa.1927.0103 . ISSN 0950-1207 .
- ^ Лоусон, AC; Ларсон, Аллен С.; Аронсон, MC; и др. (1994). «Магнитный и кристаллографический порядок в α-марганце». Дж. Прил. Физ . 76 (10): 7049–7051. Бибкод : 1994JAP....76.7049L . дои : 10.1063/1.358024 . ISSN 0021-8979 .
- ^ Перейти обратно: а б Прайор, Тимоти Дж; Нгуен-Ман, Дык; Купер, Виктория Дж; Битва, Питер Д. (2004). «Ферромагнетизм в структуре бета-марганца: Fe 1,5 Pd 0,5 Mo 3 N». Физический журнал: конденсированное вещество . 16 (13): 2273–2281. Бибкод : 2004JPCM...16.2273P . дои : 10.1088/0953-8984/16/13/008 . ISSN 0953-8984 . S2CID 250784683 .
- ^ Фунахаси, С.; Кохара, Т. (1984). «Диффузионное рассеяние нейтронов в β-марганце». Дж. Прил. Физ . 55 (6): 2048–2050. Бибкод : 1984JAP....55.2048F . дои : 10.1063/1.333561 . ISSN 0021-8979 .
- ^ Перейти обратно: а б с Душанек, Х.; Мон, П.; Шварц, К. (1989). «Антиферромагнитное и ферромагнитное гамма-марганцевое обобщение метода фиксированного спинового момента». Физика Б: Конденсированное вещество . 161 (1–3): 139–142. дои : 10.1016/0921-4526(89)90120-8 . ISSN 0921-4526 .
- ^ Бэкон, GE; Коулэм, Н. (1970). «Исследование некоторых сплавов гамма-марганца методом нейтронографии». Журнал физики C: Физика твердого тела . 3 (3): 675–686. Бибкод : 1970JPhC....3..675B . дои : 10.1088/0022-3719/3/3/023 . ISSN 0022-3719 .
- ^ «Гл. 20». Неорганическая химия Шрайвера и Аткинса . Издательство Оксфордского университета. 2010. ISBN 978-0-19-923617-6 .
- ^ Люфт, Дж. Х. (1956). «Перманганат – новый фиксатор для электронной микроскопии» . Журнал биофизической и биохимической цитологии . 2 (6): 799–802. дои : 10.1083/jcb.2.6.799 . ПМК 2224005 . ПМИД 13398447 .
- ^ Ман, Вай-Лунь; Лам, Уильям, Вайоминг; Лау, Тай-Чу (2014). «Реакционная способность нитридных комплексов рутения (VI), осмия (VI) и марганца (V), несущих основание Шиффа и простые анионные лиганды». Отчеты о химических исследованиях . 47 (2): 427–439. дои : 10.1021/ar400147y . ПМИД 24047467 .
- ^ Голдберг, Дэвид П. (2007). «Корролазины: новые рубежи стабильности и реакционной способности высоковалентных металлопорфириноидов». Отчеты о химических исследованиях . 40 (7): 626–634. дои : 10.1021/ar700039y . ПМИД 17580977 .
- ^ Яно, Джунко; Ячандра, Виттал (2014). «Кластер Mn4Ca в фотосинтезе: где и как вода окисляется до дикислорода» . Химические обзоры . 114 (8): 4175–4205. дои : 10.1021/cr4004874 . ПМК 4002066 . ПМИД 24684576 .
- ^ Рейнер-Кэнэм, Джеффри и Овертон, Тина (2003) Описательная неорганическая химия , Macmillan, стр. 491, ISBN 0-7167-4620-4 .
- ^ Шмидт, Макс (1968). «VII. Подгруппа». Неорганическая химия II (на немецком языке). Научное издательство. стр. 100–109.
- ^ Кадассери, Картика Дж.; Макмиллан, Саманта Н.; Лейси, Дэвид С. (2019). «Возрождение химии марганца (I). Бидентатные фосфин-фенол (ат) комплексы марганца (I)». Неорганическая химия . 58 (16): 10527–10535. doi : 10.1021/acs.inorgchem.9b00941 . ПМИД 31247867 .
- ^ Джиролами, Грегори С.; Уилкинсон, Джеффри; Торнтон-Петт, Марк; Херстхаус, Майкл Б. (1983). «Гидридо-, алкил- и этилен-1,2-бис(диметилфосфино)этановые комплексы марганца и кристаллические структуры MnBr2(dmpe)2, [Mn(AlH4)(dmpe)2]2 и MnMe2(dmpe)2». Журнал Американского химического общества . 105 (22): 6752–6753. дои : 10.1021/ja00360a054 .
- ^ LanguageHat (28 мая 2005 г.). «МАГНИТ» . LanguageHat.com . Проверено 18 июня 2020 г.
- ^ Плиний Старший . «Глава 25 — МАГНИТ: ТРИ СРЕДСТВА». Естественная история Плиния. КНИГА XXXVI. ЕСТЕСТВЕННАЯ ИСТОРИЯ КАМНЕЙ .
- ^ Калверт, Дж. Б. (24 января 2003 г.). «Хром и марганец» . Архивировано из оригинала 31 декабря 2016 года . Проверено 10 декабря 2022 г.
- ^ Чалмин, Эмили; Меню, Мишель; Виньо, Колетт (2003). «Анализ наскальной живописи и техники палеолитических художников». Измерительная наука и технология . 14 (9): 1590–1597. дои : 10.1088/0957-0233/14/9/310 . S2CID 250842390 .
- ^ Чалмин, Э.; Виньо, К.; Саломон, Х.; Фарж, Ф.; Сузини, Дж.; Меню, М. (2006). «Минералы, обнаруженные в палеолитических черных пигментах с помощью просвечивающей электронной микроскопии и микрорентгеновской абсорбционной прикраевой структуры» (PDF) . Прикладная физика А. 83 (12): 213–218. Бибкод : 2006ApPhA..83..213C . дои : 10.1007/s00339-006-3510-7 . hdl : 2268/67458 . S2CID 9221234 .
- ^ Сейр, EV; Смит, RW (1961). «Композиционные категории древнего стекла». Наука . 133 (3467): 1824–1826. Бибкод : 1961Sci...133.1824S . дои : 10.1126/science.133.3467.1824 . ПМИД 17818999 . S2CID 25198686 .
- ^ Перейти обратно: а б с Маккрей, В. Патрик (1998). «Стеклопроизводство в Италии эпохи Возрождения: инновация венецианского кристалло». ДЖОМ . 50 (5): 14–19. Бибкод : 1998JOM....50e..14M . дои : 10.1007/s11837-998-0024-0 . S2CID 111314824 .
- ^ Ранке-Мадсен, Э. (1975). «Открытие элемента». Центавр . 19 (4): 299–313. Бибкод : 1975Cent...19..299R . дои : 10.1111/j.1600-0498.1975.tb00329.x .
- ^ Мишковец, Павел (2022). «Игра в имена: история наименования химических элементов — часть 1 — от древности до конца XVIII века» . Основы химии . 25 : 29–51. дои : 10.1007/s10698-022-09448-5 .
- ^ Хэдфилд, Роберт (1927). «Металлический марганец и его свойства: также руды, производство ферромарганца и его история» . Журнал Института железа и стали . 115 (1): 251–252.
- ^ Алессио, Л.; Кампанья, М.; Луккини, Р. (2007). «От свинца к марганцу через ртуть: мифология, наука и уроки профилактики». Американский журнал промышленной медицины . 50 (11): 779–787. дои : 10.1002/ajim.20524 . ПМИД 17918211 .
- ^ Перейти обратно: а б с Купер, Джон (1837). «О влиянии черной оксида марганца при вдыхании на легкие». Бр. Энн. Мед. Фарм. Жизненно важный. Стат. Общие науки . 1 : 41–42.
- ^ Олсен, Сверре Э.; Тангстад, Мерете; Линдстад, Тор (2007). «История омарганца». Производство марганцевых ферросплавов . Тапир Академик Пресс. стр. 11–12. ISBN 978-82-519-2191-6 .
- ^ Перейти обратно: а б Прейслер, Эберхард (1980). «Современные процессы в большой химии: Браунштейн». Химия в наше время (на немецком языке). 14 (5): 137–148. дои : 10.1002/ciuz.19800140502 .
- ^ Перейти обратно: а б с д Обзор минеральных ресурсов Геологической службы США за 2009 г.
- ^ Бхаттачарья, ПК; Дасгупта, Сомнатх; Фукуока, М.; Рой Суприя (1984). «Геохимия браунита и связанных с ним фаз в метаморфизованных неизвестковых марганцевых рудах Индии». Вклад в минералогию и петрологию . 87 (1): 65–71. Бибкод : 1984CoMP...87...65B . дои : 10.1007/BF00371403 . S2CID 129495326 .
- ^ Кук, Найджел Дж.; Чобану, Кристиана Л.; Принг, Аллан; Скиннер, Уильям; Симидзу, Масааки; Данюшевский Леонид; Сайни-Эйдукат, Бернхардт; Мельчер, Фрэнк (2009). «Следы и второстепенные элементы в сфалерите: исследование LA-ICPMS» . Geochimica et Cosmochimica Acta . 73 (16): 4761–4791. Бибкод : 2009GeCoA..73.4761C . дои : 10.1016/j.gca.2009.05.045 .
- ^ Ван, X; Шредер, ХК; Винс, М; Шлоссмахер, У; Мюллер, WEG (2009). «Марганцевые/полиметаллические конкреции: микроструктурная характеристика экзолитобионтических и эндолитобионтических микробных биопленок с помощью сканирующей электронной микроскопии». Микрон . 40 (3): 350–358. дои : 10.1016/j.micron.2008.10.005 . ПМИД 19027306 .
- ^ Организация Объединенных Наций (1978). Марганцевые конкреции: размеры и перспективы . Библиотека Форума природных ресурсов. Том. 41. Спрингер. п. 343. Бибкод : 1981МГеол..41..343С . дои : 10.1016/0025-3227(81)90092-X . ISBN 978-90-277-0500-6 . ОСЛК 4515098 .
{{cite book}}:|journal=игнорируется ( помогите ) - ^ «Добыча марганца в Южной Африке – обзор» . Информационные службы МБенди. Архивировано из оригинала 5 февраля 2016 года . Проверено 10 декабря 2022 г.
- ^ Эллиотт, Р.; Коли, К; Мостагель, С; Барати, М (2018). «Обзор обработки марганца для производства сталей TRIP/TWIP, Часть 1: Текущая практика и основы обработки». ДЖОМ . 70 (5): 680–690. Бибкод : 2018JOM....70e.680E . дои : 10.1007/s11837-018-2769-4 . S2CID 139950857 .
- ^ Коратерс, Луизиана; Мачамер, Дж. Ф. (2006). «Марганец» . Промышленные минералы и горные породы: товары, рынки и использование (7-е изд.). МСП. стр. 631–636. ISBN 978-0-87335-233-8 .
- ^ Перейти обратно: а б Чжан, Вэньшэн; Ченг, Чу Юн (2007). «Обзор металлургии марганца. Часть I: Выщелачивание руд/вторичных материалов и извлечение электролитического/химического диоксида марганца». Гидрометаллургия . 89 (3–4): 137–159. Бибкод : 2007HydMe..89..137Z . doi : 10.1016/j.гидромет.2007.08.010 .
- ^ Чоу, Норман; Наку, Анка; Варкентин, Дуг; Аксенов, Игорь и Тех, Мотыга (2010). «Извлечение марганца из низкосортных ресурсов: завершена программа стендовых металлургических испытаний» (PDF) . Kemetco Research Inc. Архивировано из оригинала (PDF) 2 февраля 2012 года.
- ^ «Тайна ЦРУ на дне океана» . Новости Би-би-си . 19 февраля 2018 года . Проверено 3 мая 2018 г.
- ^ «Проект Азориан: рассекреченная ЦРУ история Glomar Explorer» . Архив национальной безопасности Университета Джорджа Вашингтона. 12 февраля 2010 г. Проверено 18 сентября 2013 г.
- ^ Хейн, Джеймс Р. (январь 2016 г.). Энциклопедия морских геолого-геофизических наук — Марганцевые конкреции . Спрингер. стр. 408–412 . Проверено 2 февраля 2021 г.
- ^ Международный орган по морскому дну. «Полиметаллические конкреции» (PDF) . isa.org . Международный орган по морскому дну. Архивировано из оригинала (PDF) 23 октября 2021 года . Проверено 2 февраля 2021 г.
- ^ Обиус, Хорст У; Беккер, Герман Дж; Ролински, Сюзанна; Янковский, Яцек А. (январь 2001 г.). «Параметризация и оценка воздействия на морскую окружающую среду глубоководной добычи марганцевых конкреций» . Глубоководные исследования, часть II: Актуальные исследования в океанографии . 48 (17–18): 3453–3467. Бибкод : 2001DSRII..48.3453O . дои : 10.1016/s0967-0645(01)00052-2 . ISSN 0967-0645 .
- ^ Томпсон, Кирстен Ф.; Миллер, Кэтрин А.; Карри, Дункан; Джонстон, Пол; Сантильо, Дэвид (2018). «Добыча полезных ископаемых на морском дне и подходы к управлению глубоководными участками морского дна» . Границы морской науки . 5 . дои : 10.3389/fmars.2018.00480 . hdl : 10871/130176 . S2CID 54465407 .
- ^ Перейти обратно: а б Хернрот, Бодил; Тассидис, Хелена; Баден, Сюзанна П. (март 2020 г.). «Иммуносупрессия водных организмов, подвергшихся воздействию повышенного уровня марганца: от глобальной к молекулярной перспективе» . Развивающая и сравнительная иммунология . 104 : 103536. doi : 10.1016/j.dci.2019.103536 . ISSN 0145-305X . ПМИД 31705914 . S2CID 207935992 .
- ^ Рэй, Дурбар; Бабу, ЕВССК; Сурья Пракаш, Л. (1 января 2017 г.). «Природа взвешенных частиц в гидротермальном шлейфе на 3 ° 40' с.ш. Карлсбергского хребта: сравнение с глубоководной океанической взвесью» . Современная наука . 112 (1): 139. doi : 10.18520/cs/v112/i01/139-146 . ISSN 0011-3891 .
- ^ Перейти обратно: а б Сим, Нари; Орианс, Кристин Дж. (октябрь 2019 г.). «Годовая изменчивость растворенного марганца в северо-восточной части Тихого океана вдоль линии P: 2010–2013 гг.» . Морская химия . 216 : 103702. Бибкод : 2019MarCh.21603702S . дои : 10.1016/j.marchem.2019.103702 . ISSN 0304-4203 . S2CID 203151735 .
- ^ Бартлетт, Ричмонд; Росс, Дональд (2005). «Химия окислительно-восстановительных процессов в почвах». В Табатабае, Массачусетс; Спаркс, Д.Л. (ред.). Химические процессы в почвах . Книжная серия SSSA, вып. 8. Мэдисон, Висконсин: Американское общество почвоведения. стр. 461–487. LCCN 2005924447 .
- ^ Диксон, Джо Б.; Уайт, Дж. Норман (2002). «Оксиды марганца». В Диксоне, Дж. Б.; Шульце, Д.Г. (ред.). Минералогия почвы с экологическими приложениями . Серия книг SSSA №. 7. Мэдисон, Висконсин: Американское общество почвоведения. стр. 367–386. LCCN 2002100258 .
- ^ Верховен, Джон Д. (2007). Металлургия стали для неметаллурга . Парк материалов, Огайо: ASM International. стр. 56–57. ISBN 978-0-87170-858-8 .
- ^ Марганец Геологической службы США, 2006 г.
- ^ Дастур, Ю.Н.; Лесли, WC (1981). «Механизм наклепа марганцевой стали Гадфилда». Металлургические операции А . 12 (5): 749–759. Бибкод : 1981MTA....12..749D . дои : 10.1007/BF02648339 . S2CID 136550117 .
- ^ Стэнсби, Джон Генри (2007). Железо и сталь . Читайте книги. стр. 351–352. ISBN 978-1-4086-2616-0 .
- ^ Брэди, Джордж С.; Клаузер, Генри Р.; Ваккари. Джон А. (2002). Справочник материалов: энциклопедия для менеджеров, технических специалистов, менеджеров по закупкам и производству, техников и руководителей . Нью-Йорк, штат Нью-Йорк: МакГроу-Хилл. стр. 585–587. ISBN 978-0-07-136076-0 .
- ^ Твидейл, Джеффри (1985). «Сэр Роберт Эбботт Хэдфилд FRS (1858–1940) и открытие марганцевой стали Джеффри Твидейлом». Заметки и отчеты Лондонского королевского общества . 40 (1): 63–74. дои : 10.1098/rsnr.1985.0004 . JSTOR 531536 . S2CID 73176861 .
- ^ «Химические свойства алюминия 2024 позволяют» . Поставщики металлов онлайн, ООО . Проверено 30 апреля 2009 г.
- ^ Перейти обратно: а б Кауфман, Джон Гилберт (2000). «Применение алюминиевых сплавов и закалок» . Знакомство с алюминиевыми сплавами и состояниями . АСМ Интернешнл. стр. 93–94. ISBN 978-0-87170-689-8 .
- ^ Перейти обратно: а б Делл, РМ (2000). «Батареи пятьдесят лет развития материалов». Ионика твердого тела . 134 (1–2): 139–158. дои : 10.1016/S0167-2738(00)00722-0 .
- ^ «WSK1216» (PDF) . вишай . Вишай Интертехнология . Проверено 30 апреля 2022 г.
- ^ Рейдис, Арно Х. (2000). «Соединения марганца». Энциклопедия промышленной химии Ульмана . дои : 10.1002/14356007.a16_123 . ISBN 9783527303854 .
- ^ «Комментарии Агентства по охране окружающей среды по поводу присадки к бензину ММТ» . epa.gov . Агентство по охране окружающей среды. 5 октября 2015 года . Проверено 25 июня 2023 г.
- ^ Краткий Оксфордский словарь английского языка (5-е изд.). Издательство Оксфордского университета. 2002. ISBN 978-0-19-860457-0 .
Красно-коричневая земля, содержащая оксиды железа и марганца, более темная, чем охра и сиена, используемая для изготовления различных пигментов.
- ^ Чен, Дакин; Чжун, Цзясун (2016); 4+ Активаторы в твердых веществах для светодиодов теплого белого цвета». RSC Advances . 6 (89): 86285–86296. Bibcode : 2016RSCAd...686285C . doi : 10.1039/C6RA19584A .
- ^ Баур, Флориан; Юстель, Томас (2016). «Зависимость оптических свойств Mn 4+ активированный A 2 Ge 4 O 9 (A=K,Rb) от температуры и химического окружения». Журнал Люминесценции . 177 : 354–360. Bibcode : 2016JLum..177..354B . doi : 10.1016/j.jlumin.2016.04 .046 .
- ^ Янсен, Т.; Горобез Ж.; Кирм, М.; Брик, М.Г.; Вильхауэр, С.; Оджа, М.; Хайдуков, Н.М.; Махов В.Н.; Юстель, Т. (1 января 2018 г.). «Узкополосная темно-красная фотолюминесценция Y 2 Mg 3 Ge 3 O 12 :Mn». 4+ , Что + Инверсный гранат для светодиодов с преобразованием люминофора высокой мощности» . ECS Journal of Solid State Science and Technology . 7 (1): R3086–R3092. doi : 10.1149/2.0121801jss . S2CID 103724310 .
- ^ Янсен, Томас; Баур, Флориан; Юстель, Томас (2017). «Красное излучение K 2 NbF 7 :Mn 4+ и K 2 TaF 7 :Mn 4+ для светодиодов теплого белого цвета». Journal of Luminescent . 192 : 644–652. Bibcode : 2017JLum..192..644J . doi : 10.1016/j.jlumin.2017.07.061 .
- ^ Чжоу, Чжи; Чжоу, Нань; Ся, Мао; Ёкояма, Мейсо; Хинтцен, Х.Т. (Берт) (6 октября 2016 г.). «Ход исследования и перспективы применения переходного металла Mn 4+ -активированные люминесцентные материалы». Journal of Materials Chemistry C. 4 ( 39): 9143–9161. doi : 10.1039/c6tc02496c .
- ^ «Светодиодная люминофорная система TriGain с использованием красного Mn 4+ -легированные сложные фториды» (PDF) . GE Global Research . Получено 10 декабря 2022 г. .
- ^ Кувахара, Раймонд Т.; Скиннер III, Роберт Б.; Скиннер-младший, Роберт Б. (2001). «Никелевая чеканка в США» . Западный медицинский журнал . 175 (2): 112–114. дои : 10.1136/ewjm.175.2.112 . ПМК 1071501 . ПМИД 11483555 .
- ^ «Дизайн доллара Сакагавеа» . Монетный двор США. Архивировано из оригинала 22 апреля 2021 года . Проверено 4 мая 2009 г.
- ^ Шепард, Анна Ослер (1956). «Марганцевые и железо-марганцевые краски». Керамика для археолога . Институт Карнеги в Вашингтоне. стр. 40–42. ISBN 978-0-87279-620-1 .
- ^ Ли, Цзюнь; Лоргер, Саймон; Сталик, Джудит К.; Слейт, Артур В.; Субраманиан, Массачусетс (3 октября 2016 г.). «От интуиции к рациональному дизайну: настройка синего тригонально-бипирамидального хромофора Mn 3+ на фиолетовый и фиолетовый посредством применения химического давления» . Неорганическая химия . 55 (19): 9798–9804. doi : 10.1021/acs.inorgchem.6b01639 . ISSN 0020-1669 . ПМИД 27622607 .
- ^ Сильверман, Элиан (28 июня 2018 г.). «Как же вам удалось обнаружить совершенно новый синий пигмент? Случайно» . Идеи ТЭД . Проверено 26 июня 2024 г.
- ^ Райс, Дерек Б.; Мэсси, Аллисса А.; Джексон, Тимоти А. (2017). «Марганец-кислородные интермедиаты в активации связи O – O и реакциях переноса атома водорода». Отчеты о химических исследованиях . 50 (11): 2706–2717. doi : 10.1021/acs.accounts.7b00343 . ПМИД 29064667 .
- ^ Умена, Ясуфуми; Каваками, Кейсуке; Шен, Цзянь-Рен; Камия, Нобуо (май 2011 г.). «Кристаллическая структура фотосистемы II, выделяющей кислород, с разрешением 1,9 Å» (PDF) . Природа . 473 (7345): 55–60. Бибкод : 2011Природа.473...55У . дои : 10.1038/nature09913 . ПМИД 21499260 . S2CID 205224374 .
- ^ Дисмукс, Г. Чарльз; Виллиген, Рогир Т. ван (2006). «Марганец: комплекс и модели, выделяющие кислород». Марганец: комплекс и модели, выделяющие кислород, частично основан на статье Марганец: комплекс и модели, выделяющие кислород, написанной Ларсом-Эриком Андреассоном и Торе Ваннгордом, которая появилась в Энциклопедии неорганической химии, первое издание, первое издание . Энциклопедия неорганической химии . дои : 10.1002/0470862106.ia128 . ISBN 978-0470860786 .
- ^ Такеда, А. (2003). «Действие марганца на функцию мозга». Обзоры исследований мозга . 41 (1): 79–87. дои : 10.1016/S0165-0173(02)00234-5 . ПМИД 12505649 . S2CID 1922613 .
- ^ Перейти обратно: а б Группа экспертов Института медицины (США) по микроэлементам (2001 г.). «Марганец» . Рекомендуемая диетическая норма потребления витамина А, витамина К, мышьяка, бора, хрома, хрома, йода, железа, марганца, молибдена, никеля, кремния, ванадия и хрома . Национальная Академия Пресс. стр. 394–419. ISBN 978-0-309-07279-3 . ПМИД 25057538 .
- ^ См. «Марганец» . Информационный центр микроэлементов . при Университете штата Орегон Институт Лайнуса Полинга . 23 апреля 2014 г.
- ^ «Обзор диетических эталонных значений для населения ЕС, составленный Группой EFSA по диетическим продуктам, питанию и аллергиям» (PDF) . 2017.
- ^ Допустимые верхние уровни потребления витаминов и минералов (PDF) , Европейское управление по безопасности пищевых продуктов, 2006 г.
- ^ «Федеральный реестр, 27 мая 2016 г. Маркировка пищевых продуктов: пересмотренная версия этикеток с информацией о пищевой ценности и пищевых добавках. Страница FR 33982» (PDF) .
- ^ «Справочник по дневной норме базы данных этикеток пищевых добавок (DSLD)» . База данных этикеток пищевых добавок (DSLD) . Архивировано из оригинала 7 апреля 2020 года . Проверено 16 мая 2020 г.
- ^ Сильва Авила, Дайана; Луис Пунтель, Робсон; Ашнер, Майкл (2013). «Марганец в здоровье и болезнях». В Астрид Сигел; Хельмут Сигель; Роланд К.О. Сигел (ред.). Взаимосвязь между ионами незаменимых металлов и заболеваниями человека . Ионы металлов в науках о жизни. Том. 13. Спрингер. стр. 199–227. дои : 10.1007/978-94-007-7500-8_7 . ISBN 978-94-007-7499-5 . ПМК 6589086 . ПМИД 24470093 .
- ^ Ван, Цуй-Юэ; Ся, Вэй-Хао; Ван, Линь; Ван, Чжэнь-Юн (1 ноября 2021 г.). «Дефицит марганца вызывает у птиц дисхондроплазию большеберцовой кости, подавляя пролиферацию и дифференцировку хондроцитов» . Исследования в области ветеринарии . 140 : 164–170. дои : 10.1016/j.rvsc.2021.08.018 . ПМИД 34481207 .
- ^ Бушар, MF; Сове, С; Барбо, Б; Легран, М; Буффар, Т; Лимож, Э; Беллинджер, округ Колумбия; Мерглер, Д. (2011). «Интеллектуальные нарушения у детей школьного возраста, подвергшихся воздействию марганца из питьевой воды» . Перспективы гигиены окружающей среды . 119 (1): 138–143. дои : 10.1289/ehp.1002321 . ПМК 3018493 . ПМИД 20855239 .
- ^ Барселу, Дональд; Барселу, Дональд (1999). «Марганец». Клиническая токсикология . 37 (2): 293–307. дои : 10.1081/CLT-100102427 . ПМИД 10382563 .
- ^ Девеньи, А.Г.; Бэррон, Т.Ф; Мамурян, AC (1994). «Дистония, гиперинтенсивность базальных ганглиев и высокий уровень марганца в цельной крови при синдроме Алажилля». Гастроэнтерология . 106 (4): 1068–71. дои : 10.1016/0016-5085(94)90769-2 . ПМИД 8143974 . S2CID 2711273 .
- ^ Хернрот, Бодил; Кронг, Анна-Сара; Баден, Сюзанна (февраль 2015 г.). «Бактериостатическое подавление у норвежского лобстера (Nephrops norvegicus), подвергшегося воздействию марганца или гипоксии под давлением закисления океана» . Водная токсикология . 159 : 217–224. Бибкод : 2015AqTox.159..217H . дои : 10.1016/j.aquatox.2014.11.025 . ISSN 0166-445X . ПМИД 25553539 .
- ^ Агентство по регистрации токсичных веществ и заболеваний (2012) 6. Потенциал воздействия на человека , в Токсикологическом профиле марганца , Атланта, Джорджия: Министерство здравоохранения и социальных служб США.
- ^ Инь, З.; Цзян, Х.; Ли, ES; Ни, М.; Эриксон, К.М.; Милатович, Д.; Боуман, AB; Ашнер, М. (2010). «Ферропортин представляет собой белок, чувствительный к марганцу, который снижает цитотоксичность и накопление марганца» (PDF) . Журнал нейрохимии . 112 (5): 1190–8. дои : 10.1111/j.1471-4159.2009.06534.x . ПМК 2819584 . ПМИД 20002294 .
- ^ Перейти обратно: а б «Темы безопасности и здоровья: соединения марганца (в виде Mn)» . США Управление по безопасности и гигиене труда .
- ^ «Карманный справочник NIOSH по химическим опасностям – соединения марганца и дым (в виде Mn)» . Центры по контролю заболеваний . Проверено 19 ноября 2015 г.
- ^ «Загрязнения питьевой воды» . Агентство по охране окружающей среды США . Проверено 2 февраля 2015 г.
- ^ Базелт, Р. (2008) Утилизация токсичных лекарств и химических веществ в организме человека , 8-е издание, Biomedical Publications, Фостер-Сити, Калифорния, стр. 883–886, ISBN 0-9626523-7-7 .
- ^ Нормандин, Луиза; Хейзелл, А.С. (2002). «Нейротоксичность марганца: обновление патофизиологических механизмов». Метаболические заболевания головного мозга . 17 (4): 375–87. дои : 10.1023/А:1021970120965 . ПМИД 12602514 . S2CID 23679769 .
- ^ Перейти обратно: а б Серсосимо, Миннесота; Коллер, WC (2007). «Диагноз марганцевого паркинсонизма». Нейротоксикология . 27 (3): 340–346. дои : 10.1016/j.neuro.2005.10.006 . ПМИД 16325915 .
- ^ Лу, CS; Хуанг, CC; Чу, Н.С.; Кальн, Д.Б. (1994). «Неэффективность леводопы при хроническом манганизме». Неврология . 44 (9): 1600–1602. дои : 10.1212/WNL.44.9.1600 . ПМИД 7936281 . S2CID 38040913 .
- ^ Перейти обратно: а б Гиларте Т.Р., Гонсалес К.К. (август 2015 г.). «Вызванный марганцем паркинсонизм не является идиопатической болезнью Паркинсона: экологические и генетические данные» . Токсикологические науки (Обзор). 146 (2): 204–12. doi : 10.1093/toxsci/kfv099 . ПМК 4607750 . ПМИД 26220508 .
- ^ Перейти обратно: а б Квакье Г.Ф., Паолиелло М.М., Мухопадьяй С., Боуман А.Б., Ашнер М. (июль 2015 г.). «Марганцево-индуцированный паркинсонизм и болезнь Паркинсона: общие и отличительные черты» . Int J Environ Res Public Health (обзор). 12 (7): 7519–40. дои : 10.3390/ijerph120707519 . ПМЦ 4515672 . ПМИД 26154659 .
- ^ Перес Т.В., Шеттингер М.Р., Чен П., Карвалью Ф., Авила Д.С., Боуман А.Б., Ашнер М. (ноябрь 2016 г.). «Нейротоксичность, вызванная марганцем: обзор ее поведенческих последствий и нейропротекторных стратегий» . BMC Фармакология и токсикология (обзор). 17 (1): 57. дои : 10.1186/s40360-016-0099-0 . ПМК 5097420 . ПМИД 27814772 .
- ^ Лазришвили И.; и др. (2016). «Загрузка марганца вызывает у неагрессивных крыс поведение, убивающее мышей». Журнал биологической физики и химии . 16 (3): 137–141. дои : 10.4024/31LA14L.jbpc.16.03 .
- ^ «Паспорт безопасности» . Сигма-Олдрич . Проверено 26 июля 2021 г.
- ^ Хасан, Хизер (2008). Марганец . Издательская группа Розен. п. 31. ISBN 978-1-4042-1408-8 .
- ^ «Химическая основа марганца» . Институт морской и экологической отчетности Меткалфа, Университет Род-Айленда. Апрель 2006 г. Архивировано из оригинала 28 августа 2006 г. Проверено 30 апреля 2008 г.
- ^ «Краткая информация о токсичности информационной системы оценки рисков для марганца» . Окриджская национальная лаборатория . Проверено 23 апреля 2008 г.
- ^ Прабхакаран, К.; Гош, Д.; Чепмен, Джорджия; Гунасекар, ПГ (2008). «Молекулярный механизм дофаминергической токсичности, вызванной воздействием марганца». Бюллетень исследований мозга . 76 (4): 361–367. дои : 10.1016/j.brainresbull.2008.03.004 . ISSN 0361-9230 . ПМИД 18502311 . S2CID 206339744 .


