Ацетат марганца(II)

| |
| Имена | |
|---|---|
| Название ИЮПАК
Ацетат марганца(II)
| |
| Другие имена
Диацетат марганца
| |
| Идентификаторы | |
| |
3D model ( JSmol )
|
|
| ХимическийПаук | |
| Информационная карта ECHA | 100.010.305 |
ПабХим CID
|
|
| НЕКОТОРЫЙ |
|
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| Mn(CH 3 CO 2 ) 2 (безводный) Mn(CH 3 CO 2 ) 2 ·4H 2 O (тетрагидрат) | |
| Молярная масса | 173,027 г/моль (безводный) 245,087 г/моль (тетрагидрат) |
| Появление | белые кристаллы (безводные) светло-розовые моноклинные кристаллы (тетрагидрат) |
| Плотность | 1,74 г/см 3 (безводный) 1,59 г/см 3 (тетрагидрат) |
| Температура плавления | 210 ° C (410 ° F, 483 К) (безводный) 80 ° C (тетрагидрат) |
| Растворимость | растворим в воде (около 700 г/л при 20°C для тетрагидрата), метаноле , уксусной кислоте (безводной) растворим в воде , этаноле (тетрагидрат) |
| +13,650·10 −6 см 3 /моль | |
| Опасности | |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | > 130 ° C (266 ° F; 403 К) (тетрагидрат) |
| Летальная доза или концентрация (LD, LC): | |
ЛД 50 ( средняя доза )
|
2940 мг/кг (крыса, перорально) [ 2 ] |
| Родственные соединения | |
Другие анионы
|
Фторид марганца(II) Хлорид марганца(II) Бромид марганца(II) |
Другие катионы
|
Ацетат цинка Ацетат ртути(II) Ацетат серебра |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
Ацетат марганца(II) представляет собой химическое соединение формулы Mn(CH 3 CO 2 ) 2 ·(H 2 O)n , где n = 0, 2, 4. Эти материалы представляют собой белые или бледно-розовые твердые вещества. Некоторые из этих соединений используются в качестве катализатора и удобрения . [ 3 ]
Подготовка
[ редактировать ]Ацетат марганца(II) можно получить обработкой оксида марганца(II,III) или карбоната марганца(II) уксусной кислотой: [ 4 ]
- Mn 3 O 4 + 2 CH 3 CO 2 H → Mn(CH 3 CO 2 ) 2 + Mn 2 O 3 + H 2 O
- MnCO 3 + 2 CH 3 CO 2 H → Mn(CH 3 CO 2 ) 2 + CO 2 + H 2 O
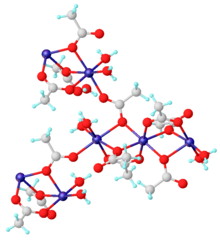
Структура
[ редактировать ]Безводный материал и дигидрат Mn(CH 3 CO 2 ) 2 ·2H 2 O являются координационными полимерами . Дигидрат охарактеризован методом рентгеновской кристаллографии. Каждый центр Mn(II) окружен шестью кислородными центрами, представленными аква-лигандами и ацетатами.
Ссылки
[ редактировать ]- ^ Лиде, Дэвид Р. (1998), Справочник по химии и физике (87-е изд.), Бока-Ратон, Флорида: CRC Press, стр. 3–354, 4–68, ISBN 0-8493-0594-2
- ^ «Соединения марганца (в виде Mn)» . Непосредственно опасные для жизни и здоровья концентрации (IDLH) . Национальный институт охраны труда и здоровья (NIOSH).
- ^ Томас Скотт; Мэри Иглсон (1994), Краткая энциклопедия химии , Уолтер де Грюйтер, стр. 620, ISBN 3-11-011451-8 , получено 20 июля 2009 г.
- ^ Арно Х. Рейдис (2002). «Соединения марганца». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a16_123 . ISBN 3527306730 .
- ^ Чи-И Ченг; Сью-Лейн Ван (1991). «Структура дигидрата ацетата марганца». Acta Crystallographica Раздел C. 47 (8): 1734. doi : 10.1107/S0108270191002202 .
