Пентакарбонилгидромарганец
| |

| |
| Имена | |
|---|---|
| Другие имена
Пентакарбонилманганат водорода(-I) (7CI); Марганец пентакарбонилгидро- (8CI); пентакарбонил гидридомарганца; гидридопентакарбонилмарганец; Пентакарбонилгидрид марганца; пентакарбонилгидромарганец; Пентакарбонилмарганцевый гидрид
| |
| Идентификаторы | |
3D model ( JSmol )
|
|
| ХимическийПаук | |
ПабХим CID
|
|
| Характеристики | |
| HMn(CO) 5 | |
| Молярная масса | 195.99799 g/mol |
| Появление | При комнатной температуре он жидкий и бесцветный. Ниже температуры плавления он может быть сублимирован в вакууме. [ 1 ] |
| Кислотность ( pKa ) | 7.1 |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
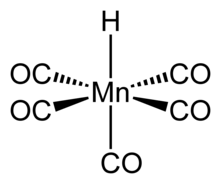
Пентакарбонилгидридомарганец — металлоорганическое соединение формулы HMn(CO) 5 . Это соединение является одним из наиболее стабильных гидридов переходных металлов «первого ряда» .
Подготовка
[ редактировать ]Впервые об этом сообщили в 1931 году. [ 2 ] Из нескольких способов получения этого соединения, [ 3 ] представляет собой протонирование пентакарбонилманганат-аниона. Последний образуется при восстановлении декакарбонила димарганца , например, супергидридом :
- 2 LiHB(C 2 H 5 ) 3 + Mn 2 (CO) 10 → 2 LiMn(CO) 5 + H 2 + 2 B(C 2 H 5 ) 3
- Li[Mn(CO) 5 ] + CF 3 SO 3 H → HMn(CO) 5 + CF 3 SO 3 Li
Соли [Mn(CO)
5 ] −
можно выделить в виде кристаллического PPN +
(μ-нитридо-бис-(трифенилфосфор)) соль, плавно протонируемая CF.
3 ТАК
3 H . [ 3 ]
- ППН[Mn(CO)
5 ] + КФ
3 ТАК
3 H → HMn(CO) 5 + ППН +
CF
3 ТАК −
3
Это соединение также может быть образовано гидролизом пентакарбонил(триметилсилил)марганца: [ 4 ]
- (CO) 5 MnSiMe 3 + H 2 O → HMn(CO) 5 + Me 3 SiOH (Me = CH 3 )
Структура и свойства
[ редактировать ]Структура HMn(CO) 5 была изучена многими методами, включая дифракцию рентгеновских лучей , дифракцию нейтронов и дифракцию электронов . [ 5 ] HMn(CO) 5 может быть связан со структурой гексакарбонильного комплекса, такого как Mn(CO) +
6 , и поэтому имеет аналогичные свойства. [ 6 ] Соединение имеет октаэдрическую симметрию. [ 7 ] и его молекулярная точечная группа — C 4v . [ 5 ] H-Mn Длина связи составляет 1,44 ± 0,03 Å. [ 5 ] Газофазный электронографический анализ подтверждает эти выводы.
Основные реакции
[ редактировать ]PK 5 a HMn(CO) в воде составляет 7,1. [ 8 ] Таким образом, по своей кислотности он сравним с сероводородом , обычной неорганической кислотой.
Обычной реакцией с участием HMn(CO) 5 является замещение лигандов CO органофосфинами , которое происходит как термически, так и фотохимически. Таким образом, образуется множество производных типа HMn(CO) 5-x (PR 3 ) x . [ 9 ] (Здесь R не обязательно должен быть чисто углеводородным компонентом; это может быть, например, OEt, где Et = этильная группа .)
HMn(CO) 5 можно использовать для восстановления олефинов и других органических соединений, а также галогенидов металлов. [ 3 ]
Его можно метилировать диазометаном . [ 1 ]
- HMn(CO) 5 + CH 2 N 2 → Mn(CO) 5 CH 3 + N 2
Примечания
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б Эли, Д.Д.; Пайнс, Герман; Вайс, П.Б. Прогресс в катализе . 32. 385. ISBN 978-0-12-007832-5
- ^ Хибер, В. Лейтерт, Ф. Естественные науки . 1931. 360.
- ^ Jump up to: а б с Хантер, Алан Д; Бьянкони, Ларри Дж; ДиМузио, Стивен Дж; Брахо, Дайан Л. Синтез и взаимосвязи структура-свойство в химии η6-арена Cr(CO)3: от управляемых экспериментов к открытиям. Дж. Хим. Образование. 75. 1998. 891. два : 10.1021/ed075p891
- ^ Финн, М.Г. Пентакарбонил(триметилсилил)марганец. Энциклопедия реагентов для органического синтеза . дои : 10.1002/047084289X.rp022s
- ^ Jump up to: а б с Куколич С.Г. Микроволновой спектр и молекулярная структура пентакарбонилгидрида марганца. 33. 1994. 1217-1219.
- ^ Фенске, Ричард. Электронная структура и связь в пентакарбонилгалогенидах марганца и Гидрид. Неорганическая химия . 9. 1970. 1053-1060.
- ^ Лю, Сянь-мэй; Ван, Чао-ян; Цянь-шу; Се; Яомин; Кинг, Р. Брюс; Шефер, Генри Ф., III. Моноядерные и биядерные карбонилгидриды марганца. Далтон Транс. , 2009, 3774-3785, дои : 10.1039/b822913a
- ^ Моррис, Роберт Х. (10 августа 2016 г.). «Кислотная сила по Бренстеду-Лоури металлогидридных и дигидрогенных комплексов». Химические обзоры . 116 (15): 8588–8654. doi : 10.1021/acs.chemrev.5b00695 . hdl : 1807/78047 . ISSN 0009-2665 . ПМИД 26963836 .
- ^ Альбертен, Габриэле. Катионные молекулярные водородные комплексы Mn (I). Металлоорганические соединения. 16. 1997. 4959-4969.