Органофосфин
Органофосфины представляют собой фосфорорганические соединения формулы PR n H 3− n , где R – органический заместитель. Эти соединения можно классифицировать по значению n : первичные фосфины ( n = 1), вторичные фосфины ( n = 2), третичные фосфины ( n = 3). Все принимают пирамидальные структуры. [1] Органофосфины обычно представляют собой бесцветные липофильные жидкости или твердые вещества. [2] Родителем органофосфинов является фосфин (PH 3 ). [3]
1° против 2° против 3° фосфинов
[ редактировать ]Органоффины классифицируются по числу органических заместителей.
Первичные фосфины
[ редактировать ]Первичные (1°) фосфины формулы RPH 2 обычно получают алкилированием фосфина. Простые алкильные производные, такие как метилфосфин (CH 3 PH 2 ), получают алкилированием производных щелочных металлов MPH 2 (M представляет собой Li , Na или K ). Другой путь синтеза включает обработку соответствующих хлорфосфинов гидридными реагентами. Например, восстановление дихлорфенилфосфина алюмогидридом лития дает фенилфосфин (PhPH 2 ). [4]

Первичные (RPH 2 ) и вторичные фосфины (RRPH и R 2 PH) присоединяются к алкенам в присутствии сильного основания (например, КОН в ДМСО ). Применяются правила Марковникова . Аналогичные реакции происходят с участием алкинов . [5] Основание не требуется для электронодефицитных алкенов (например, производных акрилонитрила ) и алкинов.
Вторичные фосфины
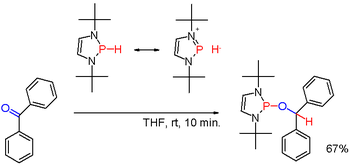
[ редактировать ]Вторичные (2°) фосфины формулы R 2 PH получают аналогично первичным фосфинам. Их также получают восстановительным расщеплением триарилфосфинов щелочными металлами с последующим гидролизом образующейся фосфидной соли. Последний путь используется для получения дифенилфосфина (Ph 2 PH). Диорганофосфиновые кислоты R 2 P(O)OH также можно восстановить диизобутилалюминийгидридом . Вторичные фосфины обычно имеют протонный характер. Но при модификации подходящими заместителями, как в некоторых (редких) диазафосфоленах ( схема 3 ), полярность связи PH может быть инвертирована (см.: умполунг ) и образующийся фосфингидрид может восстанавливать карбонильную группу, как в примере бензофенона в еще один способ. [6] Вторичные фосфины встречаются в циклических формах. Трехчленные кольца — фосфираны (ненасыщенные: фосфирены ), пятичленные кольца — фосфоланы (ненасыщенные: фосфолы ), шестичленные кольца — фосфинаны .
Третичные фосфины
[ редактировать ]Третичные (3°) фосфины формулы R 3 P традиционно получают алкилированием трихлорида фосфора с использованием реактивов Гриньяра или родственных литийорганических соединений:
- 3 RMgX + PCl 3 → PR 3 + 3 MgX 2
случае триметилфосфина : используется трифенилфосфит вместо высокоэлектрофильного PCl 3 В [7]
- 3 CH 3 MgBr + P(OC 6 H 5 ) 3 → P(CH 3 ) 3 + 3 C 6 H 5 OMgBr
Несколько более сложные методы используются для получения несимметричных третичных фосфинов с формулой R 2 R'P. использование фосфорорганических нуклеофилов Типично . Например, дифенилфосфид лития легко метилируется метилиодидом с образованием метилдифенилфосфина :
- LiiP(C 6 H 5 ) 2 + CH 3 I → CH 3 P(C 6 H 5 ) 2 + LiI
Фосфин является предшественником некоторых третичных фосфинов в результате гидрофосфинирования алкенов. Например, в присутствии основных катализаторов PH 3 добавляются акцепторы Михаэля, такие как акрилонитрил : [8]
- PH 3 + 3 CH 2 =CHZ → P(CH 2 CH 2 Z) 3 (Z = NO 2 , CN, C(O)NH 2 )
Третичные фосфины типа PRR'R″ являются « P -хиральными » и оптически стабильными.
С коммерческой точки зрения наиболее важным фосфином является трифенилфосфин , ежегодно производится несколько миллионов килограммов. Его получают реакцией хлорбензола , PCl 3 и натрия. [9] Фосфины более специализированной природы обычно получают другими способами. [10]
Ди- и трифосфины
[ редактировать ]
Дифосфины также доступны в виде первичных, вторичных и третичных фосфорных заместителей. Трифосфины и т. д. аналогичны.
Структура и связь
[ редактировать ]Органофосфины, как и сам фосфин, представляют собой с приблизительной C3v молекулы пирамидальные симметрией . Валентные углы C–P–C составляют примерно 98,6°. [3] Валентные углы C–P–C согласуются с представлением о том, что фосфор преимущественно использует 3p-орбитали для образования связей и что sp-гибридизация атома фосфора незначительна. Последнее является общей особенностью химии фосфора. В результате неподеленная пара триметилфосфина имеет преимущественно s-характер, как и в случае фосфина PH 3 . [11]
Третичные фосфины имеют пирамидальную форму. Когда все органические заместители различаются, фосфин является хиральным и конфигурационно стабильным (в отличие от NRR'R»). Комплексы, полученные из хиральных фосфинов, могут катализировать реакции с образованием хиральных , энантиообогащенных продуктов.
Сравнение фосфинов и аминов
[ редактировать ]Атом фосфора в фосфинах имеет формальную степень окисления -3 (σ 3 л 3 ) и являются фосфорными аналогами аминов . Как и амины, фосфины имеют тригонально-пирамидальную молекулярную геометрию, хотя часто и с меньшими углами ЕКО (E = N, P), по крайней мере, при отсутствии стерических эффектов. CPC Валентный угол составляет 98,6° для триметилфосфина и увеличивается до 109,7° при замене метильных групп трет -бутильными группами. При использовании в качестве лигандов стерическую массу третичных фосфинов оценивают по углу их конуса . Барьер для пирамидальной инверсии также намного выше, чем для инверсии азота , и поэтому фосфины с тремя различными заместителями могут быть разделены на термически стабильные оптические изомеры . Фосфины часто менее основные, чем соответствующие амины, например, сам ион фосфония имеет p K a -14 по сравнению с 9,21 для иона аммония; триметилфосфоний имеет ap K a 8,65 по сравнению с 9,76 для триметиламмония . Однако трифенилфосфин (p K a 2,73) является более основным, чем трифениламин (p K a -5), главным образом потому, что неподеленная пара азота в NPh 3 частично делокализован в три фенильных кольца. В то время как неподеленная пара атома азота делокализована в пирроле , неподеленная пара атома фосфора в фосфорном эквиваленте пиррола ( фосфоле ) — нет. Реакционная способность фосфинов соответствует реакционной способности аминов по нуклеофильности при образовании фосфониевых солей общего строения PR 4. + Х − . Это свойство используется в реакции Аппеля для превращения спиртов в алкилгалогениды . Фосфины легко окисляются до соответствующих оксидов фосфинов , тогда как оксиды аминов образуются с меньшей готовностью. Отчасти по этой причине фосфины очень редко встречаются в природе.
Реакции
[ редактировать ]Координационная химия
[ редактировать ]Третичные фосфины часто используются в качестве лигандов в координационной химии. При связывании фосфины связываются с металлами, которые служат кислотами Льюиса . Например, хлорид серебра реагирует с трифенилфосфином с образованием комплексов 1;1 и 1:2:
- ПФ 3 + AgCl → ClAgPPh 3
- ПФ 3 + ClAgPPh 3 → ClAg(PPh 3 ) 2
Аддукты, образующиеся из фосфинов и борана, являются полезными реагентами. Эти фосфинбораны стабильны на воздухе, но борановую защитную группу можно удалить обработкой аминами. [12] [13]
кватернизация
[ редактировать ]Подобно комплексообразованию, фосфины легко алкилируются. Например, бромистый метил превращает трифенилфосфин в бромид метилтрифенилфосфония , «четвертичную соль»:
- ПФ 3 + СН 3 Br → [СН 3 ППф 3 + ]Бр −
Фосфины являются нуклеофильными катализаторами в органическом синтезе , например, в реакции Раухута-Кюрриера и реакции Бэйлиса-Хиллмана .
Протонирование и депротонирование
[ редактировать ]Как и сам фосфин, но проще, органофосфины подвергаются протонированию. Реакция обратима. В то время как органофосфины чувствительны к кислороду, протонированные производные - нет.
Первичные и вторичные производные. Они могут быть депротонированы сильными основаниями с образованием фосфидорганических производных . Таким образом, дифенилфосфин реагирует с литийорганическим реагентом с образованием дифенилфосфида лития :
- HPPh 2 + RLi → LiPPh 2 + RH
Окисление и сульфидирование
[ редактировать ]Третичные фосфины обычно окисляются с образованием оксидов фосфина формулы R 3 PO. Реакция с кислородом запрещена по спину, но все же протекает с достаточной скоростью, поэтому образцы третичных фосфинов обычно загрязнены оксидами фосфина. Качественно скорости окисления триалкилов выше, чем у триарилфосфинов. Еще быстрее идут окисления с использованием перекиси водорода . Первичные и вторичные фосфины также окисляются, но продукт(ы) подвергаются таутомеризации и дальнейшему окислению.
Третичные фосфины обычно окисляются с образованием сульфидов фосфина .
Восстановительные свойства органофосфинов также иллюстрируются восстановлением Штаудингера для превращения органических азидов в амины и реакцией Мицунобу для превращения спиртов в сложные эфиры. В этих процессах фосфин окисляется до фосфора(V). Также было обнаружено, что фосфины восстанавливают активированные карбонильные группы, например, восстановление α-кетоэфира до α-гидроксиэфира на схеме 2 . [14] В предлагаемом механизме реакции первый протон заимствован у метильной группы триметилфосфина (трифенилфосфин не реагирует).
См. также
[ редактировать ]- Дифосфины , R 2 PPR 2 , R 2 P(CH 2 ) n PR 2
- Оксид фосфина , R 3 P=O
- Фосфоран , PR 5 , R 3 P=CR 2
- Фосфинит , P(OR)R 2
- Фосфонит , P(OR) 2 R
- Фосфит , P(OR) 3
- Фосфинат , R 2 P(RO)O
- Фосфонат , RP(RO) 2 O
Ссылки
[ редактировать ]- ^ Пол Си Джей Камер, Пит ВНМ ван Леувен, изд. (2012). Лиганды фосфора(III) в гомогенном катализе: дизайн и синтез . Нью-Йорк: Уайли. ISBN 978-0-470-66627-2 .
- ^ Г. М. Косолапов; Л. Майер (1972). Органические соединения фосфора, Том 1 . Нью-Йорк, Нью-Йорк: Джон Уайли.
- ^ Jump up to: а б Аннетт Шир и Хуберт Шмидбаур «P-донорные лиганды» в Энциклопедии неорганической химии 2006, Wiley-VCH, Вайнхайм. два : 10.1002/0470862106.ia177
- ^ Хайни, Рэйчел М.; Хайэм, Ли Дж.; Мюллер-Бунц, Хельге; Гилхиани, Деклан Г. (2006). «Укрощение функциональной группы: создание устойчивых на воздухе хиральных первичных фосфанов». Angewandte Chemie, международное издание . 45 (43): 7248–7251. дои : 10.1002/anie.200602143 . ПМИД 17022105 .
- ^ Арбузова С.Н.; Гусарова, Н.К.; Трофимов, Б.А. (2006). «Нуклеофильные и свободнорадикальные присоединения фосфинов и фосфинхалькогенидов к алкенам и алкинам» . Аркивок . v (5): 12–36. дои : 10.3998/ark.5550190.0007.503 . hdl : 2027/spo.5550190.0007.503 .
- ^ Берк, С.; Гудат, Д.; Нигер, М.; Дю Мон, В.-В. (2006). « Р -водородзамещенные 1,3,2-диазафосфолены: молекулярные гидриды». Журнал Американского химического общества . 128 (12): 3946–3955. дои : 10.1021/ja057827j . ПМИД 16551102 .
- ^ Лейткенс, М.Л. младший; Саттельбергер, AP; Мюррей, Х.Х.; Бэзил, доктор юридических наук; Факлер, Джей Пи младший (1990). «Триметилфосфин». Неорганические синтезы . Неорганические синтезы. Том. 28. С. 305–310. дои : 10.1002/9780470132593.ch76 . ISBN 9780470132593 .
- ^ Трофимов Борис А.; Арбузова Светлана Н.; Гусарова, Нина К. (1999). «Фосфин в синтезе фосфорорганических соединений». Российское химическое обозрение . 68 (3): 215–227. Бибкод : 1999RuCRv..68..215T . дои : 10.1070/RC1999v068n03ABEH000464 . S2CID 250775640 .
- ^ Свара, Юрген; Веферлинг, Норберт и Хофманн, Томас (2006). «Соединения фосфора органические». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a19_545.pub2 . ISBN 978-3527306732 .
- ^ Даунинг, Дж. Х.; Смит, МБ (2003). «Фосфорные лиганды». Комплексная координационная химия II . 2003 : 253–296. дои : 10.1016/B0-08-043748-6/01049-5 . ISBN 9780080437484 .
- ^ Э. Флак, Химия фосфина, Темы современной химии, том. 35, 64 стр., 1973.
- ^ Алайрак, Кэрол; Лахдар, Сами; Абделла, Ибрагим; Гомон, Анни-Клод (2014). «Последние достижения в синтезе соединений P-BH 3 ». Химия фосфора II . Темы современной химии. Том. 361. стр. 1–82. дои : 10.1007/128_2014_565 . ISBN 978-3-319-15511-1 . ПМИД 25504072 .
- ^ Брюнель, Жан Мишель; Фор, Бруно; Маффеи, Мишель (1998). «Фосфан-бораны: синтез, характеристика и синтетические применения». Обзоры координационной химии . 178–180: 665–698. дои : 10.1016/S0010-8545(98)00072-1 .
- ^ Чжан, В.; Ши, М. (2006). «Восстановление активированных карбонильных групп алкилфосфинами: образование α-гидроксиэфиров и кетонов». ХимКомм . 2006 (11): 1218–1220. дои : 10.1039/b516467b . ПМИД 16518496 .

