Реакция Бейлиса-Хиллмана
| (Морита–)Реакция Бейлиса–Хиллмана | |
|---|---|
| Назван в честь | Кен-ичи Морита Энтони Б. Бэйлис Мелвилл Э. Д. Хиллман |
| Тип реакции | Реакция сцепления |
| Идентификаторы | |
| Портал органической химии | Реакция Бэйлиса-Хиллмана |
| RSC Идентификатор онтологии | RXNO: 0000076 |
В органической химии реакция Бейлиса -Хиллмана , Мориты-Бейлиса-Хиллмана или MBH представляет собой реакцию образования углерод-углеродной связи между активированным алкеном и углеродным электрофилом в присутствии нуклеофильного катализатора , такого как третичный амин или фосфин. . Продукт плотно функционализирован , присоединяя алкен в α-положении к восстановленной форме электрофила (например, в случае альдегида , аллилового спирта ) . [ 1 ] [ 2 ]
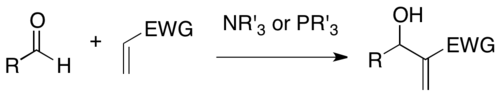
Реакция названа в честь Энтони Б. Бейлиса и Мелвилла Э. Д. Хиллмана, двух химиков, разработавших реакцию в Целанезе ; и К. Морита, опубликовавший более раннюю работу [ 3 ] на том же.
Реакция MBH дает несколько преимуществ в органическом синтезе :
- Он сочетает в себе легкость приготовления исходных материалов и высокую атомную экономичность .
- Он требует только мягких условий и не требует переходных металлов .
- Асимметричный синтез возможен из прохиральных электрофилов.
- Плотная функциональность продукта позволяет осуществлять множество дальнейших преобразований .
Его недостатком является то, что реакция протекает чрезвычайно медленно.
Общие реагенты
[ редактировать ]Наиболее часто используемым катализатором реакции является третичный амин DABCO (триэтилендиамин) ; другие известные катализаторы включают 4-диметиламинопиридин , DBU (диазабициклоундецен) и различные фосфины .
Механизм реакции
[ редактировать ]По состоянию на 2012 год [update]Однако некоторые вопросы о механизме реакции MBH остаются открытыми.
Хилл и Айзекс провели первые кинетические эксперименты в 1990-х годах, обнаружив, что скорость реакции между акрилонитрилом и ацетальдегидом имеет первый порядок в каждом реагенте и в катализаторе DABCO. α- Дейтерированный акрилонитрил не проявлял кинетического изотопного эффекта , но продукт, по-видимому, катализирует собственное образование . [ 4 ]
В модели, предложенной Хоффманном семь лет назад, [ 5 ] реакция начинается с 1,4-присоединения каталитического амина к активированному алкену. Образующийся цвиттер-ионный азаенолят альдольному подвергается присоединению к альдегиду. Затем внутримолекулярный сдвиг протона приводит к образованию конечного аддукта MBH, который удаляет катализатор.

Если бы модель Хоффмана была правильной, то присоединение альдолов было бы стадией, лимитирующей скорость , что согласуется с отсутствием кинетического изотопного эффекта. [ 4 ] Однако механизм Хоффмана не объясняет ни автокатализа продукта, ни (при реакции арилальдегидов с акрилатами ) значительного образования побочного продукта диоксанона .
В более поздних работах McQuade et al. и Aggarwal et al. пересмотрели механизм MBH, сосредоточив внимание на переносе протона и автокатализе. [ 6 ] [ 7 ] По Маккуаду, реакция между метилакрилатом и п-нитробензальдегидом имеет второй порядок относительно альдегида. Более того, он показал значительный кинетический изотопный эффект для α-водорода акрилата (5,2 в ДМСО , но ≥2 во всех растворителях), что предполагает, что отщепление протона является стадией, определяющей скорость.
Чтобы объяснить этот повторный анализ, МакКуэйд предложил изменить предложение Хоффмана так, чтобы после добавления первого альдола добавлялся второй альдол с образованием полуацетального алкоксида. Затем определяющий скорость перенос протона высвобождает аддукт A через шестичленное переходное состояние , которое далее реагирует с образованием продукта MBH B побочного продукта диоксанона C. или
В дальнейшей модификации Аггарвал отметил, что заметил, что метанол ингибирует автокатализ в реакции MBH. Таким образом, он предположил, что на ранних стадиях реакции действует механизм, эквивалентный предложению Маккуэйда, но после 20% конверсии реакция со спиртовым растворителем может заменить присоединение второго альдола. В подтверждение этого утверждения Аггарвал и Харви смоделировали два пути, используя расчеты теории функционала плотности , и показали, что вычисленный энергетический профиль соответствует экспериментальным кинетическим изотопным эффектам и наблюдаемой скорости реакции. [ 8 ] Также они показали, что общий энтальпийный барьер пути, катализируемого алкоголем, немного меньше, чем у пути, не катализируемого алкоголем, объясняя это тем, что по мере увеличения концентрации спирта (продукта MBH) путь, катализируемый алкоголем, начинает доминировать.

Хотя исследования Маккуэйда и Аггарвала привлекли большое внимание, промежуточного соединения А оставались неуловимыми. по состоянию на 2012 год однозначные доказательства роли [update]. Поскольку A может образоваться путем отдельного присоединения B к альдегиду, любые изолированные A и C могут быть результатом побочных реакций , а не самого MBH. Также до сих пор не было представлено убедительное объяснение исходным данным первого порядка Хилла и Айзека.
Модификация Аггарвала имеет свои противоречия. Если это верно, то в ходе реакции определяющая скорость стадия меняется с переноса протона на альдольное присоединение. [ 7 ] — но последующие компьютерные исследования пришли к выводу, что перенос протона по-прежнему имеет самый высокий барьер даже на поздних стадиях процесса реакции. С другой стороны, Коэльо и Эберлин и др. получили данные электрораспыления - масс-спектроскопии , которые являются структурным свидетельством двух разных форм стадии переноса протона в реакции. [ 9 ]
Область применения и ограничения
[ редактировать ]
Реакция MBH чрезвычайно общая. В большинстве случаев электрофилом является альдегид, кетон (но см. ниже) или имин (в последнее время реакция аза -Бейлиса-Хиллмана ); но сообщения показывают, что аллилгалогениды , алкилгалогениды и эпоксиды . также возможны [ 10 ] [ 11 ] [ 12 ] Использование аллена вместо простого алкена в качестве предшественника дает промежуточный продукт, который может реагировать с γ-углеродом, а не с α. [ 13 ]
В то же время может быть сложно разработать подходящие условия реакции. Реакция протекает медленно (нередко время в , недели или дольше, даже при 25-100 мол.% катализатора), особенно с (в качестве алкена) β-замещенными активированными олефинами винилсульфонами или винилсульфоксидами две ; или (как электрофил) затрудненные алифатические альдегиды или богатые электронами бензальдегиды, . Кетоны, как правило, недостаточно реакционноспособны в обычных условиях, чтобы участвовать в синтетических процессах. [ 14 ] Например, реакция между стерически затрудненным т - бутилакрилатом и бензальдегидом с каталитическим DABCO в отсутствие растворителя потребовала 4 недель, чтобы обеспечить умеренную конверсию в конечный продукт.

В апротонных растворителях скорость реакции еще медленнее, хотя восстановление возможно с помощью протонных добавок (например, спиртов и карбоновых кислот). [ 15 ]
При столь низких скоростях активность субстратов может вызывать конкурирующие побочные реакции: акролеины также олигомеризуются, а алленоаты циклоаддируются. Электрофилы аллилгалогенидов и алкилэпоксидов также часто оказываются непослушными. [ нужны разъяснения ] [ нужна ссылка ] Реакция MBH арилвинилкетона с альдегидом не является простой (см. § Реакцию Sila-MBH ), поскольку реакционноспособный арилвинилкетон легко подвергается присоединению по Михаэлю к другой молекуле арилвинилкетона, которая затем присоединяется к альдегиду с образованием образуют аддукт с двойным MBH. [ 16 ]

Благодаря сильно отрицательному объему активации можно реализовать медленные реакции Бейлиса–Хиллмана, в том числе кетоновые, проводя реакцию под высоким давлением (до 20 кбар). [ 14 ]
Варианты
[ редактировать ]Реакция Сила-МБГ
[ редактировать ]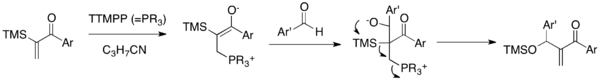
В реакции сила-MBH α-силилированные виниларилкетоны соединяются с альдегидами в присутствии каталитического TTMPP , большого триарилфосфинового реагента . [ 17 ] Цвиттер-ионный енолят, полученный при добавлении нуклеофильного катализатора к енону, присоединяется к карбонилу альдегида с образованием алкоксида. Этот алкоксид подвергается последующей 1,3- перегруппировке Брука и каскаду отщепления с силоксиметиленона образованием и высвобождением катализатора.
Реакция Раухута-Карриера
[ редактировать ]
Реакция Раухута-Карриера является винилологичным аналогом реакции MBH, в которой электрофилом является акцептор Михаэля , а не альдегид или имин. Межмолекулярные реакции Раухута-Кюрриера обычно демонстрируют плохую хемоселективность , поскольку в реакции соединяются два активированных алкена, но использовались внутримолекулярные реакции Раухута-Карриера. Например, циклизацию α,β-ненасыщенных альдегидов можно проводить в присутствии производного пролина и уксусной кислоты с получением энантиообогащенных продуктов. [ 18 ]
Тандемные стратегии
[ редактировать ]Как упоминалось выше, медленная скорость реакции MBH часто приводит к побочным реакциям на активированных субстратах. В стратегиях тандемных реакций это является достоинством, поскольку позволяет осуществлять синтез с высокой экономией атомов. Например, при трехкомпонентном сочетании альдегидов, аминов и активированных алкенов альдегид реагирует с амином с образованием имина перед образованием аддукта аза -MBH, как в реакции арилальдегидов, дифенилфосфинамида и метилвинила. кетон , в присутствии TiCl 4 , трифенилфосфина и триэтиламина : [ 19 ]

Аналогичным образом, активированные ацетилены могут подвергаться конъюгатному присоединению и оставаться активированным алкеном для реакции MBH, как в следующей реакции энантиоселективной циклизации , в которой фенолятный нуклеофил присоединяется к функционализированному енину перед замыканием кольца аза -MBH, катализируемым хиральным аминным основанием. [ 20 ]

Асимметричный синтез
[ редактировать ]Хиральные вспомогательные вещества
[ редактировать ]Султам Оппольцера можно использовать в качестве хирального вспомогательного средства для асимметричной реакции MBH. При взаимодействии акрилата, замещенного сультамом Оппольцера, с различными альдегидами в присутствии катализатора DABCO были получены оптически чистые 1,3-диоксан-4-оны с отщеплением вспомогательного соединения (выход 67-98%, ее >99%). Циклические продукты можно превратить в желаемые продукты MBH с помощью камфорсульфоновой кислоты и метанола. [ 21 ]
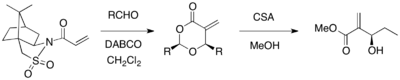
Родственным вспомогательным гидразидом является хиральный акрилоилгидразид , который диастереоселективно реагирует с альдегидами. [ 22 ] Оба диастереомера могут быть получены с различным выбором растворителей (ДМСО по сравнению со смесью ТГФ и H 2 O), что позволяет предположить, что конформация переходной структуры находится под влиянием растворителя.
Хиральные аллены и имины также могут быть использованы для асимметричной реакции аза -MBH, катализируемой DABCO. [ 23 ] Оптически активный 10-фенилсульфонилизоборнилбута-2,3-диеноат реагирует с ариимином с образованием α-аллениламина диастереоселективным образом (выход 37–57%).

Хиральный катализатор Льюиса
[ редактировать ]В некоторых энантиоселективных реакциях MBH используются катализаторы на основе хиральных третичных аминов. Например, β-ICD , производное алкалоида хинного дерева, известно среди катализаторов на основе хинидинового каркаса и катализирует энантиоселективную реакцию MBH с 1,1,1,3,3,3-гексафторизопропилакрилатом в качестве активированного алкена: [ 24 ]
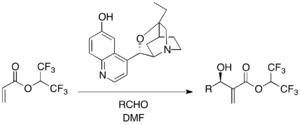
Было показано, что фенольный кислород β-ICD важен в реакции, а это означает, что β-ICD действует как кислота Бренстеда, а не просто нуклеофил.
Циклопентенон и различные ароматические и алифатические альдегиды вступают в асимметричную реакцию с использованием планарного хирального катализатора DMAP Фу в изопропаноле (выход 54–96%, ee 53–98%). В этом случае для ускорения реакции требовался йодид магния в качестве сокатализатора кислоты Льюиса. [ 25 ]

P -хиральные фосфины . Были исследованы [ 26 ]
В качестве катализаторов MBH также можно использовать простые диамины. Было обнаружено, что метилвинилкетон и различные замещенные бензальдегиды вступают в асимметричную реакцию MBH. Хиральный пирролидиновый катализатор эффективен для орто- и паразамещенных электронодефицитных бензальдегидов (выход 75-99%, э.и. 8-73%). [ 27 ]

Хиральные фосфиновые катализаторы MBH часто содержат в своей основной цепи фрагменты кислоты Бренстеда. Например, для асимметричной реакции аза -MBH были разработаны хиральные фосфины, содержащие основание Льюиса, кислоту Бренстеда и активированное кислотой основание Бренстеда (выход 86-96%, э.и. 79-92%). Было высказано предположение, что кислотные и основные фрагменты Бренстеда участвуют в стабилизации цвиттер-ионных частиц стереоселективным образом. [ 28 ]

Хиральный фосфиновый катализатор на основе BINOL также эффективен для асимметричной реакции аза-MBH N-тозилиминов с активированными алкенами, такими как метилвинилкетон и фенилакрилат. [ 29 ]
Кроме того, отдельный класс хиральных молекул фосфин- скварамида может эффективно катализировать внутримолекулярную асимметричную реакцию MBH. ω-формиленоны реагируют с образованием энантиообогащенных циклических продуктов при температуре окружающей среды (выход 64–98%, ee 88–93%). [ 30 ]

Хиральный кислотный катализатор Льюиса
[ редактировать ]Хиральные катализаторы на основе кислот Льюиса представляют интерес, поскольку они могут активировать электроноакцепторную группу энантиоселективным образом. Показано, что хиральные катионные оксазаборолидиниевые катализаторы эффективны в трехкомпонентном сочетании α,β-ацетиленовых эфиров, альдегидов и триметилсилилиодида (выход 50–99 %, э.и. 62–94 %). Оба энантиомерных продукта можно было получить, используя разные энантиомеры катализатора. [ 31 ]

Комплекс соли металла и хирального лиганда также является жизнеспособной стратегией. La(OTf) 3 и хиральные лиганды, полученные из камфоры, могут индуцировать энантиоселективность в реакции MBH, катализируемой DABCO, с различными альдегидами и акрилатами (выход 25-97%, ee 6-95%). В этих случаях обычно использовались мультидентатные лиганды для хелатирования с металлом, который активирует как цвиттер-ионный енолят, так и альдегид. [ 32 ]

La(O-iPr) 3 и лигандная система, полученная из БИНОЛа, в сочетании с каталитическим DABCO также работает в асимметричной реакции аза-MBH различных N-дифенилфосфиноилиминов и метилакрилата. Арил, гетероарил и алкенилимины подходили для хорошего выхода и энантиоселективности. [ 33 ]
Хиральные клещевые комплексы палладия (II) действуют как кислота Льюиса в энантиоселективной DABCO-катализируемой реакции аза-MBH акрилонитрила и различных тозилиминов с образованием функционализированных α-метилен-β-аминонитрилов (выход 75–98%, ee) 76–98%. . Ацетат серебра необходим для активации предкатализатора бромида палладия в каталитическом цикле. [ 34 ]
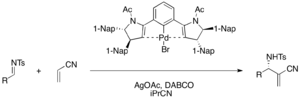
Хиральный сокатализатор кислоты Бренстеда
[ редактировать ]различные хиральные катализаторы из тиомочевины В настоящее время исследуются для асимметричных реакций MBH. Хиральные катализаторы из тиомочевины и бис(тиомочевины) могут быть эффективны в реакциях MBH и аза-MBH, катализируемых DABCO. [ 35 ] [ 36 ] Например, тиомочевинный катализатор Якобсена осуществляет энантиоселективную реакцию аза-MBH (выход 25-49%, ee 87-99%).
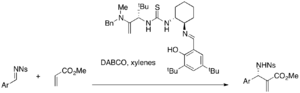
В то время как простая тиомочевина требует совместного использования нуклеофильного катализатора, бифункциональные катализаторы, такие как фосфин-тиомочевины, могут использоваться отдельно для асимметричных реакций MBH. Например, различные акрилаты и ароматические альдегиды реагируют в присутствии этих катализаторов с образованием энантиомерных аддуктов MBH (выход 32–96%, ee 9–77%). [ 37 ]

Реакция MBH может включать производное пролина в качестве сокатализатора. Было высказано предположение, что имидазольный нуклеофильный катализатор и пролин влияют на реакцию через иминиевый интермедиат. [ 38 ] С (S)-пролином и DABCO α-амидосульфоны и α,β-ненасыщенные альдегиды вступают в высокоэнантиоселективную реакцию аза-MBH (выход 46–87%, E/Z 10:1–19:1, 82–99%). эээ). [ 39 ]

Применение в органическом синтезе
[ редактировать ]Аддукты Бейлиса-Хиллмана и их производные широко использовались для создания гетероциклов и других циклических каркасов. [ 40 ]
Реакции МБГ широко используются в органическом синтезе. Например, эта реакция была использована для создания ключевых циклических промежуточных продуктов для синтеза салиноспорамида А, диверсонола и анатоксина-а. [ 41 ] [ 42 ] [ 43 ]



Дальнейшее чтение
[ редактировать ]Написано множество отзывов, в том числе:
- Диви Басавайя, Анумолу Джаганмохан Рао и Тумманапалли Сатьянараяна (2003), «Последние достижения в реакции Бейлиса-Хиллмана и ее применение». хим. Преподобный. , 103 (3), с. 811–892. два : 10.1021/cr010043d
- Г. Массон, К. Хаусман и Дж. Чжу (2007), «Энантиоселективная реакция Морита-Бейлиса-Хиллмана и ее аза-аналог». Angewandte Chemie International Edition , 46: 4614–4628. два : 10.1002/anie.200604366
- Валери Деклерк, Жан Мартинес и Фредерик Ламати (2009), « Реакция аза -Бейлиса-Хиллмана» , Chem. Rev. , 109 (1), стр. 1–48. два : 10.1021/cr068057c
- Диви Басавая, Бхаванам Секхара Редди и Сатпал Сингх Бадсара (2010), «Недавний вклад реакции Бейлиса-Хиллмана в органическую химию», Chemical Reviews 110 (9), стр. 5447-5674. два : 10.1021/cr900291g
- Диви Басавайя и Горре Вирарагхавайя (2012), «Реакция Бейлиса-Хиллмана: новая концепция творчества в химии» Chem. Соц. Преподобный. два : 10.1039/C1CS15174F
Ссылки
[ редактировать ]- ^ Бэйлис, AB; Хиллман, MED, патент Германии 2155113, 1972 г.
- ^ Циганек, E. Org. Реагировать. 1997 , 51 , 201. два : 10.1002/0471264180.or051.02
- ^ К. Морита, З. Сузуки и Х. Хиросе, Bull. хим. Соц. Япония, 1968 , 41, 2815.
- ^ Jump up to: а б Дж. Физ. Орг. хим. 1990, 3, 285.
- ^ Энджю. хим. Межд. Эд. англ. 1983, 22, 795.
- ^ Органические письма, 2005, 7, 1, 147–150.
- ^ Jump up to: а б Энджью. хим. Межд. Эд. 2005, 44, 1706–1708.
- ^ J. Am. Chem. Soc. 2007, 129, 15513.
- ^ J. Org. Chem., 2009, 74(8), 3031-3037
- ^ Тетраэдр Летт. 2001, 42, 85.
- ^ Орг. Легкий. 2010, 12, 2418.
- ^ Chem. Commun. 2006, 2977.
- ^ J. Am. Chem. Soc. 2009, 131, 4196.
- ^ Jump up to: а б Басавайя, Рао и Сатьянараяна 2003 .
- ^ Форт, Ив; Берта, Мари Кристина; Кабере, Поль (1992). «Пересмотр механизма и приложений« Реакция Бейлиса-Хиллмана »». Тетраэдр . 48 (31): 6371–6384. дои : 10.1016/s0040-4020(01)88227-2 .
- ^ «Энантиоселективные реакции Аза-Морита-Бейлиса-Хиллмана акрилонитрила, катализируемые клещевыми комплексами палладия (II), имеющими C 2 -симметричные хиральные бис (имидазолиновые) лиганды» Хиодо, К.; Накамура, С.; Шибата, Н. Ангью. хим. Межд. Эд. 2012, 51, 10337. два : 10.1002/anie.201204891
- ^ Трофимов, Александр; Геворкян, Владимир (2009). «Реакция Силы-Мориты-Бейлиса-Хиллмана арилвинилкетонов: преодоление проблемы димеризации». Органические письма . 11 (1): 253–255. дои : 10.1021/ol8026522 .
- ^ Маркес-Лопес, Евгения; Эррера, Ракель П.; Маркс, Тимо; Джейкобс, Вибке К.; Кеннинг, Дэниел; де Фигейредо, Рената М.; Кристманн, Матиас (2009). «Скрещенные внутримолекулярные реакции типа Раухата-Карриера посредством активации диенамина». Органические письма . 11 (18): 4116–4119. дои : 10.1021/ol901614t . hdl : 10261/113980 .
- ^ Ши, Мин; Чжао, Гуй-Лин (2002). «Реакции аза-Бейлиса-Хиллмана аза-Бейлиса-Хиллмана в одном горшке арилальдегидов и дифенилфосфинамида с метилвинилкетоном в присутствии TiCl 4 , PPh 3 и Et 3 N». Буквы тетраэдра . 43 (50): 9171–9174. дои : 10.1016/S0040-4039(02)02263-3 .
- ^ Герман, Йозеф; Нуньес, Альберто; Марш, Лейр; Марк, Ванесса; Альварадо, Куаутемок; Руано, Хосе Луис Гарсия (2010). «Асимметричный синтез 4-амино-4H-хроменов с помощью органокаталитических тандемных реакций Окса-Майкла/Аза-Бейлиса-Хиллмана». хим. Евро. Дж 16 (31): 9453–9456. дои : 10.1002/chem.201001293 .
- ^ J. Am. Chem. Soc. 1997, 119, 4317-4318
- ^ Орг. Легкий. 2000, 2, 6, 729-731
- ^ Евр. Дж. Орг. хим. 2010, 3249–3256
- ^ J. Am. Chem. Soc. 1999, 121, 10219-10220
- ^ Chem. Commun. 2010, 46, 2644-2646
- ^ Сяо, Ю.; Солнце, З.; Го, Х.; Квон, О. (2014). «Хиральные фосфины в нуклеофильном органокатализе» . Журнал органической химии Байльштейна . 10 : 2089–2121. дои : 10.3762/bjoc.10.218 . ПМЦ 4168899 . ПМИД 25246969 .
- ^ Дж. Тетраэдр: Асимметрия, 2010, 1511.
- ^ Реклама. Синтез. Катал. 2009, 351, 331
- ^ Chem. Commun. 2003, 1310
- ^ Chem. Commun. 2011, 47, 1012
- ^ Энджю. хим. Межд. Эд. 2009, 48, 4398
- ^ J. Org. Chem. 2003, 68, 915-919
- ^ J. Am. Chem. Soc. 2010, 132, 11988
- ^ Энджю. хим. Межд. Эд. 2012, 51, 10337-10341
- ^ Реклама. Синтез. Катал. 2005, 347, 1701-1708 гг.
- ^ Тетраэдр Летт. 2011, 52, 6234
- ^ Тетраэдр 2009, 65, 8185
- ^ Хим. Евр, Дж. 2009, 15, 1734 г.
- ^ Дж. Адв. Синтез. Катал. 2011, 353, 1096
- ^ Тетраэдр, 2008, 64(20), 4511-4574.
- ^ J. Am. Chem. Soc. 2004, 126, 6230-6231.
- ^ Энджю. хим. Межд. Эд. 2006, 45, 307–309.
- ^ Chem. Commun. 2008, 3432.