Конденсация Пехмана
| Конденсация Пехмана | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Назван в честь | Ганс фон Пехманн | ||||||||
| Тип реакции | Реакция образования кольца | ||||||||
| Реакция | |||||||||
| |||||||||
| Условия | |||||||||
| Температура | Переменная | ||||||||
| Катализатор | |||||||||
| Идентификаторы | |||||||||
| Портал органической химии | Пехмана-конденсация | ||||||||
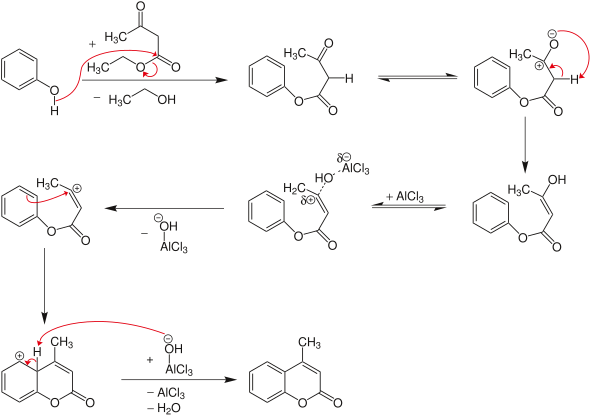
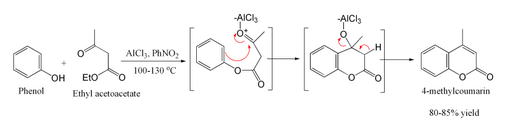
Конденсация Пехмана представляет собой синтез кумаринов , исходя из фенола и карбоновой кислоты или сложного эфира, содержащего β- карбонильную группу. [1] Конденсацию проводят в кислых условиях. Механизм включает этерификацию/переэтерификацию с последующей атакой активированного карбонила орто-кислорода с образованием нового кольца. Последней стадией является дегидратация, наблюдаемая после альдольной конденсации . Его открыл немецкий химик Ганс фон Пехманн. [2] .

Механизм
[ редактировать ]Для синтеза производных кумарина β-кетоэфиры можно конденсировать с фенолами в кислых условиях. [3] В этом случае сначала происходит реакция переэтерификации с образованием эфира фенола. Затем следует замыкание кольца, аналогичное алкилированию Фриделя-Крафтса .
Примеры
[ редактировать ]Для простых фенолов условия суровые, хотя урожайность все равно может быть хорошей. [4]
С высокоактивированными фенолами, такими как резорцин , реакцию можно проводить в гораздо более мягких условиях. Это открывает полезный путь к производным умбеллиферона :

Для кумаринов, незамещенных в положении 4, метод требует использования формилуксусной кислоты или ее сложного эфира. Они нестабильны и коммерчески недоступны, но кислоту можно получить in situ из яблочной и серной кислот при температуре выше 100 °C. Сразу после образования формилуксусная кислота осуществляет конденсацию Пехмана. В показанном примере производится сам умбеллиферон, хотя и с низким выходом:

Механистические исследования
[ редактировать ]Механизм реакции детально изучен с помощью теоретической обработки. [5]
Исследование показало, что реакция протекает по оксо-форме, а не по енольной форме. Были предложены три различных оксо-маршрута.
Циклизация хромона Симониса
[ редактировать ]В другом варианте реакция фенолов, бета-кетоэфиров и пятиокиси фосфора дает хромон . Эта реакция называется циклизацией хромона Симониса . [6] [7] Кетон в кетоэфире активируется P 2 O 5 сначала для реакции с фенольной гидроксильной группой, затем эфирная группа в нем активируется для электрофильной атаки арена.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ К. Миллса Дж. А. Джоуль, Гетероциклическая химия , 4-е издание, Blackwell Science, Оксфорд, Великобритания, 2000.
- ^ Х.в. Пехманн (1884 г.). «Новое образование кумаринов. Синтез дафнетина» . Отчеты Немецкого химического общества . 17 (1): 929–936. дои : 10.1002/cber.188401701248 .
- ^ К. Миллса Дж. А. Джоуль, Гетероциклическая химия , 4-е издание, Blackwell Science, Оксфорд, Великобритания, 2000.
- ^ Юджин Х. Вудрафф, Органический синтез, Сб. Том. 3 , с.581. Доступно онлайн. Архивировано 14 мая 2011 г. на Wayback Machine .
- ^ Дару, Янош; Стирлинг, Андраш (4 ноября 2011 г.). «Механизм реакции Пехмана: теоретическое исследование». Журнал органической химии . 76 (21): 8749–8755. дои : 10.1021/jo201439u . ПМИД 21932799 .
- ^ Э. Петчек, Х. Симонис, Бер. 46, 2014 (1913).
- ^ Назовите реакции: сборник подробных механизмов реакций , Цзе Джек Ли.