Метансульфоновая кислота
| |

| |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК
Метансульфоновая кислота | |
| Другие имена
Метилсульфоновая кислота, MSA; мезиловая кислота
| |
| Идентификаторы | |
3D model ( JSmol )
|
|
| 1446024 | |
| КЭБ | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.000.817 |
| Номер ЕС |
|
| 1681 | |
ПабХим CID
|
|
| НЕКОТОРЫЙ | |
| Число | 2585 |
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| CH4O3CH4O3S | |
| Молярная масса | 96.10 g·mol −1 |
| Появление | Прозрачная бесцветная жидкость |
| Плотность | 1,48 г/см 3 |
| Температура плавления | От 17 до 19 ° C (от 63 до 66 ° F; от 290 до 292 К) |
| Точка кипения | 167 ° C (333 ° F; 440 К) при 10 мм рт. ст., 122 ° C/1 мм рт. ст. |
| смешиваемый | |
| Растворимость | Смешивается с метанолом , диэтиловым эфиром . Не смешивается с гексаном. |
| войти P | −2.424 [ 1 ] |
| Кислотность ( pKa ) | −1.9 [ 2 ] |
| Опасности | |
| СГС Маркировка : | |

| |
| Опасность | |
| H314 | |
| P260 , P264 , P280 , P301+P330+P331 , P303+P361+P353 , P304+P340 , P305+P351+P338 , P310 , P321 , P363 , P405 , P501 | |
| Паспорт безопасности (SDS) | Оксфордский паспорт безопасности материалов |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
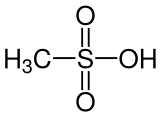
Метансульфоновая кислота ( MsOH ) или метансульфоновая кислота (в британском английском языке) представляет собой сероорганическую бесцветную жидкость с молекулярной формулой CH 3 SO 3 H и строение ЧАС 3 C - S(=O) 2 - ОН . Это простейшая из алкилсульфоновых кислот ( R-S(=O) 2 -OH ). Соли и эфиры метансульфоновой кислоты известны как мезилаты (или метансульфонаты, как в этилметансульфонате ). он гигроскопичен В концентрированной форме . Метансульфоновая кислота может растворять широкий спектр солей металлов, многие из которых находятся в значительно более высоких концентрациях, чем в соляной кислоте (HCl) или серной кислоте ( Н 2 SO 4 ). [ 3 ]
История и производство
[ редактировать ]Первое коммерческое производство MSA, разработанное в 1940-х годах компанией Oil of Indiana , было основано на окислении диметилсульфида O. Standard
2 из воздуха. Хотя этот процесс и недорогой, он страдает от низкого качества продукции и опасности взрыва.
В 1967 году корпорация Pennwalt (США) разработала другой процесс окисления диметилсульфида (в виде водной эмульсии) с использованием хлора с последующей экстракционной очисткой. В 2022 году этот процесс хлорокисления использовался только компанией Arkema (Франция) для производства МСА высокой чистоты. Этот процесс не популярен в больших масштабах, поскольку при нем производится большое количество соляной кислоты .
В период с 1970 по 2000 годы MSA использовался лишь в относительно небольших масштабах на нишевых рынках (например, в микроэлектронной и гальванической промышленности с 1980-х годов), что объяснялось главным образом его довольно высокой ценой и ограниченной доступностью. Однако ситуация изменилась примерно в 2003 году, когда компания BASF запустила коммерческое производство MSA в Людвигсхафене на основе модифицированной версии вышеупомянутого процесса окисления воздухом, при котором диметилдисульфид . окисляется азотной кислотой , а затем восстанавливается с помощью кислорода воздуха Первый производится в одну стадию из метанола газа синтез- , водорода и серы . [ 4 ]
Еще более совершенный (дешевый и экологически чистый) процесс получения метансульфокислоты разработала в 2016 году компания Grillo-Werke AG (Германия). Он основан на прямой реакции между метаном и олеумом при температуре около 50 °C и давлении 100 бар в присутствии инициатора персульфата калия . [ 5 ] Эта технология была приобретена и коммерциализирована BASF в 2019 году. [ 6 ]
Приложения
[ редактировать ]Начиная с ок. 2000 Метансульфоновая кислота стала популярной заменой других кислот во многих промышленных и лабораторных применениях, поскольку она:
- является сильной кислотой,
- имеет низкое давление пара (см. температуры кипения во вставке «Свойства»),
- не является окислителем или взрывчатым веществом, как азотная , серная или хлорная кислоты.
- представляет собой жидкость при комнатной температуре,
- растворим во многих органических растворителях,
- образует водорастворимые соли со всеми неорганическими катионами и с большинством органических катионов,
- не образует комплексов с ионами металлов в воде,
- его анион, мезилат , нетоксичен и подходит для фармацевтических препаратов.
Близкородственная п- толуолсульфоновая кислота (ПТСК) является твердой.
Метансульфоновую кислоту можно использовать для получения борана (BH 3 ) путем взаимодействия метансульфоновой кислоты с NaBH 4 в апротонном растворителе, таком как ТГФ или ДМСО комплекс BH 3 и растворителя. , при этом образуется [ 7 ]
Гальваника
[ редактировать ]Растворы метансульфоновой кислоты применяют для гальваники оловянными и оловянно-свинцовыми припоями. Он заменяет использование фторборной кислоты , которая выделяет едкий и летучий фторид водорода . [ 8 ]
Метансульфоновая кислота также является основным ингредиентом средств для удаления ржавчины и накипи. [ 9 ] Он используется для очистки поверхности ржавчины с керамики, плитки и фарфора, которые обычно подвержены воздействию кислоты.
См. также
[ редактировать ]- Трифторметансульфоновая кислота , более кислый аналог трифтора.
Ссылки
[ редактировать ]- ^ Таулер, Кристофер С.; Ли, Тонглей; Викстрем, Хокан; Ремик, Дэвид М.; Санчес-Феликс, Мануэль В.; Тейлор, Линн С. (декабрь 2008 г.). «Исследование влияния противоиона на свойства некоторых аморфных органических солей». Молекулярная фармацевтика . 5 (6): 946–955. дои : 10.1021/mp8000342 . ПМИД 19434850 .
- ^ Гатри, Дж. Питер (сентябрь 1978 г.). «Гидролиз эфиров оксикислот: значения pKa сильных для кислот; соотношение Бренстеда для атаки воды по метилу; свободные энергии гидролиза эфиров оксикислот; и линейная зависимость между свободной энергией гидролиза и удерживанием pKa в определенном диапазоне. 20 п К единиц» . Канадский химический журнал . 56 (17): 2342–2354. дои : 10.1139/v78-385 .
- ^ Гернон, доктор медицины; Ву, М.; Буста, Т.; Дженни, П. (1999). «Экологическая польза метансульфокислоты: сравнительные свойства и преимущества». Зеленая химия . 1 (3): 127–140. дои : 10.1039/a900157c .
- ^ Патент США 6531629B1 , Маттиас Эйерманн, Кристиан Трагут, Клаус Эбель, «Способ получения алкансульфоновой кислоты», выдан 11 марта 2003 г., передан BASF SE.
- ^ Лобри, Лиза Дж.; Белл, Алексис Т. (2001). «K 2 S 2 O 8 -Инициированное сульфирование метана в метансульфоновую кислоту». Индийский англ. хим. Рез . 40 (3): 736–742. дои : 10.1021/ie000725b .
- ^ Биннеманс, К.; Джонс, ПТ (2022). «Метансульфоновая кислота (МСК) в гидрометаллургии» . Журнал устойчивой металлургии . 20 . дои : 10.1007/s40831-022-00641-6 .
- ^ Лоббен, Пол К.; Люнг, Саймон Шун-Ван; Туммала, Шринивас (2004). «Комплексный подход к разработке и пониманию боранового восстановления карбоновой кислоты». Орг. Процесс Рез. Дев. 8 (6): 1072–1075. дои : 10.1021/op049910h .
- ^ Баладжи, Р.; Пушпаванам, Малати (2003). «Метансульфоновая кислота в гальванических отраслях отделки металлов». Операции МВФ . 81 (5): 154–158. дои : 10.1080/00202967.2003.11871526 . S2CID 91584456 .
- ^ «Архивная копия» (PDF) . Архивировано из оригинала (PDF) 4 марта 2016 г. Проверено 1 декабря 2015 г.
{{cite web}}: CS1 maint: архивная копия в заголовке ( ссылка )