Водород
 Пурпурное свечение в плазменном состоянии | ||||||||||||||||||||||||||
| Водород | ||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Появление | Бесцветный газ | |||||||||||||||||||||||||
| Стандартный атомный вес А р °(Н) | ||||||||||||||||||||||||||
| ||||||||||||||||||||||||||
| Водород в таблице Менделеева | ||||||||||||||||||||||||||
| ||||||||||||||||||||||||||
| Атомный номер ( Z ) | 1 | |||||||||||||||||||||||||
| Группа | группа 1: водород и щелочные металлы | |||||||||||||||||||||||||
| Период | период 1 | |||||||||||||||||||||||||
| Блокировать | S-блок | |||||||||||||||||||||||||
| Электронная конфигурация | 1 с 1 | |||||||||||||||||||||||||
| Электроны на оболочку | 1 | |||||||||||||||||||||||||
| Физические свойства | ||||||||||||||||||||||||||
| Фаза в СТП | газ | |||||||||||||||||||||||||
| Температура плавления | ( H 2 ) 13,99 К (-259,16 °С, -434,49 °F) | |||||||||||||||||||||||||
| Точка кипения | ( H 2 ) 20,271 К (-252,879 °С, -423,182 °F) | |||||||||||||||||||||||||
| Плотность (при СТП) | 0,08988 г/л | |||||||||||||||||||||||||
| в жидком состоянии (при температуре плавления ) | 0,07 г/см 3 (твердый: 0,0763 г/см 3 ) [3] | |||||||||||||||||||||||||
| в жидком состоянии (при температуре кипения ) | 0,07099 г/см 3 | |||||||||||||||||||||||||
| Тройная точка | 13,8033 К, 7,041 кПа | |||||||||||||||||||||||||
| Критическая точка | 32,938 К, 1,2858 МПа | |||||||||||||||||||||||||
| Теплота плавления | ( H 2 ) 0,117 кДж/моль | |||||||||||||||||||||||||
| Теплота испарения | ( H 2 ) 0,904 кДж/моль | |||||||||||||||||||||||||
| Молярная теплоемкость | ( H 2 ) 28,836 Дж/(моль·К) | |||||||||||||||||||||||||
Давление пара
| ||||||||||||||||||||||||||
| Атомные свойства | ||||||||||||||||||||||||||
| Стадии окисления | −1 , 0, +1 ( амфотерный оксид) | |||||||||||||||||||||||||
| Электроотрицательность | Шкала Полинга: 2,20. | |||||||||||||||||||||||||
| Энергии ионизации |
| |||||||||||||||||||||||||
| Ковалентный радиус | 31±5 вечера | |||||||||||||||||||||||||
| Радиус Ван-дер-Ваальса | 120 вечера | |||||||||||||||||||||||||
| Другие объекты недвижимости | ||||||||||||||||||||||||||
| Естественное явление | первобытный | |||||||||||||||||||||||||
| Кристаллическая структура | шестиугольный ( hP4 ) | |||||||||||||||||||||||||
| Константы решетки | а = 378,97 вечера c = 18:31 (в тройной точке) [4] | |||||||||||||||||||||||||
| Теплопроводность | 0,1805 Вт/(м⋅К) | |||||||||||||||||||||||||
| Магнитный заказ | диамагнитный [5] | |||||||||||||||||||||||||
| Молярная магнитная восприимчивость | −3.98 × 10 −6 см 3 /моль (298 К) [6] | |||||||||||||||||||||||||
| Скорость звука | 1310 м/с (газ, 27 °C) | |||||||||||||||||||||||||
| Номер CAS | 12385-13-6 1333-74-0 ( Н 2 ) | |||||||||||||||||||||||||
| История | ||||||||||||||||||||||||||
| Открытие | Генри Кавендиш [7] [8] (1766) | |||||||||||||||||||||||||
| Назван | Луи-Бернар Гайтон де Морво Антуан Лавуазье [9] [10] (1787) | |||||||||||||||||||||||||
| Изотопы водорода | ||||||||||||||||||||||||||
| ||||||||||||||||||||||||||
Водород — химический элемент ; он имеет символ H и атомный номер 1. Это самый легкий элемент и при стандартных условиях представляет собой газ двухатомных молекул с формулой H 2 , иногда называемый диводородом , [11] но чаще его называют газообразным водородом , молекулярным водородом или просто водородом. Он бесцветен, не имеет запаха, вкуса, [12] нетоксичный и очень горючий . Составляя примерно 75% всей нормальной материи , водород является самым распространенным химическим веществом во Вселенной . [13] [примечание 1] Звезды , включая Солнце , в основном состоят из водорода в состоянии плазмы , тогда как на Земле водород встречается в воде , органических соединениях , в виде диводорода и в других молекулярных формах . Самый распространенный изотоп водорода (обозначение 1 H) состоит из одного протона , одного электрона и не содержит нейтронов .
В ранней Вселенной образование протонов водорода произошло в первую секунду после Большого взрыва , а нейтральные атомы водорода образовались только примерно 370 000 лет спустя, в эпоху рекомбинации , когда Вселенная остыла, а плазма остыла достаточно, чтобы электроны оставались связанными с протонами. . [14] Водород, обычно неметаллический , за исключением экстремальных давлений , легко образует ковалентные связи с большинством неметаллов, способствуя образованию таких соединений, как вода и различные органические вещества. Его роль имеет решающее значение в кислотно-основных реакциях , которые преимущественно включают обмен протонов между растворимыми молекулами. В ионных соединениях водород может принимать форму либо отрицательно заряженного аниона , известного как гидрид , либо положительно заряженного катиона, обозначаемого символом H. + . Катион, просто протон (символ p ), демонстрирует специфическое поведение в водных растворах , а в ионных соединениях включает экранирование своего электрического заряда окружающими полярными молекулами или анионами. Уникальное положение водорода как единственного нейтрального атома, для которого уравнение Шредингера может быть решено напрямую, внесло значительный вклад в разработку основополагающих принципов квантовой механики посредством исследования его энергетики и химической связи . [15]
Исторически газообразный водород был впервые получен искусственно в начале 16 века путем реакции кислот с металлами. Генри Кавендиш между 1766 и 1781 годами определил газообразный водород как отдельное вещество. [16] и обнаружил его свойство производить воду при сжигании - отсюда и его название, происходящее от греческого «образующий воду».
Сегодня большая часть производства водорода происходит посредством паровой конверсии природного газа , а меньшая часть получается с помощью энергоемких методов, таких как электролиз воды . [17] [18] Его основные промышленные применения включают переработку ископаемого топлива , такую как гидрокрекинг , и производство аммиака , а также новые применения в топливных элементах для выработки электроэнергии и в качестве источника тепла. [19] При использовании в топливных элементах единственным выбросом водорода в месте использования является водяной пар. [19] хотя при горении могут образовываться оксиды азота . [19] Взаимодействие водорода с металлами может вызвать охрупчивание . [20]
Характеристики
Горение

Водород легко воспламеняется:
- 2 H 2 (г) + O 2 (г) → 2 H 2 O(л) (572 кДж/2 моль = 286 кДж/моль = 141,865 МДж/кг) [примечание 2]
Энтальпия сгорания составляет -286 кДж/моль. [21]
Водород образует с воздухом взрывоопасные смеси в концентрациях от 4 до 74 %. [22] и с хлором 5–95%. водорода Температура самовоспламенения , температура самовоспламенения на воздухе, составляет 500 °C (932 °F). [23]
Пламя
чистого водородно-кислородного газа Пламя излучает ультрафиолетовый свет и с высоким содержанием кислорода почти невидимо невооруженным глазом, о чем свидетельствует слабый шлейф главного двигателя космического корабля "Шаттл" , по сравнению с хорошо видимым шлейфом твердотопливного ракетного ускорителя космического корабля "Шаттл" , в котором используется композит на основе перхлората аммония . Для обнаружения утечки горящего водорода может потребоваться детектор пламени ; такие утечки могут быть очень опасны. Водородное пламя в других условиях имеет синий цвет, напоминающий синее пламя природного газа. [24] Гибель дирижабля « » Гинденбург была печально известным примером сгорания водорода, и причина которого до сих пор обсуждается. Видимое пламя на фотографиях возникло в результате сгорания соединений углерода в обшивке дирижабля. [25]
Реагенты
H 2 нереакционноспособен по сравнению с двухатомными элементами, такими как галогены или кислород. Термодинамической основой такой низкой реакционной способности является очень прочная связь H–H с энергией диссоциации связи 435,7 кДж/моль. [26] Кинетической основой низкой реакционной способности является неполярная природа H 2 и его слабая поляризуемость. Он самопроизвольно реагирует с хлором и фтором с образованием хлористого водорода и фторида водорода соответственно. [27] Реакционная способность На H 2 сильно влияет присутствие металлических катализаторов. Таким образом, хотя смеси Н 2 с O 2 или воздух легко воспламеняются при нагревании искрой или пламенем до температуры не менее 500 °C; они не реагируют при комнатной температуре в отсутствие катализатора.
Уровни энергии электронов

Уровень основного состояния энергии электрона в атоме водорода составляет -13,6 эВ , [28] что эквивалентно ультрафиолетовому фотону с длиной волны примерно 91 нм . [29]
Энергетические уровни водорода можно довольно точно рассчитать, используя модель атома Бора , которая концептуализирует электрон как «вращающийся вокруг» протона по аналогии с орбитой Земли относительно Солнца. Однако атомный электрон и протон удерживаются вместе электромагнитной силой , тогда как планеты и небесные объекты удерживаются гравитацией . Из-за дискретизации углового момента, постулированной Бором в ранней квантовой механике , электрон в модели Бора может занимать только определенные разрешенные расстояния от протона и, следовательно, только определенные разрешенные энергии. [30]
Более точное описание атома водорода можно получить с помощью чисто квантовомеханического подхода, который использует уравнение Шредингера , уравнение Дирака или Фейнмана формулировку интеграла по траекториям для расчета плотности вероятности движения электрона вокруг протона. [31] Самые сложные методы лечения учитывают небольшие эффекты специальной теории относительности и поляризации вакуума . В квантово-механической трактовке электрон в основном состоянии атома водорода вообще не имеет углового момента, что иллюстрирует, чем «планетарная орбита» отличается от движения электрона.
Спиновые изомеры
Молекулярный H 2 существует в виде двух спиновых изомеров , т.е. соединений, различающихся только спиновыми состояниями своих ядер. [32] В ортоводородной форме спины двух ядер параллельны, образуя спиновое триплетное состояние, имеющее общий молекулярный спин. ; в параводородной форме спины антипараллельны и образуют спин- синглетное состояние, имеющее спин . Равновесное соотношение орто- и параводорода зависит от температуры. При комнатной температуре или выше равновесный газообразный водород содержит около 25% пара-формы и 75% орто-формы. [33] Орто-форма представляет собой возбужденное состояние , имеющее более высокую энергию, чем пара-форма, на 1,455 кДж/моль. [34] и он превращается в пара-форму в течение нескольких минут при охлаждении до низкой температуры. [35] Термические свойства форм различаются, поскольку они различаются разрешенными вращательными квантовыми состояниями , что приводит к различным термическим свойствам, таким как теплоемкость. [36]
Отношение орто-пара в H 2 является важным фактором при сжижении и хранении жидкого водорода : превращение орто-водорода в пара является экзотермическим и выделяет достаточно тепла для испарения большей части жидкости, если он не преобразуется сначала в параводород в процессе охлаждения. [37] Катализаторы взаимного превращения орто-пара, такие как оксид железа и соединения активированного угля , используются во время охлаждения водородом, чтобы избежать потери жидкости. [38]
Фазы


- Газообразный водород
- Жидкий водород
- Твердый водород
- Металлический водород
- Плазменный водород
Соединения
Ковалентные и органические соединения
Пока H 2 не очень реакционноспособен в стандартных условиях, образует соединения с большинством элементов. Водород может образовывать соединения с более электроотрицательными элементами , такими как галогены (F, Cl, Br, I) или кислород ; в этих соединениях водород принимает частичный положительный заряд. [39] При соединении с более электроотрицательным элементом, особенно с фтором , кислородом или азотом , водород может участвовать в форме нековалентной связи средней прочности с другим электроотрицательным элементом с неподеленной парой. Это явление называется водородной связью и имеет решающее значение для стабильности многих элементов. биологические молекулы. [40] [41] Водород также образует соединения с менее электроотрицательными элементами, такими как металлы и металлоиды , где он принимает частичный отрицательный заряд. Эти соединения часто называют гидридами . [42]
Водород образует широкий спектр соединений с углеродом, называемых углеводородами , и еще более обширный набор соединений с гетероатомами , которые из-за их общей связи с живыми существами называются органическими соединениями . [43] Изучение их свойств известно как органическая химия. [44] и их изучение в контексте живых организмов известно как биохимия . [45] По некоторым определениям, «органические» соединения должны содержать только углерод. Однако большинство из них также содержат водород, и поскольку именно углерод-водородная связь придает этому классу соединений большую часть его особых химических характеристик, углерод-водородные связи необходимы в некоторых определениях слова «органический» в химии. [43] миллионы углеводородов Известны , и они обычно образуются сложными путями, в которых редко участвует элементарный водород.
Водород хорошо растворяется во многих редкоземельных и переходных металлах. [46] и растворим как в нанокристаллических, так и в аморфных металлах . [47] водорода На растворимость в металлах влияют местные искажения или примеси в кристаллической решетке . [48] Эти свойства могут быть полезны при очистке водорода путем пропускания через горячие палладиевые диски, но высокая растворимость газа представляет собой металлургическую проблему, способствующую охрупчиванию многих металлов. [20] усложнение конструкции трубопроводов и резервуаров для хранения. [49]
Гидриды

Соединения водорода часто называют гидридами , этот термин используется довольно широко. Термин «гидрид» предполагает, что атом H приобрел отрицательный или анионный характер, обозначаемый ЧАС − и используется, когда водород образует соединение с более электроположительным элементом. Существование гидрид -аниона , предложенное Гилбертом Н. Льюисом в 1916 году для солеподобных гидридов групп 1 и 2, было продемонстрировано Моерсом в 1920 году с помощью электролиза расплавленного гидрида лития (LiH), производящего стехиометрическое количество водорода при анод. [50] Для гидридов, отличных от металлов 1 и 2 групп, этот термин вводит в заблуждение, учитывая низкую электроотрицательность водорода. Исключением в гидридах 2-й группы являются BeH 2 , который является полимерным. В литийалюминийгидриде [АлХ 4 ] − анион несет гидридные центры, прочно связанные с Al(III).
Хотя гидриды могут образовываться почти со всеми элементами основной группы, количество и комбинация возможных соединений широко варьируются; например, известно более 100 бинарных гидридов борана, но только один бинарный гидрид алюминия. [51] Бинарный гидрид индия еще не идентифицирован, хотя существуют более крупные комплексы. [52]
В неорганической химии гидриды могут также служить мостиковыми лигандами , связывающими два металлических центра в координационный комплекс . Эта функция особенно распространена у элементов 13 группы , особенно в боранах ( гидридах бора ) и комплексах алюминия , а также в кластерных карборанах . [53]
Протоны и кислоты
Окисление водорода отрывает его электрон и дает ЧАС + , который не содержит электронов и имеет ядро , обычно состоящее из одного протона. Поэтому ЧАС + часто называют протоном. Этот вид занимает центральное место в обсуждении кислот . Согласно кислотно-основной теории Бренстеда-Лоури , кислоты являются донорами протонов, а основания - акцепторами протонов.
Голый протон, ЧАС + , не может существовать в растворе или в ионных кристаллах из-за его непреодолимого притяжения к другим атомам или молекулам с электронами. За исключением высоких температур, связанных с плазмой, такие протоны не могут быть удалены из электронных облаков атомов и молекул и останутся прикрепленными к ним. Однако термин «протон» иногда используется свободно и метафорически для обозначения положительно заряженного или катионного водорода, присоединенного таким образом к другим видам, и поэтому обозначается как «протон». ЧАС + «без всякого намека на то, что какие-либо отдельные протоны существуют свободно как вид.
Чтобы избежать присутствия голого «сольватированного протона» в растворе, иногда считают, что кислые водные растворы содержат менее маловероятные вымышленные частицы, называемые « ионом гидроксония » ( [ Н3О ] + ). Однако даже в этом случае такие сольватированные катионы водорода более реалистично рассматривать как организованные в кластеры, образующие виды, более близкие к [Н 9 О 4 ] + . [54] Другие ионы оксония обнаруживаются, когда вода находится в кислом растворе с другими растворителями. [55]
Несмотря на экзотику на Земле, одним из наиболее распространенных ионов во Вселенной является Ион H + 3 , известный как протонированный молекулярный водород или катион триводорода. [56]
изотопы



Водород имеет три встречающихся в природе изотопа, обозначаемых 1
Х , 2
Рука 3
Х. Другие, крайне нестабильные ядра ( 4
Ч до 7
H ) были синтезированы в лаборатории, но не наблюдались в природе. [57] [58]
- 1
H — наиболее распространенный изотоп водорода, его содержание превышает 99,98%. Поскольку ядро этого изотопа состоит только из одного протона, ему присвоено описательное, но редко используемое формальное название протий . [59] Он уникален среди всех стабильных изотопов тем, что не имеет нейтронов; см. дипротон , где обсуждается, почему другие не существуют. - 2
H , другой стабильный изотоп водорода, известен как дейтерий один протон и один нейтрон и содержит в ядре . Считается, что почти весь дейтерий во Вселенной был произведен во время Большого взрыва и существует с тех пор. Дейтерий не радиоактивен и не представляет значительной токсичной опасности. Вода, обогащенная молекулами, в состав которых входит дейтерий вместо обычного водорода, называется тяжелой водой . Дейтерий и его соединения используются в качестве нерадиоактивной метки в химических экспериментах и в растворителях. 1
H - ЯМР-спектроскопия . [60] Тяжелая вода используется в качестве замедлителя нейтронов и теплоносителя ядерных реакторов. Дейтерий также является потенциальным топливом для коммерческого ядерного синтеза . [61] - 3
H известен как тритий и содержит в своем ядре один протон и два нейтрона. Он радиоактивный, распадается на гелий-3 посредством бета-распада с периодом полураспада 12,32 года. [53] Он достаточно радиоактивен, чтобы его можно было использовать в светящейся краске для улучшения видимости отображаемых данных, например, для окраски стрелок и меток на циферблате часов. Стекло часов предотвращает выход небольшого количества радиации из корпуса. [62] Небольшие количества трития производятся естественным путем при взаимодействии космических лучей с атмосферными газами; тритий также выделялся во время испытаний ядерного оружия . [63] Он используется в реакциях ядерного синтеза, [64] как индикатор в изотопной геохимии , [65] и в специализированных осветительных устройствах с автономным питанием . [66] Тритий также использовался в экспериментах по химическому и биологическому мечению в качестве радиометки . [67]
Уникальный среди элементов, его изотопам, широко используемым сегодня, присвоены отдельные названия. Во время раннего изучения радиоактивности различным тяжелым радиоактивным изотопам были присвоены собственные названия, но такие названия больше не используются, за исключением дейтерия и трития. Символы D и T (вместо 2
Рука 3
H ) иногда используются для обозначения дейтерия и трития, но символ P уже используется для фосфора и поэтому недоступен для протия. [68] В своих номенклатурных рекомендациях Международный союз теоретической и прикладной химии (IUPAC) допускает любые из D, T, 2
Рука 3
H будет использоваться, хотя 2
Рука 3
H являются предпочтительными. [69]
Экзотический атом мюония (символ Mu), состоящий из антимюона и электрона , также можно считать легким радиоизотопом водорода. [70] Поскольку мюоны распадаются со временем жизни 2,2 мкс , мюоний слишком нестабилен, чтобы проявлять наблюдаемый химический состав. [71] Тем не менее, соединения мюония являются важными тестами для квантового моделирования из-за разницы масс между антимюоном и протоном. [72] а номенклатура ИЮПАК включает такие гипотетические соединения, как хлорид мюония (MuCl) и муонид натрия (NaMu), аналогичные хлористому водороду и гидриду натрия соответственно. [73]
Термические и физические свойства
Таблица теплофизических свойств водорода (H 2 ) при атмосферном давлении: [74] [75]
| Температура (К) | Плотность (кг/м^3) | Удельная теплоемкость (кДж/кг К) | Динамическая вязкость (кг/мс) | Кинематическая вязкость (м^2/с) | Теплопроводность (Вт/м·К) | Температуропроводность (м^2/с) | Число Прандтля |
История
Открытие и использование
Роберт Бойл

В 1671 году ирландский учёный Роберт Бойль открыл и описал реакцию между железными опилками и разбавленными кислотами , в результате которой образуется газообразный водород. [76] [77]
Приготовив соляной спирт [соляную кислоту], который необычным способом приготовления стал чрезвычайно острым и колющим, мы поместили во флакон, способный вместить три или четыре унции воды, удобное количество стальных опилок, которые были не такие, которые обычно продаются в магазинах химикам и аптекарям (которые обычно недостаточно свободны от ржавчины), а такие, которые у меня некоторое время назад были намеренно оторваны от куска хорошей стали. Этот металлический порошок смачивали в виоле небольшим количеством менструального средства, а затем пропитывали еще; после чего смесь стала очень горячей и изрыгнула обильные зловонные пары; Нет необходимости здесь обсуждать, состояли ли они целиком из летучей серы Марса [железа] или из металлических паров сернистой природы и соединялись с солевыми выделениями менструального цикла. Но откуда бы ни исходил этот вонючий дым, он был настолько огнеопасен, что при приближении к нему зажженной свечи он достаточно легко воспламенялся и горел дуновевшим и несколько зеленоватым пламенем у горловины виолы довольно долгое время вместе. ; и это, хотя и с небольшим количеством света, но с большей силой, чем можно было бы легко предположить.
- Роберт Бойль, Трактаты, написанные достопочтенным Робертом Бойлем, содержащие новые эксперименты, затрагивающие связь между пламенем и воздухом...
Слово «сернистый» может несколько сбить с толку, тем более что Бойль проделал аналогичный эксперимент с железом и серной кислотой. [78] Однако, по всей вероятности, под «сернистым» здесь следует понимать горючий . [79]
Генри Кавендиш
В 1766 году Генри Кавендиш был первым, кто признал газообразный водород как дискретное вещество, назвав газ, образующийся в результате реакции металла с кислотой, «горючим воздухом». Он предположил, что «горючий воздух» на самом деле идентичен гипотетическому веществу под названием « флогистон ». [80] [81] и дальнейшее открытие в 1781 году, что при сгорании газа образуется вода. Ему обычно приписывают открытие водорода как элемента. [7] [8]
Антуан Лавуазье

В 1783 году Антуан Лавуазье определил элемент, который стал известен как водород. [82] когда он и Лаплас воспроизвели открытие Кавендиша о том, что вода образуется при сжигании водорода. [8] Лавуазье получил водород для своих экспериментов по сохранению массы путем реакции потока пара с металлическим железом через раскаленную железную трубку, нагретую в огне. Анаэробное окисление железа протонами воды при высокой температуре схематически можно представить совокупностью следующих реакций:
- 1) Fe + H 2 O → FeO + H 2
- 2) Fe + 3 H 2 O → Fe 2 O 3 + 3 H 2
- 3) Fe + 4 H 2 O → Fe 3 O 4 + 4 H 2
Многие металлы, такие как цирконий, вступают в аналогичную реакцию с водой, приводящую к образованию водорода.
19 век
Франсуа Исаак де Риваз построил первый двигатель де Риваза , двигатель внутреннего сгорания, работающий на смеси водорода и кислорода, в 1806 году. Эдвард Дэниел Кларк изобрел паяльную трубку с газообразным водородом в 1819 году. Лампа Доберейнера и прожектор были изобретены в 1823 году. [8]
Водород был сжижен впервые Джеймсом Дьюаром в 1898 году с помощью регенеративного охлаждения и его изобретения — вакуумной колбы . [8] он произвел твердый водород . В следующем году [8]
Дирижабль на водороде

Первый воздушный шар, наполненный водородом, был изобретен Жаком Шарлем в 1783 году. [8] Водород обеспечил подъемную силу для первой надежной формы воздушного путешествия после изобретения Анри Жиффаром в 1852 году первого водородным дирижабля с подъемником . [8] Немецкий граф Фердинанд фон Цеппелин выдвинул идею жестких дирижаблей, поднимаемых на водороде, которые позже были названы цеппелинами ; первый из которых совершил первый полет в 1900 году. [8] Регулярные регулярные рейсы начались в 1910 году, а к началу Первой мировой войны в августе 1914 года они перевезли 35 000 пассажиров без серьезных происшествий. Во время войны дирижабли с водородными двигателями использовались в качестве наблюдательных платформ и бомбардировщиков.
Первый беспосадочный трансатлантический перелет совершил британский дирижабль R34 в 1919 году. Регулярные пассажирские перевозки возобновились в 1920-х годах, а открытие запасов гелия в США обещало повышение безопасности, но правительство США отказалось продавать газ для этой цели. . Поэтому, H 2 использовался на дирижабле «Гинденбург» , который был уничтожен в результате пожара в воздухе над Нью-Джерси 6 мая 1937 года. [8] Инцидент транслировался в прямом эфире по радио и был снят на видео. Широко распространено мнение, что причиной является возгорание вытекшего водорода, но более поздние исследования указали на возгорание алюминизированного тканевого покрытия из-за статического электричества . Но ущерб репутации водорода как подъемного газа уже был нанесен, и коммерческие полеты на водородных дирижаблях прекратились . Водород по-прежнему используется вместо негорючего, но более дорогого гелия в качестве подъемного газа для метеозондов .
Дейтерий и тритий
Дейтерий был открыт в декабре 1931 года Гарольдом Юри , а тритий был получен в 1934 году Эрнестом Резерфордом , Марком Олифантом и Полом Хартеком . [7] Тяжелая вода , состоящая из дейтерия вместо обычного водорода, была открыта группой Юри в 1932 году. [8]
Турбогенератор с водородным охлаждением
Первый турбогенератор с водородным охлаждением, был введен в эксплуатацию использующий газообразный водород в качестве хладагента в роторе и статоре, в 1937 году в Дейтоне , штат Огайо, компанией Dayton Power & Light Co.; [83] из-за теплопроводности и очень низкой вязкости газообразного водорода, что, следовательно, меньшее сопротивление, чем у воздуха, сегодня это наиболее распространенный тип в своей области для больших генераторов (обычно 60 МВт и больше; генераторы меньшего размера обычно имеют воздушное охлаждение ).
Никель-водородный аккумулятор
Никель -водородная батарея была впервые использована в 1977 году на борту спутника-2 навигационных технологий ВМС США (NTS-2). [84] Международная космическая станция , [85] Марс Одиссея [86] и Mars Global Surveyor [87] оснащены никель-водородными аккумуляторами. В темной части своей орбиты космический телескоп Хаббл также питается от никель-водородных батарей, которые были окончательно заменены в мае 2009 года. [88] более 19 лет после запуска и 13 лет после окончания расчетного срока службы. [89]
Роль в квантовой теории

Из-за своей простой атомной структуры, состоящей только из протона и электрона, атом водорода вместе со спектром света, производимого им или поглощаемого им, сыграл центральную роль в развитии теории атомного строения. [90] Кроме того, изучение соответствующей простоты молекулы водорода и соответствующего катиона H + 2 принес понимание природы химической связи , которое последовало вскоре после того, как в середине 1920-х годов была разработана квантово-механическая обработка атома водорода.
Одним из первых квантовых эффектов, которые были явно замечены (но в то время не были поняты), было наблюдение Максвелла с участием водорода, сделанное за полвека до появления полной квантовомеханической теории . Максвелл заметил, что теплоемкость удельная H 2 по необъяснимым причинам отличается от двухатомного газа при температуре ниже комнатной и начинает все больше напоминать одноатомный газ при криогенных температурах. Согласно квантовой теории, такое поведение возникает из-за расстояния между (квантованными) вращательными уровнями энергии, которые особенно широко разнесены в H 2 из-за своей малой массы. Эти широко расположенные уровни препятствуют равному распределению тепловой энергии во вращательное движение в водороде при низких температурах. Двухатомные газы, состоящие из более тяжелых атомов, не имеют таких широко расположенных уровней и не проявляют такого эффекта. [91]
Антиводород (
ЧАС
) является антивеществом, аналогом водорода. Он состоит из антипротона и позитрона . Антиводород - единственный тип атома антивещества, полученный по состоянию на 2015 год. [update]. [92] [93]
Космическое распространение и распространение

Hydrogen, as atomic H, is the most abundant chemical element in the universe, making up 75 percent of normal matter by mass and more than 90 percent by number of atoms. (Most of the mass of the universe, however, is not in the form of chemical-element type matter, but rather is postulated to occur as yet-undetected forms of mass such as dark matter and dark energy.[94])
Hydrogen is found in great abundance in stars and gas giant planets. Molecular clouds of H2 are associated with star formation. Hydrogen plays a vital role in powering stars through the proton-proton reaction in case of stars with very low to approximately 1 mass of the Sun and the CNO cycle of nuclear fusion in case of stars more massive than the Sun.[95]
States
Throughout the universe, hydrogen is mostly found in the atomic and plasma states, with properties quite distinct from those of molecular hydrogen. As a plasma, hydrogen's electron and proton are not bound together, resulting in very high electrical conductivity and high emissivity (producing the light from the Sun and other stars). The charged particles are highly influenced by magnetic and electric fields. For example, in the solar wind they interact with the Earth's magnetosphere giving rise to Birkeland currents and the aurora.
Hydrogen is found in the neutral atomic state in the interstellar medium because the atoms seldom collide and combine. They are the source of the 21-cm hydrogen line at 1420 MHz that is detected in order to probe primordial hydrogen.[96] The large amount of neutral hydrogen found in the damped Lyman-alpha systems is thought to dominate the cosmological baryonic density of the universe up to a redshift of z = 4.[97]
Under ordinary conditions on Earth, elemental hydrogen exists as the diatomic gas, H2. Hydrogen gas is very rare in the Earth's atmosphere (around 0.53 ppm on a molar basis[98]) because of its light weight, which enables it to escape from the atmosphere more rapidly than heavier gases. However, hydrogen is the third most abundant element on the Earth's surface,[99] mostly in the form of chemical compounds such as hydrocarbons and water.[53]
A molecular form called protonated molecular hydrogen (H+3) is found in the interstellar medium, where it is generated by ionization of molecular hydrogen from cosmic rays. This ion has also been observed in the upper atmosphere of the planet Jupiter. The ion is relatively stable in the environment of outer space due to the low temperature and density. H+3 is one of the most abundant ions in the universe, and it plays a notable role in the chemistry of the interstellar medium.[100] Neutral triatomic hydrogen H3 can exist only in an excited form and is unstable.[101] By contrast, the positive hydrogen molecular ion (H+2) is a rare molecule in the universe.
Production
Many methods exist for producing H2, but three dominate commercially: steam reforming often coupled to water-gas shift, partial oxidation of hydrocarbons, and water electrolysis.[102]
Steam reforming
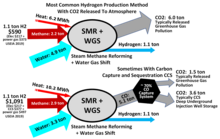
Hydrogen is mainly produced by steam methane reforming (SMR), the reaction of water and methane.[103][104] [105] Thus, at high temperatures (1000–1400 K, 700–1100 °C or 1300–2000 °F), steam (water vapor) reacts with methane to yield carbon monoxide and H2.
- CH4 + H2O → CO + 3 H2
Steam reforming is also used for the industrial preparation of ammonia.
This reaction is favored at low pressures, Nonetheless, conducted at high pressures (2.0 MPa, 20 atm or 600 inHg) because high-pressure H2 is the most marketable product, and pressure swing adsorption (PSA) purification systems work better at higher pressures. The product mixture is known as "synthesis gas" because it is often used directly for the production of methanol and many other compounds. Hydrocarbons other than methane can be used to produce synthesis gas with varying product ratios. One of the many complications to this highly optimized technology is the formation of coke or carbon:
- CH4 → C + 2 H2
Consequently, steam reforming typically employs an excess of H2O. Additional hydrogen can be recovered from the steam by use of carbon monoxide through the water gas shift reaction (WGS). This process requires an iron oxide catalyst:[105]
- CO + H2O → CO2 + H2
Hydrogen is sometimes produced and consumed in the same industrial process, without being separated. In the Haber process for the production of ammonia, hydrogen is generated from natural gas.[106]
Partial oxidation of hydrocarbons
Other methods for CO and H2 production include partial oxidation of hydrocarbons:[107]
- 2 CH4 + O2 → 2 CO + 4 H2
Although less important commercially, coal can serve as a prelude to the shift reaction above:[105]
- C + H2O → CO + H2
Olefin production units may produce substantial quantities of byproduct hydrogen particularly from cracking light feedstocks like ethane or propane.[108]
Water electrolysis

The electrolysis of water is a conceptually simple method of producing hydrogen.
- 2 H2O(l) → 2 H2(g) + O2(g)
Commercial electrolyzers use nickel-based catalysts in strongly alkaline solution. Platinum is a superior catalyst but is expensive.[109]
Electrolysis of brine to yield chlorine also produces hydrogen as a co-product.[110]
Methane pyrolysis
Hydrogen can be produced by pyrolysis of natural gas (methane).
Этот маршрут имеет меньший углеродный след, чем коммерческие процессы производства водорода. [111][112] [113] [114] Разработка коммерческого процесса пиролиза метана может ускорить расширение использования водорода в промышленности и транспорте. Пиролиз метана осуществляется путем пропускания метана через расплавленный металлический катализатор, содержащий растворенный никель . Метан преобразуется в газообразный водород и твердый углерод . [115] [116]
- CH 4 (г) → C(т) + 2 H 2 (г) (ΔH° = 74 кДж/моль)
Углерод может быть продан в качестве производственного сырья или топлива или выброшен на свалку.
Дальнейшие исследования продолжаются в нескольких лабораториях, в том числе в Лаборатории жидких металлов Карлсруэ. [117] и в Калифорнийском университете в Санта-Барбаре. [118] BASF построил пилотную установку пиролиза метана. [119]
Термохимический
можно использовать более 200 термохимических циклов Для расщепления воды . Многие из этих циклов, такие как цикл оксида железа , цикл оксида церия (IV)-оксида церия (III) , цикл цинк-цинк-оксид , цикл сера-йод , цикл медь-хлор и гибридный цикл серы , были оценены на предмет их коммерческого потенциала. производить водород и кислород из воды и тепла без использования электричества. [120] Ряд лабораторий (в том числе во Франции , Германии , Греции , Японии и США ) разрабатывают термохимические методы получения водорода из солнечной энергии и воды. [121]
Лабораторные методы
H 2 производится в лабораториях часто как побочный продукт других реакций. Многие металлы реагируют с водой с образованием H 2 , но скорость выделения водорода зависит от металла, pH и присутствия легирующих добавок. Чаще всего выделение водорода вызывают кислоты. Щелочные и щелочноземельные металлы, алюминий, цинк, марганец и железо легко реагируют с водными кислотами. Эта реакция лежит в основе аппарата Киппа , который когда-то использовался в качестве лабораторного источника газа:
- Цинк + 2 Н + → Цинк 2+ + Ч 2
В отсутствие кислоты происходит выделение H 2 медленнее. Поскольку железо является широко используемым конструкционным материалом, его анаэробная коррозия имеет технологическое значение:
- Fe + 2 H 2 O → Fe(OH) 2 + H 2
Многие металлы, такие как алюминий , медленно реагируют с водой, поскольку образуют пассивированные оксидные покрытия. Однако сплав алюминия и галлия реагирует с водой. [122] При высоком pH алюминий может производить Ч2 :
- 2 Аl + 6 Н 2 О + 2 ОН − → 2 [Ал(ОН) 4 ] − + 3 Ч 2
Некоторые металлосодержащие соединения реагируют с кислотами с выделением Н 2 . В анаэробных условиях гидроксид железа ( Fe(OH)
2 ) может окисляться протонами воды с образованием магнетита и Н 2 . Этот процесс описывается реакцией Шикорра :
- 3 Fe(OH) 2 → Fe 3 O 4 + 2 H 2 O + H 2
Этот процесс происходит при анаэробной коррозии железа и стали в бескислородных грунтовых водах и при восстановлении почв ниже уровня грунтовых вод .
Биоводород
H 2 вырабатывается ферментами гидрогеназами при некоторых ферментациях . [123]
Уэллс
Есть скважина в Мали и месторождения в ряде других стран, например, во Франции. [124]
Приложения

Нефтехимическая промышленность
Большое количество H 2 используются при «модернизации» ископаемого топлива . Ключевые потребители H 2 включают гидродесульфурацию и гидрокрекинг . Многие из этих реакций можно отнести к гидрогенолизу , т. е. разрыву связей водородом. Показательным является отделение серы из жидкого ископаемого топлива: [102]
- Р 2 С + 2 Ч 2 → Ч 2 С + 2 Правая
гидрирование
Гидрирование , добавление H 2 на различные подложки проводится в больших масштабах. Гидрирование N 2 для производства аммиака по процессу Габера-Боша потребляет несколько процентов энергетического бюджета всей отрасли. Полученный аммиак используется для обеспечения большей части белка, потребляемого человеком. [126] Гидрирование используется для преобразования ненасыщенных жиров и масел в насыщенные (транс) жиры и масла. Основное применение — производство маргарина . Метанол получают гидрированием углекислого газа. Это также источник водорода при производстве соляной кислоты . H 2 также используется в качестве восстановителя при превращении некоторых руд в металлы. [127]
охлаждающая жидкость
Водород обычно используется на электростанциях в качестве теплоносителя в генераторах благодаря ряду полезных свойств, которые являются прямым результатом его легких двухатомных молекул. К ним относятся низкая плотность , низкая вязкость и самая высокая удельная теплоемкость и теплопроводность среди всех газов.
Энергоноситель
Элементарный водород широко обсуждается в контексте энергетики как энергоноситель, способный помочь декарбонизации экономики и снижению выбросов парниковых газов. [128] [129] Поэтому для этого необходимо производить чистый водород в количествах, которые будут поставляться в сектора и приложения, где более дешевые и энергоэффективные альтернативы смягчения последствий ограничены. К ним относятся тяжелая промышленность и перевозки на дальние расстояния. [128] Водород является «носителем» энергии, а не энергетическим ресурсом, поскольку не существует природного источника водорода в полезных количествах. [130]
Водород можно использовать в качестве источника энергии в топливных элементах для производства электроэнергии или путем сжигания для выработки тепла. [19] Когда водород потребляется в топливных элементах, единственным выбросом в месте использования является водяной пар. [19] Сгорание водорода может привести к термическому образованию вредных оксидов азота . [19] Общие выбросы водорода в течение жизненного цикла зависят от того, как он производится. Почти весь нынешний мировой запас водорода создается из ископаемого топлива. [131] [132] Основным методом является паровая конверсия метана , при которой водород получается в результате химической реакции между паром и метаном , основным компонентом природного газа. При производстве одной тонны водорода с помощью этого процесса выделяется 6,6–9,3 тонны углекислого газа. [133] Хотя улавливание и хранение углерода (CCS) могло бы устранить значительную часть этих выбросов, общий углеродный след водорода из природного газа по состоянию на 2021 год оценить сложно. [update], отчасти из-за выбросов (включая выбрасываемый и неорганизованный метан ), образующихся при производстве самого природного газа. [134]
Электричество можно использовать для расщепления молекул воды и получения устойчивого водорода, при условии, что электричество вырабатывается экологически устойчивым способом. Однако этот процесс электролиза в настоящее время дороже, чем получение водорода из метана без CCS, а эффективность преобразования энергии по своей сути низка. [129] Водород можно производить, когда имеется избыток возобновляемой электроэнергии , а затем хранить и использовать для выработки тепла или для регенерации электроэнергии. [135] Водород, полученный посредством электролиза с использованием возобновляемых источников энергии, обычно называют « зеленым водородом ». [136] В дальнейшем его можно перерабатывать в синтетическое топливо, такое как аммиак и метанол . [137]
Инновации в области электролизеров водорода могут сделать крупномасштабное производство водорода из электроэнергии более конкурентоспособным. [138] Водород, производимый таким способом, может сыграть значительную роль в декарбонизации энергетических систем, где существуют проблемы и ограничения для замены ископаемого топлива прямым использованием электроэнергии. [128]
Водородное топливо может производить интенсивное тепло, необходимое для промышленного производства стали, цемента, стекла и химикатов, тем самым способствуя декарбонизации промышленности наряду с другими технологиями, такими как электродуговые печи для производства стали. [139] Однако он, вероятно, будет играть более важную роль в обеспечении промышленного сырья для более чистого производства аммиака и органических химикатов. [128] Например, в сталелитейном производстве водород может выступать в качестве экологически чистого энергоносителя, а также в качестве низкоуглеродного катализатора, заменяющего кокс, получаемый из угля . [140] Водород, используемый для декарбонизации транспорта, вероятно, найдет свое наибольшее применение в судоходстве, авиации и, в меньшей степени, в грузовых автомобилях за счет использования синтетического топлива, полученного из водорода, такого как аммиак и метанол , а также технологии топливных элементов. [128] Для транспортных средств малой грузоподъемности, включая легковые автомобили, водород значительно отстает от других транспортных средств на альтернативном топливе , особенно по сравнению с темпами внедрения аккумуляторных электромобилей , и может не играть существенной роли в будущем. [141]
К недостаткам водорода как энергоносителя относятся высокие затраты на хранение и распространение из-за взрывоопасности водорода, его большого объема по сравнению с другими видами топлива и склонности к хрупкости труб. [134]
Полупроводниковая промышленность
Водород используется для насыщения разорванных («оборванных») связей аморфного кремния и аморфного углерода , что помогает стабилизировать свойства материала. [142] Он также является потенциальным донором электронов в различных оксидных материалах, включая ZnO . [143] [144] SnO 2 , CdO , MgO , [145] ЗрО 2 , HfO 2 , Ла2О3 O3, Y 2 О 3 , ТиО 2 , СрТиО 3 , ЛаАлО3 , SiO 2 , Ал2О3 O3, ZrSiO 4 , HfSiO 4 и SrZrO3 . [146]
Ниша и развивающееся использование
- Защитный газ: Водород используется в качестве защитного газа в таких методах сварки , как сварка атомарным водородом . [147] [148]
- Криогенные исследования: Жидкость H 2 используется в криогенных исследованиях, в том числе в исследованиях сверхпроводимости . [149]
- Плавучий подъем: потому что H 2 легче воздуха, имея лишь 7% плотности воздуха, когда-то он широко использовался в качестве подъемного газа в воздушных шарах и дирижаблях . [150]
- Обнаружение утечек: Водород в чистом виде или в смеси с азотом (иногда называемым формовочным газом ) является индикаторным газом для обнаружения мельчайших утечек. Приложения можно найти в автомобильной, химической, энергетической, аэрокосмической и телекоммуникационной отраслях. [151] Водород является разрешенной пищевой добавкой (Е 949), которая позволяет проверять герметичность упаковки пищевых продуктов, а также обладает антиоксидантными свойствами. [152]
- Замедление нейтронов: Дейтерий (водород-2) используется в приложениях ядерного деления в качестве замедлителя для замедления нейтронов .
- Топливо для ядерного синтеза: Дейтерий используется в ядерного синтеза . реакциях [8]
- Изотопная маркировка. Соединения дейтерия находят применение в химии и биологии при изучении влияния изотопов на скорость реакций. [153]
- Ракетное топливо: жидкий водород и жидкий кислород вместе служат криогенным топливом в жидкостных ракетах , например, в главных двигателях космических шаттлов . НАСА исследовало использование ракетного топлива, изготовленного из атомарного водорода, бора или углерода, замороженного в твердые молекулярные частицы водорода, суспендированные в жидком гелии. При нагревании смесь испаряется, позволяя атомным частицам рекомбинироваться, нагревая смесь до высокой температуры. [154]
- Использование трития: Тритий (водород-3), производимый в ядерных реакторах , используется при производстве водородных бомб , [155] как изотопная метка в биологических науках, [67] и в качестве источника бета-излучения в радиолюминесцентной краске для циферблатов приборов и аварийных указателей. [62]
Биологические реакции
H 2 является продуктом некоторых типов анаэробного метаболизма и вырабатывается несколькими микроорганизмами , обычно в результате реакций катализируемых ферментами железо- или никельсодержащими , называемыми , гидрогеназами . Эти ферменты катализируют обратимую окислительно-восстановительную реакцию между H 2 и его составляющая два протона и два электрона. Образование газообразного водорода происходит при переносе восстанавливающих эквивалентов, образующихся при пируватном брожении , в воду. [156] Естественный цикл производства и потребления водорода организмами называется водородным циклом . [157] Бактерии, такие как Mycobacterium smegmatis, могут использовать небольшое количество водорода в атмосфере в качестве источника энергии, когда другие источники отсутствуют, используя гидрогеназу с небольшими каналами, которые исключают кислород и, таким образом, позволяют реакции происходить, даже если концентрация водорода очень низкая. а концентрация кислорода такая же, как в обычном воздухе. [98] [158]
Водород является наиболее распространенным элементом в человеческом организме по количеству атомов элемента, но третьим по распространенности элементом по массе. Н 2 появляется в дыхании человека вследствие метаболической активности гидрогеназосодержащих микроорганизмов в толстом кишечнике и является естественным компонентом газов . Концентрация в дыхании голодающих людей в состоянии покоя обычно составляет менее 5 частей на миллион (ppm), но может достигать 50 ppm, когда люди с кишечными расстройствами потребляют молекулы, которые они не могут усвоить во время диагностических водородных дыхательных тестов . [159]
Расщепление воды , при котором вода разлагается на составляющие ее протоны, электроны и кислород, происходит в световых реакциях у всех фотосинтезирующих организмов. Некоторые такие организмы, в том числе водоросли Chlamydomonas Reinhardtii и цианобактерии , развили вторую стадию темновых реакций , в которых протоны и электроны восстанавливаются с образованием Газ H 2 под действием специализированных гидрогеназ в хлоропластах . [160] Были предприняты усилия по генетической модификации цианобактериальных гидрогеназ для эффективного синтеза. Газ H 2 даже в присутствии кислорода. [161] Были также предприняты усилия по использованию генетически модифицированных водорослей в биореакторе . [162]
Безопасность и меры предосторожности
| Опасности | |
|---|---|
| СГС Маркировка : | |
 | |
| Опасность | |
| Н220 | |
| П202 , П210 , П271 , П377 , П381 , П403 [163] | |
| NFPA 704 (огненный алмаз) | |
Водород представляет ряд опасностей для безопасности человека: от возможных детонаций и пожаров при смешивании с воздухом до удушливого действия в чистой, бескислородной форме. [164] Кроме того, жидкий водород является криогеном и представляет опасность (например, обморожение ), связанную с очень холодными жидкостями. [165] Водород растворяется во многих металлах и помимо утечки может оказывать на них вредное воздействие, например, водородное охрупчивание . [166] что приводит к трещинам и взрывам. [167] Водород, попадающий в наружный воздух, может самовозгораться. Более того, водородный огонь, хотя и чрезвычайно горячий, практически невидим и поэтому может привести к случайным ожогам. [168]
Даже интерпретация данных по водороду (включая данные по безопасности) затруднена рядом явлений. Многие физические и химические свойства водорода зависят от соотношения параводород/ортоводород (при данной температуре часто требуются дни или недели для достижения равновесного соотношения, для которого обычно приводятся данные). Параметры детонации водорода, такие как критическое давление и температура детонации, сильно зависят от геометрии контейнера. [164]
См. также
- Водородная электростанция комбинированного цикла
- Водородная экономика . Использование водорода для декарбонизации секторов, которые трудно электрифицировать.
- Производство водорода – Промышленное производство молекулярного водорода
- Безопасность водорода . Процедуры безопасного производства, обращения и использования водорода.
- Водородные технологии - Технологии, связанные с производством и использованием водорода.
- Водородный транспорт
- Жидкий водород - жидкое состояние элемента водорода.
- Пиролиз метана – термическое разложение материалов. (для водорода).
- Природный водород - Молекулярный водород, встречающийся на Земле в природе.
- Пиролиз - Термическое разложение материалов.
Примечания
- ^ Однако большая часть массы Вселенной находится не в форме барионов или химических элементов. См. темную материю и темную энергию .
- ^ 286 кДж/моль: энергия на моль горючего материала (молекулярного водорода).
Ссылки
- ^ «Стандартные атомные массы: водород» . ЦИАВ . 2009.
- ^ Прохаска, Томас; Ирргехер, Йоханна; Бенефилд, Жаклин; Бёлке, Джон К.; Чессон, Лесли А.; Коплен, Тайлер Б.; Дин, Типинг; Данн, Филип Дж. Х.; Грёнинг, Манфред; Холден, Норман Э.; Мейер, Харро Эй Джей (4 мая 2022 г.). «Стандартные атомные веса элементов 2021 (Технический отчет ИЮПАК)» . Чистая и прикладная химия . дои : 10.1515/pac-2019-0603 . ISSN 1365-3075 .
- ^ Виберг, Эгон; Виберг, Нильс; Холлеман, Арнольд Фредерик (2001). Неорганическая химия . Академическая пресса. стр. 240. ISBN 978-0123526519 .
- ^ Арбластер, Джон В. (2018). Некоторые значения кристаллографических свойств элементов . Парк материалов, Огайо: ASM International. ISBN 978-1-62708-155-9 .
- ^ Лиде, Д.Р., изд. (2005). «Магнитная восприимчивость элементов и неорганических соединений». Справочник CRC по химии и физике (PDF) (86-е изд.). Бока-Ратон (Флорида): CRC Press. ISBN 978-0-8493-0486-6 .
- ^ Уэст, Роберт (1984). CRC, Справочник по химии и физике . Бока-Ратон, Флорида: Издательство компании Chemical Rubber Company. стр. E110. ISBN 978-0-8493-0464-4 .
- ^ Jump up to: Перейти обратно: а б с «Водород». Химическая энциклопедия Ван Ностранда . Уайли-Интерсайенс. 2005. стр. 797–799. ISBN 978-0-471-61525-5 .
- ^ Jump up to: Перейти обратно: а б с д и ж г час я дж к л Эмсли, Джон (2001). Строительные блоки природы . Оксфорд: Издательство Оксфордского университета. стр. 183–191. ISBN 978-0-19-850341-5 .
- ^ Мишковец, Павел (апрель 2023 г.). «Игра в имена: История наименований химических элементов — часть 1 — от древности до конца XVIII века» . Основы химии . 25 (1): 29–51. дои : 10.1007/s10698-022-09448-5 .
- ^ Ствертка, Альберт (1996). Руководство по элементам . Издательство Оксфордского университета. стр. 16–21. ISBN 978-0-19-508083-4 .
- ^ «Дигидроген» . O=CHem Каталог . Университет Южного Мэна . Архивировано из оригинала 13 февраля 2009 года . Проверено 6 апреля 2009 г.
- ^ «Водород» . Британская энциклопедия . Архивировано из оригинала 24 декабря 2021 года . Проверено 25 декабря 2021 г.
- ^ Бойд, Пади (19 июля 2014 г.). «Каков химический состав звезд?» . НАСА . Архивировано из оригинала 15 января 2015 года . Проверено 5 февраля 2008 г.
- ^ Танабаши, М.; и др. (2018). «Космология большого взрыва» (PDF) . Физический обзор D . 98 (3): 358. doi : 10.1103/PhysRevD.98.030001 . Архивировано (PDF) из оригинала 29 июня 2021 года - через группу данных о частицах Беркли Национальной лаборатории Лоуренса в .
Глава 21.4.1 - Это произошло, когда возраст Вселенной составлял около 370 000 лет.
(Пересмотрено в сентябре 2017 г.) Кейт А. Олив и Джон А. Пикок . - ^ Лаурсен, С.; Чанг, Дж.; Медлин, В.; Гюрмен, Н.; Фоглер, HS (27 июля 2004 г.). «Чрезвычайно краткое введение в вычислительную квантовую химию» . Молекулярное моделирование в химической технологии . Мичиганский университет. Архивировано из оригинала 20 мая 2015 года . Проверено 4 мая 2015 г.
- ^ Докладчик: профессор Джим Аль-Халили (21 января 2010 г.). «Открытие стихий» . Химия: изменчивая история . 25:40 минута. BBC . BBC Четыре . Архивировано из оригинала 25 января 2010 года . Проверено 9 февраля 2010 г.
- ^ Динсер, Ибрагим; Акар, Канан (14 сентября 2015 г.). «Обзор и оценка методов производства водорода для повышения устойчивости» . Международный журнал водородной энергетики . 40 (34): 11094–11111. Бибкод : 2015IJHE...4011094D . doi : 10.1016/j.ijhydene.2014.12.035 . ISSN 0360-3199 . Архивировано из оригинала 15 февраля 2022 года . Проверено 4 февраля 2022 г.
- ^ «Основы водорода – Производство» . Центр солнечной энергии Флориды . 2007. Архивировано из оригинала 18 февраля 2008 года . Проверено 5 февраля 2008 г.
- ^ Jump up to: Перейти обратно: а б с д и ж Льюис, Аластер К. (10 июня 2021 г.). «Оптимизация сопутствующих выгод от качества воздуха в водородной экономике: аргументы в пользу конкретных водородных стандартов выбросов NO x» . Наука об окружающей среде: Атмосфера . 1 (5): 201–207. дои : 10.1039/D1EA00037C . S2CID 236732702 .
 В эту статью включен текст из этого источника, доступного по лицензии CC BY 3.0 .
В эту статью включен текст из этого источника, доступного по лицензии CC BY 3.0 . - ^ Jump up to: Перейти обратно: а б Роджерс, ХК (1999). «Водородное охрупчивание металлов». Наука . 159 (3819): 1057–1064. Бибкод : 1968Sci...159.1057R . дои : 10.1126/science.159.3819.1057 . ПМИД 17775040 . S2CID 19429952 .
- ^ Комитет по альтернативам и стратегиям будущего производства и использования водорода (2004 г.). Водородная экономика: возможности, затраты, барьеры и потребности в исследованиях и разработках . Пресса национальных академий . п. 240. ИСБН 978-0-309-09163-3 . Архивировано из оригинала 29 января 2021 года . Проверено 3 сентября 2020 г.
- ^ Каркасси, Миннесота; Финески, Ф. (2005). «Дефлаграция бедных смесей H 2 –воздух и CH 4 –воздух в вентилируемой многокамерной среде». Энергия . 30 (8): 1439–1451. Бибкод : 2005Ene....30.1439C . дои : 10.1016/j.energy.2004.02.012 .
- ^ Патнаик, П. (2007). Комплексное руководство по опасным свойствам химических веществ . Уайли-Интерсайенс. п. 402. ИСБН 978-0-471-71458-3 . Архивировано из оригинала 26 января 2021 года . Проверено 3 сентября 2020 г.
- ^ Шефер, EW; Кулатилака, В.Д.; Паттерсон, Б.Д.; Сеттерстен, ТБ (июнь 2009 г.). «Видимое излучение водородного пламени» . Горение и пламя . 156 (6): 1234–1241. Бибкод : 2009CoFl..156.1234S . дои : 10.1016/j.combustflame.2009.01.011 . Архивировано из оригинала 29 января 2021 года . Проверено 30 июня 2019 г.
- ^ «Мифы о катастрофе Гинденбурга» . Дирижабли.нет . Архивировано из оригинала 20 апреля 2021 года . Проверено 29 марта 2021 г.
- ^ Лиде, Дэвид Р., изд. (2006). Справочник CRC по химии и физике (87-е изд.). Бока-Ратон, Флорида: CRC Press . ISBN 0-8493-0487-3 .
- ^ Клейтон, Д.Д. (2003). Справочник по изотопам в космосе: от водорода до галлия . Издательство Кембриджского университета . ISBN 978-0-521-82381-4 .
- ^ Лаборатории НААП (2009). «Уровни энергии» . Университет Небраски, Линкольн. Архивировано из оригинала 11 мая 2015 года . Проверено 20 мая 2015 г.
- ^ «длина волны фотона 13,6 эВ» . Вольфрам Альфа . 20 мая 2015 года. Архивировано из оригинала 12 мая 2016 года . Проверено 20 мая 2015 г.
- ^ Стерн, ДП (16 мая 2005 г.). «Атомное ядро и ранняя модель атома Бора» . Центр космических полетов имени Годдарда НАСА (зеркало). Архивировано из оригинала 17 октября 2008 года . Проверено 20 декабря 2007 г.
- ^ Стерн, Д.П. (13 февраля 2005 г.). «Волновая механика» . Центр космических полетов имени Годдарда НАСА. Архивировано из оригинала 13 мая 2008 года . Проверено 16 апреля 2008 г.
- ^ Персонал (2003). «Свойства, использование и применение водорода (H 2 ): газообразный водород и жидкий водород» . Universal Industrial Gases, Inc. Архивировано из оригинала 19 февраля 2008 года . Проверено 5 февраля 2008 г.
- ^ Грин, Ричард А.; и др. (2012). «Теория и практика гиперполяризации в магнитном резонансе с использованием параводорода » . Прог. Нукл. Магн. Резон. Спектроск . 67 : 1–48. Бибкод : 2012PNMRS..67....1G . дои : 10.1016/j.pnmrs.2012.03.001 . ПМИД 23101588 . Архивировано из оригинала 28 августа 2021 года . Проверено 28 августа 2021 г.
- ^ «Открытие параводорода» . Институт биофизической химии Макса Планка (на немецком языке). Архивировано из оригинала 16 ноября 2020 года . Проверено 9 ноября 2020 г.
- ^ Миленко, Ю. Я.; Сибилева Р.М.; Стржемечный, М.А. (1997). «Степень естественной орто-пара-конверсии в жидком и газообразном водороде». Журнал физики низких температур . 107 (1–2): 77–92. Бибкод : 1997JLTP..107...77M . дои : 10.1007/BF02396837 . S2CID 120832814 .
- ^ Хритц, Дж. (март 2006 г.). «Гл. 6 – Водород» (PDF) . Руководство по безопасности Гленна НАСА, Исследовательский центр Гленна, документ GRC-MQSA.001 . НАСА. Архивировано из оригинала (PDF) 16 февраля 2008 года . Проверено 5 февраля 2008 г.
- ^ Амос, Уэйд А. (1 ноября 1998 г.). «Затраты на хранение и транспортировку водорода» (PDF) . Национальная лаборатория возобновляемых источников энергии. стр. 6–9. Архивировано (PDF) из оригинала 26 декабря 2014 года . Проверено 19 мая 2015 г.
- ^ Свадленак, Р.Э.; Скотт, AB (1957). «Превращение орто- в параводород на железо-оксидных катализаторах». Журнал Американского химического общества . 79 (20): 5385–5388. дои : 10.1021/ja01577a013 .
- ^ Кларк, Дж. (2002). «Кислотность галогеноводородов» . Химгид . Архивировано из оригинала 20 февраля 2008 года . Проверено 9 марта 2008 г.
- ^ Кимбалл, JW (7 августа 2003 г.). «Водород» . Страницы биологии Кимбалла . Архивировано из оригинала 4 марта 2008 года . Проверено 4 марта 2008 г.
- ^ Сборник химической терминологии IUPAC, электронная версия, Водородная связь. Архивировано 19 марта 2008 г. в Wayback Machine.
- ^ Сандрок, Г. (2 мая 2002 г.). «Системы Металл-Водород» . Сандианские национальные лаборатории. Архивировано из оригинала 24 февраля 2008 года . Проверено 23 марта 2008 г.
- ^ Jump up to: Перейти обратно: а б «Структура и номенклатура углеводородов» . Университет Пердью. Архивировано из оригинала 11 июня 2012 года . Проверено 23 марта 2008 г.
- ^ «Органическая химия» . Словарь.com . Издательская группа Лексико. 2008. Архивировано из оригинала 18 апреля 2008 года . Проверено 23 марта 2008 г.
- ^ «Биохимия» . Словарь.com . Издательская группа Лексико. 2008. Архивировано из оригинала 29 марта 2008 года . Проверено 23 марта 2008 г.
- ^ Такешита, Т.; Уоллес, МЫ; Крейг, Р.С. (1974). «Растворимость водорода в соединениях иттрия или тория и никеля или кобальта 1:5». Неорганическая химия . 13 (9): 2282–2283. дои : 10.1021/ic50139a050 .
- ^ Кирххайм, Р.; Мучеле, Т.; Кинингер, В.; Глейтер, Х.; Бирринджер, Р.; Кобле, Т. (1988). «Водород в аморфных и нанокристаллических металлах». Материаловедение и инженерия . 99 (1–2): 457–462. дои : 10.1016/0025-5416(88)90377-1 .
- ^ Кирххайм, Р. (1988). «Растворимость и диффузия водорода в дефектных и аморфных металлах». Прогресс в материаловедении . 32 (4): 262–325. дои : 10.1016/0079-6425(88)90010-2 .
- ^ Кристенсен, Швейцария; Норсков, Дж. К.; Йоханнессен, Т. (9 июля 2005 г.). «Сделать общество независимым от ископаемого топлива – датские исследователи раскрывают новую технологию» . Технический университет Дании . Архивировано из оригинала 21 мая 2015 года . Проверено 19 мая 2015 г.
- ^ Моерс, К. (1920). «Исследования солевого характера гидрида лития» . Журнал неорганической и общей химии . 113 (191): 179–228. дои : 10.1002/zaac.19201130116 . Архивировано (PDF) из оригинала 24 августа 2019 г. Проверено 24 августа 2019 г.
- ^ Даунс, Эй Джей; Пулхэм, ЧР (1994). «Гидриды алюминия, галлия, индия и таллия: переоценка». Обзоры химического общества . 23 (3): 175–184. дои : 10.1039/CS9942300175 .
- ^ Хиббс, Делавэр; Джонс, К.; Смитис, Северная Каролина (1999). «Чрезвычайно стабильный комплекс тригидрида индия: синтез и характеристика [InH 3 P(C 6 H 11 ) 3 ]». Химические коммуникации (2): 185–186. дои : 10.1039/a809279f .
- ^ Jump up to: Перейти обратно: а б с Мисслер, Г.Л.; Тарр, Д.А. (2003). Неорганическая химия (3-е изд.). Прентис Холл. ISBN 978-0-13-035471-6 .
- ^ Окумура, AM; Да, ЛИ; Майерс, доктор медицинских наук; Ли, Ю.Т. (1990). «Инфракрасные спектры сольватированного иона гидроксония: колебательная предиссоциационная спектроскопия массово-селектированного H 3 O+•(H 2 O )n •(H 2 ) m ». Журнал физической химии . 94 (9): 3416–3427. дои : 10.1021/j100372a014 .
- ^ Пердонсин, Г.; Скоррано, Г. (1977). «Равновесия протонирования в воде при нескольких температурах спиртов, простых эфиров, ацетона, диметилсульфида и диметилсульфоксида». Журнал Американского химического общества . 99 (21): 6983–6986. дои : 10.1021/ja00463a035 .
- ^ Кэррингтон, А.; Макнаб, ИК (1989). «Инфракрасный спектр предиссоциации трехатомного катиона водорода (H 3 + )». Отчеты о химических исследованиях . 22 (6): 218–222. doi : 10.1021/ar00162a004 .
- ^ Gurov, Y. B.; Aleshkin, D. V.; Behr, M. N.; Lapushkin, S. V.; Morokhov, P. V.; Pechkurov, V. A.; Poroshin, N. O.; Sandukovsky, V. G.; Tel'kushev, M. V.; Chernyshev, B. A.; Tschurenkova, T. D. (2004). "Spectroscopy of superheavy hydrogen isotopes in stopped-pion absorption by nuclei". Physics of Atomic Nuclei . 68 (3): 491–97. Bibcode : 2005PAN....68..491G . doi : 10.1134/1.1891200 . S2CID 122902571 .
- ^ Коршенинников А.; Никольский Е.; Кузьмин Е.; Одзава, А.; Моримото, К.; Токанай, Ф.; Канунго, Р.; Танихата, И.; и др. (2003). «Экспериментальные доказательства существования 7 H и для конкретной структуры 8 He». Physical Review Letters . 90 (8): 082501. Bibcode : 2003PhRvL..90h2501K . doi : 10.1103/PhysRevLett.90.082501 . PMID 12633420 .
- ^ Юри, ХК; Брикведде, ФГ; Мерфи, генеральный директор (1933). «Названия изотопов водорода». Наука . 78 (2035): 602–603. Бибкод : 1933Sci....78..602U . дои : 10.1126/science.78.2035.602 . ПМИД 17797765 .
- ^ Ода, Ю.; Накамура, Х.; Ямадзаки, Т.; Нагаяма, К.; Ёсида, М.; Канайя, С.; Икехара, М. (1992). «Исследование 1H-ЯМР дейтерированной рибонуклеазы HI, избирательно меченной протонированными аминокислотами». Журнал биомолекулярного ЯМР . 2 (2): 137–47. дои : 10.1007/BF01875525 . ПМИД 1330130 . S2CID 28027551 .
- ^ Броуд, WJ (11 ноября 1991 г.). «Прорыв в области ядерного синтеза дает надежду на будущее» . Нью-Йорк Таймс . Архивировано из оригинала 29 января 2021 года . Проверено 12 февраля 2008 г.
- ^ Jump up to: Перейти обратно: а б Трауб, Р.Дж.; Дженсен, Дж. А. (июнь 1995 г.). «Тритиевые радиолюминесцентные устройства. Руководство по охране труда и технике безопасности» (PDF) . Международное агентство по атомной энергии. п. 2.4. Архивировано (PDF) из оригинала 6 сентября 2015 года . Проверено 20 мая 2015 г.
- ^ Персонал (15 ноября 2007 г.). «Тритий» . Агентство по охране окружающей среды США. Архивировано из оригинала 2 января 2008 года . Проверено 12 февраля 2008 г.
- ^ Нейв, Чехия (2006). «Дейтерий-тритиевый синтез» . Гиперфизика . Государственный университет Джорджии. Архивировано из оригинала 16 марта 2008 года . Проверено 8 марта 2008 г.
- ^ Кендалл, К.; Колдуэлл, Э. (1998). К. Кендалл; Джей Джей МакДоннелл (ред.). «Глава 2: Основы изотопной геохимии» . Изотопные индикаторы в гидрологии водосборных бассейнов . Геологическая служба США: 51–86. дои : 10.1016/B978-0-444-81546-0.50009-4 . Архивировано из оригинала 14 марта 2008 года . Проверено 8 марта 2008 г.
- ^ «Тритиевая лаборатория» . Университет Майами. 2008. Архивировано из оригинала 28 февраля 2008 года . Проверено 8 марта 2008 г.
- ^ Jump up to: Перейти обратно: а б Холте, А.Е.; Хоук, Массачусетс; Колли, Нидерланды (2004). «Потенциальная роль паразитизма в эволюции мутуализма у астигматидных клещей». Экспериментальная и прикладная акарология . 25 (2): 97–107. дои : 10.1023/A:1010655610575 . ПМИД 11513367 . S2CID 13159020 .
- ^ ван дер Крогт, П. (5 мая 2005 г.). «Водород» . Элементимология и элементы Multidict. Архивировано из оригинала 23 января 2010 года . Проверено 20 декабря 2010 г.
- ^ § IR-3.3.2, Предварительные рекомендации. Архивировано 9 февраля 2016 г. в Wayback Machine , Отдел номенклатуры неорганической химии, химической номенклатуры и представления структуры, ИЮПАК. Доступ онлайн 3 октября 2007 г.
- ^ ИЮПАК (1997). «Муоний» . В AD Макнот, А. Уилкинсон (ред.). Сборник химической терминологии (2-е изд.). Научные публикации Блэквелла . дои : 10.1351/goldbook.M04069 . ISBN 978-0-86542-684-9 . Архивировано из оригинала 13 марта 2008 года . Проверено 15 ноября 2016 г.
- ^ Фольксваген Хьюз; и др. (1960). «Образование мюония и наблюдение его ларморовской прецессии». Письма о физических отзывах . 5 (2): 63–65. Бибкод : 1960PhRvL...5...63H . дои : 10.1103/PhysRevLett.5.63 .
- ^ Бонди, Дания; Коннор, JNL; Манц, Дж.; Ремельт, Дж. (20 октября 1983 г.). «Точное квантовое и колебательно-адиабатическое квантовое, полуклассическое и квазиклассическое исследование коллинеарных реакций Cl + MuCl, Cl + HCl, Cl + DCl». Молекулярная физика . 50 (3): 467–488. Бибкод : 1983MolPh..50..467B . дои : 10.1080/00268978300102491 . ISSN 0026-8976 .
- ^ WH Коппенол; ИЮПАК (2001). «Названия атомов мюония и водорода и их ионов» (PDF) . Чистая и прикладная химия . 73 (2): 377–380. дои : 10.1351/pac200173020377 . S2CID 97138983 . Архивировано (PDF) из оригинала 14 мая 2011 года . Проверено 15 ноября 2016 г.
- ^ Холман, Джек П. (2002). Теплопередача (9-е изд.). Нью-Йорк, штат Нью-Йорк: МакГроу-Хилл. стр. 600–606. ISBN 0-07-240655-0 . OCLC 46959719 .
- ^ Инкропера, Фрэнк П .; Девитт, Дэвид П.; Бергман, Теодор Л.; Лавин, Адриенн С. (2007). Основы тепломассообмена (6-е изд.). Хобокен, Нью-Джерси: John Wiley and Sons, Inc., стр. 941–950. ISBN 978-0-471-45728-2 . OCLC 62532755 .
- ^ Бойль, Р. (1672). Трактаты, написанные достопочтенным Робертом Бойлем, содержащие новые эксперименты, затрагивающие связь между пламенем и воздухом, а также взрывы, гидростатический дискурс, вызванный некоторыми возражениями доктора Генри Мора против некоторых объяснений новых экспериментов, сделанных автором этих трактатов. : К которому прилагается гидростатическое письмо, поясняющее эксперимент о способе взвешивания воды в воде, новые эксперименты о положительной или относительной легкости тел под водой, о воздействии воздуха на тела под водой, о различии давление тяжелых твердых тел и жидкостей . Напечатано для Ричарда Дэвиса. стр. 64–65.
- ^ Зима, М. (2007). «Водород: исторические сведения» . WebElements Ltd. Архивировано из оригинала 10 апреля 2008 года . Проверено 5 февраля 2008 г.
- ^ Шидло, ЗА (2020). «Водород – некоторые исторические моменты» . Химия-Дидактика-Экология-Метрология . 25 (1–2): 5–34. doi : 10.2478/cdem-2020-0001 . S2CID 231776282 .
- ^ Рамзи, В. (1896). Газы атмосферы: История их открытия . Макмиллан. п. 19.
- ^ Масгрейв, А. (1976). «Почему кислород вытеснил флогистон? Исследовательские программы химической революции» . В Хаусоне, К. (ред.). Метод и оценка в физических науках . Критический фон современной науки, 1800–1905 гг. Издательство Кембриджского университета. дои : 10.1017/CBO9780511760013 . ISBN 978-0-521-21110-9 . Проверено 22 октября 2011 г.
- ^ Кавендиш, Генри (12 мая 1766 г.). «Три статьи, содержащие эксперименты с искусственным воздухом, достопочтенного Генри Кавендиша, FRS», «Философские труды » . 56 : 141–184. Бибкод : 1766RSPT...56..141C . дои : 10.1098/rstl.1766.0019 . JSTOR 105491 .
- ^ Ствертка, Альберт (1996). Руководство по элементам . Издательство Оксфордского университета. стр. 16–21 . ISBN 978-0-19-508083-4 .
- ^ Национальная ассоциация производителей электротехники (1946 г.). Хронологическая история развития электротехники с 600 г. до н.э. Нью-Йорк, штат Нью-Йорк, Национальная ассоциация производителей электрооборудования. п. 102. Архивировано из оригинала 4 марта 2016 года . Проверено 9 февраля 2016 г.
- ^ Стокель, Дж. Ф.; Джей Джей Данлоп; Бетц, Ф (1980). «Руководство никель-водородной батареи НТС-2 31». Журнал космических кораблей и ракет . 17 : 31–34. Бибкод : 1980JSpRo..17...31S . дои : 10.2514/3.57704 .
- ^ Джанетт, АГ; Хойницкий, Дж. С.; МакКиссок, Д.Б.; Финканнон, Дж.; Керслейк, ТВ; Родригес, CD (июль 2002 г.). Проверка модели электрических характеристик международной космической станции с помощью орбитальной телеметрии (PDF) . МЭКЕС '02. 2002 г. 37-я Межобщественная конференция по вопросам преобразования энергии, 2002 г. стр. 45–50. doi : 10.1109/IECEC.2002.1391972 . hdl : 2060/20020070612 . ISBN 0-7803-7296-4 . Архивировано (PDF) из оригинала 14 мая 2010 года . Проверено 11 ноября 2011 г.
- ^ Андерсон, премьер-министр; Койн, JW (2002). «Легкая, высоконадежная система питания с одной батареей для межпланетных космических кораблей». Материалы аэрокосмической конференции IEEE . Том. 5. С. 5–2433. дои : 10.1109/AERO.2002.1035418 . ISBN 978-0-7803-7231-3 . S2CID 108678345 .
- ^ «Глобальный исследователь Марса» . Astronautix.com. Архивировано из оригинала 10 августа 2009 года . Проверено 6 апреля 2009 г.
- ^ Лори Тяхла, изд. (7 мая 2009 г.). «Основы обслуживания миссии Хаббл 4» . НАСА. Архивировано из оригинала 13 марта 2015 года . Проверено 19 мая 2015 г.
- ^ Хендрикс, Сьюзен (25 ноября 2008 г.). Лори Тяхла (ред.). «Продление срока службы Хаббла с помощью новых батарей» . НАСА. Архивировано из оригинала 5 марта 2016 года . Проверено 19 мая 2015 г.
- ^ Крепо, Р. (1 января 2006 г.). Нильс Бор: Модель атома . Великие научные умы. ISBN 978-1-4298-0723-4 .
- ^ Берман, Р.; Кук, АХ; Хилл, RW (1956). «Криогеника». Ежегодный обзор физической химии . 7 :1–20. Бибкод : 1956ARPC....7....1B . дои : 10.1146/annurev.pc.07.100156.000245 .
- ^ Чарльтон, Майк; Ван дер Верф, Дирк Питер (1 марта 2015 г.). «Достижения физики антиводорода» . Научный прогресс . 98 (1): 34–62. дои : 10.3184/003685015X14234978376369 . ПМЦ 10365473 . ПМИД 25942774 . S2CID 23581065 .
- ^ Келлербауэр, Альбан (29 января 2015 г.). «Почему антивещество имеет значение». Европейский обзор . 23 (1): 45–56. дои : 10.1017/S1062798714000532 . S2CID 58906869 .
- ^ Ганьон, С. «Водород» . Джефферсонская лаборатория. Архивировано из оригинала 10 апреля 2008 года . Проверено 5 февраля 2008 г.
- ^ Хаубольд, Х.; Матай, AM (15 ноября 2007 г.). «Генерация солнечной термоядерной энергии» . Колумбийский университет . Архивировано из оригинала 11 декабря 2011 года . Проверено 12 февраля 2008 г.
- ^ «Водород» . mysite.du.edu . Архивировано из оригинала 18 апреля 2009 года . Проверено 20 апреля 2008 г.
- ^ Сторри-Ломбарди, LJ; Вульф, AM (2000). «Обзоры для z > 3 затухающих абсорбционных систем Лайман-альфа: эволюция нейтрального газа». Астрофизический журнал . 543 (2): 552–576. arXiv : astro-ph/0006044 . Бибкод : 2000ApJ...543..552S . дои : 10.1086/317138 . S2CID 120150880 .
- ^ Jump up to: Перейти обратно: а б Рис Гринтер; Кропп, А.; Венугопал; и др. (2023). «Структурные основы бактериального извлечения энергии из атмосферного водорода» . Природа . 615 (7952): 541–547. Бибкод : 2023Natur.615..541G . дои : 10.1038/s41586-023-05781-7 . ПМЦ 10017518 . ПМИД 36890228 .
- ^ Дрессельхаус, М. ; и др. (15 мая 2003 г.). «Потребности в фундаментальных исследованиях водородной экономики» (PDF) . Тезисы мартовского заседания APS . 2004 . Аргоннская национальная лаборатория, Министерство энергетики США, Научная лаборатория Управления: m1.001. Бибкод : 2004APS..MAR.m1001D . Архивировано из оригинала (PDF) 13 февраля 2008 года . Проверено 5 февраля 2008 г.
- ^ МакКолл Групп; Группа «Ока» (22 апреля 2005 г.). «Ресурсный центр H3+» . Университеты Иллинойса и Чикаго. Архивировано из оригинала 11 октября 2007 года . Проверено 5 февраля 2008 г.
- ^ Хельм, Х.; и др. (2003), «Связь связанных состояний с состояниями континуума в нейтральном трехатомном водороде», Диссоциативная рекомбинация молекулярных ионов с электронами , факультет молекулярной и оптической физики, Фрайбургский университет, Германия, стр. 275–288, doi : 10.1007/978 -1-4615-0083-4_27 , ISBN 978-1-4613-4915-0
- ^ Jump up to: Перейти обратно: а б Бааде, Уильям Ф.; Парех, Удай Н.; Раман, Венкат С. (2001). «Водород». Энциклопедия химической технологии Кирка-Отмера . дои : 10.1002/0471238961.0825041803262116.a01.pub2 . ISBN 9780471484943 .
- ^ Фрейермут, Джордж Х. «Патент 1934 г.: «Производство водорода из метановых углеводородов действием пара при повышенной температуре » . Патентные полнотекстовые базы данных . Ведомство США по патентам и товарным знакам. Архивировано из оригинала 1 октября 2021 года . Проверено 30 октября 2020 г. .
- ^ Пресс, Роман Дж.; Сантанам, КСВ; Мири, Массуд Дж.; Бейли, Алла В.; Такач, Джеральд А. (2008). Введение в водородную технологию . Джон Уайли и сыновья. п. 249. ИСБН 978-0-471-77985-8 .
- ^ Jump up to: Перейти обратно: а б с Окстоби, Д.В. (2002). Принципы современной химии (5-е изд.). Томсон Брукс/Коул. ISBN 978-0-03-035373-4 .
- ^ Фундербург, Э. (2008). «Почему цены на азот такие высокие?» . Благородный фонд Сэмюэля Робертса. Архивировано из оригинала 9 мая 2001 года . Проверено 11 марта 2008 г.
- ^ «Свойства, использование, применение водорода» . Universal Industrial Gases, Inc. 2007. Архивировано из оригинала 27 марта 2008 года . Проверено 11 марта 2008 г.
- ^ Ханнула, Илкка (2015). «Совместное производство синтетического топлива и централизованного теплоснабжения из остатков биомассы, углекислого газа и электроэнергии: анализ эффективности и затрат» . Биомасса и биоэнергетика . 74 : 26–46. Бибкод : 2015BmBe...74...26H . дои : 10.1016/j.biombioe.2015.01.006 . ISSN 0961-9534 .
- ^ Гонг, Мин, Ву; Цай, Чжоу, Цзиган; Гуань, Минг-Чан; Ван, Ди-Янь; Хван, Бинг-Джо; Дай, Хунцзе (2014). никеля/никеля для электрокатализа выделения активного водорода» Бибкод « Наноразмерные оксида гетероструктуры : 2014NatCo ...5.4695G . . . ; . PMID 25146255
- ^ Лиз, А. (2007). «Химия из соли» . Би-би-си. Архивировано из оригинала 26 октября 2007 года . Проверено 11 марта 2008 г.
- ^ Фон Вальд, Грегори А. (2020). «Оптимизационный технико-экономический анализ пиролиза метана в расплавленных средах для снижения выбросов CO2 в промышленности» . Устойчивая энергетика и топливо . 4 (9). Королевское химическое общество: 4598–4613. дои : 10.1039/D0SE00427H . S2CID 225676190 . Архивировано из оригинала 8 ноября 2020 года . Проверено 31 октября 2020 г.
- ^ Шнайдер, Стефан (2020). «Современное состояние производства водорода путем пиролиза природного газа» . ХимБиоИнж Обзоры . 7 (5). Интернет-библиотека Wiley: 150–158. дои : 10.1002/cben.202000014 .
- ^ Картрайт, Джон. «Реакция, которая навсегда даст нам чистое ископаемое топливо» . Новый учёный . Архивировано из оригинала 26 октября 2020 года . Проверено 30 октября 2020 г. .
- ^ Технологический институт Карлсруэ. «Водород из метана без выбросов CO2» . Физ.орг . Архивировано из оригинала 21 октября 2020 года . Проверено 30 октября 2020 г. .
- ^ Апэм, Д. Честер (2017). «Каталитические расплавленные металлы для прямой конверсии метана в водород и отделяемый углерод» . Наука . 358 (6365). Американская ассоциация развития науки: 917–921. Бибкод : 2017Sci...358..917U . дои : 10.1126/science.aao5023 . ПМИД 29146810 . S2CID 206663568 .
- ^ Кларк, Палмер (2020). «Сухой риформинг метана, катализируемый расплавленными металлическими сплавами» . Природный катализ . 3 : 83–89. дои : 10.1038/s41929-019-0416-2 . S2CID 210862772 . Архивировано из оригинала 29 января 2021 года . Проверено 31 октября 2020 г.
- ^ Гусев, Александр. «KITT/IASS – Производство водорода без CO2 из природного газа для использования в энергии» . Европейские энергетические инновации . Институт перспективных исследований в области устойчивого развития. Архивировано из оригинала 29 января 2021 года . Проверено 30 октября 2020 г. .
- ^ Фернандес, Соня. «Исследователи разрабатывают потенциально недорогую технологию с низким уровнем выбросов, которая может конвертировать метан без образования CO2» . Физ-орг . Американский институт физики. Архивировано из оригинала 19 октября 2020 года . Проверено 19 октября 2020 г.
- ^ БАСФ. «Исследователи BASF работают над принципиально новым, низкоуглеродистым процессом производства — пиролизом метана» . Устойчивое развитие США . БАСФ. Архивировано из оригинала 19 октября 2020 года . Проверено 19 октября 2020 г.
- ^ Веймер, Эл (25 мая 2005 г.). «Развитие термохимического производства водорода из воды на солнечной энергии» (PDF) . Проект солнечной термохимической генерации водорода. Архивировано (PDF) из оригинала 17 апреля 2007 г. Проверено 21 декабря 2008 г.
- ^ Перре, Р. «Развитие термохимического производства водорода из воды с помощью солнечной энергии, Водородная программа Министерства энергетики, 2007 г.» (PDF) . Архивировано из оригинала (PDF) 27 мая 2010 года . Проверено 17 мая 2008 г.
- ^ Пармузина А.В.; Кравченко О.В. (2008). «Активация металлического алюминия для выделения водорода из воды». Международный журнал водородной энергетики . 33 (12): 3073–3076. Бибкод : 2008IJHE...33.3073P . doi : 10.1016/j.ijhydene.2008.02.025 .
- ^ Любиц, Вольфганг; Рейерсе, Эдуард; Ван Гастель, Морис (2007). «[NiFe] и [FeFe] гидрогеназы, изученные с помощью передовых методов магнитного резонанса». Химические обзоры . 107 (10): 4331–4365. дои : 10.1021/cr050186q . ПМИД 17845059 .
- ^ «Природный водород: потенциальный источник чистой энергии под нашими ногами» . Йель E360 . Проверено 27 января 2024 г.
- ^ Барнард, Майкл (22 октября 2023 г.). «Что нового на ступенях водородной лестницы Либрайха?» . ЧистаяТехника . Проверено 10 марта 2024 г.
- ^ Смиль, Вацлав (2004). Обогащение Земли: Фриц Хабер, Карл Бош и трансформация мирового производства продуктов питания (1-е изд.). Кембридж, Массачусетс: Массачусетский технологический институт. ISBN 978-0-262-69313-4 .
- ^ Химические операции (15 декабря 2003 г.). «Водород» . Лос-Аламосская национальная лаборатория. Архивировано из оригинала 4 марта 2011 года . Проверено 5 февраля 2008 г.
- ^ Jump up to: Перейти обратно: а б с д и МГЭИК (2022 г.). Шукла, PR; Ски, Дж.; Слэйд, Р.; Аль Хурдаджи, А.; и др. (ред.). Изменение климата 2022: Смягчение последствий изменения климата (PDF) . Вклад Рабочей группы III в шестой оценочный доклад Межправительственной группы экспертов по изменению климата. Кембридж, Великобритания, и Нью-Йорк, штат Нью-Йорк, США: Издательство Кембриджского университета (в печати). стр. 91–92. дои : 10.1017/9781009157926 . ISBN 9781009157926 .
- ^ Jump up to: Перейти обратно: а б Эванс, Саймон; Габбатисс, Джош (30 ноября 2020 г.). «Углубленные вопросы и ответы: нужен ли миру водород для решения проблемы изменения климата?» . Карбоновое резюме . Архивировано из оригинала 1 декабря 2020 года . Проверено 1 декабря 2020 г.
- ^ Маккарти, Дж. (31 декабря 1995 г.). «Водород» . Стэнфордский университет . Архивировано из оригинала 14 марта 2008 года . Проверено 14 марта 2008 г.
- ^ Рид, Стэнли; Юинг, Джек (13 июля 2021 г.). «Водород — один из ответов на изменение климата. Получить его — трудная часть» . Нью-Йорк Таймс . ISSN 0362-4331 . Архивировано из оригинала 14 июля 2021 года . Проверено 14 июля 2021 г.
- ^ ИРЕНА (2019). Водород: перспективы возобновляемой энергетики (PDF) . п. 9. ISBN 978-92-9260-151-5 . Архивировано (PDF) из оригинала 29 сентября 2021 года . Проверено 17 октября 2021 г. .
- ^ Бонёр, Майк; Вандевалле, Лориен А.; Марин, Гай Б.; Ван Гим, Кевин М. (март 2021 г.). «Мечта или реальность? Электрификация химических производств» . Журнал КЭП . Американский институт инженеров-химиков . Архивировано из оригинала 17 июля 2021 года . Проверено 6 июля 2021 г.
- ^ Jump up to: Перейти обратно: а б Гриффитс, Стив; Совакул, Бенджамин К.; Ким, Джинсу; Базилиан, Морган; и др. (2021). «Промышленная декарбонизация с помощью водорода: критический и систематический обзор событий, социотехнических систем и вариантов политики» . Энергетические исследования и социальные науки . 80 : 39. Бибкод : 2021ERSS...8002208G . дои : 10.1016/j.erss.2021.102208 . ISSN 2214-6296 . Архивировано из оригинала 16 октября 2021 года . Проверено 11 сентября 2021 г.
- ^ Палис, Мэтью Дж.; Даутидис, Продромос (2020). «Использование водорода и аммиака для хранения возобновляемой энергии: географически комплексное технико-экономическое исследование» . Компьютеры и химическая инженерия . 136 : 106785. doi : 10.1016/j.compchemeng.2020.106785 . ISSN 0098-1354 .
- ^ «Водородная промышленность должна очиститься, прежде чем расширяться в новые…» . Канарские СМИ . 31 августа 2021 г. Проверено 5 апреля 2023 г.
- ^ ИРЕНА (2021). Перспективы мирового энергетического перехода: путь к повышению температуры на 1,5°C (PDF) . стр. 12, 22. ISBN. 978-92-9260-334-2 . Архивировано (PDF) из оригинала 11 июня 2021 года.
- ^ МЭА (2021 г.). Net Zero к 2050 году: дорожная карта для глобального энергетического сектора (PDF) . стр. 15, 75–76. Архивировано (PDF) из оригинала 23 мая 2021 года.
- ^ Чельберг-Моттон, Брендан (7 февраля 2022 г.). «Декарбонизация стали набирает обороты | Argus Media» . www.argusmedia.com . Проверено 7 сентября 2023 г.
- ^ Бланк, Томас; Молли, Патрик (январь 2020 г.). «Влияние декарбонизации водорода на промышленность» (PDF) . Институт Роки Маунтин . стр. 2, 7, 8. Архивировано (PDF) из оригинала 22 сентября 2020 года.
- ^ Плётц, Патрик (31 января 2022 г.). «Водородная технология вряд ли сыграет важную роль в устойчивом автомобильном транспорте» . Природная электроника . 5 (1): 8–10. дои : 10.1038/s41928-021-00706-6 . ISSN 2520-1131 . S2CID 246465284 .
- ^ Ле Комбер, разыгрывающий; Джонс, Д.И.; Копье, МЫ (1977). «Эффект Холла и примесная проводимость в аморфном кремнии, легированном замещением». Философский журнал . 35 (5): 1173–1187. Бибкод : 1977PMag...35.1173C . дои : 10.1080/14786437708232943 .
- ^ Ван де Валле, CG (2000). «Водород как причина легирования оксида цинка» (PDF) . Письма о физических отзывах . 85 (5): 1012–1015. Бибкод : 2000PhRvL..85.1012V . doi : 10.1103/PhysRevLett.85.1012 . hdl : 11858/00-001M-0000-0026-D0E6-E . ПМИД 10991462 . Архивировано (PDF) из оригинала 15 августа 2017 года . Проверено 1 августа 2018 г.
- ^ Джанотти, А.; Ван Де Валле, CG (2007). «Водородные многоцентровые связи». Природные материалы . 6 (1): 44–47. Бибкод : 2007NatMa...6...44J . дои : 10.1038/nmat1795 . ПМИД 17143265 .
- ^ Килич, К.; Зунгер, Алекс (2002). «Допирование оксидов n-типа водородом». Письма по прикладной физике . 81 (1): 73–75. Бибкод : 2002АпФЛ..81...73К . дои : 10.1063/1.1482783 . S2CID 96415065 .
- ^ Павлин, военнопленный; Робертсон, Дж. (2003). «Поведение водорода в оксидных изоляторах с высокой диэлектрической проницаемостью». Письма по прикладной физике . 83 (10): 2025–2027. Бибкод : 2003АпФЛ..83.2025П . дои : 10.1063/1.1609245 .
- ^ Дургутлу, А. (2003). «Экспериментальное исследование влияния водорода в аргоне как защитного газа на сварку TIG аустенитной нержавеющей стали». Материалы и дизайн . 25 (1): 19–23. дои : 10.1016/j.matdes.2003.07.004 .
- ^ «Атомноводородная сварка» . Специальные сварные швы. 2007. Архивировано из оригинала 16 июля 2011 года.
- ^ Харди, WN (2003). «От H2 к криогенным H-мазерам и сверхпроводникам HiTc: маловероятный, но полезный путь». Физика C: Сверхпроводимость . 388–389: 1–6. Бибкод : 2003PhyC..388....1H . дои : 10.1016/S0921-4534(02)02591-1 .
- ^ Альмквист, Эббе (2003). История промышленных газов . Нью-Йорк, штат Нью-Йорк: Издательство Kluwer Academic/Plenum. стр. 47–56. ISBN 978-0-306-47277-0 . Проверено 20 мая 2015 г.
- ^ Блок, М. (3 сентября 2004 г.). Водород как индикаторный газ для обнаружения утечек . 16-я ВКНДТ 2004 г. Монреаль, Канада: Sensistor Technologies. Архивировано из оригинала 8 января 2009 года . Проверено 25 марта 2008 г.
- ^ «Отчет Комиссии по потреблению пищевых добавок» (PDF) . Евросоюз . Архивировано (PDF) из оригинала 16 февраля 2008 г. Проверено 5 февраля 2008 г.
- ^ Рейнш, Дж.; Кац, А.; Уин, Дж.; Апраамян, Г.; МакФарланд, Дж. Т. (1980). «Влияние изотопа дейтерия на реакцию жирной ацил-КоА-дегидрогеназы и бутирил-КоА» . Ж. Биол. Хим . 255 (19): 9093–97. дои : 10.1016/S0021-9258(19)70531-6 . ПМИД 7410413 .
- ^ «NASA/TM—2002-211915: Эксперименты с твердым водородом для атомного топлива» (PDF) . Архивировано (PDF) из оригинала 9 июля 2021 года . Проверено 2 июля 2021 г.
- ^ Бержерон, К.Д. (2004). «Смерть отсутствия двойного использования» . Бюллетень ученых-атомщиков . 60 (1): 15–17. Бибкод : 2004БуАтС..60а..15Б . дои : 10.2968/060001004 . Архивировано из оригинала 19 апреля 2008 года . Проверено 13 апреля 2008 г.
- ^ Каммак, Р.; Робсон, Р.Л. (2001). Водород как топливо: чему учиться у природы . Taylor & Francisco Ltd., стр. 202–203. ISBN 978-0-415-24242-4 . Архивировано из оригинала 29 января 2021 года . Проверено 3 сентября 2020 г.
- ^ Ри, ТС; Бреннинкмейер, CAM; Рёкманн, Т. (19 мая 2006 г.). «Подавляющая роль почв в глобальном цикле водорода в атмосфере» (PDF) . Химия и физика атмосферы . 6 (6): 1611–1625. Бибкод : 2006ACP.....6.1611R . дои : 10.5194/acp-6-1611-2006 . Архивировано (PDF) из оригинала 24 августа 2019 г. Проверено 24 августа 2019 г.
- ^ Алекс Уилкинс (8 марта 2023 г.). «Фермент почвенных бактерий вырабатывает электричество из водорода в воздухе» . Новый учёный . 257 (3430): 13. Бибкод : 2023NewSc.257...13W . дои : 10.1016/S0262-4079(23)00459-1 . S2CID 257625443 .
- ^ Эйзенманн, Александр; Аманн, Антон; Саид, Майкл; Датта, Беттина; Ледоховский, Максимилиан (2008). «Проведение и интерпретация водородных дыхательных тестов» (PDF) . Журнал исследований дыхания . 2 (4): 046002. Бибкод : 2008JBR.....2d6002E . дои : 10.1088/1752-7155/2/4/046002 . ПМИД 21386189 . S2CID 31706721 . Архивировано из оригинала (PDF) 29 января 2021 года . Проверено 26 декабря 2020 г.
- ^ Крузе, О.; Рупрехт, Дж.; Бадер, К.; Томас-Холл, С.; Шенк, ПМ; Финацци, Г.; Ханкамер, Б. (2005). «Улучшение фотобиологического производства H 2 в сконструированных клетках зеленых водорослей» (PDF) . Журнал биологической химии . 280 (40): 34170–7. дои : 10.1074/jbc.M503840200 . ПМИД 16100118 . S2CID 5373909 . Архивировано (PDF) из оригинала 29 января 2021 года . Проверено 24 августа 2019 г.
- ^ Смит, Гамильтон О.; Сюй, Цин (2005). «IV.E.6 Водород из воды в новой рекомбинантной кислородтолерантной системе цианобактерий» (PDF) . Отчет о проделанной работе за 2005 финансовый год . Министерство энергетики США. Архивировано (PDF) из оригинала 29 декабря 2016 года . Проверено 6 августа 2016 г.
- ^ Уильямс, К. (24 февраля 2006 г.). «Жизнь в пруду: будущее энергетики» . Наука . Регистр. Архивировано из оригинала 9 мая 2011 года . Проверено 24 марта 2008 г.
- ^ «MyChem: Химия» (PDF) . Архивировано из оригинала (PDF) 1 октября 2018 года . Проверено 1 октября 2018 г.
- ^ Jump up to: Перейти обратно: а б Браун, WJ; и др. (1997). «Стандарт безопасности для водорода и водородных систем» (PDF) . НАСА . НСС 1740.16. Архивировано (PDF) из оригинала 1 мая 2017 года . Проверено 12 июля 2017 г. .
- ^ «Паспорт безопасности жидкого водорода» (PDF) . Praxair, Inc., сентябрь 2004 г. Архивировано из оригинала (PDF) 27 мая 2008 г. . Проверено 16 апреля 2008 г.
- ^ « Ошибки» и водородное охрупчивание». Новости науки . 128 (3): 41. 20 июля 1985 г. doi : 10.2307/3970088 . JSTOR 3970088 .
- ^ Хейс, Б. «Башня абсорбера аминов Union Oil» . ТВИ. Архивировано из оригинала 20 ноября 2008 года . Проверено 29 января 2010 г.
- ^ Уокер, Джеймс Л.; Уолтрип, Джон С.; Занкер, Адам (1988). «Отношения спроса и предложения молочной кислоты и магния» . У Джона Дж. МакКетты; Уильям Аарон Каннингем (ред.). Энциклопедия химической обработки и дизайна . Том. 28. Нью-Йорк: Деккер. п. 186. ИСБН 978-0-8247-2478-8 . Проверено 20 мая 2015 г.
Дальнейшее чтение
- Сверхтонкое расщепление водорода - Фейнмановские лекции по физике
- Таблица нуклидов (17-е изд.). Лаборатория атомной энергии Ноллса. 2010. ISBN 978-0-9843653-0-2 .
- Ньютон, Дэвид Э. (1994). Химические элементы . Нью-Йорк: Франклин Уоттс. ISBN 978-0-531-12501-4 .
- Ригден, Джон С. (2002). Водород: необходимый элемент . Кембридж, Массачусетс: Издательство Гарвардского университета. ISBN 978-0-531-12501-4 .
- Ромм, Джозеф Дж. (2004). Шумиха вокруг водорода: факты и вымыслы в гонке за спасение климата . Остров Пресс. ISBN 978-1-55963-703-9 .
- Шерри, Эрик (2007). Периодическая система, ее история и значение . Нью-Йорк: Издательство Оксфордского университета. ISBN 978-0-19-530573-9 .




