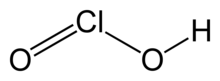
Хлористая кислота
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Хлористая кислота, Хлорная (III) кислота | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ЧЭБИ | |
| ХимическийПаук | |
| КЕГГ | |
ПабХим CID | |
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| HClO2 | |
| Молярная масса | 68.46 g/mol |
| Кислотность ( pKa ) | 1.96 |
| Сопряженная база | Хлорит |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Хлористая кислота – неорганическое соединение формулы HClO 2 . Это слабая кислота . хлор имеет степень окисления В этой кислоте +3. Чистое вещество нестабильно, диспропорционально хлорноватистой кислоте (степень окисления Cl +1) и хлорной кислоте (степень окисления Cl +5):
- 2 HClO 2 → HClO + HClO 3
Хотя кислоту трудно получить в чистом виде, сопряженное основание хлорит , полученное из этой кислоты, стабильно. Одним из примеров соли этого аниона является хорошо известный хлорит натрия . Эту и родственные соли иногда используют при производстве диоксида хлора .
Подготовка
[ редактировать ]HClO 2 можно получить реакцией хлорита бария или свинца и разбавленной серной кислоты :
- Ba(ClO 2 ) 2 + H 2 SO 4 → BaSO 4 + 2 HClO 2
- Pb(ClO 2 ) 2 + H 2 SO 4 → PbSO 4 + 2 HClO 2
Стабильность
[ редактировать ]Хлористая кислота является мощным окислителем, хотя ее склонность к диспропорционированию нейтрализует ее окислительный потенциал. [ нужна ссылка ]
Хлор является единственным галогеном , образующим изолируемую кислоту формулы HXO 2 . [1] Фтор сопротивляется окислению выше уровня гипофтористой кислоты . Ни бромистая, ни йодистая кислота никогда не были выделены. несколько солей бромистой кислоты Известно — бромитов, но не йодитов . [1]
Ссылки
[ редактировать ]![]() СМИ, связанные с хлористой кислотой, на Викискладе?
СМИ, связанные с хлористой кислотой, на Викискладе?
- ^ Jump up to: а б Эгон Виберг, Арнольд Фредерик Холлеман (2001) Неорганическая химия , Elsevier ISBN 0-12-352651-5