Тетрахлорид титана
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Хлорид титана(IV) | |
| Другие имена Тетрахлорид титана Тетрахлортитан | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ЧЭБИ | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.028.584 |
| Номер ЕС |
|
| МеШ | Титан+тетрахлорид |
ПабХим CID | |
| номер РТЭКС |
|
| НЕКОТОРЫЙ | |
| Число | 1838 |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| ТиСl 4 | |
| Молярная масса | 189.679 g/mol |
| Появление | Бесцветная жидкость |
| Запах | резкий запах кислоты |
| Плотность | 1,726 г/см 3 |
| Температура плавления | -24,1 ° C (-11,4 ° F; 249,1 К) |
| Точка кипения | 136,4 ° С (277,5 ° F; 409,5 К) |
| реагирует (экзотермический гидролиз) [1] | |
| Растворимость | растворим в дихлорметане , [2] толуол , [3] пентан [4] |
| Давление пара | 1,3 кПа (20 °С) |
| −54.0·10 −6 см 3 /моль | |
Показатель преломления ( n D ) | 1,61 (10,5 °С) |
| Вязкость | 827 мкПа·с |
| Структура | |
| четырехугольный | |
| Тетраэдрический | |
| 0 Д | |
| Термохимия | |
Стандартный моляр энтропия ( S ⦵ 298 ) | 355 Джмоль −1 ·К −1 [5] |
Стандартная энтальпия образование (Δ f H ⦵ 298 ) | −763 кДж·моль −1 [5] |
| Опасности [6] | |
| Безопасность и гигиена труда (OHS/OSH): | |
Основные опасности | Токсично, коррозийно, реагирует с водой с выделением HCl. |
| СГС Маркировка : | |
   | |
| Опасность | |
| Х314 , Х317 , Х330 , Х335 , Х370 , Х372 | |
| П280 , П301+П330+П331 , П304+П340 , П305+П351+П338 , П308+П310 | |
| NFPA 704 (огненный алмаз) | |
| Паспорт безопасности (SDS) | Паспорт безопасности |
| Родственные соединения | |
Другие анионы | Бромид титана(IV) Фторид титана(IV) Йодид титана(IV) |
Другие катионы | Хлорид гафния(IV) Хлорид циркония(IV) |
Родственные соединения | Хлорид титана(II) Хлорид титана(III) |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |

титана — неорганическое соединение формулы Тетрахлорид ТиСl 4 . Это важный промежуточный продукт в производстве металлического титана и пигмента диоксида титана . TiCl 4 — летучая жидкость. При контакте с влажным воздухом образует густые облака диоксида титана ( TiO 2 ) и соляной кислоты — реакция, которая ранее использовалась для использования в дымовых машинах. Его иногда называют «щекотать» или «щекотать 4», как фонетическое представление символов его молекулярной формулы ( TiCl4 ) . [7] [8]
Свойства и структура
[ редактировать ]TiCl 4 — плотная бесцветная жидкость, хотя сырые образцы могут быть желтого или даже красно-коричневого цвета. Это один из редких галогенидов переходных металлов, который при комнатной температуре представляет собой жидкость. VCl 4 является еще одним примером. Это свойство отражает тот факт, что молекулы TiCl 4 слабо самоассоциируется. Большинство хлоридов металлов представляют собой полимеры , в которых атомы хлорида образуют мостики между металлами. Его температура плавления аналогична температуре плавления ССl 4 . [9] [10]
Из 4+ имеет «замкнутую» электронную оболочку с таким же количеством электронов, как и у благородного газа аргона . Тетраэдрическая для структура TiCl 4 соответствует своему описанию как рекламный 0 металлический центр ( Из 4+ ) окружен четырьмя одинаковыми лигандами. Эта конфигурация приводит к высокосимметричным структурам, отсюда и тетраэдрическая форма молекулы. TiCl 4 имеет структуру, аналогичную ТиБр 4 и ТиI 4 ; эти три соединения имеют много общего. TiCl 4 и TiBr 4 реагирует с образованием смешанных галогенидов. TiCl 4− x Br x , где x = 0, 1, 2, 3, 4. Измерения магнитного резонанса также показывают, что обмен галогенидов также происходит быстро между TiCl 4 и ВКл 4 . [11]
TiCl 4 растворим в толуоле и хлоруглеродах . Некоторые арены образуют комплексы типа [(C 6 R 6 )TiCl 3 ] + . [12] TiCl 4 реагирует экзотермически с донорными растворителями, такими как ТГФ, с образованием гексакоординированных аддуктов . [13] Более объемные лиганды (L) дают пентакоординированные аддукты. ТиСl 4 л .
Производство
[ редактировать ]TiCl 4 производится хлоридным процессом , который включает восстановление оксида титана, обычно ильменита ( FeTiO 3 ) с углеродом в токе хлора при температуре 900 °C. Примеси удаляются перегонкой . [10]
- 2 FeTiO 3 + 7 Cl 2 + 6 C → 2 TiCl 4 + 2 FeCl 3 + 6 CO
Совместное производство FeCl 3 нежелателен, что послужило стимулом для разработки альтернативных технологий. Вместо непосредственного использования ильменита используется «рутиловый шлак». Этот материал, нечистая форма TiO 2 получают из ильменита путем удаления железа либо с помощью восстановления углерода, либо с помощью экстракции серной кислотой . сырой TiCl 4 содержит множество других летучих галогенидов, включая хлорид ванадила ( VOCl 3 ), тетрахлорид кремния ( SiCl 4 ) и тетрахлорид олова ( SnCl 4 ), который необходимо отделить. [10]
Приложения
[ редактировать ]Производство металлического титана
[ редактировать ]Мировые поставки металлического титана, около 250 000 тонн в год, производятся из ТиСl 4 . Конверсия включает восстановление тетрахлорида металлическим магнием . Эта процедура известна как процесс Кролла : [14]
- 2 Mg + TiCl 4 → 2 MgCl 2 + Ti
В процессе Хантера жидкий натрий . является восстановителем вместо магния [15]
Производство диоксида титана
[ редактировать ]Около 90% Производство TiCl 4 используется для получения пигмента диоксида титана ( ТиО 2 ). Превращение гидролиз включает TiCl 4 , процесс образования хлористого водорода : [14]
- TiCl 4 + 2 H 2 O → TiO 2 + 4 HCl
В некоторых случаях TiCl 4 окисляется непосредственно кислородом :
- TiCl 4 + O 2 → TiO 2 + 2 Cl 2
Дымовые завесы
[ редактировать ]Его использовали для создания дымовых завес, поскольку он производит густой белый дым, мало склонный подниматься вверх. «Щекотка» была стандартным средством создания эффектов дыма на съемочной площадке для кинофильмов, но в 1980-х годах от нее отказались из-за опасений по поводу воздействия гидратированной HCl на дыхательную систему. [16]
Химические реакции
[ редактировать ]Тетрахлорид титана — универсальный реагент, образующий разнообразные производные, в том числе показанные ниже. [17]
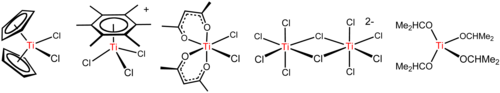
Алкоголиз и связанные с ним реакции
[ редактировать ]Характерная реакция TiCl 4 происходит его легкий гидролиз , о чем свидетельствует выделение HCl паров титана , а также оксидов и оксихлоридов . Тетрахлорид титана использовался для создания военно-морских дымовых завес , поскольку образующийся аэрозоль соляной кислоты и диоксид титана очень эффективно рассеивают свет. Однако этот дым едкий. [10]
Спирты реагируют с TiCl 4 дает алкоксиды формулы [Ti(OR) 4 ] n (R = алкил , n = 1, 2, 4). Как видно из их формулы, эти алкоксиды могут принимать сложные структуры, от мономеров до тетрамеров. Такие соединения полезны в материаловедении, а также в органическом синтезе . Хорошо известным производным является изопропоксид титана , который представляет собой мономер. Бис(ацетилацетонат)дихлорид титана получается в результате обработки тетрахлорида титана избытком ацетилацетона : [18]
Органические амины реагируют с TiCl 4 с образованием комплексов, содержащих амидо ( Р 2 Н − -содержащие) и имидо ( РН 2− -содержащие) комплексы. С аммиаком нитрид титана образуется . Показательной реакцией является синтез тетракис(диметиламидо)титана. Ti(N(CH 3 ) 2 ) 4 , желтая, растворимая в бензоле жидкость: [19] Эта молекула тетраэдрическая, с плоскими азотистыми центрами. [20]
- 4 LiN(CH 3 ) 2 + TiCl 4 → 4 LiCl + Ti(N(CH 3 ) 2 ) 4
Комплексы с простыми лигандами
[ редактировать ]TiCl 4 представляет собой кислоту Льюиса , о чем свидетельствует ее склонность к гидролизу . С эфиром ТГФ , TiCl 4 реагирует с образованием желтых кристаллов TiCl 4 (ТГФ) 2 . С хлоридными солями, TiCl 4 реагирует с образованием последовательно [Ти 2 Cl 9 ] − , [Ти 2 Cl 10 ] 2− (см. рисунок выше) и [ TiCl6 ] 2− . [21] Реакция хлорид-ионов с TiCl 4 зависит от противоиона. [N(CH 2 CH 2 CH 2 CH 3 ) 4 ]Cl и TiCl 4 дает пятикоординатный комплекс [N(CH 2 CH 2 CH 2 CH 3 ) 4 ][TiCl 5 ] , тогда как меньшие [Н(СН 2 СН 3 ) 4 ] + дает [N(CH 2 CH 3 ) 4 ] 2 [Ti 2 Cl 10 ] . Эти реакции подчеркивают влияние электростатики на структуру соединений с высокой ионной связью.
Редокс
[ редактировать ]Сокращение TiCl 4 с алюминием приводит к одноэлектронному восстановлению. Трихлорид ( TiCl 3 ) и тетрахлорид обладают контрастными свойствами: трихлорид представляет собой окрашенное твердое вещество, являющееся координационным полимером , и парамагнитен . При восстановлении в растворе ТГФ продукт Ti(III) превращается в голубой аддукт. TiCl 3 (ТГФ) 3 .
Металлоорганическая химия
[ редактировать ]Металлоорганическая химия титана обычно начинается с ТиСl 4 . Важная реакция включает циклопентадиенил натрия с образованием дихлорида титаноцена . TiCl 2 (C 5 H 5 ) 2 . Это соединение и многие его производные являются предшественниками катализаторов Циглера-Натта . Реактив Теббе , полезный в органической химии, представляет собой алюминийсодержащее производное титаноцена, образующееся в результате реакции дихлорида титаноцена с триметилалюминием . Его используют для реакций «олефинирования». [17]
Арены , такие как C 6 (CH 3 ) 6 реагирует с образованием комплексов рояль-табурет . [Ti(C 6 R 6 )Cl 3 ] + (Р = Н, СН 3 ; см. рисунок выше). Эта реакция иллюстрирует высокую кислотность Льюиса. Образец TiCl + 3 , который образуется при отщеплении хлорида от TiCl 4 от АлСl3 . [12]
Реагент в органическом синтезе
[ редактировать ]TiCl 4 время от времени находит применение в органическом синтезе , используя его кислотность по Льюису , оксофильность и свойства переноса электронов его восстановленных галогенидов титана. Он используется при катализируемом кислотой Льюиса . альдольном присоединении, [22] Ключом к этому приложению является тенденция TiCl 4 для активации альдегидов (RCHO) путем образования аддуктов, таких как (RCHO)TiCl 4 OC(H)R . [23]
Соображения токсичности и безопасности
[ редактировать ]Опасности, связанные с тетрахлоридом титана, обычно возникают из-за его реакции с водой, в результате которой выделяется соляная кислота , которая сама по себе является сильной коррозией и пары которой также чрезвычайно раздражают. TiCl 4 — сильная кислота Льюиса , которая экзотермически образует аддукты даже со слабыми основаниями, такими как ТГФ и вода.
Ссылки
[ редактировать ]- ^ Ерёменко Б.В.; Безуглая, Теннесси; Савицкая А.Н.; Малышева, М.Л.; Козлов И.С.; Богодист, Л.Г. (2001). «Стабильность водных дисперсий гидратированного диоксида титана, полученного гидролизом тетрахлорида титана». Коллоидный журнал . 63 (2): 173–178. дои : 10.1023/А:1016673605744 . S2CID 93971747 .
- ^ «хлорид титана(IV), 1М раствор в дихлорметане» . Альфа Айсар . Проверено 7 марта 2018 г.
- ^ «Раствор хлорида титана(IV) 1,0 М в толуоле» . Сигма-Олдрич . Проверено 7 марта 2018 г.
- ^ Баттс, Эдвард Х. Де. «патент US3021349A» .
- ^ Jump up to: а б Зумдал, Стивен С. (2009). Химические принципы (6-е изд.). Хоутон-Миффлин. п. А23. ISBN 978-0-618-94690-7 .
- ^ «Классификации – Опись КЛ» . echa.europa.eu .
- ^ [1] Архивировано 17 февраля 2013 г. в Wayback Machine Американском химическом совете - «Тетрахлорид титана: ступенька к удивительной технологии».
- ^ «Архивная копия» . Архивировано из оригинала 19 марта 2014 г. Проверено 10 апреля 2013 г.
{{cite web}}: CS1 maint: архивная копия в названии ( ссылка ) Университет штата Айова – «Паспорта безопасности химических материалов» - ^ Эрншоу, А.; Гринвуд, Н. (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн .
- ^ Jump up to: а б с д Хайнц Сибум; Фолькер Гютер; Оскар Ройдл; Фатхи Хабаши; Ханс Уве Вольф; Карстен Симерс (2017). «Титан, титановые сплавы и титановые соединения». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. стр. 1–35. дои : 10.1002/14356007.a27_095.pub2 . ISBN 978-3-527-30673-2 .
- ^ Уэбб, СП; Гордон, MS (1999). «Межмолекулярные самодействия тетрагалогенидов титана TiX 4 (X = F, Cl, Br)» . Дж. Ам. хим. Соц. 121 (11): 2552–2560. дои : 10.1021/ja983339i .
- ^ Jump up to: а б Кальдераццо, Ф.; Ферри, И.; Пампалони, Г.; Троянов, С. (1996). " η 6 -Ареновые производные титана (IV), циркония (IV) и гафния (IV)». J. Organomet. Chem . 518 (1–2): 189–196. doi : 10.1016/0022-328X (96) 06194-3 .
- ^ Манзер, Л.Е. (1982). «31. Тетрагтдрфурановые комплексы некоторых ранних переходных металлов». Неорганические синтезы . Том. 21. С. 135–40. дои : 10.1002/9780470132524.ch31 . ISBN 978-0-470-13252-4 .
- ^ Jump up to: а б Вёльц, Ганс Г.; и др. (2006). «Пигменты неорганические». Неорганические пигменты . Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.n20_n04 . ISBN 978-3-527-30673-2 .
- ^ Шашке, Карл (2014). «Охотничий процесс». Словарь химической инженерии . Издательство Оксфордского университета. doi : 10.1093/acref/9780199651450.001.0001 . ISBN 978-0-19-965145-0 .
- ^ Королевский флот на войне (DVD). Лондон: Имперский военный музей . 2005.
- ^ Jump up to: а б «Титанорганические реагенты в органическом синтезе (концепции реакционной способности и структуры в органической химии, том 24)» Манфред Т. Ритц, 1986 г. ISBN 0-387-15784-0
- ^ Уилки, Калифорния; Лин, Г.; Хаворт, DT (1979). « Цисс- [дигалобис(2,4-пентаэдионато)титан(IV)] комплексы». Неорганические синтезы . Том. 19. С. 145–148. дои : 10.1002/9780470132500.ch33 . ISBN 978-0-470-13250-0 .
{{cite book}}:|journal=игнорируется ( помогите ) - ^ Брейди, округ Колумбия; Томас, М. (1960). «Некоторые диалкиламинопроизводные титана и циркония». Дж. Хим. Соц. : 3857–3861. дои : 10.1039/JR9600003857 .
- ^ Я Дэви; Т. Ферстер; С. Парсонс; К. Пулэм; DWH Рэнкин; Бакалавр Смарт (2006). «Кристаллическая структура тетракис (диметиламино) титана (IV)». Многогранник . 25 (4): 923–929. дои : 10.1016/j.poly.2005.10.019 .
- ^ Кризер, CS; Крейтон, Дж. А. (1975). «Ионы пентахлор- и пентабромтитаната (IV)». Далтон Транс. (14): 1402–1405. дои : 10.1039/DT9750001402 .
- ^ Мариаппан Периасами (2002): «Новые методы синтеза с использованием системы реагентов TiCl4-NR3», Arkivoc , стр. 151-166.
- ^ Гундерсен, Л.-Л.; Райз, Ф.; Ундхейм, К. (2004). «Хлорид титана (IV)». В Пакетте, Л. (ред.). Энциклопедия реагентов для органического синтеза . Нью-Йорк, штат Нью-Йорк: Дж. Уайли и сыновья.
Общее чтение
[ редактировать ]- Холлеман, А.Ф.; Виберг, Э. (2001). Неорганическая химия . Сан-Диего, Калифорния: Academic Press. ISBN 978-0-12-352651-9 .
- Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8 .
