Хлорид церия(III)
 | |||
| |||
| Имена | |||
|---|---|---|---|
| ИЮПАК имена Хлорид церия(III) трихлорид церия | |||
| Другие имена Хлорид церия | |||
| Идентификаторы | |||
| |||
3D model ( JSmol ) | |||
| ЧЭБИ | |||
| ХимическийПаук | |||
| Информационная карта ECHA | 100.029.298 | ||
| Номер ЕС |
| ||
| 1828 | |||
ПабХим CID | |||
| НЕКОТОРЫЙ |
| ||
Панель управления CompTox ( EPA ) | |||
| Характеристики | |||
| СеСl 3 | |||
| Молярная масса | 246,48 г/моль (безводный) 372,58 г/моль (гептагидрат) | ||
| Появление | мелкий белый порошок | ||
| Плотность | 3,97 г/см 3 | ||
| Температура плавления | 817 ° C (1503 ° F; 1090 К) (безводный) 90 °C (гептагидрат, разлагается) | ||
| Точка кипения | 1727 ° C (3141 ° F; 2000 К) | ||
| Растворимость | растворим в спирте | ||
| +2490.0·10 −6 см 3 /моль | |||
| Структура | |||
| шестиугольный ( UCl 3 тип ), hP8 | |||
| Р6 3 /м, №176 | |||
| Треугольная треугольная призматика (девятикоординатный) | |||
| Опасности | |||
| СГС Маркировка : | |||
   | |||
| Опасность | |||
| Х315 , Х318 , Х319 , Х335 , Х410 | |||
| P261 , P264 , P271 , P273 , P280 , P302+P352 , P304+P340 , P305+P351+P338 , P310 , P312 , P321 , P332+P313 , P337+P313 , P362 , P391 , 3+П233 , П405 , П501 | |||
| точка возгорания | Невоспламеняющийся | ||
| Родственные соединения | |||
Другие анионы | Оксид церия(III) Фторид церия(III) Бромид церия(III) Йодид церия(III) | ||
Другие катионы | Хлорид лантана(III) Хлорид празеодима(III) | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Хлорид церия(III) (CeCl 3 ), также известный как хлорид церия или трихлорид церия, представляет собой соединение церия и хлора . Это белая гигроскопичная соль; он быстро поглощает воду при воздействии влажного воздуха с образованием гидрата , который имеет переменный состав, [1] гептагидрат CeCl 3 ·7H 2 хотя известен O. Он хорошо растворим в воде и (в безводном состоянии) растворим в этаноле и ацетоне . [2]
Получение безводного CeCl 3
[ редактировать ]Простое быстрое нагревание гидрата само по себе может вызвать небольшой гидролиз . [3]
Полезную форму безводного CeCl 3 можно получить, если позаботиться о постепенном нагревании гептагидрата до 140 °C (284 °F) в течение многих часов под вакуумом. [2] [4] [5] Он может содержать или не содержать немного CeOCl в результате гидролиза , но пригоден для использования с литийорганическими реактивами и реактивами Гриньяра . Чистый безводный CeCl 3 можно получить путем дегидратации гидрата либо путем медленного нагревания до 400 °C (752 °F) с 4–6 эквивалентами хлорида аммония в высоком вакууме, [3] [6] [7] [8] или нагреванием с избытком тионилхлорида в течение трех часов. [3] [9] Безводный галогенид альтернативно может быть получен из металлического церия и хлористого водорода . [10] [11] Обычно его очищают высокотемпературной сублимацией в высоком вакууме. Экстракция Сокслета CeCl 3 с этим дает CeCl 3 (thf) 1,04 . [12]
Использование
[ редактировать ]Хлорид церия (III) можно использовать в качестве отправной точки для получения других церия солей , таких как кислоты Льюиса трифторметансульфонат церия (III) . [13]
Органический синтез
[ редактировать ]Хлорид церия (III) является реагентом в нескольких процедурах, используемых в органическом синтезе. [14] уменьшение луче [15] Альфа-, бета-ненасыщенных карбонильных соединений стал популярным методом в органическом синтезе , где CeCl 3 ·7H 2 O используется в сочетании с боргидридом натрия . Например, карвон дает только аллиловый спирт 1 и не дает ни одного насыщенного спирта 2 . Без CeCl 3 смесь 1 и 2 образуется .
Он также может снимать защиту группы МЕМ от спирта в присутствии других ацетальных защитных групп (например, THP ).
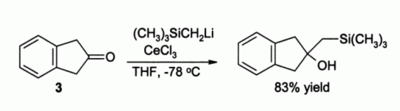
Еще одним важным применением в органическом синтезе является алкилирование кетонов , которые в противном случае образовали бы еноляты, простые литийорганические реагенты если бы использовались . Например, можно было бы ожидать, что соединение 3 просто образует енолят без присутствия CeCl 3 , но в присутствии CeCl 3 происходит плавное алкилирование: [4]
Сообщается, что литийорганические реагенты действуют в этой реакции более эффективно, чем реактивы Гриньяра . [4]
Ссылки
[ редактировать ]- ^ Некоторые крупные производители, такие как «Альфа» и «Стрем», указывают свою продукцию просто как «гидрат» с « x H 2 O» в формуле, но Aldrich продает гептагидрат.
- ^ Jump up to: а б Пакетт, Луизиана (1999). Коутс, Р.М.; Дания, ЮВ (ред.). Справочник реагентов для органического синтеза: реагенты, вспомогательные вещества и катализаторы для образования CC-связей . Нью-Йорк: Уайли. ISBN 0-471-97924-4 .
- ^ Jump up to: а б с Эдельманн, FT; Поремба, П. (1997). Херрманн, Вашингтон (ред.). Синтетические методы металлоорганической и неорганической химии . Том. VI. Штутгарт: Георг Тиме Верлаг. ISBN 3-13-103021-6 .
- ^ Jump up to: а б с Джонсон, ЧР; Тейт, Б.Д. (1987). «Модификация реакции Петерсона на церий (III): метиленирование легко енолизируемых карбонильных соединений». Журнал органической химии . 52 (2): 281–283. дои : 10.1021/jo00378a024 . ISSN 0022-3263 .
- ^ Димитров Владимир; Костова, Калина; Генов, Мирослав (1996). «Безводный хлорид церия (III). Влияние процесса сушки на активность и эффективность». Буквы тетраэдра . 37 (37): 6787–6790. дои : 10.1016/S0040-4039(96)01479-7 .
- ^ Тейлор, доктор медицины; Картер, ПК (1962). «Получение безводных галогенидов лантаноидов, особенно йодидов». Журнал неорганической и ядерной химии . 24 (4): 387–391. дои : 10.1016/0022-1902(62)80034-7 .
- ^ Кучер, Дж.; Шнайдер, А. (1971). «Примечание о получении безводных галогенидов лантаноидов, особенно йодидов». Неорг. Нукл. Хим . 7 (9): 815. дои : 10.1016/0020-1650(71)80253-2 .
- ^ Гринвуд, штат Нью-Йорк; Эрншоу, А. (1984). Химия элементов . Нью-Йорк: Пергамон Пресс. ISBN 0-08-022056-8 .
- ^ Фриман, Дж. Х.; Смит, М.Л. (1958). «Получение безводных неорганических хлоридов дегидратацией тионилхлоридом». Журнал неорганической и ядерной химии . 7 (3): 224–227. дои : 10.1016/0022-1902(58)80073-1 .
- ^ Друдинг, Л.Ф.; Корбетт, доктор юридических наук (1961). «Низшие степени окисления лантаноидов. Хлорид и йодид неодима (II)». Журнал Американского химического общества . 83 (11): 2462–2467. дои : 10.1021/ja01472a010 . ISSN 0002-7863 .
- ^ Корбетт, доктор юридических наук (1973). «Восстановленные галогениды редкоземельных элементов». Преподобный Чим. Минерал . 10 : 239.
- ^ Хирнейз, Ларс; Бушманн, Деннис А.; Майхле-Мессмер, Сесилия; Анвандер, Райнер (2022). «Флуоренильные комплексы церия, включая реакции сочетания CC». Металлоорганические соединения . 41 (8): 962–976. doi : 10.1021/acs.organomet.2c00029 . S2CID 248065310 .
- ^ Мой, Нориоки; Фудзивара, Юзо; Танигучи, Хироши (1986). «Реакции алкилирования Фриделя-Крафтса, катализируемые трихлорлантаноидом (LnCl 3 )». Химические письма . 15 (3): 357–360. дои : 10.1246/кл.1986.357 .
- ^ Пакетт, Лео А.; Сабита, Г.; Ядав, Дж.С.; Шойерманн, Анжелика М.; Торговец, Рохан Р. (2021). «Церия(III) Хлорид». Энциклопедия реагентов для органического синтеза . стр. 1–15. дои : 10.1002/047084289X.rc041.pub3 . ISBN 9780471936237 .
- ^ Люш, Жан-Луи; Родригес-Хан, Лидия; Краббе, Пьер (1978). «Восстановление природных енонов в присутствии трихлорида церия». Журнал Химического общества, Химические коммуникации (14): 601–602. дои : 10.1039/C39780000601 .
Дальнейшее чтение
[ редактировать ]- Справочник CRC по химии и физике (58-е издание), CRC Press, Уэст-Палм-Бич, Флорида, 1977.
- Анвандер, Р. (1999). Кобаяши, С. (ред.). Лантаниды: химия и использование в органическом синтезе . Берлин: Springer-Verlag. стр. 10–12 . ISBN 9783540645269 .