Хлорид радия
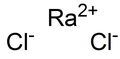 | |
 Ампула с хлоридом радия | |
| Идентификаторы | |
|---|---|
3D model ( JSmol ) | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.030.020 |
| Номер ЕС |
|
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| РаСл 2 | |
| Молярная масса | 296.094 g/mol |
| Появление | Бесцветное твердое вещество, светится сине-зеленым. [1] |
| Плотность | 4,9 г/см 3 [1] |
| Температура плавления | 900 ° C (1650 ° F; 1170 К) [1] |
| 245 г/л (20 °С) [2] | |
| Опасности | |
| Безопасность и гигиена труда (OHS/OSH): | |
Основные опасности | радиоактивный, высокотоксичный, коррозионный |
| СГС Маркировка : | |
   | |
| Х300 , Х310 , Х330 , Х350 , Х370 , Х373 , Х410 | |
| NFPA 704 (огненный алмаз) | |
| Родственные соединения | |
Другие анионы | Бромид радия |
Другие катионы | Бериллий хлорид Хлорид магния Хлорид кальция Хлорид стронция Хлорид бария |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Хлорид радия — неорганическое соединение с химической формулой Ра Cl 2 . Это радиевая соль хлористого водорода . Это было первое радия соединение , выделенное в чистом виде. Мария Кюри и Андре-Луи Дебьерн использовали его в своем первоначальном отделении радия от бария . [3] Впервые металлический радий был получен электролизом раствора этой соли с использованием ртутного катода. [4]
Подготовка
[ редактировать ]Хлорид радия кристаллизуется из водного раствора в виде дигидрата . Дигидрат обезвоживают путем нагревания до 100°С на воздухе в течение одного часа, а затем в течение 5,5 часов при 520°С в атмосфере аргона . [5] Если подозревается присутствие других анионов, дегидратацию можно осуществить плавлением в хлористом водороде . [6]
Хлорид радия также можно получить нагреванием бромида радия в потоке сухого газообразного хлористого водорода . Его можно получить обработкой карбоната радия соляной кислотой.
Характеристики
[ редактировать ]Хлорид радия — бесцветная соль с сине-зеленым свечением , особенно при нагревании. С возрастом его цвет постепенно меняется на желтый, а загрязнение барием может придать розовый оттенок. [1] Он менее растворим в воде, чем другие хлориды щелочноземельных металлов - при 25 ° C его растворимость составляет 245 г/л, тогда как растворимость хлорида бария - 307 г/л, а в растворах соляной кислоты разница еще больше. Это свойство используется на первых стадиях отделения радия от бария фракционной кристаллизацией . [2] Хлорид радия лишь умеренно растворим в азеотропной соляной кислоте и практически нерастворим в концентрированной соляной кислоте. [7]
Газообразный RaCl 2 демонстрирует сильное поглощение в видимом спектре при 676,3 нм и 649,8 нм (красный): энергия диссоциации связи радий-хлор оценивается как 2,9 эВ , [8] и его длина - 292 часа . [9]
В отличие от диамагнитного хлорида бария, хлорид радия слабо парамагнитен с магнитной восприимчивостью 1,05 × 10. 6 . Цвет его пламени красный. [1]
Использование
[ редактировать ]Хлорид радия до сих пор используется на начальных стадиях отделения радия от бария при извлечении радия из настуранта . Большое количество задействованного материала (для извлечения грамма чистого металлического радия требуется около 7 тонн настурана) делает этот менее дорогостоящий (но менее эффективный) метод более предпочтительным, чем методы, основанные на бромиде радия или хромате радия (используемые на более поздних стадиях добычи). разделение).
Его также использовали в медицине для производства газообразного радона , который, в свою очередь, использовался для брахитерапевтического лечения рака . [10] [11]
Дихлорид радия-223 ( USP с альфа-излучением , хлорид радия Ra 223), торговое название Ксофиго (ранее Альфарадин), представляет собой радиофармацевтический препарат . В мае 2013 года компания Bayer получила одобрение FDA на этот препарат для лечения остеобластических костных метастазов рака простаты. Хлорид радия-223 является одним из наиболее мощных (противоопухолевых препаратов) из известных. [ нужна ссылка ] Одна доза (50 кБк/кг) для взрослого человека составляет около 60 нанограмм; это количество составляет 1/1000 веса ресницы (75 микрограмм).
Ссылки
[ редактировать ]- ^ Jump up to: а б с д и Кирби, с. 5
- ^ Jump up to: а б Кирби, с. 6
- ^ Кюри, М .; Дебьерн, А. (1910). CR Hebd. акад. Знать Париж 151 : 523–25.
- ^ Кирби, с. 3
- ^ Вейгель, Ф.; Тринкль, А. (1968). «Кристаллохимия радия. I. Галогениды радия». Радиохимика Акта . 9 : 36–41. дои : 10.1524/ract.1968.9.1.36 . S2CID 201843329 .
- ^ Хёнигшмид, О.; Захтлебен, Р. (1934). «Ревизия атомного веса радия». Журнал неорганической и общей химии . 221 : 65–82. дои : 10.1002/zaac.19342210113 .
- ^ Эрбахер, Отто (1930). «Определение растворимости некоторых солей радия». Отчеты Немецкого химического общества (серии A и B) . 63 : 141–156. дои : 10.1002/cber.19300630120 .
- ^ Лагерквист, А. (1953). Архивы Физика 6 : 141–42.
- ^ Karapet'yants, M. Kh.; Ch'ing, Ling-T'ing (1960). Zh. Strukt. Khim. 1 :277–85; J. Struct. Chem. (USSR) 1 :255–63.
- ^ Гольдштейн, Н. (1975). «Имплантаты семян радона. Остаточная радиоактивность через 33 года». Архив дерматологии . 111 (6): 757–759. doi : 10.1001/archderm.1975.01630180085013 . ПМИД 1137421 .
- ^ Уинстон, П. (июнь 1958 г.). «Рак трахеи, лечение имплантацией семян радона». Журнал ларингологии и отологии . 72 (6): 496–499. дои : 10.1017/S0022215100054232 . ПМИД 13564019 . S2CID 36790323 .
Библиография
[ редактировать ]- Кирби, Х.В. и Салуцкий, Мюррел Л. (1964) Радиохимия радия , Подкомитет по радиохимии, Национальная академия наук.
Источники
[ редактировать ]- Справочник Гмелина по неорганической химии (8-е издание) , Берлин: Verlag Chemie, 1928, стр. 60–61.
- Справочник Гмелина по неорганической химии (8-е издание, 2-й дополнительный том) , Берлин: Springer, 1977, стр. 362–64.
