Тетрахлорид молибдена
 | |
| Имена | |
|---|---|
| Название ИЮПАК Тетрахлорид молибдена | |
| Другие имена Хлорид молибдена(IV) | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.033.039 |
ПабХим CID | |
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| Cl 4 Мо | |
| Молярная масса | 237.752 g/mol |
| Появление | черный сплошной |
| Температура плавления | 552 ° C (1026 ° F; 825 К) |
| Разлагается | |
| Опасности | |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | Невоспламеняющийся |
| Родственные соединения | |
Родственные соединения | Хлорид молибдена(II) Хлорид молибдена(III) Хлорид молибдена(V) |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Тетрахлорид молибдена — неорганическое соединение с брутто-формулой MoCl 4 . Материал существует в виде двух полиморфов , оба из которых представляют собой парамагнитные твердые тела темного цвета. Эти соединения представляют интерес главным образом как предшественники других комплексов молибдена.
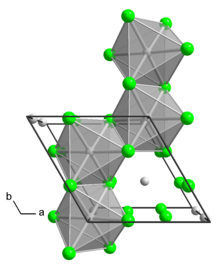
Структура
[ редактировать ]Полиморфная модификация α представляет собой полимер. Полиморф β представляет собой гексамер. В обоих полиморфах центр Mo имеет октаэдрическую форму с двумя концевыми хлоридными лигандами и четырьмя двойными мостиковыми лигандами. [1] Помимо этих двух бинарных фаз, известен ряд аддуктов с формулой MoCl 4 L 2 где L – основание Льюиса .
Подготовка
[ редактировать ]α-Тетрахлорид молибдена можно получить дехлорированием пентахлорида молибдена с использованием тетрахлорэтена : [2]
- 2 MoCl 5 + C 2 Cl 4 → 2 MoCl 4 + C 2 Cl 6
Нагревание тетрахлорида α-молибдена в герметичном контейнере в присутствии пентахлорида молибдена вызывает превращение в β-полиморфную модификацию. [2]
Реакции
[ редактировать ]При нагревании в открытом сосуде тетрахлорид молибдена выделяет хлор, образуя трихлорид молибдена ; [2]
- 2 MoCl 4 → 2 MoCl 3 + Cl 2
Аддукт ацетонитрилового комплекса можно получить восстановлением пентахлорида ацетонитрилом: [3] [4]
- 2 MoCl 5 + 5 CH 3 CN → 2 MoCl 4 (CH 3 CN) 2 + ClCH 2 CN + HCl
MeCN Лиганды могут быть заменены другими лигандами:
- MoCl 4 (CH 3 CN) 2 + 2 THF → MoCl 4 (THF) 2 + 2 CH 3 CN
Пентахлорид можно восстановить до эфирного комплекса MoCl 4 (Et 2 O) 2 с помощью оловянного порошка. Это парамагнитное твердое вещество бежевого цвета. [5]
Ссылки
[ редактировать ]- ^ Ульрих Мюллер (1981). «Гексамерный тетрахлорид молибдена». Международное издание «Прикладная химия» на английском языке . 20 (8): 692. doi : 10.1002/anie.198106921 .
- ^ Jump up to: а б с Макканн III, Эл; Браун, ТМ (1970). «Хлорид молибдена(IV)». Неорганические синтезы . Неорганические синтезы. Том. 12. с. 181. дои : 10.1002/9780470132432.ch31 . ISBN 9780470132432 .
- ^ Бродерик, Эрин М.; Браун, Сэмюэл К.; Джонсон, Марк Дж.А. (2014). «Димолибден и дивольфрам гекса (алкоксиды)». Неорганические синтезы: Том 36 . Неорганические синтезы. Том. 36. С. 95–102. дои : 10.1002/9781118744994.ch18 . ISBN 9781118744994 .
- ^ Дилворт, Джонатан Р.; Ричардс, Раймонд Л. (1990). «Синтез азотистых комплексов молибдена и вольфрама». Неорганические синтезы . Неорганические синтезы. Том. 28. с. 33. дои : 10.1002/9780470132593.ch7 . ISBN 9780470132593 .
- ^ Мария, Себастьян; Поли, Ринальдо (2014). «Эфирные комплексы хлоридов молибдена (III) и молибдена (IV)». Неорганические синтезы: Том 36 . Неорганические синтезы. Том. 36. С. 15–18. дои : 10.1002/9781118744994.ch03 . ISBN 9781118744994 .
