Четыреххлористый углерод
| |||
 | |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название ИЮПАК Тетрахлорметан | |||
| Другие имена Бензиноформ хлорид углерода(IV) углеродный тет Карбонеум тетрахлоратум / Carbonei тетрахлоридум Хлорид углерода / Хлорид углерода хлорид углерода Фреон-10 Халон-104 тетрахлорид метана метилтетрахлорид Некаторина перхлорметан Хладагент-10 Тетрахлоретум карбоникум Тетрахлоруглерод Тетраформ Тетрасол | |||
| Идентификаторы | |||
3D model ( JSmol ) | |||
| Сокращения | КТК, ТКМ, ПКМ, Р-10 | ||
| 1098295 | |||
| ЧЭБИ | |||
| ЧЕМБЛ | |||
| ХимическийПаук | |||
| Информационная карта ECHA | 100.000.239 | ||
| Номер ЕС |
| ||
| 2347 | |||
| КЕГГ | |||
ПабХим CID | |||
| номер РТЭКС |
| ||
| НЕКОТОРЫЙ | |||
| Число | 1846 | ||
Панель управления CompTox ( EPA ) | |||
| Характеристики | |||
| С Cl 4 | |||
| Молярная масса | 153.81 g·mol −1 | ||
| Появление | Бесцветная жидкость | ||
| Запах | хлороформа запах | ||
| Плотность |
| ||
| Температура плавления | -22,92 ° C (-9,26 ° F; 250,23 К) | ||
| Точка кипения | 76,72 ° С (170,10 ° F; 349,87 К) | ||
| |||
| Растворимость | Растворим в спирте , эфире , хлороформе , бензоле , нафте , CS 2 , муравьиной кислоте. | ||
| войти P | 2.64 | ||
| Давление пара | 11,94 кПа при 20 °C | ||
Закон Генри постоянная ( k H ) | 2.76×10 −2 атм·м 3 /моль | ||
| −66.60×10 −6 см 3 /моль | |||
| Теплопроводность | 0,1036 Вт/м·К (300 К) [1] | ||
Показатель преломления ( n D ) | 1.4607 | ||
| Вязкость | 0,86 мПа·с [2] | ||
| 0 Д | |||
| Структура | |||
| Моноклиника | |||
| четырехугольный | |||
| Тетраэдрический | |||
| 0 Д | |||
| Термохимия | |||
Теплоемкость ( С ) | 132,6 Дж/моль·К | ||
Стандартный моляр энтропия ( S ⦵ 298 ) | 214,39 Дж/моль К | ||
Стандартная энтальпия образование (Δ f H ⦵ 298 ) | −95,6 кДж/моль | ||
Свободная энергия Гиббса (Δ f G ⦵ ) | −87,34 кДж/моль [3] | ||
| Опасности | |||
| Безопасность и гигиена труда (OHS/OSH): | |||
Основные опасности | чрезвычайно токсичен для печени и почек, потенциальный профессиональный канцероген, вреден для озонового слоя. | ||
| СГС Маркировка : | |||
   | |||
| Опасность | |||
| Х301 , Х302 , Х311 , Х331 , Х351 , Х372 , Х412 , Х420 | |||
| P201 , P202 , P260 , P261 , P264 , P270 , P271 , P273 , P280 , P281 , P301+P310 , P302+P352 , P304+P340 , P308+P313 , P311 , P312 , P314 , 321 , П322 , П330 , П361 , П363 , П403+П233 , П405 , П501 , П502 | |||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | негорючий | ||
| Летальная доза или концентрация (LD, LC): | |||
ЛД 50 ( средняя доза ) | 7749 мг/кг (перорально, мышь); 5760 мг/кг (перорально, кролик); 2350 мг/кг (перорально, крыса) [5] | ||
ЛК 50 ( средняя концентрация ) |
| ||
LC Lo ( самый низкий из опубликованных ) |
| ||
| NIOSH (пределы воздействия на здоровье в США): | |||
МЕХ (Допускается) | TWA 10 частей на миллион C 25 частей на миллион 200 частей на миллион (максимальный 5-минутный пик за каждые 4 часа) [4] | ||
РЕЛ (рекомендуется) | Ca ST 2 ppm (12,6 мг/м 3 ) [60 минут] [4] | ||
IDLH (Непосредственная опасность) | 200 частей на миллион [4] | ||
| Паспорт безопасности (SDS) | КМГС 0024 | ||
| Родственные соединения | |||
Другие анионы | Тетрафторид углерода Четырехбромистый углерод Тетраиодид углерода | ||
Другие катионы | Тетрахлорид кремния Тетрахлорид германия Тетрахлорид олова Тетрахлорид свинца | ||
Родственные хлорметаны | хлорметан дихлорметан Трихлорметан | ||
| Страница дополнительных данных | |||
| Четыреххлористый углерод (страница данных) | |||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Четыреххлористый углерод , также известный под многими другими названиями (например, «углерод-тет» сокращенно и тетрахлорметан , также признанный ИЮПАК ), представляет собой химическое соединение с химической формулой CCl 4 . Это негорючая, плотная, бесцветная жидкость со «сладким» запахом, напоминающим хлороформ , который можно обнаружить при низких концентрациях. Раньше он широко использовался в огнетушителях , в качестве предшественника хладагентов и в качестве чистящего средства , но с тех пор его использование было прекращено из соображений экологии и безопасности. Воздействие высоких концентраций четыреххлористого углерода может повлиять на центральную нервную систему и вызвать дегенерацию печени и почек. Длительное воздействие может быть фатальным.
Торговые названия включают: Carbon-Tet , Katharin (Германия, 1890-е гг.), [7] Бензиноформ , Карбона и Таупит в клининговой промышленности , Галон-104 в пожаротушении, Хладагент-10 в системах отопления, вентиляции и кондиционирования , а также Некаторин и Серетин в качестве лекарств.
Свойства [ править ]
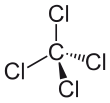
четыреххлористого углерода В молекуле четыре хлора атома расположены симметрично в виде углов в тетраэдрической конфигурации, соединенной с центральным атомом углерода одинарными ковалентными связями . Из-за такой симметричной геометрии CCl 4 неполярен. Газообразный метан имеет ту же структуру, что делает четыреххлористый углерод галометаном . В качестве растворителя он хорошо подходит для растворения других неполярных соединений, таких как жиры и масла. Он также может растворять йод . Он летуч , выделяет пары с запахом, характерным для других хлорированных растворителей, чем-то похожим на запах тетрахлорэтилена , напоминающий запах химчистки магазинов .
Твердый тетрахлорметан имеет две полиморфные модификации : кристаллическую II при температуре ниже -47,5 °C (225,6 К) и кристаллическую I при температуре выше -47,5 °C. [8] При -47,3 °C он имеет моноклинную кристаллическую структуру с пространственной группой C2/c и константами решетки a = 20,3, b = 11,6, c = 19,9 (0,10 −1 нм), β = 111°. [9]
Четыреххлористый углерод с удельным весом более 1 будет присутствовать в виде плотной неводной жидкой фазы, если в окружающую среду попадет достаточное количество.
Реакция [ править ]
Несмотря на то, что четыреххлористый углерод в целом инертен, он может вступать в различные реакции. Водород или кислота в присутствии железного катализатора могут восстановить четыреххлористый углерод до хлороформа, дихлорметана, хлорметана и даже метана. [10] При пропускании его паров через раскаленную трубку четыреххлористый углерод дехлорируется до тетрахлорэтилена и гексахлорэтана . [11]
Четыреххлористый углерод при обработке HF дает различные соединения, такие как трихлорфторметан (R-11), дихлордифторметан (R-12), хлортрифторметан (R-13) и тетрафторид углерода с HCl в качестве побочного продукта:
Когда-то это было одно из основных применений тетрахлорметана, поскольку R-11 и R-12 широко использовались в качестве хладагентов.
Спиртовой раствор гидроксида калия разлагает его в воде на хлорид и карбонат калия: [12]
При нагревании смеси четыреххлористого углерода и углекислого газа до 350 градусов С образуется фосген: [13]
- Аналогичная реакция с окисью углерода вместо этого дает фосген и тетрахлорэтилен: [13]
Реакция с сероводородом дает тиофосген : [14]
Реакция с триоксидом серы дает фосген и пиросульфурилхлорид : [14]
Реакция с фосфорным ангидридом дает фосген и фосфорилхлорид : [14]
Четыреххлористый углерод реагирует с сухим оксидом цинка при 200 градусах Цельсия с образованием хлорида цинка , фосгена и углекислого газа : [13]
История и синтез [ править ]
Четыреххлористый углерод был первоначально синтезирован в 1820 году Майклом Фарадеем , который назвал его «протохлоридом углерода», путем разложения гексахлорэтана («перхлорид углерода»), который он синтезировал хлорированием этилена . [15] [16] Протохлорид углерода ранее ошибочно идентифицировали как тетрахлорэтилен, поскольку его можно получить той же реакцией, что и гексахлорэтан. Позже, в 19 веке, название «протохлорид углерода» использовалось для обозначения тетрахлорэтилена, а четыреххлористый углерод назывался «бихлоридом углерода» или «перхлоридом углерода». Анри Виктор Реньо разработал другой метод синтеза четыреххлористого углерода из хлороформа , хлорэтана или метанола с избытком хлора в 1839 году. [17]
Кольбе получил четыреххлористый углерод в 1845 году, пропуская хлор над сероуглеродом через фарфоровую трубку. [17] До 1950-х годов четыреххлористый углерод производился путем хлорирования сероуглерода при температуре от 105 до 130 °C: [18]
Но сейчас его производят в основном из метана :
- CH 4 + 4 Cl 2 → CCl 4 + 4 HCl
В производстве часто используются побочные продукты других реакций хлорирования , например, синтеза дихлорметана и хлороформа . Высшие хлоруглероды также подвергаются этому процессу, называемому «хлоринолизом»:
- C 2 Cl 6 + Cl 2 → 2 CCl 4
Производство четыреххлористого углерода резко сократилось с 1980-х годов из-за экологических проблем и снижения спроса на ХФУ , которые были получены из четыреххлористого углерода. В 1992 году производство в США/Европе/Японии оценивалось в 720 000 тонн. [18]
Естественное явление [ править ]
Четыреххлористый углерод был обнаружен наряду с хлорметаном и хлороформом в океанах , морских водорослях и вулканах . [19] Естественные выбросы тетрахлорметана слишком малы по сравнению с выбросами из антропогенных источников; например, вулкан Момотомбо в Никарагуа выбрасывает тетрахлорметан с потоком 82 грамма в год, в то время как глобальные промышленные выбросы составляли 2 × 10 10 грамм в год. [20]
Четыреххлористый углерод был обнаружен в красных водорослях Asparagopsis Taxiformis и Asparagopsis Armata . [21] Он был обнаружен в экосистемах Южной Калифорнии, озерах Калмыцкой соленых обыкновенной степи и печеночнице в Чехии. [20]
Безопасность [ править ]
При высоких температурах воздуха он разлагается или горит с образованием ядовитого фосгена . Это была распространенная проблема, когда в качестве огнетушителя использовался четыреххлористый углерод: [22] Сообщалось о случаях смерти в результате его превращения в фосген. [23]
Четыреххлористый углерод является подозреваемым канцерогеном для человека на основании достаточных доказательств канцерогенности, полученных в ходе исследований на экспериментальных животных. [24] Всемирная организация здравоохранения сообщает, что четыреххлористый углерод может вызывать гепатоцеллюлярную карциному (гепатому) у мышей и крыс. Дозы, вызывающие опухоли печени, выше доз, вызывающих клеточную токсичность. [25] Международное агентство по изучению рака (IARC) отнесло это соединение к группе 2B , « возможно канцерогенное для человека ». [26] Четыреххлористый углерод является одним из наиболее сильных гепатотоксинов (токсичных для печени), настолько, что он широко используется в научных исследованиях для оценки гепатопротекторных средств. [27] [28] Воздействие высоких концентраций четыреххлористого углерода (включая пары) может повлиять на центральную нервную систему и вызвать дегенерацию печени. [28] и почки, [29] длительное воздействие может привести к коме или смерти. [30] Хроническое воздействие четыреххлористого углерода может вызвать повреждение печени [31] [32] и повреждение почек и может привести к раку . [33] [34]
Употребление алкоголя усиливает токсическое воздействие четыреххлористого углерода и может вызвать более серьезное повреждение органов, например, острую почечную недостаточность , у злоупотребляющих алкоголем. Дозы, которые могут вызвать легкую токсичность у непьющих, могут быть смертельными для пьющих. [35]
Влияние четыреххлористого углерода на здоровье человека и окружающую среду было оценено в рамках REACH в 2012 году в контексте оценки вещества, проведенной Францией. [36]
В 2008 году исследование распространенных чистящих средств выявило наличие четыреххлористого углерода в «очень высоких концентрациях» (до 101 мг/м). 3 ) в результате смешивания производителями поверхностно-активных веществ или мыла с гипохлоритом натрия (отбелителем). [37]
Четыреххлористый углерод также разрушает озоновый слой. [38] и парниковый газ . [39] Однако с 1992 г. [40] его концентрация в атмосфере снижается по причинам, описанным выше (см. графики концентрации в атмосфере в галерее ). CCl 4 имеет срок жизни в атмосфере 85 лет. [41]
Использует [ править ]
В органической химии четыреххлористый углерод служит источником хлора в реакции Аппеля .

Четыреххлористый углерод, полученный из тяжелого хлора-37, использовался для обнаружения нейтрино .
использование Историческое
Четыреххлористый углерод широко использовался в качестве растворителя для химической чистки , в качестве хладагента и в лавовых лампах . [42] В последнем случае четыреххлористый углерод является ключевым ингредиентом, который придает вес плавучему воску.
Одной из специализаций четыреххлористого углерода было коллекционирование марок , чтобы выявить водяные знаки на почтовых марках, не повреждая их. Небольшое количество жидкости наносится на обратную сторону марки и помещается в поднос из черного стекла или обсидиана. Тогда буквы или рисунок водяного знака будут четко видны. Сегодня это делается на освещенных столах без использования четыреххлористого углерода.
Уборка [ править ]
Будучи хорошим растворителем для многих материалов (таких как жир и деготь), четыреххлористый углерод широко использовался в качестве чистящей жидкости в течение почти 70 лет. Он негорюч, невзрывоопасен и не оставлял никакого запаха на очищаемом материале, в отличие от бензина , который в то время также использовался для очистки. Его использовали как «безопасную» альтернативу бензину. Впервые он был продан под названием Katharin в 1890 году. [43] или 1892 год [44] и как позже Бензиноформ .

Четыреххлористый углерод был первым хлорированным растворителем, который использовался при химической чистке , и использовался до 1950-х годов. [45] Его недостатки заключались в том, что он вызывал коррозию оборудования химчисток и вызывал заболевания среди операторов химчисток, поэтому его заменили трихлорэтиленом и тетрахлорэтиленом. [45] и метилхлороформ (трихлорэтан). [46]
Четыреххлористый углерод также использовался в качестве альтернативы бензину (бензину) в сухих шампунях с начала 1903 по 1930-е годы. Несколько женщин потеряли сознание от его паров во время мытья волос в парикмахерских; парикмахеры часто использовали электрические вентиляторы, чтобы выдувать пары. В 1909 году дочь баронета , Хеленора Элфинстон-Дэлримпл (29 лет), умерла после того, как ей помыли волосы четыреххлористым углеродом. [47] [48]
Предполагается, что по состоянию на 2006 год четыреххлористый углерод все еще использовался в качестве растворителя для химической чистки в Северной Корее . [49]
Медицинское использование
Анестетик и анальгетик [ править ]
Четыреххлористый углерод некоторое время использовался в качестве летучего ингаляционного анестетика и анальгетика при сильных менструальных и головных болях в середине 19 века. [50] Его анестезирующее действие было известно еще в 1847 или 1848 годах. [51] [52]
как более безопасная альтернатива хлороформу . Он был представлен доктором Протеро Смитом в 1864 году [53] , открывший обезболивающее действие хлороформа на человека, В декабре 1865 года шотландский акушер Джеймс Янг Симпсон экспериментировал с четыреххлористым углеродом в качестве анестетика. [54] Симпсон назвал это соединение «Хлоруглеродом» из-за его сходства с хлороформом. Его эксперименты включали введение четыреххлористого углерода во влагалище двум женщинам. Симпсон перорально принял четыреххлористый углерод и описал, что он оказывает «тот же эффект, что и проглатывание капсулы хлороформа». [55]
Из-за большего количества атомов хлора (по сравнению с хлороформом) в молекуле четыреххлористый углерод оказывает более сильное анестезирующее действие, чем хлороформ, и его требуется меньшее количество. [50] Его анестезирующее действие сравнивали с эфиром , а не с родственным ему хлороформом. [54] Он менее летуч, чем хлороформ, поэтому его было труднее наносить, и для испарения требовалась теплая вода. [54] Его запах был описан как «фруктовый». [54] похожий на айву [56] и «приятнее хлороформа», [50] и имел «приятный вкус». [54] Четыреххлористый углерод для анестезии получали путем хлорирования сероуглерода . Его использовали как минимум у 50 пациенток, большинство из которых были роженицами. [57] Во время анестезии четыреххлористый углерод вызывал сильные мышечные сокращения и негативное воздействие на сердце у некоторых пациентов, поэтому его пришлось заменить хлороформом или эфиром. [54] [58] Такое использование было экспериментальным, и применение четыреххлористого углерода для анестезии так и не завоевало популярность из-за его потенциальной токсичности.
Лекарство от паразитов [ править ]

Реклама Merck's Necatorina, Колумбия, 1942 год.
Ветеринарный врач Морис Кроутер Холл (1881-1938) обнаружил в 1921 году, что четыреххлористый углерод невероятно эффективен в качестве антигельминтного средства при уничтожении нематод при приеме внутрь. В ходе одного из клинических испытаний четыреххлористого углерода его испытывали на преступниках, чтобы определить его безопасность для применения на людях. [59] Начиная с 1922 года капсулы чистого четыреххлористого углерода продавались компанией Merck под названием Necatorina (варианты включают Neo-necatorina и Necatorine ). Некаторин использовался как лекарство против паразитарных заболеваний человека. Этот препарат наиболее широко использовался в странах Латинской Америки . [60] [61] В то время его токсичность еще не была хорошо изучена, и токсическое воздействие приписывалось примесям в капсулах, а не самому тетрахлорметану. [62] Из-за токсичности четыреххлористого углерода тетрахлорэтилен (который также исследовался Холлом в 1925 году) заменил его использование в качестве антигельминтного средства к 1940-м годам. [63]

Растворитель [ править ]
Когда-то он был популярным растворителем в органической химии, но из-за его вредного воздействия на здоровье сегодня он используется редко. [27] Иногда он полезен в качестве растворителя для инфракрасной спектроскопии , поскольку не имеет значительных полос поглощения выше 1600 см. −1 . Поскольку четыреххлористый углерод не имеет атомов водорода, он исторически использовался в протонной ЯМР-спектроскопии . Помимо того, что он токсичен, его растворяющая способность низка. [64] Его использование в ЯМР-спектроскопии в значительной степени вытеснено дейтерированными растворителями (в основном дейтерохлороформом ). Использование четыреххлористого углерода при определении нефти было заменено различными другими растворителями, такими как тетрахлорэтилен . [27] Поскольку четыреххлористый углерод не имеет связей C–H, он с трудом вступает в свободнорадикальные реакции . Это полезный растворитель для галогенирования либо элементарным галогеном , либо реагентом галогенирования, таким как N -бромсукцинимид (эти условия известны как бромирование Воля-Циглера ). [ нужна ссылка ]
Пожаротушение [ править ]


Между 1902 и 1908 годами огнетушители на основе четыреххлористого углерода начали появляться в Соединенных Штатах, спустя годы после Европы. [43]
В 1910 году компания Pyrene Manufacturing Company из Делавэра подала патент на использование четыреххлористого углерода для тушения пожаров. [65] Жидкость испарялась под действием тепла сгорания и гасила пламя — раннюю форму газового пожаротушения . В то время считалось, что газ вытеснил кислород в районе пожара, но более поздние исследования показали, что газ ингибирует химическую цепную реакцию процесса горения. [ нужна ссылка ]
В 1911 году Пирен запатентовал небольшой портативный огнетушитель, в котором использовалось это химическое вещество. [66] Огнетушитель представлял собой латунную бутылку со встроенным ручным насосом, который использовался для подачи струи жидкости в сторону огня. Поскольку контейнер не находился под давлением, его можно было легко наполнить после использования. [67] Четыреххлористый углерод пригоден для тушения пожаров, связанных с жидкостями и электричеством, а огнетушители часто перевозятся на самолетах или автомобилях. Однако уже в 1920 году поступали сообщения о смертельных случаях, вызванных применением этого химического вещества для тушения пожара в замкнутом пространстве. [23]
В первой половине 20-го века другим распространенным огнетушителем был одноразовый герметичный стеклянный шар, «пожарная граната», наполненная четыреххлористым углеродом или соленой водой. Лампочку можно было бросить в основание пламени, чтобы потушить огонь. Тип с четыреххлористым углеродом также можно установить в подпружиненный настенный светильник с фиксатором на основе припоя . Когда припой плавился от высокой температуры, пружина либо ломала шар, либо выбрасывала его из кронштейна, позволяя огнетушащему веществу автоматически распыляться в очаге возгорания. [68]

Хорошо известной маркой пожарных гранат была «Красная комета», которая производилась вместе с другим противопожарным оборудованием в районе Денвера, штат Колорадо, компанией Red Comet Manufacturing Company с момента ее основания в 1919 году до закрытия производственных предприятий в самом начале. 1980-е годы. [69] [ мертвая ссылка ]
Поскольку четыреххлористый углерод замерзает при –23 °С, огнетушители должны содержать только 89–90% четыреххлористого углерода и 10% трихлорэтилена ( т.пл. –85 °С) или хлороформа (т.пл. –63 °С) для снижения температуры замерзания огнетушащей смеси. до температуры до –45°C. Огнетушители с 10% трихлорэтилена будут содержать 1% сероуглерода в качестве стабилизатора. [43]
Хладагенты [ править ]
До принятия Монреальского протокола большие количества четыреххлористого углерода использовались для производства хлорфторуглеродных хладагентов R-11 ( трихлорфторметан ) и R-12 ( дихлордифторметан ). Однако эти хладагенты играют роль в разрушении озона , и их использование было постепенно прекращено. Четыреххлористый углерод до сих пор используется для производства менее разрушительных хладагентов. [ нужна ссылка ]
Фумигант [ править ]
Четыреххлористый углерод широко использовался в качестве фумиганта для уничтожения насекомых-вредителей в хранящемся зерне. [70] Его использовали в смеси, известной как 80/20, которая состояла из 80% четыреххлористого углерода и 20% сероуглерода . [71] Агентство по охране окружающей среды США запретило его использование в 1985 году. [72]
Другая смесь для приготовления фумиганта на основе четыреххлористого углерода содержала акрилонитрил . Четыреххлористый углерод снижает воспламеняемость смеси. Наиболее распространенными торговыми названиями препарата были Акритет , Карбакрил и Акрилофум . [73] Самый распространенный препарат, Акритет , был приготовлен из 34 процентов акрилонитрила и 66 процентов четыреххлористого углерода. [74] [75]
и Общество культура
- Французский писатель Рене Домаль отравился, вдыхая четыреххлористый углерод, которым он убивал собранных им жуков, чтобы «встретиться с другими мирами», добровольно погрузившись в опьянение, близкое к коматозному состоянию. [76]
- Четыреххлористый углерод указан (наряду с салициловой кислотой , толуолом , тетраборатом натрия , силикагелем , метанолом , карбонатом калия , этилацетатом и «BHA») в качестве ингредиента специальной формулы веб-жидкости Питера Паркера ( Человек-паук ) в книге «Ваканда». Файлы: Технологическое исследование Мстителей и не только . [77]
- Австралийский ютубер Том из Explosions&Fire и Extractions&Ire снял видео об извлечении четыреххлористого углерода из старого огнетушителя в 2019 году. [78] а позже экспериментировал с ним, смешивая его с натрием , [79] и химическое вещество приобрело базу поклонников под названием « Tet Gang » в социальных сетях (особенно на Reddit ). Позже владелец канала использовал в сувенирной продукции канала дизайн на тему тетрахлорметана.
- В песне Ramones « Carbona Not Glue », выпущенной в 1977 году, рассказчик говорит, что вдыхать пары Carbona , пятновыводителя на основе четыреххлористого углерода, было лучше, чем вдыхать клей. Позже они удалили песню из альбома, поскольку Carbona была корпоративной торговой маркой. [80]
углеродом от отравления четыреххлористым смерти Известные
- Эвелин Босток , (1917–1944) британская актриса, которая умерла от случайного употребления четыреххлористого углерода, приняв его за свой напиток во время работы в фотолаборатории. [81]
- Гарри Эдвардс (1887–1952), американский режиссер, умерший от отравления четыреххлористым углеродом вскоре после того, как снял свою первую телевизионную постановку. [82]
- Зильфия Хортон (1910–1956) — американская музыкантша и активистка, которая умерла от того, что случайно выпила стакан, полный жидкости для чистки пишущих машинок на основе тетрахлорметана, которую она приняла за воду. [83]
- Марго Джонс (1911–1955) американский режиссер, подвергшийся воздействию паров четыреххлористого углерода, которым счищали краску с ковра. Через неделю она умерла от почечной недостаточности. [84]
- Джим Бек (1919–1956), американский продюсер, умер после воздействия паров четыреххлористого углерода, которым он подвергся во время чистки записывающего оборудования. [85]
- Томми Такер (1933–1982), американский блюзовый певец, умер после использования четыреххлористого углерода при ремонте пола. [86] [87]
Галерея [ править ]
- CCl 4 измерен в рамках Advanced Global Atmospheres Gas Experiment ( AGAGE ) в нижних слоях атмосферы ( тропосфере ) на станциях по всему миру. Численность дана как среднемесячная мольная доля незагрязненной среды в частях на триллион .
- Средние концентрации CCl 4 в полушарии и мире (NOAA/ESRL).
- Временной ряд атмосферных концентраций CCl 4 (Walker et al. , 2000).
Ссылки [ править ]
- ^ Тулукян Ю.С., Лили П.Е. и Саксена С.С. Теплофизические свойства материи - серия данных TPRC. Том 3. Теплопроводность - неметаллических жидкостей и газов. Книга данных. 1970.
- ^ Рид, Роберт С.; Праусниц, Джон М.; Полинг, Брюс Э. (1987), Свойства газов и жидкостей , McGraw-Hill Book Company, стр. 442, ISBN 0-07-051799-1
- ^ «Тетрахлорид углерода» (PDF) . Чемео . Проверено 14 июня 2022 г.
- ↑ Перейти обратно: Перейти обратно: а б с Карманный справочник NIOSH по химическим опасностям. «#0107» . Национальный институт охраны труда и здоровья (NIOSH).
- ^ Паспорт безопасности тетрахлорида углерода от Fisher Scientific.
- ↑ Перейти обратно: Перейти обратно: а б «Четверохлористый углерод» . Непосредственно опасные для жизни и здоровья концентрации (IDLH) . Национальный институт охраны труда и здоровья (NIOSH).
- ^ LC Стюард, «Тетрахлорид углерода в химчистке», 1931 г.
- ^ «Тетрахлорид углерода» . webbook.nist.gov . Архивировано из оригинала 30 июня 2017 года . Проверено 28 апреля 2018 г.
- ^ Ф. Брезина, Дж. Моллин, Р. Пасторек, З. Синделар. Химические таблицы соединений неорганических . СНТЛ, 1986.
- ^ Джонсон, Тимоти Л.; Фиш, Уильям; Горби Юрий А.; Тратник, Пол Г. (март 1998 г.). «Разложение четыреххлористого углерода металлическим железом: влияние комплексообразования на поверхность оксида». Журнал загрязняющей гидрологии . 29 (4): 379–398. Бибкод : 1998JCHyd..29..379J . дои : 10.1016/S0169-7722(97)00063-6 .
- ^ Тиди, CM (1887). Справочник по современной химии неорганической и органической. Великобритания: Смит, Элдер и компания. [ нужна страница ]
- ^ Вислиценус, Дж., Шлитцер, А., Ходжкинсон, WRE (1882). Краткий учебник органической химии Адольфа Шлитцера. США: Д. Эпплтон.
- ↑ Перейти обратно: Перейти обратно: а б с Уоттс, Х. (1872). Химический словарь. Великобритания: Лонгман, Грин, Робертс и Грин.
- ↑ Перейти обратно: Перейти обратно: а б с Подробный учебник химии Грэма-Отто. (1881). Германия: Просмотрег.
- ^ Фарадей, Майкл (1859). Экспериментальные исследования в области химии и физики . Тейлор и Фрэнсис. п. 46. ИСБН 978-0-85066-841-4 .
- ^ Тернер, Эдвард. Элементы химии: включая недавние открытия и доктрины науки. Великобритания, Джон Тейлор, 1834 г. Страница 247.
- ↑ Перейти обратно: Перейти обратно: а б Грэм Т., Уоттс Х. (1850). Элементы химии: включая применение науки в искусстве. США: Байьер.
- ↑ Перейти обратно: Перейти обратно: а б Манфред Россберг, Вильгельм Лендле, Герхард Пфлайдерер, Адольф Тёгель, Эберхард-Людвиг Дреер, Эрнст Лангер, Хайнц Йертс, Петер Кляйншмидт, Хайнц Штрак, Ричард Кук, Уве Бек, Карл-Август Липпер, Теодор Р. Торкельсон, Экхард Лёзер, Клаус К. мешочек, «Хлорированные углеводороды» в Энциклопедии промышленной химии Ульмана, 2006 г., Wiley-VCH, Вайнхайм. два : 10.1002/14356007.a06_233.pub2
- ^ Гриббл, GW (1996). «Природные галогенорганические соединения - комплексное исследование». Прогресс в химии органических природных продуктов . 68 (10): 1–423. дои : 10.1021/np50088a001 . ПМИД 8795309 .
- ↑ Перейти обратно: Перейти обратно: а б Природные галогенорганические соединения. (2023). Шпрингер Природа Швейцария.
- ^ Гриббл, Г. (2012). Прогресс в химии органических природных продуктов. Австрия: Шпрингер Вена.
- ^ Берк, Роберт (6 ноября 2007 г.). Противопожарная защита: системы и реагирование . ЦРК Пресс. п. 209. ИСБН 978-0-203-48499-9 .
- ↑ Перейти обратно: Перейти обратно: а б Филднер, AC; Кац, С.Х.; Кинни, СП; Лонгфелло, ES (октябрь 1920 г.). «Ядовитые газы из четыреххлоруглеродных огнетушителей». Журнал Института Франклина . 190 (4): 543–565. дои : 10.1016/S0016-0032(20)91494-1 .
- ^ «Отчет о канцерогенах, четырнадцатое издание - Четыреххлористый углерод» (PDF) . ntp.niehs.nih.gov.
- ^ «Критерии гигиены окружающей среды 208: ТЕТРАХЛОРИД УГЛЕРОДА» (PDF) . кто.инт.
- ^ «Заявление общественного здравоохранения о тетрахлорметане (Tetracloruro de Carbono)» . atsdr.cdc.gov.
- ↑ Перейти обратно: Перейти обратно: а б с Использование озоноразрушающих веществ в лабораториях. ТемаНорд 516/2003. Архивировано 27 февраля 2008 г. в Wayback Machine.
- ↑ Перейти обратно: Перейти обратно: а б Зейферт В.Ф., Босма А., Брауэр А. и др. (январь 1994 г.). «Дефицит витамина А усиливает фиброз печени у крыс, вызванный четыреххлористым углеродом». Гепатология . 19 (1): 193–201. дои : 10.1002/hep.1840190129 . ПМИД 8276355 . S2CID 205863459 .
- ^ Лю К.Х., Като Ю., Ямадзаки М., Хигучи О., Накамура Т., Сугияма Ю. (апрель 1993 г.). «Снижение печеночного клиренса фактора роста гепатоцитов у крыс, отравленных четыреххлористым углеродом» . Гепатология . 17 (4): 651–60. дои : 10.1002/hep.1840170420 . ПМИД 8477970 . S2CID 25794501 .
- ^ Рекнагель Р.О.; Гленде Э.А.; Долак Ж.А.; Уоллер Р.Л. (1989). «Механизм токсичности четыреххлористого углерода». Фармакология и терапия . 43 (43): 139–154. дои : 10.1016/0163-7258(89)90050-8 . ПМИД 2675128 .
- ^ Рекнагель Р.О. (июнь 1967 г.). «Гепатотоксичность тетрахлорида углерода» . Фармакол. Преподобный . 19 (2): 145–208. ПМИД 4859860 .
- ^ Масуда Ю. (октябрь 2006 г.). «[Изучение токсикологии гепатотоксичности, вызванной тетрахлорметаном]» . Якугаку Дзасси (на японском языке). 126 (10): 885–99. дои : 10.1248/yakushi.126.885 . ПМИД 17016019 .
- ^ Руд А.С., МакГавран П.Д., Аненсон Дж.В., Тилль Дж.Э. (август 2001 г.). «Стохастические оценки воздействия и риска рака от четыреххлористого углерода, выбрасываемого в воздух с завода на скалистых равнинах». Рискованный анал . 21 (4): 675–95. Бибкод : 2001РискА..21..675Р . дои : 10.1111/0272-4332.214143 . ПМИД 11726020 . S2CID 31797685 .
- ^ Паспорт безопасности материала, тетрахлорметан. Архивировано 13 сентября 2010 г. в Wayback Machine в Fisher Scientific.
- ^ Токсикологический профиль четыреххлористого углерода. (2005). США: Агентство по регистрации токсичных веществ и заболеваний.
- ^ «Оценка веществ – CoRAP – ECHA» . echa.europa.eu . Архивировано из оригинала 20 августа 2016 года . Проверено 28 апреля 2018 г.
- ^ Одабаси М. (2008). «Галогенированные летучие органические соединения, образующиеся при использовании хлорсодержащих бытовых товаров». Экологические науки и технологии . 42 (5): 1445–51. Бибкод : 2008EnST...42.1445O . дои : 10.1021/es702355u . ПМИД 18441786 .
- ^ Фрейзер П. (1997). «Химия стратосферного озона и истощение озона». Австралийский метеорологический журнал . 46 (3): 185–193.
- ^ Эванс В.Ф., Пукрин Э. (1996). «Измерение парникового излучения, связанного с четыреххлористым углеродом (CCl 4 )». Письма о геофизических исследованиях . 23 (14): 1769–72. Бибкод : 1996GeoRL..23.1769E . дои : 10.1029/96GL01258 .
- ^ Уокер, С.Дж.; Вайс РФ и Саламе ПК (2000). «Восстановленная история среднегодовых мольных долей в атмосфере галогенуглеродов CFC-11, CFC-12, CFC-113 и четыреххлористого углерода» . Журнал геофизических исследований . 105 (С6): 14285–96. Бибкод : 2000JGR...10514285W . дои : 10.1029/1999JC900273 .
- ^ Атлас изменения климата (2006) Кирстин Доу и Томаса Э. Даунинга ISBN 978-0-520-25558-6
- ^ Доэрти Р.Э. (2000). «История производства и использования тетрахлорида углерода, тетрахлорэтилена, трихлорэтилена и 1,1,1-трихлорэтана в Соединенных Штатах: Часть 1 - Историческая справка; Четыреххлористый углерод и тетрахлорэтилен». Экологическая криминалистика . 1 (2): 69–81. Бибкод : 2000EnvFo...1...69D . дои : 10.1006/энфо.2000.0010 . S2CID 97680726 .
- ↑ Перейти обратно: Перейти обратно: а б с Опасности огнетушителей на основе четыреххлористого углерода: Рекомендуемая практика № 3. США, Совет, 1967.
- ^ Новейшие изобретения и опыт в области практических технологий, электротехники, торговли, промышленности, химии, сельского хозяйства и домашнего хозяйства. (1895). Австрия: (np).
- ↑ Перейти обратно: Перейти обратно: а б "ХИМЧИСТКА МАРК"
- ^ Руководство по охране труда и технике безопасности для прачечных и химчисток. (1975) Министерство здравоохранения, образования и социального обеспечения США, Служба общественного здравоохранения, Центр контроля заболеваний, Национальный институт безопасности и гигиены труда, Отдел технических служб.
- ^ Фармацевтический журнал: Еженедельный отчет по фармации и смежным наукам. (1909). Великобритания: Дж. Черчилль.
- ^ Микер, Р., Гамильтон, А. (1915). Промышленные яды, используемые в резиновой промышленности. Типография правительства США.
- ^ Отчет ГТОЭО, отчет о ходе работы за май 2006 г. (2006). Кения: Секретариат Программы ООН по окружающей среде по озону.
- ↑ Перейти обратно: Перейти обратно: а б с «Тетрахлорид углерода как анестетик», доктор Протеро Смит, Британский журнал стоматологии и протезирования (1867 г.). Великобритания: JP Segg & Company, стр. 302.
- ^ Об анестезирующем использовании терхлорида и протохлорида углерода The Lancet. Великобритания, Дж. Онуин, 1848 г.
- ^ Г-н Наннели об анестезии и анестезирующих веществах, Эдинбургский медицинский и хирургический журнал (1849). Великобритания
- ^ «Новый анестетик», Британский журнал стоматологической науки и протезирования (1867). Великобритания: JP Segg & Company, стр. 239.
- ↑ Перейти обратно: Перейти обратно: а б с д и ж Заметки Артура Эрнеста Сэнсома об анестезирующих свойствах бихлорида углерода, Труды Лондонского акушерского общества. (1867) Великобритания: Лонгманс, Грин и компания.
- ^ Страницы 170-173, «Анестетические и седативные свойства бихлорида углерода или хлоруглерода» (декабрь 1865 г.), Симпсон, Дж. Ю., Анестезия, госпитализм, гермафродитизм и предложение по искоренению оспы и других заразных заболеваний. (1871(Великобритания: Адам и Чарльз Блэк.
- ^ Протеро Смит, Dental Cosmos. (1867). США: SS White Dental Manufacturing Company, стр. 673.
- ^ «Тетрахлорид углерода как анестетик», доктор Протеро Смит, Британский журнал стоматологических наук и протезирования (1867). Великобритания: JP Segg & Company, стр. 260.
- ^ Am J Dent Sci. 1868 г., январь; 1 (9): 462–463.«Испытание тетрахлорида углерода в качестве анестетика. Опасные эффекты» Э. Эндрюс [1]
- ^ Браунинг, Э. (1940). Современные лекарства в общей практике.
- ^ Бюллетень тропических болезней (1927) Великобритания: Бюро гигиены и тропических болезней.
- ^ Тэгер, Х. (2013) Клиника компенсируемых профессиональных заболеваний. Германия: Springer Berlin Heidelberg.
- ^ Бюллетень тропических болезней (1925) Великобритания: Бюро гигиены и тропических болезней.
- ^ Мэнсон-Бар, PH, Мэнсон, П. (1954). Тропические болезни Мэнсона: Руководство по болезням теплого климата.
- ^ В. Ройш. «Введение в спектроскопию ядерного магнитного резонанса» . Виртуальный учебник органической химии . Мичиганский государственный университет . Архивировано из оригинала 31 августа 2006 года.
- ↑ Патент США № 1010870 , поданный 5 апреля 1910 г.
- ↑ Патент США № 1105263 , поданный 7 января 1911 г.
- ^ «Пиреновые огнетушители» . Винтажные огнетушители. Архивировано из оригинала 25 марта 2010 года . Проверено 23 декабря 2009 г.
- ^ Берк, Роберт (6 ноября 2007 г.). Противопожарная защита: системы и реагирование . ЦРК Пресс. п. 209. ИСБН 978-0-203-48499-9 .
- ^ «Производственная компания «Красная комета» . Город Литтлтон, Колорадо. Архивировано из оригинала 1 октября 2016 года . Проверено 30 сентября 2016 г.
- ^ «ACSH объясняет: какова история с четыреххлористым углеродом?» . Американский совет по науке и здоровью . 09.08.2018 . Проверено 3 февраля 2022 г.
- ^ Питерс, штат Ха; Левин, РЛ; Мэтьюз, CG; Заутер, С.; Чепмен, Л. (1986). «Синергетическая нейротоксичность четыреххлористого углерода/сероуглерода (фумигантов 80/20) и других пестицидов у работников зернохранилищ» . Acta Pharmacologica et Toxicologica . 59 : 535–546. дои : 10.1111/j.1600-0773.1986.tb02820.x . ПМИД 3535379 . Проверено 3 февраля 2022 г.
- ^ Дарст, Гай (12 февраля 1985 г.). «Производители убирают с рынка зерновой фумигант перед лицом испытаний EPA» . АП Новости . Проверено 3 февраля 2022 г.
- ^ КОММЕРЧЕСКАЯ ПРОДУКЦИЯ Morgan, DP (1996). Распознавание и борьба с отравлениями пестицидами. (np): Издательская компания ДИАНА.
- ^ Слушания, отчеты и распечатки сенатского комитета по операциям правительства (1964). Типография правительства США.
- ^ Руководство по защите растений и карантинной обработке. (1976). Министерство сельского хозяйства США, Служба инспекции здоровья животных и растений, программы защиты растений и карантина.
- ^ Фредерик Руссель (2011). «Круг недостающих фрарес» .
- ^ «Официальная формула жидкости Marvel Spider-Man Web Fluid» . 23 октября 2020 г.
- ^ де Принс, Том (22 сентября 2019 г.). «Нелегальный химикат из старинного огнетушителя 1960-х годов» . Ютуб .
- ^ де Принс, Том (27 марта 2020 г.). «Смешивать натрий и хлорированные растворители очень вредно (тетрахлорид углерода и натрий)» . Ютуб .
- ^ Бессман, Джим (1993). Ramones: американская группа. Грифон Святого Мартина. стр74.
- ^ «Эвелин Гермия (1917 – 1944)» .
- ^ Окуда, Тед ; Ватц, Эдвард (1986). Комедийные короткометражки «Колумбия» . McFarland & Company, Inc., Издательства. п. 214. ИСБН 0-89950-181-8 .
- ^ Глен, Джон М. (1996). Горец: Необычная школа, 2-е изд . Ноксвилл: Университет Теннесси Press. п. 138.
- ^ «Театр Марго Джонс приостановит работу 15 декабря» . Нью-Йорк Таймс . Проверено 23 марта 2022 г.
- ^ Свидетельство о смерти: Джеймс А. Бек, Департамент здравоохранения Техаса, Бюро статистики естественного движения населения, файл № 24027.
- ^ «Томми Такер» . Soulfulkindamusic.net . Проверено 13 июня 2014 г.
- ^ «Роберт Хиггинботэм, певец блюза и джаза, умер в 48 лет» . Нью-Йорк Таймс . 25 января 1982 года . Проверено 20 августа 2012 г.
Роберт Хиггинботэм, блюзовый и джазовый певец, выступавший под именем Томми Такер, скончался в пятницу в больнице колледжа в Ньюарке. Г-ну Хиггинботэму, который жил в Ист-Ориндже, штат Нью-Джерси, было 48 лет. ... Уроженец Спрингфилда, штат Огайо, он прожил в Ист-Ориндже 17 лет. Он был лицензированным брокером по недвижимости и в молодости был борцом-любителем.
Внешние ссылки [ править ]
- Международная карта химической безопасности 0024
- Карманный справочник NIOSH по химическим опасностям. «#0107» . Национальный институт охраны труда и здоровья (NIOSH).
- «Углерод четыреххлористый (группа 2Б)» . Международное агентство по исследованию рака (IARC) – Резюме и оценки . 71 : 401. 1999.
- Монография МАИР: «Тетрахлорид углерода»
- Токсикологический профиль четыреххлористого углерода
- Критерии гигиены окружающей среды для тетрахлорметана
- Паспорт безопасности тетрахлорида углерода в базе данных опасных химических веществ
- Профиль вещества на сайте ntp.niehs.nih.gov.
- ChemSub Online: Четыреххлористый углерод