Йодоформ
 | |||
| |||
 | |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название ИЮПАК Трииодметан | |||
| Другие имена | |||
| Идентификаторы | |||
3D model ( JSmol ) | |||
| 1697010 | |||
| ЧЭБИ | |||
| ЧЕМБЛ | |||
| ХимическийПаук | |||
| Информационная карта ECHA | 100.000.795 | ||
| Номер ЕС |
| ||
| КЕГГ | |||
| МеШ | йодоформ | ||
ПабХим CID | |||
| номер РТЭКС |
| ||
| НЕКОТОРЫЙ | |||
Панель управления CompTox ( EPA ) | |||
| Характеристики | |||
| Ч И 3 | |||
| Молярная масса | 393.732 g·mol −1 | ||
| Появление | Бледные, светло-желтые, непрозрачные кристаллы. | ||
| Запах | Шафрановый [3] | ||
| Плотность | 4,008 г/см 3 [3] | ||
| Температура плавления | 119 ° С (246 ° F; 392 К) [3] | ||
| Точка кипения | 218 ° С (424 ° F; 491 К) [3] | ||
| 100 мг/л [3] | |||
| Растворимость в диэтиловом эфире | 136 г/л | ||
| Растворимость в ацетоне | 120 г/л | ||
| Растворимость в этаноле | 78 г/л | ||
| войти P | 3.118 | ||
Закон Генри постоянная ( k H ) | 3,4 мкмоль·Па −1 ·кг −1 | ||
| −117.1·10 −6 см 3 /моль | |||
| Структура | |||
| Шестиугольный | |||
| Тетраэдр в точке C | |||
| Термохимия | |||
Теплоемкость ( С ) | 157,5 Дж/(К·моль) | ||
Стандартная энтальпия образование (Δ f H ⦵ 298 ) | 180,1 – 182,1 кДж/моль | ||
Стандартная энтальпия горение (Δ c H ⦵ 298 ) | −716,9 – −718,1 кДж/моль | ||
| Фармакология | |||
| D09AA13 ( ВОЗ ) | |||
| Опасности | |||
| СГС Маркировка : | |||
 | |||
| Предупреждение | |||
| Х315 , Х319 , Х335 | |||
| П261 , П280 , П305+П351+П338 | |||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | 204 ° С (399 ° F; 477 К) | ||
| Летальная доза или концентрация (LD, LC): | |||
ЛД 50 ( средняя доза ) | |||
| NIOSH (пределы воздействия на здоровье в США): | |||
МЕХ (Допускается) | никто [4] | ||
РЕЛ (рекомендуется) | 0,6 частей на миллион (10 мг/м 3 ) [4] | ||
IDLH (Непосредственная опасность) | без даты [4] | ||
| Родственные соединения | |||
Родственные соединения | |||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||

Йодоформ (также известный как трийодметан ) представляет собой йодорганическое соединение с химической формулой Ч И 3 . Это бледно-желтое кристаллическое летучее вещество с проникающим и характерным запахом (в старых учебниках по химии этот запах иногда называют запахом больниц, где это соединение до сих пор широко используется) и, аналогично хлороформу , сладковатым вкусом. . Иногда его используют в качестве дезинфицирующего средства .
Мы
[ редактировать ]Название «йодоформ» происходит от «формильного радикала», архаичного термина для фрагмента HC, и сохранено для исторической последовательности. Полное современное название – трииодметан. «Гидрид» в последнем иногда опускается, [2] но ИЮПАК не рекомендует этого делать, поскольку «трийодид углерода» также может означать C 2 I 6 ( гексаиодэтан , крайне нестабильное соединение).
Структура
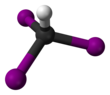
[ редактировать ]Молекула имеет тетраэдрическую геометрию с C3v симметрией .
Синтез и реакции
[ редактировать ]Синтез йодоформа впервые описал Жорж-Симон Серуллас в 1822 г. по реакции паров йода с водяным паром над раскаленными углями, а также по реакции калия с этанольным йодом в присутствии воды; [6] и в то же время независимо от Джона Томаса Купера . [7] Он синтезируется в галоформной реакции путем реакции йода и гидроксида натрия с любым из этих четырех видов органических соединений: метилкетоном ( CH 3 COR ), ацетальдегид ( CH 3 CHO ), этанол ( CH 3 CH 2 OH ) и некоторые вторичные спирты ( CH 3 CHROH , где R представляет собой алкильную или арильную группу).
Реакция йода и основания с настолько метилкетонами надежна, что йодоформную пробу для проверки наличия метилкетона применяют (по появлению желтого осадка). Это также имеет место при тестировании конкретных вторичных спиртов , содержащих хотя бы одну метильную группу в альфа-положении .
Некоторые реагенты (например , йодистый водород ) превращают йодоформ в дииодметан . преобразование в углекислый газ Также возможно : йодоформ реагирует с водным раствором нитрата серебра с образованием монооксида углерода . При обработке порошкообразным элементарным серебром йодоформ восстанавливается с образованием ацетилена . При нагревании йодоформ разлагается с образованием двухатомного йода, газообразного йодистого водорода и углерода.
Естественное явление
[ редактировать ]содержит Шляпка ангела йодоформ и имеет характерный запах.
Приложения
[ редактировать ]Соединение находит небольшое применение в качестве дезинфицирующего средства. [5] [8] Примерно в начале 20-го века он использовался в медицине в качестве заживляющей и антисептической повязки для ран и язв, и, хотя сейчас это применение в значительной степени вытеснено более совершенными антисептиками , он все еще используется в отоларингологии в виде субнитрата висмута, йодоформного парафина. паста (БИПП) в качестве антисептической тампона при кариесе. Он является активным ингредиентом многих ушных присыпок для собак и кошек , наряду с оксидом цинка и пропионовой кислотой , которые используются для предотвращения инфекций и облегчения удаления волос из ушей. [ нужна ссылка ]
См. также
[ редактировать ]Ссылки
[ редактировать ]Рандхава Г.К., Грэм Р., Матару К.С., Парафиновая паста с йодоформом висмута: история и использование. Британский журнал челюстно-лицевой хирургии. 2019;67:E53-E54.
- ^ «Фронт материи». Номенклатура органической химии: рекомендации ИЮПАК и предпочтительные названия 2013 г. (Синяя книга) . Кембридж: Королевское химическое общество . 2014. с. 661. дои : 10.1039/9781849733069-FP001 . ISBN 978-0-85404-182-4 .
Сохраненные названия «бромоформ» для HCBr 3 , «хлороформ» для HCCl 3 и «йодоформ» для HCl 3 приемлемы в общей номенклатуре. Предпочтительные имена IUPAC являются замещающими именами.
- ^ Jump up to: а б «Йодоформ» .
- ^ Jump up to: а б с д и ж г Запись в базе данных веществ ГЕСТИС Института охраны труда.
- ^ Jump up to: а б с Карманный справочник NIOSH по химическим опасностям. «#0343» . Национальный институт охраны труда и здоровья (NIOSH).
- ^ Jump up to: а б Индекс Merck , 12 издание, 5054
- ^ Суреллас, Жорж-Симон (1822), Заметки о гидродате поташа и соляной кислоте. -- Гидродиод углерода; способы получения на данный момент этого тройного соединения [ Заметки о иодоводороде калия и о иодоводородной кислоте — иодоводороде; средства мгновенного получения этого соединения трех элементов ] (на французском языке), Мец, Франция: Антуан, стр. 17–20, 28–29
- ^ Джеймс, Фрэнк ЭйДжейл (2004). «Купер, Джон Томас» . Оксфордский национальный биографический словарь (онлайн-изд.). Издательство Оксфордского университета. doi : 10.1093/ref:odnb/39361 . Проверено 26 января 2012 г. (Требуется подписка или членство в публичной библиотеке Великобритании .)
- ^ Лайдей, Филлис А. (2005), «Йод и соединения йода», Энциклопедия промышленной химии Ульмана , Wiley-VCH, Вайнхайм, стр. 1–13, doi : 10.1002/14356007.a14_381.pub2 , ISBN 9783527306732
Внешние ссылки
[ редактировать ]- Карманный справочник NIOSH по химическим опасностям. «#0343» . Национальный институт охраны труда и здоровья (NIOSH).
- Паспорт безопасности JT Baker
- Метод специфического превращения иодоформа в углекислый газ
- Подготовка
- . Британская энциклопедия . Том. 14 (11-е изд.). 1911. с. 726.