ацетальдегид
| |||
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название ИЮПАК ацетальдегид [3] | |||
| Систематическое название ИЮПАК Этанал [3] | |||
| Другие имена | |||
| Идентификаторы | |||
3D model ( JSmol ) | |||
| ЧЭБИ | |||
| ЧЕМБЛ | |||
| ХимическийПаук | |||
| Информационная карта ECHA | 100.000.761 | ||
| Номер ЕС |
| ||
| КЕГГ | |||
ПабХим CID | |||
| номер РТЭКС |
| ||
| НЕКОТОРЫЙ | |||
Панель управления CompTox ( EPA ) | |||
| Характеристики | |||
| С 2 Н 4 О | |||
| Молярная масса | 44.053 g·mol −1 | ||
| Появление | Бесцветный газ или жидкость | ||
| Запах | эфирный | ||
| Плотность | 0,784 г·см −3 (20 °С) [4] 0,7904–0,7928 г·см −3 (10 °С) [4] | ||
| Температура плавления | -123,37 ° C (-190,07 ° F; 149,78 К) | ||
| Точка кипения | 20,2 ° C (68,4 ° F; 293,3 К) | ||
| смешиваемый | |||
| Растворимость | смешивается с этанолом , эфиром , бензолом , толуолом , ксилолом , скипидаром , ацетоном. мало растворим в хлороформе | ||
| войти P | -0.34 | ||
| Давление пара | 740 мм рт.ст. (20 °С) [5] | ||
| Кислотность ( pKa ) | 13,57 (25°С, Н 2 О) [6] | ||
| -.5153 −6 см 3 /г | |||
Показатель преломления ( n D ) | 1.3316 | ||
| Вязкость | 0,21 мПа-с при 20 °C (0,253 мПа-с при 9,5 °C) [7] | ||
| Структура | |||
| тригонально-плоскостной (sp 2 ) и С 1 тетраэдрический (sp 3 ) в С 2 | |||
| 2,7 Д | |||
| Термохимия [8] | |||
Теплоемкость ( С ) | 89 Дж·моль −1 ·К −1 | ||
Стандартный моляр энтропия ( S ⦵ 298 ) | 160,2 Дж·моль −1 ·К −1 | ||
Стандартная энтальпия образование (Δ f H ⦵ 298 ) | −192,2 кДж·моль −1 | ||
Свободная энергия Гиббса (Δ f G ⦵ ) | -127,6 кДж·моль −1 | ||
| Родственные соединения | |||
Родственные альдегиды | Формальдегид Пропиональдегид | ||
Родственные соединения | Оксид этилена | ||
| Опасности | |||
| Безопасность и гигиена труда (OHS/OSH): | |||
Основные опасности | потенциальный профессиональный канцероген [10] | ||
| СГС Маркировка : | |||
   [9] [9] | |||
| Х224 , Х319 , Х335 , Х351 [9] | |||
| П210 , П261 , П281 , П305+П351+П338 [9] | |||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | −39,00 °С; −38,20 ° F; 234,15 К | ||
| 175,00 °С; 347,00 °Ф; 448,15 К [5] | |||
| Взрывоопасные пределы | 4.0–60% | ||
| Летальная доза или концентрация (LD, LC): | |||
ЛД 50 ( средняя доза ) | 1930 мг/кг (крыса, перорально) | ||
ЛК 50 ( средняя концентрация ) | 13 000 частей на миллион (крыса), 17 000 частей на миллион (хомяк), 20 000 частей на миллион (крыса) [10] | ||
| NIOSH (пределы воздействия на здоровье в США): | |||
МЕХ (Допускается) | 200 частей на миллион (360 мг/м 3 ) [5] | ||
IDLH (Непосредственная опасность) | 2000 частей на миллион [5] [10] | ||
| Паспорт безопасности (SDS) | ХМДБ | ||
| Страница дополнительных данных | |||
| Ацетальдегид (страница данных) | |||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Ацетальдегид (систематическое название этаналь по ИЮПАК ) представляет собой органическое химическое соединение с формулой CH 3 CHO , иногда сокращенно Me CHO. Это бесцветная жидкость или газ, температура кипения которого близка к комнатной. Это один из важнейших альдегидов , широко встречающийся в природе и производимый в больших масштабах в промышленности. Ацетальдегид в природе содержится в кофе, хлебе и спелых фруктах. [11] и вырабатывается растениями. Он также образуется в результате частичного окисления этанола ферментом печени алкогольдегидрогеназой и является одной из причин похмелья после употребления алкоголя . [12] Пути воздействия включают воздух, воду, землю или грунтовые воды, а также питье и дым. [13] Потребление дисульфирама ингибирует ацетальдегиддегидрогеназу , фермент, ответственный за метаболизм ацетальдегида, тем самым вызывая его накопление в организме.
Международное агентство по изучению рака (IARC) отнесло ацетальдегид к канцерогенам первой группы . [14] Ацетальдегид является «одним из наиболее часто встречающихся воздушных токсинов, риск рака которого превышает один на миллион». [15]
История
[ редактировать ]Ацетальдегид впервые наблюдал шведский фармацевт/химик Карл Вильгельм Шееле (1774 г.); [16] затем его исследовали французские химики Антуан Франсуа, граф де Фуркруа и Луи Николя Воклен (1800 г.), [17] и немецкие химики Иоганн Вольфганг Дёберейнер (1821, 1822, 1832). [18] и Юстус фон Либих (1835 г.). [19] [20] В 1835 году Либих назвал его «альдегидом»; [21] позже название было изменено на «ацетальдегид». [22]
Производство
[ редактировать ]В 2003 году мировое производство составило около 1 миллиона тонн. [ нужна ссылка ] До 1962 года этанол и ацетилен основными источниками ацетальдегида были . С тех пор этилен является доминирующим сырьем . [23]
Основным методом производства является окисление этена по процессу Вакера , который предполагает окисление этена с использованием гомогенной каталитической системы палладий/медь:
В 1970-х годах мировая мощность процесса прямого окисления Wacker-Hoechst превышала 2 миллиона тонн в год.
Меньшие количества можно получить путем частичного окисления этанола в экзотермической реакции. Этот процесс обычно проводится на серебряном катализаторе при температуре около 500–650 ° C. [23]
Этот метод является одним из старейших способов промышленного получения ацетальдегида.
Другие методы
[ редактировать ]Гидратация ацетилена
[ редактировать ]До появления Вакера и появления дешевого этилена ацетальдегид получали путем гидратации ацетилена процесса . [24] Реакция катализируется солями ртути(II) :
Механизм включает посредничество винилового спирта , который таутомеризуется до ацетальдегида. Реакцию проводят при 90–95 °С, образовавшийся ацетальдегид отделяют от воды и ртути и охлаждают до 25–30 °С. В мокрого окисления процессе сульфат железа (III) используется для повторного окисления ртути обратно в соль ртути (II). Полученный сульфат железа(II) окисляют в отдельном реакторе азотной кислотой . [23]
Фермент ацетиленгидратаза, обнаруженный у строго анаэробной бактерии Pelobacter acetylenicus, может катализировать аналогичную реакцию без участия каких-либо соединений ртути. [25] Однако до сих пор он не был доведен до какого-либо крупномасштабного или коммерческого использования.
Дегидрирование этанола
[ редактировать ]Традиционно ацетальдегид получали частичным дегидрированием этанола:
В этом эндотермическом процессе пары этанола пропускают при температуре 260–290 ° C над катализатором на основе меди. Когда-то этот процесс был привлекателен из-за ценности попутного водородного продукта, [23] но в наше время это экономически нецелесообразно.
Гидроформилирование метанола
[ редактировать ]Гидроформилирование , метанола с помощью катализаторов таких как соли кобальта, никеля или железа, также дает ацетальдегид, хотя этот процесс не имеет промышленного значения. Столь же неконкурентоспособен ацетальдегид, который образуется из синтез-газа с умеренной селективностью. [23]
Реакции
[ редактировать ]Таутомеризация в виниловый спирт
[ редактировать ]
Как и многие другие карбонильные соединения , ацетальдегид таутомеризуется с образованием енола ( винилового спирта ; название IUPAC: этенол):
- CH 3 CH=O ⇌ CH 2 =CHOH ∆ H 298,г = +42,7 кДж/моль
Константа равновесия равна 6 × 10 −7 при комнатной температуре, поэтому относительное количество енольной формы в образце ацетальдегида очень мало. [26] При комнатной температуре ацетальдегид (СН 3 СН=О) стабильнее винилового спирта (СН 2 =СНОН) на 42,7 кДж/моль: [27] В целом таутомеризация кето-енолов происходит медленно, но катализируется кислотами.
Фотоиндуцированная таутомеризация кето-енолов возможна в атмосферных или стратосферных условиях. Эта фототаутомеризация актуальна для атмосферы Земли, поскольку считается, что виниловый спирт является предшественником карбоновых кислот в атмосфере. [28] [29]
Реакции присоединения и конденсации
[ редактировать ]Ацетальдегид — распространенный электрофил в органическом синтезе . [30] Кроме того, реакции с ацетальдегидом прохиральны . Он используется главным образом как источник «CH 3 C». + H(OH)" Синтон в альдольных реакциях и родственных реакциях конденсации . [31] Реагенты Гриньяра и литийорганические соединения реагируют с MeCHO с образованием гидроксиэтильных производных. [32] В одной из наиболее впечатляющих реакций присоединения формальдегид в присутствии гидроксида кальция присоединяется к MeCHO с образованием пентаэритрита , C(CH 2 OH) 4 и формиата . [33]
В реакции Стрекера с цианидом и аммиаком , образуя после гидролиза аминокислоту ацетальдегид конденсируется аланин . [34] Ацетальдегид может конденсироваться с аминами с образованием иминов ; например, с циклогексиламином с получением N - этилиденциклогексиламина . Эти имины можно использовать для управления последующими реакциями, такими как альдольная конденсация. [35]
Это также строительный блок в синтезе гетероциклических соединений . В одном примере он превращается при обработке аммиаком в 5-этил-2-метилпиридин («альдегид-коллидин»). [36]
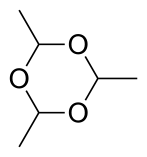
Полимерные формы
[ редактировать ]Три молекулы ацетальдегида конденсируются с образованием « паральдегида », циклического тримера, содержащего одинарные связи CO. Аналогично конденсация четырех молекул ацетальдегида дает циклическую молекулу метальдегида . Паральдегид можно получить с хорошими выходами, используя катализатор на основе серной кислоты. Металдегид получают лишь с выходом в несколько процентов и при охлаждении, часто используя HBr, а не H 2 SO 4 в качестве катализатора . При -40 °С в присутствии кислотных катализаторов образуется полиацетальдегид. [23] Существует два стереомера паральдегида и четыре метальдегида.
Немецкий химик Валентин Герман Вайденбуш (1821–1893) синтезировал паральдегид в 1848 году, обрабатывая ацетальдегид кислотой (серной или азотной) и охлаждая до 0 ° C. Он нашел весьма примечательным, что когда паральдегид нагревали с небольшим количеством той же кислоты, реакция шла в другую сторону, воссоздавая ацетальдегид. [37]
Хотя виниловый спирт является полимерной формой ацетальдегида ( § Таутомеризация в виниловый спирт ), поливиниловый спирт не может быть получен из ацетальдегида.
Производные ацеталя
[ редактировать ]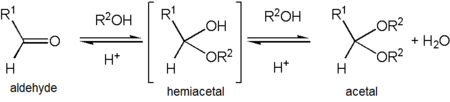
Ацетальдегид образует стабильный ацеталь при реакции с этанолом в условиях, способствующих дегидратации. Продукт CH 3 CH(OCH 2 CH 3 ) 2 официально называется 1,1-диэтоксиэтан, но обычно его называют «ацеталем». [38] Это может вызвать путаницу, поскольку слово «ацеталь» чаще используется для описания соединений с функциональными группами RCH(OR') 2 или RR'C(OR'') 2, а не для обозначения этого конкретного соединения – фактически, 1,1- диэтоксиэтан также называют диэтилацеталем ацетальдегида.
Прекурсор винилфосфоновой кислоты
[ редактировать ]Ацетальдегид является предшественником винилфосфоновой кислоты , которая используется для изготовления клеев и ионопроводящих мембран. Последовательность синтеза начинается с реакции с трихлоридом фосфора : [39]
- PCl 3 + CH 3 CHO → CH 3 CH(O − )PCl 3 +
- СН 3 СН(О − )PCl 3 + + 2 CH 3 CO 2 H → CH 3 CH(Cl)PO(OH) 2 + 2 CH 3 COCl
- CH 3 CH(Cl)PO(OH) 2 → CH 2 =CHPO(OH) 2 + HCl
Биохимия
[ редактировать ]В печени фермент алкогольдегидрогеназа этанол окисляет под в ацетальдегид, который затем далее окисляется до безвредной уксусной кислоты действием ацетальдегиддегидрогеназы . Эти две реакции окисления сопровождаются восстановлением НАД. + к НАДН . [40] фермент каталаза В головном мозге за окисление этанола до ацетальдегида в первую очередь отвечает , а алкогольдегидрогеназа играет второстепенную роль. [40] Последние этапы спиртового брожения у бактерий, растений и дрожжей включают превращение пирувата в ацетальдегид и углекислый газ ферментом пируватдекарбоксилазой с последующим превращением ацетальдегида в этанол. Последняя реакция снова катализируется алкогольдегидрогеназой, действующей теперь в противоположном направлении.
Многие жители Восточной Азии имеют мутацию ALDH2 , которая делает их значительно менее эффективными в окислении ацетальдегида. При употреблении алкоголя их организм склонен накапливать чрезмерное количество ацетальдегида, вызывая так называемую реакцию алкогольного прилива . [41] У них появляется характерный румянец на лице и теле, а также «тошнота, головная боль и общий физический дискомфорт». [42] прием препарата дисульфирама К аналогичной реакции приводит , который ингибирует АЛДГ2. См. раздел #Отягчающие факторы ниже. [43]
Использование
[ редактировать ]Традиционно ацетальдегид в основном использовался в качестве предшественника уксусной кислоты. Это применение было отклонено, поскольку уксусная кислота более эффективно производится из метанола с помощью процессов Monsanto и Cativa . Ацетальдегид является важным предшественником производных пиридина , пентаэритрита и кротональдегида . Мочевина и ацетальдегид в сочетании образуют полезную смолу . Уксусный ангидрид реагирует с ацетальдегидом с образованием этилидендиацетата , предшественника винилацетата , который используется для производства поливинилацетата . [23]
Мировой рынок ацетальдегида сокращается. На спрос повлияли изменения в производстве спиртов-пластификаторов, которое изменилось, поскольку н -бутиральдегид реже производят из ацетальдегида, а вместо этого получают путем гидроформилирования пропилена . Аналогичным образом, уксусная кислота , когда-то полученная из ацетальдегида, производится преимущественно с помощью более дешевого процесса карбонилирования метанола. [44] Влияние на спрос привело к росту цен и, как следствие, к замедлению рынка.

| Продукт | олень | Мексика | Западная Европа | Япония | Общий |
|---|---|---|---|---|---|
| Уксусная кислота/уксусный ангидрид | - | 11 | 89 | 47 | 147 |
| Ацетатные эфиры | 35 | 8 | 54 | 224 | 321 |
| Пентаэритрит | 26 | – | 43 | 11 | 80 |
| Пиридин и пиридиновые основания | 73 | – | 10 | * | 83 |
| Перуксусная кислота | 23 | – | – | * | 23 |
| 1,3-Бутиленгликоль | 14 | – | – | * | 14 |
| Другие | 5 | 3 | 10 | 80 | 98 |
| Общий | 176 | 22 | 206 | 362 | 766 |
Китай является крупнейшим потребителем ацетальдегида в мире, на его долю в 2012 году пришлось почти половина мирового потребления. Основным его применением является производство уксусной кислоты. Ожидается, что другие области применения, такие как пиридины и пентаэритрит, будут расти быстрее, чем уксусная кислота, но объемы недостаточно велики, чтобы компенсировать снижение потребления уксусной кислоты. Как следствие, общее потребление ацетальдегида в Китае может незначительно вырасти на 1,6% в год до 2018 года. Западная Европа является вторым по величине потребителем ацетальдегида в мире, на ее долю приходится 20% мирового потребления в 2012 году. Как и в случае с Китаем, западноевропейский рынок ацетальдегида Ожидается, что рынок будет расти лишь незначительно, на 1% в год в течение 2012–2018 годов. Однако Япония может стать потенциальным потребителем ацетальдегида в ближайшие пять лет благодаря новому использованию бутадиена в коммерческом производстве . Поставки бутадиена в Японии и других странах Азии были нестабильными. Это должно обеспечить столь необходимый импульс для плоского рынка с 2013 года. [45]
Безопасность
[ редактировать ]Пределы воздействия
[ редактировать ]Пороговое предельное значение составляет 25 частей на миллион (STEL/потолочное значение), а MAK (максимальная концентрация на рабочем месте) составляет 50 частей на миллион. При концентрации ацетальдегида 50 ppm не носа раздражения или местного повреждения тканей слизистой оболочки наблюдается . Поступая в организм, ацетальдегид быстро метаболизируется в печени до уксусной кислоты. Лишь небольшая часть выдыхается в неизмененном виде. После внутривенного введения период полувыведения в крови составляет примерно 90 секунд. [23]
Опасности
[ редактировать ]Токсичность
[ редактировать ]Зафиксировано множество серьезных случаев острой интоксикации. [23] Ацетальдегид естественным образом расщепляется в организме человека. [13] [46]
Раздражение
[ редактировать ]Ацетальдегид раздражает кожу, глаза, слизистые оболочки, горло и дыхательные пути. Это происходит при концентрациях всего 1000 частей на миллион. Симптомы воздействия этого соединения включают тошноту , рвоту и головную боль . Эти симптомы могут проявиться не сразу. Порог восприятия ацетальдегида в воздухе находится в диапазоне от 0,07 до 0,25 частей на миллион. [23] При таких концентрациях очевиден фруктовый запах ацетальдегида. Раздражение конъюнктивы наблюдалось после 15-минутного воздействия концентраций 25 и 50 ppm, но о преходящих конъюнктивитах и раздражении дыхательных сообщалось путей после воздействия 200 ppm ацетальдегида в течение 15 минут.
Канцерогенность
[ редактировать ]Ацетальдегид канцерогенен для человека. [47] [48] В 1988 году Международное агентство по изучению рака заявило: «Имеется достаточно доказательств канцерогенности ацетальдегида (основного метаболита этанола) у экспериментальных животных ». [49] В октябре 2009 года Международное агентство по изучению рака обновило классификацию ацетальдегида, заявив, что ацетальдегид, входящий в состав и образующийся эндогенно из алкогольных напитков них , является канцерогеном для человека группы I. [50] Кроме того, ацетальдегид повреждает ДНК. [51] и вызывает аномальное развитие мышц, поскольку он связывается с белками. [52]
Сшивки ДНК
[ редактировать ]Ацетальдегид индуцирует межцепочечные сшивки ДНК, форму повреждения ДНК. Их можно восстановить с помощью любого из двух путей репарации ДНК, связанных с репликацией. [53] Первый путь называется FA, поскольку в нем используются генные продукты, дефектные у пациентов с анемией Фанкони . Этот путь восстановления приводит к увеличению частоты мутаций и изменению спектра мутаций. [53] Второй путь репарации требует конвергенции репликационной вилки, разрыва ацетальдегидной поперечной связи, трансформного синтеза с помощью ДНК-полимеразы Y-семейства и гомологичной рекомбинации. [53]
Отягчающие факторы
[ редактировать ]болезнь Альцгеймера
[ редактировать ]Люди с генетическим дефицитом фермента, ответственного за превращение ацетальдегида в уксусную кислоту, могут иметь больший риск развития болезни Альцгеймера . «Эти результаты показывают, что дефицит ALDH2 является фактором риска НАГРУЗКИ (болезни Альцгеймера с поздним началом)…» [54]
Генетические условия
[ редактировать ]Исследование 818 алкоголиков показало, что те, кто подвергается воздействию большего количества ацетальдегида, чем обычно, из-за генетического варианта гена, кодирующего ADH1C , ADH1C*1, подвергаются большему риску развития рака верхних отделов желудочно-кишечного тракта и печени. [55]
Дисульфирам
[ редактировать ]Препарат дисульфирам (Антабус) ингибирует ацетальдегиддегидрогеназу, фермент, окисляющий соединение в уксусную кислоту. Метаболизм этанола образует ацетальдегид раньше, чем ацетальдегиддегидрогеназа образует уксусную кислоту, но при ингибировании фермента ацетальдегид накапливается. Если употреблять этанол во время приема дисульфирама, похмельный эффект этанола ощущается быстрее и интенсивнее ( реакция дисульфирам-алкоголь ). Таким образом, дисульфирам иногда используется в качестве сдерживающего средства для алкоголиков, желающих оставаться трезвыми. [43]
Источники воздействия
[ редактировать ]Воздух в помещении
[ редактировать ]Ацетальдегид является потенциальным загрязнителем на рабочем месте, в помещении и окружающей среде. Более того, большинство людей проводят более 90% своего времени в помещениях, что увеличивает любое воздействие и риск для здоровья человека. [56]
В исследовании, проведенном во Франции , средняя концентрация ацетальдегида в помещении, измеренная в 16 домах, была примерно в семь раз выше, чем концентрация ацетальдегида снаружи. В гостиной средний показатель составил 18,1±17,5 мкг/м. −3 и спальне - 18,2±16,9 мкг/м2. −3 , тогда как в наружном воздухе средняя концентрация составляла 2,3±2,6 мкг/м2. −3 . [ нужна ссылка ]
Был сделан вывод, что летучие органические соединения (ЛОС), такие как бензол, формальдегид, ацетальдегид, толуол и ксилолы, следует считать приоритетными загрязнителями с точки зрения их воздействия на здоровье. Отмечено, что в отремонтированных или совершенно новых зданиях уровни концентрации ЛОС зачастую на несколько порядков выше. Основными источниками ацетальдегидов в домах являются строительные материалы, ламинат, полы из ПВХ, лакированные деревянные полы и лакированные полы из пробки или сосны (содержащиеся в лаке, а не в древесине). Он также содержится в пластмассах, красках на масляной и водной основе, в композитных деревянных потолках, ДСП, фанере, обработанной сосновой древесине и мебели из ламинированного ДСП. [57]
Наружный воздух
[ редактировать ]Использование ацетальдегида широко распространено в различных отраслях промышленности, при этом в процессе производства, использования, транспортировки и хранения он может попадать в сточные воды или воздух. Источники ацетальдегида включают выбросы от сжигания топлива стационарных двигателей внутреннего сгорания и электростанций, сжигающих ископаемое топливо, древесину или мусор, предприятия по добыче нефти и газа, нефтеперерабатывающие заводы, цементные печи, лесопильные и деревообрабатывающие заводы, а также бумажные фабрики. [58] Ацетальдегид также присутствует в выхлопах автомобилей и дизельных двигателей . [59] В результате ацетальдегид является «одним из наиболее часто встречающихся токсичных веществ в воздухе, риск рака которого превышает один на миллион». [15]
Табачный дым
[ редактировать ]природные табачные полисахариды , включая целлюлозу Было показано, что , являются основными предшественниками, благодаря которым ацетальдегид становится важной составляющей табачного дыма . [60] [61] его синергетический эффект с никотином В исследованиях зависимости на грызунах было продемонстрировано . [62] [63] Ацетальдегид также является наиболее распространенным канцерогеном в табачном дыме; он растворяется в слюне во время курения.
Курение конопли
[ редактировать ]Ацетальдегид был обнаружен в дыме каннабиса . Это открытие стало возможным благодаря использованию новых химических методов, которые продемонстрировали, что присутствующий ацетальдегид вызывает повреждение ДНК в лабораторных условиях. [64]
Употребление алкоголя
[ редактировать ]Многие микробы производят ацетальдегид из этанола, но они обладают меньшей способностью удалять ацетальдегид, что может привести к накоплению ацетальдегида в слюне, желудочной кислоте и содержимом кишечника. Ферментированные продукты и многие алкогольные напитки также могут содержать значительное количество ацетальдегида. Ацетальдегид, образующийся в результате окисления этанола, табачного дыма и пищи на слизистой оболочке или микробов, по-видимому, действует как кумулятивный канцероген в верхних отделах пищеварительного тракта человека. [65] Согласно «Мнениям об ацетальдегиде» (2012) Научного комитета по безопасности потребителей Европейской комиссии (SCCS), предел особого риска для косметических продуктов составляет 5 мг/л, и ацетальдегид не следует использовать в средствах для полоскания рта . [66]
Пластмассы
[ редактировать ]Ацетальдегид можно получить фотоокислением полиэтилентерефталата ( II ПЭТ) по реакции Норриша типа . [67]
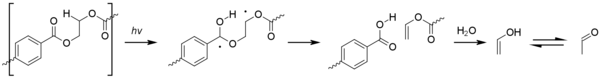
Хотя уровни, образующиеся в результате этого процесса, незначительны, ацетальдегид имеет чрезвычайно низкий порог вкуса / запаха, составляющий около 20–40 частей на миллиард, и может вызывать неприятный привкус в бутилированной воде. [68] Уровень, при котором средний потребитель может обнаружить ацетальдегид, все еще значительно ниже, чем любая токсичность. [69]
Чрезмерный рост Кандиды
[ редактировать ]Candida albicans у пациентов с потенциально канцерогенными заболеваниями полости рта производит ацетальдегид в количествах, достаточных для возникновения проблем. Было показано, что [70]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ SciFinderScholar (по состоянию на 4 ноября 2009 г.). Ацетальдегид (75-07-0) Подробности о веществе.
- ^ Молекулярная патология и диагностика рака с. 190
- ^ Перейти обратно: а б Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 (Синяя книга) . Кембридж: Королевское химическое общество . 2014. с. 908. дои : 10.1039/9781849733069-00648 . ISBN 978-0-85404-182-4 .
- ^ Перейти обратно: а б Stoffdaten Acetaldehyd от Celanese Chemicals. Архивировано 17 мая 2008 года в Wayback Machine по состоянию на декабрь 1999 года.
- ^ Перейти обратно: а б с д Карманный справочник NIOSH по химическим опасностям. «#0001» . Национальный институт охраны труда и здоровья (NIOSH).
- ^ Хейнс, Уильям М., изд. (2016). Справочник CRC по химии и физике (97-е изд.). ЦРК Пресс . стр. 5–88. ISBN 9781498754293 .
- ^ «Ацетальдегид» .
- ^ Джон Рамбл (18 июня 2018 г.). Справочник CRC по химии и физике (99-е изд.). ЦРК Пресс. стр. 5–3. ISBN 978-1138561632 .
- ^ Перейти обратно: а б с Sigma-Aldrich Co. , Ацетальдегид . Проверено 15 февраля 2022 г.
- ^ Перейти обратно: а б с «Ацетальдегид» . НИОШ. 4 декабря 2014 года . Проверено 12 февраля 2015 г.
- ^ Юбелакер, Майкл; Лахенмайер, Дирк (13 июня 2011 г.). «Количественное определение ацетальдегида в пищевых продуктах с использованием автоматического пищеварения с имитацией желудочной жидкости с последующей газовой хроматографией в свободном пространстве» . Журнал автоматизированных методов и управления в химии . 2011 : 907317. doi : 10.1155/2011/907317 . ПМК 3124883 . ПМИД 21747735 .
- ^ Лейси Перри (12 октября 2004 г.). «Как работает похмелье: биология похмелья: ацетальдегид» . health.howstuffworks.com .
- ^ Перейти обратно: а б «Химические вещества в окружающей среде: ацетальдегид (№ CAS 75-07-0)» . epa.gov . Управление по предотвращению загрязнения и токсичных веществ, Агентство по охране окружающей среды США. Август 1994 года. Архивировано из оригинала 17 августа 2002 года . Проверено 22 января 2011 г.
- ^ Список канцерогенов группы 1 IARC
- ^ Перейти обратно: а б Чжоу, Ин; Ли, Чаоян; Хейбрегтс, Марк Эй.Дж.; Мумтаз, М. Мойш (7 октября 2015 г.). «Воздействие канцерогенных токсичных веществ в воздухе и их воздействие на здоровье, связанное с раком, в Соединенных Штатах» . ПЛОС ОДИН . 10 (10): e0140013. Бибкод : 2015PLoSO..1040013Z . дои : 10.1371/journal.pone.0140013 . ПМЦ 4596837 . ПМИД 26444872 .
- ^ Шееле, CW (1774) "Om Brunsten eller Magnesia nigra och dess egenskaper" (О коричнево-каменной или черной магнезии [т.е. марганцевой руды] и ее свойствах), Kungliga Svenska vetenskapsakademiens Handingar (Труды Шведской королевской академии наук) , 35 : 89–116; 177–194. На страницах 109–110 Шееле упоминает, что кипячение («переваривание») этанола ( Alkohol vini ) с диоксидом марганца ( Brunsten ) и либо соляной кислотой ( Spirtus salis ), либо серной кислотой ( Spiritus Vitrioli ) дает запах, подобный «эфиру нитри» ( этанол, обработанный азотной кислотой). Позже исследователи поняли, что Шееле произвел ацетальдегид.
- ^ Примечание:
- Дабит, фармацевт из Нанта, Франция, провел серию экспериментов и пришел к выводу, что ацетальдегид образуется, когда водород в этаноле объединяется с кислородом в серной кислоте с образованием воды: Дабит (1800) «Extrait du mémoire du cit. Dabit sur l'éther» ( Отрывок из мемуаров гражданина Дабита в эфире), Annales de Chimie , 34 : 289–305.
- Фуркрой и Воклен заявили, что серная кислота не расходуется при производстве ацетальдегида: Фуркрой и Воклен (1800), «Об эфире, приготовленном способом гражданина Дабита», Annals of Chemistry , 34 : 318–332.
- ^ См.:
- (Дёберейнер) (1821) «Neue Aether» (Новый эфир), Журнал химии и физики , 32 : 269–270. Дёберейнер назвал новый «эфир» «кислородным эфиром» (кислород-эфир).
- (Дёберейнер) (1822) «Аппарат Дёберейнера для получения кислород -эфира», Журнал химии и физики , 34 : 124–125.
- Дёберейнер, Дж. В. (1832) «Образование оксиэфира путем атмосферного окисления спирта» , Журнал химии и физики , 64 : 466–468. В этой статье Дёберейнер получил ацетальдегид, подвергая пары этанола воздействию воздуха в присутствии платиновой черни.
- ^ Либих, Юстус (1835) «Ueber die Producte der Oxydation des Alkohols» (О продуктах окисления спирта [т. е. этанола]), Annalen der Chemie , 14 : 133–167.
- ^ Брок, Уильям Х. (1997) Юстус фон Либих: Химический привратник . Кембридж, Англия: Издательство Кембриджского университета, стр. 83–84 .
- ^ Либих, Дж. (1835) «О продуктах окисления алкоголя» , Annales de Chimie et de Physique , 59 : 289–327. Из стр. 290: «В этих мемуарах я опишу его под названием альдегид ; это название образовано от спирта дегидрогенат ». (В этих мемуарах я опишу его под названием альдегид ; это название образовано от спирта дегидрогенат .)
- ^ Смена названия произошла как минимум еще в 1868 году. См., например: Ойген Ф. фон Горуп-Безанес, изд., Учебник органической химии для обучения в университетах ... [Учебник органической химии для обучения в университетах. .], 3-е изд. (Брауншвейг, Германия: Фридрих Видег и сын, 1868), т. 1, с. 2, с. 88
- ^ Перейти обратно: а б с д и ж г час я дж к Эккерт, Марк и др. (2007) «Ацетальдегид» в Энциклопедии промышленной химии Ульмана , Wiley-VCH, Вайнхайм два : 10.1002/14356007.a01_031.pub2
- ^ Дмитрий Анатольевич Пономарев; Сергей Михайлович Шевченко (2007). «Гидратация ацетилена: 125 лет» (PDF) . Дж. Хим. Образование. 84 (10): 1725. Бибкод : 2007JChEd..84.1725P . дои : 10.1021/ed084p1725 .
- ^ Кронек, Питер М.Х. (2016). «Ацетиленгидратаза: неокислительно-восстановительный фермент с вольфрамовым и железо-серным центрами в активном центре» . Журнал биологической неорганической химии . 21 (1): 29–38. дои : 10.1007/s00775-015-1330-y . ПМИД 26790879 . S2CID 17179063 .
- ^ Киф, младший; Кресге, AJ; Шепп, Н.П. (1990). «Константы кето-енольного равновесия простых монофункциональных альдегидов и кетонов в водном растворе». Журнал Американского химического общества . 112 (12): 4862–4868. дои : 10.1021/ja00168a035 .
- ^ Джонсон, RD III «Стандартная справочная база данных CCCBDB NIST». nist.gov
- ^ Хизлвуд, Британская Колумбия; Маккароне, AT; Эндрюс, Ду; Осборн, ДЛ; Хардинг, Л.Б.; Клиппенштейн, С.Дж.; Джордан, MJT; Кейбл, С.Х. (2011). «Околопороговой обмен H/D при фотодиссоциации CD 3 CHO». Природная химия . 3 (6): 443–8. Бибкод : 2011НатЧ...3..443H . дои : 10.1038/nchem.1052 . ПМИД 21602858 .
- ^ Эндрюс, Ду; Хизлвуд, Британская Колумбия; Маккароне, AT; Конрой, Т.; Пейн, Р.Дж.; Джордан, MJT; Кейбл, С.Х. (2012). «Фототаутомеризация ацетальдегида в виниловый спирт : потенциальный путь к тропосферным кислотам». Наука . 337 (6099): 1203–6. Бибкод : 2012Sci...337.1203A . дои : 10.1126/science.1220712 . ПМИД 22903524 . S2CID 42079807 .
- ^ Совин, ТиДжей; Мельчер, Л.М. (2004) «Ацетальдегид» в Энциклопедии реагентов для органического синтеза (под ред.: Л. Пакетт ), J. Wiley & Sons, Нью-Йорк. дои : 10.1002/047084289X
- ^ Беренс, К.; Пакетт, Луизиана (1998). « N -Бензил-2,3-азетидиндион (2,3-азетидиндион, 1-(фенилметил)-)» . Органические синтезы . 75 : 106. дои : 10.15227/orgsyn.075.0106 ; Сборник томов , т. 10, с. 41 ..
- ^ Уолтер, Луизиана (1943). «1-(α-пиридил)-2-пропанол (2-(β-гидроксипропил)пиридин)» . Органические синтезы . 23 : 83. дои : 10.15227/orgsyn.023.0083 ; Сборник томов , т. 3, с. 757 .
- ^ Шуринк, HBJ (1925). «Пентаэритрит» . Органические синтезы . 4 : 53. дои : 10.15227/orgsyn.004.0053 ; Сборник томов , т. 1, с. 425 .
- ^ Кендалл, ЕС ; Маккензи, БФ (1929). « дл -Аланин» . Органические синтезы . 9 : 4. дои : 10.15227/orgsyn.009.0004 ; Сборник томов , т. 1, с. 21 .
- ^ Виттиг, Г .; Гессен, А. (1970). «Направленная альдольная конденсация: β-фенилкоричный альдегид (2-пропеналь, 3,3-дифенил-)» . Органические синтезы . 50:66 . дои : 10.15227/orgsyn.050.0066 ; Сборник томов , т. 6, с. 901 .
- ^ Фрэнк, РЛ; Пилигрим, Ф.Дж.; Ринер, Э.Ф. (1950). «5-Этил-2-метилпиридин (2-пиколин, 5-этил-)». Органические синтезы . 30:41 . дои : 10.15227/orgsyn.030.0041 .
- ^ Вайденбуш, Х. (1848) «О некоторых продуктах реакции щелочей и кислот с ацетальдегидом» , Annals of Chemistry , 66 : 152–165; см. стр. 155–158.
- ^ Адкинс, Х .; Ниссен, Б.Х. (1923). «Ацеталь» . Органические синтезы . 3 : 1. дои : 10.15227/orgsyn.003.0001 ; Сборник томов , т. 1, с. 1 .
- ^ Лавиния, М.; Георге, И. (2010). «Поли(винилфосфоновая кислота) и ее производные». Прогресс в науке о полимерах . 35 (8): 1078–1092. doi : 10.1016/j.progpolymsci.2010.04.001 .
- ^ Перейти обратно: а б Иполито, Л.; Санчес, MJ; Полаче, А.; Гранеро, Л. (2007). «Мозговой метаболизм этанола и алкоголизм: обновленная информация». Курс. Препарат Метаб . 8 (7): 716–727. дои : 10.2174/138920007782109797 . ПМИД 17979660 .
- ^ Ли Х, Ким С.С., Ю К.С., Пак В., Ян Дж.Х., Ким М., Хейман Л.Л. (2014). «Азиатское приливы: генетические и социокультурные факторы алкоголизма среди жителей Восточной Азии». Сестринское дело в гастроэнтерологии . 37 (5): 327–36. дои : 10.1097/SGA.0000000000000062 . ПМИД 25271825 . S2CID 206059192 .
- ^ «Рак пищевода и «азиатское сияние» » . Дартмутский студенческий научный журнал. 21 ноября 2009 г. Архивировано из оригинала 12 января 2016 г.
- ^ Перейти обратно: а б Омран, З. (15 мая 2021 г.). «Разработка новых аналогов дисульфирама в качестве селективных ингибиторов ALDH1a1». Письма по биоорганической и медицинской химии . 40 : 127958. doi : 10.1016/j.bmcl.2021.127958 . ПМИД 33744437 . S2CID 232311209 .
- ^ «Ацетальдегид» . ihs.com.
- ^ Исследования и рынки, ООО. «Ацетальдегид – глобальный стратегический бизнес-отчет» .
- ^ Цукамото, С; Муто, Т; Нагоя, Т; Шимамура, М; Сайто, М; Тайнака, Х (1989). «Определение этанола, ацетальдегида и ацетата в крови и моче при окислении алкоголя у человека». Алкоголь и алкоголизм . 24 (2): 101–8. doi : 10.1093/oxfordjournals.alcalc.a044872 . ПМИД 2719768 .
- ^ Химическая сводка по ацетальдегиду , Агентство по охране окружающей среды США.
- ^ Научный комитет по косметической и непищевой продукции (25 мая 2004 г.). «Мнение Научного комитета по косметической продукции и непищевым продуктам, предназначенным для потребителей, относительно ацетальдегида» (PDF) . п. 11. Архивировано (PDF) из оригинала 9 октября 2022 года . Проверено 28 сентября 2011 г.
- ^ Международное агентство по исследованию рака, Всемирная организация здравоохранения. (1988). Употребление алкоголя . Лион: Всемирная организация здравоохранения , Международное агентство по изучению рака . ISBN 978-92-832-1244-7 . п3
- ^ Рабочая группа Международного агентства по исследованию рака, специальный отчет: Политический обзор канцерогенов для человека - Часть E: табак, орех арека, алкоголь, угольный дым и соленая рыба. Ланцет, 2009, 10, 1033–1034.
- ^ Ламберт, Б; Он, С.М. (1988). «Повреждение ДНК и хромосом, индуцированное ацетальдегидом в лимфоцитах человека in vitro». Анналы Нью-Йоркской академии наук . 534 (1): 369–76. Бибкод : 1988NYASA.534..369L . дои : 10.1111/j.1749-6632.1988.tb30124.x . ПМИД 3389666 . S2CID 22732731 .
- ^ Аберле, Н.С.; Бурд, Л; Чжао, Б.Х.; Рен, Дж (2004). «Вызванная ацетальдегидом сократительная дисфункция сердца может быть облегчена витамином B1, но не витаминами B6 или B12» . Алкоголь и алкоголизм . 39 (5): 450–4. дои : 10.1093/alcalc/agh085 . ПМИД 15304379 .
- ^ Перейти обратно: а б с Ходскинсон М.Р., Болнер А., Сато К., Камимаэ-Лэннинг А.Н., Ройджерс К., Витте М., Махеш М., Силхан Дж., Петек М., Уильямс Д.М., Кинд Дж., Чин Дж.В., Патель К.Дж., Книпшеер П. Сшивки ДНК, полученные из спирта, ремонтируется двумя разными механизмами. Природа. Март 2020 г.;579(7800):603–608. дои: 10.1038/s41586-020-2059-5. Epub, 4 марта 2020 г. PMID 32132710; PMCID: PMC7116288.
- ^ Охта, С; Осава I; Камино К; Андо Ф; Симоката Х. (апрель 2004 г.). «Митохондриальный дефицит ALDH2 как окислительный стресс». Анналы Нью-Йоркской академии наук . 1011 (1): 36–44. Бибкод : 2004NYASA1011...36O . дои : 10.1196/анналы.1293.004 . ПМИД 15126281 . S2CID 28571902 .
- ^ Хоманн, Н.; Штикель, Ф.; Кениг, ИК; Джейкобс, А.; Юнгханс, К.; Бенешова, М.; Шуппан, Д.; Химзель, С.; Зубер-Йергер, И.; Хеллербранд, К.; Людвиг, Д.; Казельманн, штат Вашингтон; Зейтц, Гонконг (2006). «Аллель алкогольдегидрогеназы 1C*1 является генетическим маркером рака, связанного с алкоголем, у алкоголиков» . Международный журнал рака . 118 (8): 1998–2002. дои : 10.1002/ijc.21583 . ПМИД 16287084 . S2CID 11716548 .
- ^ Спенглер, Джон Д.; Маккарти, Джон Ф.; Самет, Джонатан М. (2000). Справочник по качеству воздуха в помещении . Нью-Йорк, штат Нью-Йорк, США: McGraw-Hill Professional Publishing. п. 761 . ISBN 978-0074455494 .
- ^ Дафни А. Миссия; Э. Деметриу; Н. Майкл; Э.И. Толис; Дж. Г. Барцис (2010). «Воздействие строительных материалов в помещении: полевое исследование». Атмосферная среда . 44 (35): 4388–4395. Бибкод : 2010AtmEn..44.4388M . дои : 10.1016/j.atmosenv.2010.07.049 .
- ^ Шрестха, Кришна Прасад; Гири, Бинод Радж; Адиль, Мохаммед; Зейдель, Ларс; Цойх, Томас; Фарук, Аамир; Мосс, Фабиан (16 сентября 2021 г.). «Детальное химико-кинетическое исследование окисления ацетальдегида и его взаимодействия с NOx» . Энергетика и топливо . 35 (18): 14963–14983. doi : 10.1021/acs.energyfuels.1c01948 . hdl : 10754/670859 . ISSN 0887-0624 . S2CID 239683740 .
- ^ Клементс, Алабама; Цзя, Ю.; Денблейкер, А.; Макдональд-Буллер, Э.; Фрейзер, член парламента; Аллен, DT; Коллинз, ДР; Мишель, Э.; Пудота, Дж.; Салливан, Д.; Чжу, Ю. (2009). «Концентрация загрязнителей воздуха возле трех дорог Техаса, часть II: Химическая характеристика и трансформация загрязнителей». Атмосферная среда . 43 (30): 4523–4534. Бибкод : 2009AtmEn..43.4523C . дои : 10.1016/j.atmosenv.2009.06.044 .
- ^ Талхаут, Р; Опперхейзен, А; ван Амстердам, JG (октябрь 2007 г.). «Роль ацетальдегида в зависимости от табачного дыма». Eur Нейропсихофармакол . 17 (10): 627–36. дои : 10.1016/j.euroneuro.2007.02.013 . ПМИД 17382522 . S2CID 25866206 .
- ^ Тальхаут, Рейнске; Шульц, Томас; Флорек, Ева; Ван Бентем, Ян; Вестер, Пит; Опперхейзен, Антон (2011). «Опасные соединения в табачном дыме» . Международный журнал экологических исследований и общественного здравоохранения . 8 (12): 613–628. дои : 10.3390/ijerph8020613 . ISSN 1660-4601 . ПМК 3084482 . ПМИД 21556207 .
- ^ «NIDA – Публикации – Заметки NIDA – Том 20, № 3». Архивировано 25 августа 2009 года в Wayback Machine . Drugabuse.gov.
- ^ По данным исследования UCI, зависимость от никотина усиливается в сочетании с другими химическими веществами табачного дыма . Калифорнийский университет. 2004-10-28
- ^ Сингх, Р. (2009). «Оценка потенциала повреждения ДНК сигаретным дымом каннабиса путем определения аддуктов N2-этил-2'-дезоксигуанозина, полученных из ацетальдегида». хим. Рез. Токсикол . 22 (6): 1181–1188. дои : 10.1021/tx900106y . ПМИД 19449825 .
- ^ Саласпуро, М. (2009). «Ацетальдегид как общий знаменатель и кумулятивный канцероген при раке пищеварительного тракта». Скандинавский журнал гастроэнтерологии . 44 (8): 912–925. дои : 10.1080/00365520902912563 . ПМИД 19396661 . S2CID 23291758 .
- ^ МНЕНИЕ Научного комитета по безопасности потребителей SCCS ОБ ацетальдегиде . Европейская комиссия. 18 сентября 2012 г.
- ^ Дэй, М.; Уайлс, DM (январь 1972 г.). «Фотохимическая деструкция полиэтилентерефталата». III. Определение продуктов разложения и механизма реакции». Журнал прикладной науки о полимерах . 16 (1): 203–215. дои : 10.1002/app.1972.070160118 .
- ^ Навроцкий, Дж; Домбровская, А; Борч, А. (ноябрь 2002 г.). «Исследование карбонильных соединений в бутилированной воде из Польши». Исследования воды . 36 (19): 4893–4901. Бибкод : 2002WatRe..36.4893N . дои : 10.1016/S0043-1354(02)00201-4 . ПМИД 12448533 .
- ^ «Приводят ли ацетальдегид и формальдегид из бутылок для домашних животных к неприемлемому вкусу или аромату воды в бутылках?» (PDF) . Ассоциация ПЭТ-смол. Архивировано (PDF) из оригинала 9 октября 2022 года . Проверено 26 февраля 2015 г.
- ^ Гаинза-Сирауки, ML; Ниеминен, Монтана; Новак Фрейзер, Л.; Агирре-Уризар, JM; Морагес, доктор медицины; Раутемаа, Р. (март 2013 г.). «Продуцирование канцерогенного ацетальдегида Candida albicans у пациентов с потенциально злокачественными заболеваниями слизистой оболочки полости рта» . Журнал патологии полости рта и медицины . 42 (3): 243–249. дои : 10.1111/j.1600-0714.2012.01203.x . ПМИД 22909057 .
Внешние ссылки
[ редактировать ]- Международная карта химической безопасности 0009
- Карманный справочник NIOSH по химическим опасностям
- Методы отбора проб и анализа
- Монография МАИР: «Ацетальдегид».
- Хэл Кибби, Генетическое влияние на употребление алкоголя и алкоголизм , Исследования и творческая деятельность Университета Индианы, Vol. 17 нет. 3.
- Информация Управления по контролю за продуктами и лекарствами США (FDA) об ацетальдегиде
- Технологическая схема производства ацетальдегида методом окисления этилена