Паральдегид
 | |
| Имена | |
|---|---|
| Название ИЮПАК 2,4,6-Триметил-1,3,5-триоксан | |
| Систематическое название ИЮПАК 2,4,6-Триметил-1,3,5-триоксан | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ЧЭБИ | |
| ЧЕМБЛ | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.004.219 |
| Номер ЕС |
|
| КЕГГ | |
| МеШ | Паральдегид |
ПабХим CID | |
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| С 6 Н 12 О 3 | |
| Молярная масса | 132.159 g·mol −1 |
| Появление | Бесцветная жидкость |
| Запах | Сладкий |
| Плотность | 0,996 г/см 3 |
| Температура плавления | 12 ° C (54 ° F; 285 К) |
| Точка кипения | 124 ° С (255 ° F, 397 К) [1] |
| растворим 10% об. при 25 град. | |
| Давление пара | 13 гПа при 20 °C [1] |
| -86.2·10 −6 см 3 /моль | |
| Фармакология | |
| N05CC05 ( ВОЗ ) | |
| Опасности | |
| Безопасность и гигиена труда (OHS/OSH): | |
Основные опасности | Легковоспламеняющийся |
| СГС Маркировка : | |
 | |
| Предупреждение | |
| H226 | |
| П210 , П233 , П303+П361+П353 , П370+П378 , П403+П235 , П501 | |
| точка возгорания | 24°C – закрытый тигель |
| Взрывоопасные пределы | Верхний предел: 17 %(В) Нижний предел: 1,3 % (В) |
| Летальная доза или концентрация (LD, LC): | |
ЛД 50 ( средняя доза ) | Перорально - Крыса - 1530 мг/кг Дермально - Кролик - 14 015 мг/кг |
| Паспорт безопасности (SDS) | [1] |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
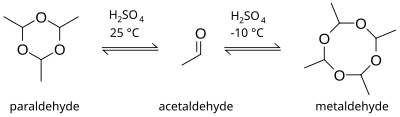
Паральдегид представляет собой циклический тример молекул ацетальдегида . [2] Формально это производное 1,3,5-триоксана , в котором метильная группа замещена атомом водорода у каждого углерода. Соответствующий тетрамер представляет собой метальдегид . Бесцветная жидкость, умеренно растворима в воде и хорошо растворима в этаноле . Паральдегид медленно окисляется на воздухе, становясь коричневым и создавая запах уксусной кислоты . Он разъедает большинство пластиков и резин, поэтому его следует хранить в стеклянных бутылках.
Паральдегид впервые наблюдал в 1835 году немецкий химик Юстус Либих ; его эмпирическая формула была определена в 1838 году учеником Либиха Германом Фелингом . [3] [4] Немецкий химик Валентин Герман Вайденбуш (1821–1893), еще один ученик Либиха, синтезировал паральдегид в 1848 году обработкой ацетальдегида кислотой (серной или азотной) и охлаждением до 0°C. Он нашел весьма примечательным, что когда паральдегид нагревали с небольшим количеством той же кислоты, реакция шла в другую сторону, воссоздавая ацетальдегид. [5] [6]
Паральдегид находит применение в промышленности и медицине.
Подготовка
[ редактировать ]Паральдегид можно получить прямой реакцией ацетальдегида и серной кислоты . Продукт реакции зависит от температуры. При комнатной температуре и выше образование тримера является предпочтительным, но при более низких температурах, около -10 ° C, тетрамерного метальдегида . более вероятно образование [7]
Реакция серной кислоты с ацетальдегидом экзотермическая, теплота реакции составляет -113 кДж·моль. −1 . [8]
Стереохимия
[ редактировать ]Паральдегид производят и используют в виде смеси двух диастереомеров, известных как цис- и транс- паральдегид. Для каждого диастереомера возможны два конформера кресла. Структуры (1), (4) и (2), (3) являются конформерами цис- и транс -паральдегида соответственно. Структуры (3) (конформер (2)) и (4) (конформер (1)) являются высокоэнергетическими конформерами по стерическому признаку (наличие 1,3-диаксиальных взаимодействий) и не существуют в сколько-нибудь заметной степени. в образце паральдегида. [9] [10]
Реакции
[ редактировать ]При нагревании с каталитическим количеством кислоты он деполимеризуется обратно в ацетальдегид : [11] [12]
- С 6 Н 12 О 3 → 3СН 3 СНО
Поскольку паральдегид обладает лучшими эксплуатационными характеристиками, его можно использовать косвенно или напрямую в качестве синтетического эквивалента безводного ацетальдегида (температура кипения 20 °C). Например, он используется в чистом виде при синтезе бромаля (трибромацетальдегида): [13]
- C 6 H 12 O 3 + 9 Br 2 → 3 CBr 3 CHO + 9 HBr
Медицинские приложения
[ редактировать ]Паральдегид был введен в клиническую практику в Великобритании итальянским врачом Винченцо Сервелло (1854–1918) в 1882 году. [14] [15] [16]
Это центральной нервной системы депрессант , и вскоре было обнаружено, что он является эффективным противосудорожным , снотворным и седативным средством . Его включали в некоторые лекарства от кашля в качестве отхаркивающего средства (хотя не существует известного механизма этой функции, кроме эффекта плацебо ).
Паральдегид был последней инъекцией, сделанной Эдит Элис Моррелл в 1950 году подозреваемым серийным убийцей Джоном Бодкином Адамсом . Его судили за ее убийство, но оправдали.
Как снотворное/седативное средство
[ редактировать ]Его обычно использовали для того, чтобы вызвать сон у страдающих белой горячкой, но в этом отношении он был заменен другими препаратами. Он считался одним из самых безопасных снотворных, и его регулярно давали перед сном в психиатрических больницах и гериатрических отделениях до 1970-х годов. [ нужна ссылка ] , но после того, как было подтверждено, что ацетальдегид является подтвержденным канцерогеном для человека категории 1, его больше нельзя было считать достаточно безопасным для использования. До 30% дозы выводится через легкие (остальная часть – через печень). Это способствует появлению сильного неприятного запаха изо рта.
В качестве противосудорожного препарата
[ редактировать ]Сегодня паральдегид иногда используют для лечения эпилептического статуса . В отличие от диазепама и других бензодиазепинов , он не подавляет дыхание в терапевтических дозах и поэтому более безопасен, когда нет реанимационных средств или когда дыхание пациента уже нарушено. [17] Это делает его полезным лекарством для оказания неотложной помощи родителям и другим лицам, осуществляющим уход за детьми, больными эпилепсией. Поскольку разница в дозе между противосудорожным и снотворным эффектом невелика, лечение паральдегидом обычно приводит к сну.
Администрация
[ редактировать ]Этот раздел нуждается в дополнительных цитатах для проверки . ( июнь 2015 г. ) |

Дженерик паральдегида доступен в запечатанных стеклянных ампулах по 5 мл. Производство в США прекращено, но ранее он продавался как Paral .
Паральдегид вводили перорально, ректально, внутривенно и внутримышечно. Он вступает в реакцию с резиной и пластиком, что ограничивает время его безопасного контакта с некоторыми шприцами или трубками перед введением.
- Инъекция . Внутримышечная инъекция может быть очень болезненной и привести к стерильным абсцессам, повреждению нервов и некрозу тканей. Внутривенное введение может привести к отеку легких , циркуляторному коллапсу и другим осложнениям.
- Оральный . Паральдегид имеет жгучий вкус и может вызвать расстройство желудка. Его часто смешивают с молоком или фруктовым соком в стеклянной чашке и перемешивают металлической ложкой.
- Ректально . Можно смешать 1 часть паральдегида с 9 частями физиологического раствора или, альтернативно, с равной смесью арахисового или оливкового масла .
Промышленное применение
[ редактировать ]Паральдегид используется в производстве смол как альтернатива формальдегиду при производстве фенолформальдегидных смол . Он также нашел применение в качестве противомикробного консерванта и редко в качестве растворителя . Он использовался для получения альдегида фуксина . [18]
Ссылки
[ редактировать ]- ^ Jump up to: а б с Sigma-Aldrich Co. , Паральдегид .
- ^ Ванхеде, штат Нью-Йорк; Ванхеде, Д.С.; Ланде, МК; Арбад, БР (март 2006 г.). «Плотность и скорости ультразвука бинарных смесей 2,4,6-триметил-1,3,5-триоксана + н -спиртов при 298,15, 303,15 и 308,15 К» (PDF) . Индийский журнал химической технологии . 13 (2): 149–155.
- ^ Либих, Юстус (1835) «Ueber die Producte der Oxydation des Alkohols» (О продуктах окисления этанола), Annalen der Chemie , 14 : 133–167; см. особенно стр. 141.
- ^ Фелинг, Х. (1838) «О двух соединениях , изомерных ацетальдегиду», Annals of Chemistry , 27 : 319–322; см. стр. 321–322.
- ^ Вайденбуш, Х. (1848) «О некоторых продуктах реакции щелочей и кислот с ацетальдегидом» , Annals of Chemistry , 66 : 152-165; см. стр. 155–158.
- ^ Паральдегид был впервые синтезирован Вейденбушем в 1848 году:
- (Редакция) (15 апреля 1885 г.) «Действие паральдегида», The The Therapeutic Gazette , 9 : 247–250; см. стр. 247.
- См. также: Генри Уоттс, Мэтью Монкрифф, Паттисон Мьюир и Генри Форстер Морли, Химический словарь Уоттса , ред., том. 1 (Лондон, Англия: Лонгманс, Грин и Ко, 1905), с. 106.
- Нил Буссе, Мастер и его ученики: сеть Юстуса Либиха и его учеников (Хильдесхайм, Германия: Georg Olms Verlag, 2015); даты Вайденбуша см. на стр. 274.
- См. также: Джозеф С. Фрутон (март 1988 г.) «Исследовательская группа Либиха: переоценка», Proceedings of the American Philosophical Society , 132 (1): 1–66; см. стр. 59.
- См. Также: Немецкая биографическая энциклопедия, заархивировано 11 августа 2014 г. в Wayback Machine (Немецкая биографическая энциклопедия), стр. 1154.
- ^ Лача, Ганс Петер; Казмайер, Ули; Кляйн, Хельмут А. (2005). Химия для биологов с 71 таблицей (на немецком языке). Берлин. п. 515. ИСБН 978-3-540-21161-7 . OCLC 76495748 .
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ) - ^ Эккерт, Марк; Флейшманн, Джеральд; Йира, Рейнхард; Болт, Герман М.; Голка, Клаус (15 декабря 2006 г.), «Ацетальдегид», Энциклопедия промышленной химии Ульмана , Вайнхайм, Германия: Wiley-VCH Verlag GmbH & Co. KGaA, номер документа : 10.1002/14356007.a01_031.pub2 , ISBN 3527306730
- ^ Кьюли, Р. (1970). «Микроволновой спектр паральдегида» . Канадский химический журнал . 48 (5): 852–855. дои : 10.1139/v70-136 .
- ^ Карпентер, округ Колумбия; Броквей, Лоу (1936). «Электронографическое исследование паральдегида». Журнал Американского химического общества . 58 (7): 1270–1273. дои : 10.1021/ja01298a053 .
- ^ Кендалл, ЕС; Маккензи, БФ (1941). «дл-аланин» . Органические синтезы ; Сборник томов , т. 1, с. 21 .
- ^ Натан Л. Дрейк и Джайлз Б. Кук (1943). «Метилизопропилкарбинол» . Органические синтезы ; Сборник томов , т. 2, с. 406 .
- ^ Ф.А. Лонг и Дж. У. Ховард. «Бромаль» . Органические синтезы ; Сборник томов , т. 2, с. 87 .
- ^ Лопес-Муньос Ф, Уча-Удабе Р, Аламо К (декабрь 2005 г.). «История барбитуратов спустя столетие после их клинического внедрения» . Нервно-психические заболевания и лечение . 1 (4): 329–43. ПМК 2424120 . ПМИД 18568113 .
- ^ См.:
- Сервелло, Винченцо (1883) «О физиологическом действии паральдегида и вкладе в изучение хлоралгидрата» , Archivio per le Scienze Mediche , 6 (12): 177–214.
- Сервелло, Винченцо (1884) Клинические и физиологические исследования паральдегида , Итальянский биологический архив , 6 : 113–134.
- ^ Биографическую информацию о Венченцо Червелло см.: Dizionario Biografico (на итальянском языке).
- ^ Норрис Э., Марзук О., Нанн А., Макинтайр Дж., Чунара И. (1999). «Депрессия дыхания у детей, получающих диазепам при острых судорогах: проспективное исследование». Dev Med Детский Нейрол . 41 (5): 340–3. дои : 10.1017/S0012162299000742 . ПМИД 10378761 .
- ^ Нетлтон Г.С. (февраль 1982 г.). «Роль паральдегида в быстром получении альдегида фуксина» . Журнал гистохимии и цитохимии . 30 (2): 175–8. дои : 10.1177/30.2.6174561 . ПМИД 6174561 .