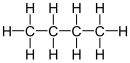
Бутан
| |||
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название ИЮПАК Бутан [3] | |||
| Систематическое название ИЮПАК Тетракарбан (никогда не рекомендуется [3] ) | |||
| Другие имена | |||
| Идентификаторы | |||
3D model ( JSmol ) | |||
| 969129 | |||
| ЧЭБИ | |||
| ЧЕМБЛ | |||
| ХимическийПаук | |||
| Информационная карта ECHA | 100.003.136 | ||
| Номер ЕС |
| ||
| номер Е | E943a (глянцеватели, ...) | ||
| 1148 | |||
| КЕГГ | |||
| МеШ | бутан | ||
ПабХим CID | |||
| номер РТЭКС |
| ||
| НЕКОТОРЫЙ | |||
| Число | 1011 | ||
Панель управления CompTox ( EPA ) | |||
| Характеристики | |||
| С 4 Ч 10 | |||
| Молярная масса | 58.124 g·mol −1 | ||
| Появление | Бесцветный газ | ||
| Запах | Бензиноподобный или природный газоподобный [1] | ||
| Плотность | 2,48 кг/м 3 (при 15 ° C (59 ° F)) | ||
| Температура плавления | от −140 до −134 °С; от –220 до –209 °F; от 133 до 139 К | ||
| Точка кипения | от −1 до 1 °С; от 30 до 34 °F; от 272 до 274 К | ||
| 61 мг/л (при 20 °C (68 °F)) | |||
| войти P | 2.745 | ||
| Давление пара | ~170 кПа при 283 К [4] | ||
Закон Генри постоянная ( k H ) | 11 нмоль Па −1 кг −1 | ||
| −57.4·10 −6 см 3 /моль | |||
| Термохимия | |||
Теплоемкость ( С ) | 98,49 Дж/(К·моль) | ||
Стандартная энтальпия образование (Δ f H ⦵ 298 ) | −126,3–−124,9 кДж/моль | ||
Стандартная энтальпия горение (Δ c H ⦵ 298 ) | −2,8781–−2,8769 МДж/моль | ||
| Опасности [5] | |||
| СГС Маркировка : | |||
  | |||
| Опасность | |||
| Н220 | |||
| Р210 | |||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | -60 ° C (-76 ° F; 213 К) | ||
| 405 ° С (761 ° F, 678 К) | |||
| Взрывоопасные пределы | 1.8–8.4% | ||
| NIOSH (пределы воздействия на здоровье в США): | |||
МЕХ (Допускается) | никто [1] | ||
РЕЛ (рекомендуется) | TWA 800 частей на миллион (1900 мг/м 3 ) [1] | ||
IDLH (Непосредственная опасность) | 1600 частей на миллион [1] | ||
| Родственные соединения | |||
Родственные алканы | |||
Родственные соединения | Перфторбутан | ||
| Страница дополнительных данных | |||
| Бутан (страница данных) | |||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Бутан ( / ˈ b juː t eɪ n / ) или н -бутан представляет собой алкан с формулой C 4 H 10 . Бутан — легковоспламеняющийся, бесцветный, легко сжижаемый газ , быстро испаряющийся при комнатной температуре и давлении. Название бутан происходит от корня бут- (от масляной кислоты , названной в честь греческого слова, обозначающего масло) и суффикса -ан . Он был обнаружен в сырой нефти в 1864 году Эдмундом Рональдсом , который первым описал его свойства. [6] [7] и коммерциализирован Уолтером О. Снеллингом в начале 1910-х годов.
Бутан относится к группе сжиженных нефтяных газов (СПГ). Остальные включают пропан , пропилен , бутадиен , бутилен , изобутилен и их смеси. Бутан горит чище, чем бензин и уголь.
История [ править ]
Этот раздел нуждается в расширении . Вы можете помочь, добавив к нему . ( июнь 2021 г. ) |
Первый синтез бутана был случайно осуществлен британским химиком Эдвардом Франклендом в 1849 году из этилиодида и цинка, но он не осознавал, что этиловый радикал димеризуется, и это вещество было ошибочно идентифицировано. [8]
Эдмунд Рональдс был первым человеком, который выделил и описал бутан, который он назвал «гидридом бутила ». [9] на основе названия известной тогда масляной кислоты , которую назвал и описал французский химик Мишель Эжен Шеврёль. [10] 40 лет назад. Другие названия возникли в 1860-х годах: «бутилгидрид», [11] «гидрид тетрила» [12] и «тетрилгидрид», [13] «диэтил» или «этилэтилид» [14] и другие. Август Вильгельм фон Хофманн в своей системной номенклатуре 1866 года предложил название «квартан». [2] а современное название было введено в английский язык из немецкого примерно в 1874 году. [15]
Бутан не имел большого практического применения до 1910-х годов, когда У. Снеллинг определил бутан и пропан как компоненты бензина и обнаружил, что, если их охладить, их можно хранить в сжиженном состоянии с уменьшенным объемом в контейнерах под давлением. В 1911 году сжиженный нефтяной газ Снеллинга стал общедоступным, а его способ производства смеси был запатентован в 1913 году. [16] Бутан является одним из наиболее производимых промышленных химикатов в 21 веке: ежегодно в Соединенных Штатах производится около 80–90 миллиардов фунтов (40 миллионов тонн США, 36 миллионов метрических тонн). [17]
Плотность [ править ]
Плотность бутана сильно зависит от температуры и давления в пласте. [18] Например, плотность жидкого бутана составляет 571,8±1 кг/м. 3 (для давления до 2 МПа и температуры 27±0,2 °С), а плотность жидкого бутана составляет 625,5±0,7 кг/м. 3 (для давления до 2 МПа и температуры -13±0,2 °С).
Изомеры [ править ]
| Общее имя | нормальный бутан неразветвленный бутан н -бутан | изобутан я -бутан |
| Название ИЮПАК | бутан | метилпропан |
| Молекулярный диаграмма |  |  |
| Скелетный диаграмма |  |
Вращение вокруг центральной связи C-C приводит к образованию двух разных конформаций ( транс- и гош ) н- бутана. [19]
Реакция [ править ]

Когда кислорода много, бутан сгорает с образованием углекислого газа и водяного пара; когда кислород ограничен, углерод ( сажа ) или окись углерода также может образовываться . Бутан плотнее воздуха.
Когда кислорода достаточно:
- 2 С 4 Н 10 + 13 О 2 → 8 СО 2 + 10 Н 2 О
Когда кислород ограничен:
- 2 С 4 Н 10 + 9 О 2 → 8 СО + 10 Н 2 О
По весу бутан содержит около 49,5 МДж / кг (13,8 кВтч /кг; 22,5 МДж/ фунт ; 21300 БТЕ /фунт) или по объему жидкости 29,7 мегаджоулей на литр (8,3 кВтч/л; 112 МДж/галлон США; 107000 БТЕ/США). Гал).
Максимальная адиабатическая температура пламени бутана с воздухом составляет 2243 К (1970 ° C; 3578 ° F).
н- Бутан является сырьем для компании DuPont каталитического процесса производства малеинового ангидрида :
- 2 СН 3 СН 2 СН 2 СН 3 + 7 О 2 → 2 С 2 Н 2 (СО) 2 О + 8 Н 2 О
н -Бутан, как и все углеводороды, подвергается свободнорадикальному хлорированию с образованием как 1-хлор-, так и 2-хлорбутанов, а также более сильно хлорированных производных. Относительная скорость хлорирования частично объясняется разной энергией диссоциации связей : 425 и 411 кДж /моль для двух типов связей CH.
Использует [ править ]
Обычный бутан может использоваться для смешивания бензинов , в качестве топливного газа, растворителя для экстракции ароматизаторов, отдельно или в смеси с пропаном , а также в качестве сырья для производства этилена и бутадиена , ключевого ингредиента синтетического каучука . Изобутан в основном используется на нефтеперерабатывающих заводах для повышения (повышения) октанового числа автомобильного бензина. [20] [21] [22] [23]
При смешивании бензина н-бутан является основным компонентом, используемым для управления давлением паров по Рейду (RVP). Поскольку для запуска двигателей зимнее топливо требует гораздо более высокого давления паров, нефтеперерабатывающие заводы повышают RVP, добавляя в топливо больше бутана. [24] н-Бутан имеет относительно высокое октановое число по исследовательскому методу (RON) и моторное октановое число (MON), которые составляют 93 и 92 соответственно. [25]
При смешивании с пропаном и другими углеводородами смесь можно назвать коммерческим сжиженным нефтяным газом (СНГ). Он используется в качестве компонента бензина, в качестве сырья для производства базовых нефтехимических продуктов при паровом крекинге , в качестве топлива для зажигалок и в качестве пропеллента в аэрозольных баллончиках, таких как дезодоранты . [26]
Чистые формы бутана, особенно изобутан, используются в качестве хладагентов и в значительной степени заменили , разрушающие озоновый слой, галогенметаны в холодильниках, морозильниках и системах кондиционирования воздуха. Рабочее давление бутана ниже, чем у галометанов, таких как фреон-12 (R-12), поэтому системы R-12, например, в автомобильных системах кондиционирования воздуха, при преобразовании в чистый бутан будут работать плохо. Вместо этого используется смесь изобутана и пропана, чтобы обеспечить эффективность системы охлаждения, сравнимую с использованием R-12. [27]
Бутан также используется в качестве топлива для обычных зажигалок или бутановых горелок и продается в бутылках в качестве топлива для приготовления пищи, барбекю и походных печей. В 20 веке немецкая компания Braun выпустила беспроводное устройство для укладки волос, в котором в качестве источника тепла для производства пара использовался бутан . [28]
В качестве топлива его часто смешивают с небольшим количеством меркаптанов , чтобы придать несгоревшему газу неприятный запах, легко уловимый человеческим носом. Таким образом можно легко обнаружить утечку бутана. Хотя сероводород и меркаптаны токсичны, их уровни настолько низки, что опасность удушья и пожара из-за бутана становится проблемой задолго до токсичности. [29] [30] Большая часть коммерчески доступного бутана также содержит некоторое количество загрязняющего масла, которое можно удалить фильтрацией, иначе оно оставит отложения в месте воспламенения и в конечном итоге может заблокировать равномерный поток газа. [31]
Бутан, используемый в качестве растворителя для экстракции ароматизаторов, не содержит этих примесей. [32] а бутан может вызвать взрывы газа в плохо вентилируемых помещениях, если утечки остаются незамеченными и воспламеняются от искры или пламени. [5] Очищенный бутан используется в качестве растворителя при промышленной экстракции масел каннабиса.
- Канистры с бутановым топливом для использования в походных печах.
- Бутановая зажигалка с резервуаром для жидкого бутана.
- Аэрозольный баллончик, в котором в качестве топлива может использоваться бутан.
- Газовый баллон с бутаном, используемый для приготовления пищи
и проблемы Последствия здоровьем со
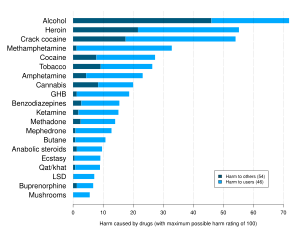
Вдыхание бутана может вызвать эйфорию , сонливость , потерю сознания , асфиксию , сердечную аритмию , колебания артериального давления и временную потерю памяти при злоупотреблении непосредственно из баллона под высоким давлением, а также может привести к смерти от удушья и фибрилляции желудочков . Он попадает в кровь и в течение нескольких секунд вызывает интоксикацию. [34] Бутан является наиболее распространенным летучим веществом, которым злоупотребляют в Великобритании, и в 2000 году он стал причиной 52% смертей, связанных с растворителями. [35] При распылении бутана непосредственно в горло струя жидкости может быстро охладиться до -20 °C (-4 °F) за счет расширения, вызывая длительный ларингоспазм . [36] Синдром «внезапной смерти нюхача» , впервые описанный Бассом в 1970 году. [37] является наиболее распространенной причиной смерти, связанной с растворителями, на которую приходится 55% известных случаев летального исхода. [36]
См. также [ править ]
- Циклобутан
- Диметиловый эфир
- Злоупотребление летучими веществами
- Бутан (страница данных)
- Бутанон
- н -бутанол
- Промышленный газ
Ссылки [ править ]
- ↑ Перейти обратно: Перейти обратно: а б с д и Карманный справочник NIOSH по химическим опасностям. «#0068» . Национальный институт охраны труда и здоровья (NIOSH).
- ↑ Перейти обратно: Перейти обратно: а б Август Вильгельм фон Хофманн (1867). «I. О действии треххлористого фосфора на соли ароматических моноаминов» . Труды Лондонского королевского общества . 15 : 54–62. дои : 10.1098/rspl.1866.0018 . S2CID 98496840 .
- ↑ Перейти обратно: Перейти обратно: а б «Фронт материи». Номенклатура органической химии: рекомендации ИЮПАК и предпочтительные названия 2013 г. (Синяя книга) . Кембридж: Королевское химическое общество . 2014. с. 4. дои : 10.1039/9781849733069-FP001 . ISBN 978-0-85404-182-4 .
Точно так же сохраненные названия «этан», «пропан» и «бутан» никогда не заменялись систематическими названиями «дикарбан», «трикарбан» и «тетракарбан», рекомендованными для аналогов силана, «дисилан»; фосфан, «трифосфан»; и сульфан, «тетрасульфан».
- ^ УБ Кей (1940). «Зависимость давления, объема и температуры для н-бутана». Промышленная и инженерная химия . 32 (3): 358–360. дои : 10.1021/ie50363a016 .
- ↑ Перейти обратно: Перейти обратно: а б «Паспорт безопасности, название материала: н-бутан» (PDF) . США: Matheson Tri-Gas Incorporated. 5 февраля 2011 г. Архивировано из оригинала (PDF) 1 октября 2011 г. . Проверено 11 декабря 2011 г.
- ^ Уоттс, Х.; Мьюир, ММП; Морли, Х.Ф. (1894 г.). Химический словарь Уоттса . Том. 4. Лонгманс, Грин. п. 385.
- ^ Мэйбери, CF (1896). «О составе серной нефти Огайо и Канады». Труды Американской академии искусств и наук . 31 : 1–66. дои : 10.2307/20020618 . JSTOR 20020618 .
- ^ Сейферт, Дитмар (2001). «Алкилы цинка, Эдвард Франкленд и начало металлоорганической химии основной группы» . Металлоорганические соединения . 20 (14): 2940–2955. дои : 10.1021/om010439f .
- ^ «Журнал Химического общества» . 1865.
- ^ Шеврёль (1817) «Отрывок из письма г-на Шеврёля редакторам «Фармацевтического журнала»» , Journal de Pharmacie et des Sciences Accessories , 3 : 79–81. Мы п. 81, он назвал масляную кислоту: я с тех пор назвал «масляной кислотой»,… « Этот принцип [то есть составляющий], который
- ^ Норман Тейт, А. (1863). «Нефть и ее продукты: отчет о свойствах, использовании, коммерческой ценности и т. д. нефти, методах ее переработки, а также свойствах, использовании и т. д. ее продуктов» .
- ^ Уоттс, Генри (1865). «Химический словарь» .
- ^ Миллер, Уильям Аллен (1867). «Элементы химии ч. 3 1867 г.» .
- ^ Миллер, Уильям Аллен (1869). «Элементы химии: Теоретические и практические: Органическая химия» .
- ^ Шорлеммер, Карл (1874). «Руководство по химии углеродных соединений, или органическая химия» .
- ^ Техасский пропан (2022 г.). «История пропана» .
- ^ «Данные химического производства» . 2024.
- ^ Зивенко, Алексей (2019). «Специфика учета СУГ при его хранении и транспортировке» . Измерительная техника и метрология . 80 (3): 21–27. дои : 10.23939/istcmtm2019.03.021 . ISSN 0368-6418 . S2CID 211776025 .
- ^ Роман Михайлович Балабин (2009). «Разница в энтальпиях между конформациями нормальных алканов: исследование рамановской спектроскопии н -пентана и н -бутана». Дж. Физ. хим. А. 113 (6): 1012–9. Бибкод : 2009JPCA..113.1012B . дои : 10.1021/jp809639s . ПМИД 19152252 .
- ^ MarkWest Energy Partners, LP Форма 10-K . Секретное правительство.
- ^ Copano Energy, LLC Форма 10-K . Секретное правительство. Проверено 3 декабря 2012 г.
- ^ Форма LP Targa Resources Partners 10-k . Секретное правительство. Проверено 3 декабря 2012 г.
- ^ Crosstex Energy, LP ФОРМА 10-K . Секретное правительство.
- ^ Морис Стюарт, Кен Арнольд. «Давление пара по Риду» . Наука Директ . Архивировано из оригинала 13 июня 2020 года.
- ^ Джечура, Джон. «Октановое число» (PDF) . Колорадская горная школа . Архивировано (PDF) из оригинала 1 мая 2015 г.
- ^ Учебник по смешиванию бензина. Архивировано 30 июня 2013 года в Wayback Machine . Информационный меморандум ЭПРИНК.
- ^ «R600a | Информация о продукте» . www.agas.com . Проверено 1 декабря 2023 г.
- ^ «Руководство пользователя утюжка для укладки Braun C 100 TS, тип 3589» . Инмар-ОЙК, ООО. nd
- ^ Грешем, Чип (16 ноября 2019 г.). «Токсичность сероводорода: основы практики, патофизиология, этиология» . Справочник Медскейп . Проверено 22 марта 2021 г.
- ^ Комитет по рекомендуемым уровням острого воздействия; Комитет по токсикологии; Совет по экологическим исследованиям и токсикологии; Отдел исследований Земли и жизни; Национальный исследовательский совет (26 сентября 2013 г.). 2. Рекомендуемые уровни острого воздействия метилмеркаптана . National Academies Press (США) – через книжную полку NCBI.
- ^ «Таинственное масло БХО» . Исследование Skunk Pharm . 26 августа 2013 года . Проверено 5 декабря 2019 г.
- ^ «Заключительный отчет об оценке безопасности изобутана, изопентана, н-бутана и пропана». Журнал Американского колледжа токсикологии . 1 (4). Публикации SAGE: 127–142. 1982. дои : 10.3109/10915818209021266 . ISSN 0730-0913 . S2CID 208503534 .
- ^ Натт DJ, King LA, Phillips LD (ноябрь 2010 г.). «Вред от наркотиков в Великобритании: многокритериальный анализ решений». Ланцет . 376 (9752): 1558–1565. CiteSeerX 10.1.1.690.1283 . дои : 10.1016/S0140-6736(10)61462-6 . ПМИД 21036393 . S2CID 5667719 .
- ^ «Нейротоксическое воздействие газа бутана» . thcfarmer.com . 19 декабря 2009 года . Проверено 3 октября 2016 г.
- ^ Филд-Смит М., Бланд Дж.М., Тейлор Дж.К. и др. «Тенденции смертности, связанной со злоупотреблением летучими веществами, 1971–2004 гг.» (PDF) . Департамент наук общественного здравоохранения. Лондон: Медицинская школа Святого Георгия. Архивировано из оригинала (PDF) 27 марта 2007 года.
- ↑ Перейти обратно: Перейти обратно: а б Рэмси Дж., Андерсон Х.Р., Блур К. и др. (1989). «Введение в практику, распространенность и химическую токсикологию злоупотребления летучими веществами». Хум Токсикол . 8 (4): 261–269. дои : 10.1177/096032718900800403 . ПМИД 2777265 . S2CID 19617950 .
- ^ Бас М (1970). «Внезапная нюхающая смерть». ДЖАМА . 212 (12): 2075–2079. дои : 10.1001/jama.1970.03170250031004 . ПМИД 5467774 .