Селеноводород
 | |||
| |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК Селеноводород | |||
| Другие имена Гидроселеновая кислота селен гидрид селена | |||
| Идентификаторы | |||
3D model ( JSmol ) | |||
| ЧЭБИ | |||
| ХимическийПаук | |||
| Информационная карта ECHA | 100.029.071 | ||
| Номер ЕС |
| ||
| КЕГГ | |||
ПабХим CID | |||
| номер РТЭКС |
| ||
| НЕКОТОРЫЙ | |||
| Число | 2202 | ||
Панель управления CompTox ( EPA ) | |||
| Характеристики | |||
| Н 2 Се | |||
| Молярная масса | 80.98 g/mol | ||
| Появление | Бесцветный газ | ||
| Запах | разложившийся хрен [1] | ||
| Плотность | 3,553 г/дм 3 | ||
| Температура плавления | -65,73 ° C (-86,31 ° F; 207,42 К) | ||
| Точка кипения | -41,25 ° C (-42,25 ° F; 231,90 К) | ||
| 0,70 г/100 мл | |||
| Растворимость | растворим в CS 2 , фосгене | ||
| Давление пара | 9,5 атм (21°С) [1] | ||
| Кислотность ( pKa ) | 3.89 | ||
| Конъюгатная кислота | Селен | ||
| Сопряженная база | Селенид | ||
| Структура | |||
| Бент | |||
| Опасности | |||
| Безопасность и гигиена труда (OHS/OSH): | |||
Основные опасности | Чрезвычайно токсичен и легковоспламеняем. | ||
| СГС Маркировка : | |||
    | |||
| Опасность | |||
| Х220 , Х280 , Х330 , Х410 | |||
| P210 , P260 , P271 , P273 , P284 , P304+P340 , P310 , P320 , P377 , P381 , P391 , P403 , P403+P233 , P405 , P410+P403 , P501 | |||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | горючий газ | ||
| Летальная доза или концентрация (LD, LC): | |||
LC Lo ( самый низкий из опубликованных ) | 0,3 ppm (морская свинка, 8 часов) 5,9 частей на миллион (крыса, 1 час) [2] | ||
| NIOSH (пределы воздействия на здоровье в США): | |||
МЕХ (Допускается) | TWA 0,05 частей на миллион (0,2 мг/м 3 ) [1] | ||
РЕЛ (рекомендуется) | TWA 0,05 частей на миллион (0,2 мг/м 3 ) [1] | ||
IDLH (Непосредственная опасность) | 1 часть на миллион [1] | ||
| Паспорт безопасности (SDS) | КМГС 0284 | ||
| Родственные соединения | |||
Другие анионы | Н 2 О Ч 2 С Н 2 Те Н 2 По | ||
Другие катионы | На 2 Се Ag 2 Se | ||
Родственные соединения | Арсин | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Селеноводород – неорганическое соединение формулы H 2 Se. Этот водорода является простейшим и наиболее часто встречающимся гидридом селена халькогенид . H 2 Se — бесцветный, легковоспламеняющийся газ при стандартных условиях. Это самое токсичное соединение селена. [3] с пределом воздействия 0,05 частей на миллион в течение 8-часового периода. [4] [5] Даже при чрезвычайно низких концентрациях это соединение имеет очень раздражающий запах, напоминающий запах гнилого хрена или «утечки газа», но при более высоких концентрациях пахнет тухлыми яйцами.
Структура и свойства
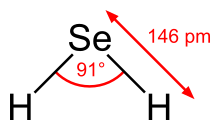
[ редактировать ]H 2 Se имеет изогнутую структуру с валентным углом H-Se-H 91°. [ нужна ссылка ] . В соответствии с этой структурой три ИК -активные колебательные полосы: 2358, 2345 и 1034 см-1. наблюдаются −1 . [6]
Свойства H 2 S и H 2 Se схожи, хотя селенид более кислый с p K a = 3,89 и вторым p K a = 11, [6] или 15,05 ± 0,02 при 25 °С. [7]
Подготовка
[ редактировать ]В промышленности его получают путем обработки элементарного селена при температуре > 300 °C газообразным водородом. [8] ряде путей получения H 2 Сообщалось о Se, которые подходят как для крупномасштабного, так и для мелкомасштабного получения. В лаборатории H 2 Se обычно получают действием воды на Al 2 Se 3 с одновременным образованием гидратированного оксида алюминия . Родственная реакция включает кислотный гидролиз FeSe. [9]
- Al 2 Se 3 + 6 H 2 O ⇌ 2 Al(OH) 3 + 3 H 2 Se
H 2 Se также можно получить различными методами, основанными на генерации in situ в водном растворе с использованием гидрида бора , теста Марша и сплава Деварда . По методу Соноды H 2 Se образуется в результате реакции H 2 с Se в присутствии Et 3 N. O и CO [10] H 2 Se можно приобрести в баллонах.
Реакции
[ редактировать ]Элементарный селен можно получить из H 2 Se посредством реакции с водным диоксидом серы (SO 2 ).
- 2 H 2 Se + SO 2 ⇌ 2 H 2 O + 2 Se + S
Его разложение используется для получения особо чистого элемента.
Приложения
[ редактировать ]H 2 Se обычно используется в синтезе Se-содержащих соединений. Он присоединяется к алкенам. Показательным является синтез селеномочевины из цианамидов : [11]
Газ H 2 Se используется для легирования полупроводников селеном.
Безопасность
[ редактировать ]Селеноводород опасен, поскольку является самым токсичным соединением селена. [3] и гораздо более токсичен, чем родственный ему сероводород . Пороговое предельное значение составляет 0,05 ppm. Газ действует как раздражитель при концентрации выше 0,3 ppm, что является основным признаком воздействия; ниже 1 ppm этого «недостаточно для предотвращения воздействия», а при 1,5 ppm раздражение «непереносимо». [5] Воздействие высоких концентраций, даже менее минуты, приводит к попаданию газа в глаза и слизистые оболочки; это вызывает симптомы, похожие на простуду, в течение как минимум нескольких дней после этого. В Германии предельно допустимый уровень загрязнения питьевой воды составляет 0,008 мг/л, а Агентство по охране окружающей среды США рекомендует максимальное загрязнение 0,01 мг/л. [8] [12]
Несмотря на то, что он чрезвычайно токсичен, о человеческих жертвах пока не сообщалось. Предполагается, что это происходит из-за склонности газа к окислению с образованием красного селена в слизистых оболочках; элементарный селен менее токсичен, чем селениды. [4]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Перейти обратно: а б с д и Карманный справочник NIOSH по химическим опасностям. «#0336» . Национальный институт охраны труда и здоровья (NIOSH).
- ^ «Селеноводород» . Непосредственно опасные для жизни и здоровья концентрации (IDLH) . Национальный институт охраны труда и здоровья (NIOSH).
- ^ Перейти обратно: а б http://www.epa.gov/ttnatw01/hlthef/selenium.html , Агентство по охране окружающей среды США, веб-сайт о воздушных токсинах
- ^ Перейти обратно: а б «CDC – Концентрации, непосредственно опасные для жизни или здоровья (IDLH): Селенид водорода (в виде Se) – Публикации и продукты NIOSH» . www.cdc.gov . 02.11.2018 . Проверено 9 января 2023 г.
- ^ Перейти обратно: а б https://www.cdc.gov/niosh/docs/81-123/pdfs/0336.pdf Руководство по гигиене труда для селеноводорода, Национальный институт безопасности и гигиены труда, 1978 г.
- ^ Перейти обратно: а б Уильям М. Хейнс; Дэвид Р. Лиде; Томас Дж. Бруно, ред. (2017). CRC справочник по химии и физике: готовый справочник химических и физических данных (97-е изд.). Бока-Ратон, Флорида. ISBN 978-1-4987-5429-3 . OCLC 957751024 .
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ) - ^ Леви, Дэниел Э.; Майерс, Ролли Дж. (1990). «Спектроскопическое определение второй константы диссоциации селеноводорода, коэффициентов активности и спектральных сдвигов его ионов». Журнал физической химии . 94 (20): 7842–7847. дои : 10.1021/j100383a020 .
- ^ Перейти обратно: а б Бернд Э. Лангнер «Селен и соединения селена» в Энциклопедии промышленной химии Ульмана, 2005, Wiley-VCH, Вайнхайм. два : 10.1002/14356007.a23_525 .
- ^ Фехер, Ф. В «Справочнике по препаративной неорганической химии»; Брауэр, Э., Ред.; Академический: Нью-Йорк, 1963; 1, с. 418.
- ^ Зонд, Н.; Кондо К.; Нагано, К.; Кэмпбелл, Н.; Моримото, Ф. Angewandte Chemie International Edition, английский 1980, том. 19, стр. 308
- ^ Коэн, VI (1980). «Удобный синтез моно-, N , N' -ди- и тризамещенных селеномочевины из метилкарбамимидотиоатов ( S -метилпсевдотиомочевины)». Синтез . 1980 : 60–63. дои : 10.1055/с-1980-28927 . S2CID 96314420 .
- ^ https://www.osha.gov/dts/chemicalsampling/data/CH_246700.html. Архивировано 2 мая 2017 г. в Wayback Machine , OSHA ОБЩАЯ ПРОМЫШЛЕННОСТЬ PEL: 0,05 частей на миллион, 0,2 мг/м3, OSHA СТРОИТЕЛЬНАЯ ПРОМЫШЛЕННОСТЬ PEL: 0,05 ppm, средневзвешенное значение 0,2 мг/м3



