фтороводород
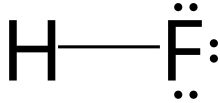 | |||
| |||
| Имена | |||
|---|---|---|---|
| Другие имена Флюоран | |||
| Идентификаторы | |||
3D model ( JSmol ) | |||
| ЧЭБИ | |||
| ХимическийПаук | |||
| Информационная карта ECHA | 100.028.759 | ||
| КЕГГ | |||
ПабХим CID | |||
| номер РТЭКС |
| ||
| НЕКОТОРЫЙ | |||
| Число | 1052 | ||
Панель управления CompTox ( EPA ) | |||
| Характеристики | |||
| ВЧ | |||
| Молярная масса | 20.006 g·mol −1 | ||
| Появление | бесцветный газ или бесцветная жидкость (ниже 19,5 °C) | ||
| Запах | неприятный | ||
| Плотность | 1,15 г/л, газ (25 °C) 0,99 г/мл, жидкость (19,5 °C) 1,663 г/мл, твердый (–125 °C) | ||
| Температура плавления | -83,6 ° C (-118,5 ° F; 189,6 К) | ||
| Точка кипения | 19,5 ° C (67,1 ° F; 292,6 К) | ||
| смешивающийся (жидкий) | |||
| Давление пара | 783 мм рт.ст. (20 °С) [1] | ||
| Кислотность ( pKa ) | 3,17 (в воде), 15 (в ДМСО) [2] | ||
| Конъюгатная кислота | Фтороний | ||
| Сопряженная база | фторид | ||
Показатель преломления ( n D ) | 1.00001 | ||
| Структура | |||
| Линейный | |||
| 1,86 Д | |||
| Термохимия | |||
Стандартный моляр энтропия ( S ⦵ 298 ) | 8,687 Дж/г К (газ) | ||
Стандартная энтальпия образование (Δ f H ⦵ 298 ) | −13,66 кДж/г (газ) −14,99 кДж/г (жидкость) | ||
| Опасности | |||
| Безопасность и гигиена труда (OHS/OSH): | |||
Основные опасности | Высокотоксичный, коррозионный, раздражающий | ||
| СГС Маркировка : | |||
   | |||
| Опасность | |||
| Х300+Х310+Х330 , Х314 | |||
| P260 , P262 , P264 , P270 , P271 , P280 , P284 , P301+P310 , P301+P330+P331 , P302+P350 , P303+P361+P353 , P304+P340 , P305+P351+P338 , П310 , П320 , П321 , П322 , П330 , П361 , П363 , П403+П233 , П405 , П501 | |||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | никто | ||
| Летальная доза или концентрация (LD, LC): | |||
ЛД 50 ( средняя доза ) | 17 частей на миллион (крыса, перорально) | ||
ЛК 50 ( средняя концентрация ) | 1276 частей на миллион (крыса, 1 час) 1774 частей на миллион (обезьяна, 1 час) 4327 частей на миллион (морская свинка, 15 мин) [3] | ||
LC Lo ( самый низкий из опубликованных ) | 313 частей на миллион (кролик, 7 часов) [3] | ||
| NIOSH (пределы воздействия на здоровье в США): | |||
МЕХ (Допускается) | СВВ 3 ppm [1] | ||
РЕЛ (рекомендуется) | СВВ 3 ppm (2,5 мг/м 3 ) C 6 ppm (5 мг/м 3 ) [15 минут] [1] | ||
IDLH (Непосредственная опасность) | 30 частей на миллион [1] | ||
| Родственные соединения | |||
Другие анионы | Хлороводород Бромистый водород Йодоводород Астатид водорода | ||
Другие катионы | фторид натрия Калия фторид Рубидий фторид фторид цезия | ||
Родственные соединения | Вода Аммиак | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Фтороводород (фторан) — неорганическое соединение с химической формулой. Х Ф. Это очень ядовитый бесцветный газ или жидкость, которая растворяется в воде с образованием водного раствора, называемого плавиковой кислотой . Это основной промышленный источник фтора , часто в форме плавиковой кислоты, и важное сырье при получении многих важных соединений, включая фармацевтические препараты и полимеры , например политетрафторэтилен (ПТФЭ). HF также широко используется в нефтехимической промышленности в качестве компонента суперкислот . Из-за сильных и обширных водородных связей он кипит при температуре, близкой к комнатной, что намного выше, чем у других галогеноводородов .
Фтороводород — чрезвычайно опасный газ, образующий едкую и проникающую плавиковую кислоту при контакте с влагой . Газ также может вызвать слепоту из-за быстрого разрушения роговицы .
История [ править ]
В 1771 году Карл Вильгельм Шееле приготовил водный раствор плавиковой кислоты в больших количествах, хотя плавиковая кислота была известна в стекольной промышленности и раньше.Французскому химику Эдмону Фреми (1814–1894) приписывают открытие фторида водорода (HF) при попытке выделить фтор .
Структура и реакции [ править ]

HF двухатомен в газовой фазе. В жидком виде HF образует относительно прочные водородные связи , отсюда и его относительно высокая температура кипения. Твердый HF состоит из зигзагообразных цепочек молекул HF. Молекулы HF с короткой ковалентной связью H–F длиной 95 пм связаны с соседними молекулами межмолекулярными расстояниями H–F 155 пм. [4] Жидкий HF также состоит из цепочек молекул HF, но цепи более короткие и состоят в среднем всего из пяти-шести молекул. [5]
Сравнение с другими галогеноводородами [ править ]
Фтороводород не кипит до 20 ° C, в отличие от более тяжелых галогеноводородов, которые кипят от -85 ° C (-120 ° F) до -35 ° C (-30 ° F). [6] [7] [8] Эта водородная связь между молекулами HF приводит к высокой вязкости в жидкой фазе и более низкому, чем ожидалось, давлению в газовой фазе.
Водные растворы [ править ]
HF смешивается с водой (растворяется в любых пропорциях). Напротив, другие галогениды водорода обладают ограниченной растворимостью в воде. Фтороводород образует моногидрат HF. . H 2 O с температурой плавления -40 °C (-40 °F), что на 44 °C (79 °F) выше температуры плавления чистого HF. [9]
| HF и H 2 O Сходство | |
 |  |
| Точки кипения галогеноводородов (синий) и халькогенидов водорода (красный): HF и H 2 O нарушают тенденции. | Температура замерзания смесей HF/H 2 O: стрелками указаны соединения в твердом состоянии. |
Водные растворы HF называются плавиковой кислотой . В разбавленном виде плавиковая кислота ведет себя как слабая кислота, в отличие от других галоидоводородных кислот, из-за образования ионных пар с водородными связями . H3H3O + ·Ф − ]. Однако концентрированные растворы являются сильными кислотами, поскольку бифторид- в них преобладают анионы, а не ионные пары. В жидком безводном HF самоионизация : происходит [10] [11]
- 3 ВЧ ⇌ Ч 2 Ж + + ВЧ − 2
который образует чрезвычайно кислую жидкость ( H 0 = -15,1 ).
Реакции с кислотами Льюиса [ править ]
Как и вода, HF может действовать как слабое основание, реагируя с кислотами Льюиса с образованием суперкислот . Функция кислотности Гаммета ( H 0 ) -21 получается с помощью пентафторида сурьмы (SbF 5 ), образующего фторсурьмяную кислоту . [12] [13]
Производство [ править ]
Фтороводород обычно получают в результате реакции между серной кислотой и чистыми сортами минерала флюорита : [14]
- CaF 2 + H 2 SO 4 → 2 HF + CaSO 4
Около 20% производимого HF является побочным продуктом производства удобрений, при котором образуется гексафторкремниевая кислота . Эта кислота может разлагаться с выделением HF термически и гидролизом:
- H 2 SiF 6 → 2 HF + SiF 4
- SiF 4 + 2 H 2 O → 4 HF + SiO 2
Используйте [ править ]
В целом безводный фтористый водород более распространен в промышленности, чем его водный раствор, плавиковая кислота . Его основное применение, в пересчете на тоннаж, — это использование в качестве прекурсора фторорганических соединений и прекурсора криолита для электролиза алюминия. [14]
Прекурсор фторорганических соединений
HF реагирует с хлоруглеродами с образованием фторуглеродов. Важным применением этой реакции является производство тетрафторэтилена (ТФЭ), предшественника тефлона . Хлороформ фторируется HF с образованием хлордифторметана (R-22): [14]
- CHCl 3 + 2 HF → CHClF 2 + 2 HCl
Пиролиз хлордифторметана (при 550–750 °С) дает ТФЭ.
HF является активным растворителем при электрохимическом фторировании органических соединений. В этом подходе HF окисляется в присутствии углеводорода , а фтор заменяет связи C–H на связи C–F . перфторкарбоновые кислоты и сульфокислоты . Таким способом получают [15]
1,1-Дифторэтан получают добавлением HF к ацетилену с использованием ртути в качестве катализатора. [15]
- HC≡CH + 2 HF → CH 3 CHF 2
Промежуточным продуктом в этом процессе является винилфторид или фторэтилен, мономерный предшественник поливинилфторида .
Прекурсор фторидов фтора и металлов
Электролитическое получение алюминия основано на электролизе фторида алюминия в расплавленном криолите. На тонну производимого Al расходуется несколько килограммов HF. С использованием HF производятся и другие фториды металлов, в том числе тетрафторид урана . [14]
HF является предшественником элементарного фтора F 2 при электролизе раствора HF и бифторида калия . Бифторид калия необходим, поскольку безводный HF не проводит электричество. несколько тысяч тонн F 2 . Ежегодно производится [16]
Катализатор [ править ]
HF служит катализатором в процессах алкилирования на нефтеперерабатывающих заводах. Он используется на большинстве установленных линейного алкилбензола в мире производств . Процесс включает дегидрирование н- парафинов до олефинов и последующую реакцию с бензолом с использованием HF в качестве катализатора. Например, на нефтеперерабатывающих заводах «алкилат» — компонент высокооктанового бензина ( бензина ) — образуется в установках алкилирования, объединяющих С 3 и С 4 олефины изобутан и . [14]
Растворитель [ править ]
Фтороводород является отличным растворителем. Отражая способность HF участвовать в образовании водородных связей, даже белки и углеводы растворяются в HF и могут быть восстановлены из него. Напротив, большинство нефторидных неорганических химикатов реагируют с HF, а не растворяются. [17]
Влияние на здоровье [ править ]

Фтороводород обладает высокой коррозионной активностью и является сильным контактным ядом. Воздействие требует немедленной медицинской помощи. [18] Это может вызвать слепоту из-за быстрого разрушения роговицы . Вдыхание фтористого водорода в больших количествах или в сочетании с его контактом с кожей может привести к смерти от нерегулярного сердцебиения или отека легких (накопление жидкости в легких). [18]
Ссылки [ править ]
- ^ Jump up to: Перейти обратно: а б с д Карманный справочник NIOSH по химическим опасностям. «#0334» . Национальный институт охраны труда и здоровья (NIOSH).
- ^ Эванс, Д.А. «pKa неорганических и оксокислот» (PDF) . Проверено 19 июня 2020 г.
- ^ Jump up to: Перейти обратно: а б «Фтороводород» . Непосредственно опасные для жизни и здоровья концентрации (IDLH) . Национальный институт охраны труда и здоровья (NIOSH).
- ^ Джонсон, Миссури; Шандор, Э.; Арзи, Э. (1975). «Кристаллическая структура фторида дейтерия». Акта Кристаллографика . B31 (8): 1998–2003 гг. дои : 10.1107/S0567740875006711 .
- ^ Маклейн, Сильвия Э.; Бенмор, CJ; Сивени, JE; Уркиди, Дж.; Тернер, Дж. Ф. (2004). «О строении жидкого фтористого водорода». Angewandte Chemie, международное издание . 43 (15): 1952–55. дои : 10.1002/anie.200353289 . ПМИД 15065271 .
- ^ Полинг, Лайнус А. (1960). Природа химической связи и структура молекул и кристаллов: введение в современную структурную химию . Издательство Корнельского университета. стр. 454–464 . ISBN 978-0-8014-0333-0 .
- ^ Аткинс, Питер; Джонс, Лоретта (2008). Химические принципы: поиски понимания . WH Freeman & Co., стр. 184–185. ISBN 978-1097774678 .
- ^ Эмсли, Джон (1981). «Скрытая сила водорода» . Новый учёный . 91 (1264): 291–292 . Проверено 25 декабря 2012 г.
- ^ Гринвуд, штат Нью-Йорк; Эрншоу, А. (1998). Химия элементов (2-е изд.). Оксфорд: Баттерворт Хайнеманн. стр. 812–816. ISBN 0-7506-3365-4 .
- ^ CE Housecroft и AG Sharpe Неорганическая химия , с. 221.
- ^ Ф. А. Коттон и Г. Уилкинсон, продвинутая неорганическая химия , стр. 111.
- ^ WL Jolly «Современная неорганическая химия» (McGraw-Hill 1984), стр. 203. ISBN 0-07-032768-8 .
- ^ Ф. А. Коттон и Г. Уилкинсон, Продвинутая неорганическая химия (5-е изд.) Джон Вили и сыновья: Нью-Йорк, 1988. ISBN 0-471-84997-9 . п. 109.
- ^ Jump up to: Перейти обратно: а б с д и Ж. Эгеперс, П. Моллард, Д. Девильерс, М. Чемла, Р. Фарон, Р. Романо, Ж. П. Куэр (2000). «Соединения фтора неорганические». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a11_307 . ISBN 3527306730 .
{{cite encyclopedia}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Jump up to: Перейти обратно: а б Г. Зигемунд, В. Швертфегер, А. Фейринг, Б. Смарт, Ф. Бер, Х. Фогель, Б. МакКузик (2005). «Соединения фтора органические». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a11_349 . ISBN 978-3527306732 .
{{cite encyclopedia}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ М. Жакко, Р. Фарон, Д. Девильерс, Р. Романо (2005). "Фтор". Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a11_293 . ISBN 978-3527306732 .
{{cite encyclopedia}}: CS1 maint: несколько имен: список авторов ( ссылка ) . - ^ Гринвуд и Эрншоу, «Химия элементов», стр. 816–819.
- ^ Jump up to: Перейти обратно: а б Факты о фтористом водороде (плавиковой кислоте)



