Гексафторид вольфрама
 Твердый WF 6 плавится в жидкий WF 6 | |||
| |||
| Имена | |||
|---|---|---|---|
| ИЮПАК имена Гексафторид вольфрама Фторид вольфрама(VI) | |||
| Идентификаторы | |||
3D model ( JSmol ) | |||
| Информационная карта ECHA | 100.029.117 | ||
| Номер ЕС |
| ||
ПабХим CID | |||
| НЕКОТОРЫЙ | |||
| Число | 2196 | ||
Панель управления CompTox ( EPA ) | |||
| Характеристики | |||
| ВФ 6 | |||
| Молярная масса | 297.830 g/mol | ||
| Появление | Бесцветный газ | ||
| Плотность | 12,4 г/л (газ) 4,56 г/см 3 (−9 ° C, твердый) | ||
| Температура плавления | 2,3 ° C (36,1 ° F; 275,4 К) | ||
| Точка кипения | 17,1 ° C (62,8 ° F; 290,2 К) | ||
| Гидролизуется | |||
| −40.0·10 −6 см 3 /моль | |||
| Структура | |||
| Октаэдрический | |||
| ноль | |||
| Опасности | |||
| Безопасность и гигиена труда (OHS/OSH): | |||
Основные опасности | Токсичный, коррозионный; дает HF при контакте с водой | ||
| СГС Маркировка : [1] | |||
    | |||
| Опасность | |||
| Х280 , Х301+Х311 , Х314 , Х330 | |||
| P260 , P264 , P264+P265 , P270 , P271 , P280 , P284 , P301+P316 , P301+P330+P331 , P302+P352 , P302+P361+P354 , P304+P340 , P305+P354+P 338 , П316 , П317 , P320 , P321 , P330 , P361+P364 , P363 , P403+P233 , P405 , P410+P403 , P501 | |||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | Невоспламеняющийся | ||
| Паспорт безопасности (SDS) | Химический советник | ||
| Родственные соединения | |||
Другие анионы | гексахлорид вольфрама Гексабромид вольфрама | ||
Другие катионы | Хром(VI) фторид Фторид молибдена(VI) | ||
Родственные соединения | Фторид вольфрама(IV) Фториды вольфрама(V) | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Фторид вольфрама(VI) , также известный как гексафторид вольфрама , представляет собой неорганическое соединение с формулой В Ж 6 . Это токсичный, едкий, бесцветный газ с плотностью около 13 кг/м. 3 (22 фунта на кубический ярд) (примерно в 11 раз тяжелее воздуха). [2] [3] Это единственное известное газообразное соединение переходного металла (или d-блока) и самый плотный известный газ при стандартной температуре и давлении окружающей среды (298 К, 1 атм). [4] WF 6 обычно используется в полупроводниковой промышленности для формирования вольфрамовых пленок методом химического осаждения из паровой фазы . Этот слой используется в с низким удельным сопротивлением металлическом межсоединении . [5] Это один из семнадцати известных бинарных гексафторидов .
Характеристики
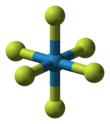
[ редактировать ]The WF 6 является октаэдрической с точечной группой симметрии Oh Молекула . Расстояния связи W–F составляют 183,2 пм . [6] При температуре от 2,3 до 17 °C гексафторид вольфрама конденсируется в бесцветную жидкость плотностью 3,44 г/см. 3 при 15 °С . [7] При 2,3 °C он замерзает в белое твердое вещество, имеющее кубическую кристаллическую структуру, постоянную решетки 628 мкм и расчетную плотность 3,99 г/см. 3 . При -9 °C эта структура превращается в ромбическое твердое тело с постоянной решетки a = 960,3 пм, b = 871,3 пм и c = 504,4 пм и плотностью 4,56 г/см. 3 . На этой фазе расстояние W–F составляет 181 пм, а среднее значение ближайших молекулярных контактов составляет 312 пм . Тогда как Газ WF 6 — один из самых плотных газов, его плотность превышает плотность самого тяжелого элементарного газа радона (9,73 г/л), плотность WF 6 в жидком и твердом состоянии довольно умеренный. [8] Давление пара WF 6 в диапазоне от -70 до 17 °C можно описать уравнением
- log 10 P = 4,55569 - 1021,208 / Т + 208,45 ,
где P = давление пара ( бар ), T = температура (°C). [9] [10]
Синтез
[ редактировать ]Гексафторид вольфрама обычно получают экзотермической реакцией газообразного фтора с вольфрамовым порошком при температуре от 350 до 400 °C : [7]
- В + 3 Ж 2 → ВФ 6
Газообразный продукт отделяют от WOF 4 , обычная примесь, полученная перегонкой. В варианте прямого фторирования металл помещают в нагретый реактор с небольшим давлением от 1,2 до 2,0 фунтов на квадратный дюйм (от 8,3 до 13,8 кПа) с постоянным потоком WF 6 с добавлением небольшого количества газообразного фтора . [11]
Газообразный фтор в описанном выше методе может быть заменен ClF . ClF 3 или БрФ 3 . Альтернативной процедурой получения фторида вольфрама является реакция триоксида вольфрама ( WO 3 ) с ВЧ , БрФ 3 или СФ 4 . Гексафторид вольфрама также можно получить конверсией гексахлорида вольфрама : [4]
- WCl 6 + 6 HF → WF 6 + 6 HCl или
- WCl 6 + 2 AsF 3 → WF 6 + 2 AsCl 3 или
- WCl 6 + 3 SbF 5 → WF 6 + 3 SbF 3 Cl 2
Реакции
[ редактировать ]При контакте с водой гексафторид вольфрама дает фторид водорода (HF) и оксифториды вольфрама, в конечном итоге образуя триоксид вольфрама : [4]
- WF 6 + 3 H 2 O → WO 3 + 6 HF
В отличие от некоторых других фторидов металлов, WF 6 не является полезным фторирующим агентом и не является сильным окислителем. Его можно уменьшить до желтого. ВФ 4 . [12]
WF 6 образует различные аддукты 1:1 и 1:2 с основаниями Льюиса , примерами которых являются WF 6 ( S(CH 3 ) 2 ), WF 6 (S(CH 3 ) 2 ) 2 , WF 6 ( P(CH 3 ) 3 ) и WF 6 ( py ) 2 . [13]
Применение в полупроводниковой промышленности
[ редактировать ]Преобладающее применение фторида вольфрама приходится на полупроводниковую промышленность, где он широко используется для осаждения металлического вольфрама в процессе химического осаждения из паровой фазы . Расширение отрасли в 1980-х и 1990-х годах привело к увеличению Потребление WF 6 остается на уровне около 200 тонн в год во всем мире. Металлический вольфрам привлекателен своей относительно высокой термической и химической стабильностью, а также низким удельным сопротивлением (5,6 мкОм·см) и очень низкой электромиграцией . WF 6 предпочтительнее родственных соединений, таких как WCl 6 или WBr 6 из-за более высокого давления пара, что приводит к более высоким скоростям осаждения. С 1967 года два WF 6 , термическое разложение и водородное восстановление. Разработаны и использованы пути осаждения [14] Требуемый Чистота газа WF 6 довольно высока и варьируется от 99,98% до 99,9995% в зависимости от применения. [4]
Молекулы WF 6 должны быть разделены в процессе CVD. Разложение обычно облегчается смешиванием WF 6 с водородом, силаном , германом , дибораном , фосфином и родственными водородосодержащими газами.
Кремний
[ редактировать ]WF 6 реагирует при контакте с кремниевой подложкой. [4] Разложение WF 6 на кремнии зависит от температуры:
- 2 WF 6 + 3 Si → 2 W + 3 SiF 4 ниже 400 °C и
- WF 6 + 3 Si → W + 3 SiF 2 выше 400 °C.
Эта зависимость имеет решающее значение, поскольку при более высоких температурах расходуется вдвое больше кремния. Осаждение происходит избирательно только на чистый Si, но не на оксид или нитрид кремния, поэтому реакция очень чувствительна к загрязнению или предварительной обработке подложки. Реакция разложения протекает быстро, но насыщается, когда толщина слоя вольфрама достигает 10–15 микрометров . Насыщение происходит потому, что слой вольфрама прекращает диффузию Молекулы WF 6 к подложке Si, которая является единственным катализатором молекулярного распада в этом процессе. [4]
Если осаждение происходит не в инертной, а в кислородсодержащей атмосфере (воздухе), то вместо вольфрама образуется слой оксида вольфрама. [15]
Водород
[ редактировать ]Процесс осаждения происходит при температуре от 300 до 800 °C и приводит к образованию паров фтористого водорода :
- ВФ 6 + 3 Ч 2 → Ж + 6 ВЧ
Кристалличностью полученных слоев вольфрама можно управлять, изменяя ВФ 6 / Отношение H 2 и температура подложки: низкие соотношения и температуры приводят к кристаллитам вольфрама с ориентацией (100) , тогда как более высокие значения благоприятствуют ориентации (111). Образование HF является недостатком, поскольку пары HF очень агрессивны и вытравливают большинство материалов. Кроме того, осажденный вольфрам демонстрирует плохую адгезию к диоксиду кремния, который является основным пассивирующим материалом в полупроводниковой электронике. Поэтому, Перед осаждением вольфрама SiO 2 необходимо покрыть дополнительным буферным слоем. С другой стороны, травление ВЧ может быть полезно для удаления нежелательных слоев примесей. [4]
Силан и герман
[ редактировать ]Характерные особенности осаждения вольфрама из ВФ 6 / SiH 4 отличаются высокой скоростью, хорошей адгезией и гладкостью слоя. Недостатками являются взрывоопасность и высокая чувствительность скорости осаждения и морфологии к параметрам процесса, таким как соотношение смешивания, температура подложки и т. д. Поэтому силан обычно используется для создания тонкого зародышевого слоя вольфрама. Затем его переключают на водород, который замедляет осаждение и очищает слой. [4]
Депонирование из ВФ 6 / Смесь GeH 4 аналогична смеси ВФ 6 / SiH 4 , но слой вольфрама загрязняется относительно (по сравнению с Si) тяжелым германием до концентраций 10–15%. Это увеличивает сопротивление вольфрама примерно с 5 до 200 мкОм·см. [4]
Другие приложения
[ редактировать ]WF 6 может использоваться для производства карбида вольфрама .
Будучи тяжелым газом, WF 6 можно использовать в качестве буфера для контроля газовых реакций. Например, он замедляет химию Ar/ Около 2 / H 2 и снижает температуру пламени. [16]
Безопасность
[ редактировать ]Гексафторид вольфрама — чрезвычайно агрессивное соединение, поражающее любые ткани. Из-за образования плавиковой кислоты при реакции WF 6 с влажностью, Емкости для хранения WF 6 имеют тефлоновые прокладки. [17]
Ссылки
[ редактировать ]- ^ «Гексафторид вольфрама» . pubchem.ncbi.nlm.nih.gov .
- ^ Рукан, Ж.-П.; Ноэль-Дютрио, М.-К. Физические свойства минеральных соединений . Эд. Инженерные методы. п. 138.
- ^ Газовая диаграмма (архив Wayback Machine, 7 сентября 2022 г.)
- ^ Jump up to: а б с д и ж г час я Ласснер, Э.; Шуберт, В.-Д. (1999). Вольфрам - свойства, химия, технология элемента, сплавы и химические соединения . Спрингер. стр. 111, 168. ISBN. 0-306-45053-4 .
- ^ «Химическое осаждение из паровой фазы вольфрама и силицидов вольфрама» . Основы сердечно-сосудистых заболеваний . ССЗ во временной области.
- ^ Лиде, Д.Р., изд. (2005). Справочник CRC по химии и физике (86-е изд.). Бока-Ратон (Флорида): CRC Press. ISBN 0-8493-0486-5 . п. 4-93.
- ^ Jump up to: а б Священник, HF; Свинхерт, CF (1950). «Безводные фториды металлов». В Одриет, LF (ред.). Неорганические синтезы . Том. 3. Вили-Интерсайенс. стр. 171–183. дои : 10.1002/9780470132340.ch47 . ISBN 978-0-470-13162-6 .
- ^ Леви, Дж. (1975). «Структуры фторидов XIII: ромбическая форма гексафторида вольфрама при 193 К по данным дифракции нейтронов». Журнал химии твердого тела . 15 (4): 360–365. Бибкод : 1975JSSCh..15..360L . дои : 10.1016/0022-4596(75)90292-3 .
- ^ Кэди, GH; Харгривз, ГБ, «Давление паров некоторых фторидов и оксифторидов молибдена, вольфрама, рения и осмия», Журнал Химического общества, апрель 1961 г., стр. 1568 - и DOI: 10.1039/jr9610001568.
- ^ Столл, Дэниел Р. (1947). «Давление паров чистых веществ. Органические и неорганические соединения» . Промышленная и инженерная химия . 39 (4): 517–540. дои : 10.1021/ie50448a022 .
- ^ Патент США 6544889 «Способ химического осаждения вольфрама из паровой фазы на полупроводниковую подложку», выдан 8 апреля 2003 г.
- ^ Гринвуд, штат Нью-Йорк; Эрншоу, А. (1997). Химия элементов (2-е изд.). Оксфорд: Баттерворт-Хайнеманн. ISBN 0-7506-3365-4 .
- ^ Бенджамин, Софи Л.; Левасон, Уильям; Рид, Джиллиан (2013). «Фторидные и оксидно-фторидные комплексы металлов и неметаллов средней и высокой степени окисления с нейтральными донорными лигандами». хим. Соц. Преподобный . 42 (4): 1460–1499. дои : 10.1039/C2CS35263J . ПМИД 23014811 .
- ^ Эгеперс, Ж.; Моллард, П.; Девильерс, Д.; Чемла, М.; Фарон, Р.; Романо, Р.; Куэр, Ж.-П. (2005). «Соединения фтора неорганические». В Ульманне (ред.). Энциклопедия промышленной химии . Вайнхайм: Wiley-VCH.
- ^ Кирсс, РУ; Меда, Л. (1998). «Химическое осаждение оксида вольфрама» (PDF) . Прикладная металлоорганическая химия . 12 (3): 155–160. doi : 10.1002/(SICI)1099-0739(199803)12:3<155::AID-AOC688>3.0.CO;2-Z . hdl : 2027.42/38321 .
- ^ Ифичо, П. (2008). Полупроводниковые наночастицы оксидов металлов из предварительно смешанного пламени низкого давления H 2 /O 2 /Ar: синтез и характеристика . Геттинген: Cuvillier Verlag. п. 64. ИСБН 978-3-86727-816-4 .
- ^ «Паспорт безопасности гексафторида вольфрама» (PDF) . Линде Газ. Архивировано из оригинала (PDF) 12 февраля 2010 г.