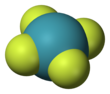
Тетрафторид ксенона
 | |||
| |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК Тетрафторид ксенона | |||
| Идентификаторы | |||
3D model ( JSmol ) | |||
| ХимическийПаук | |||
| Информационная карта ECHA | 100.033.858 | ||
ПабХим CID | |||
| НЕКОТОРЫЙ | |||
Панель управления CompTox ( EPA ) | |||
| Характеристики | |||
| XeF 4 | |||
| Молярная масса | 207.2836 g mol −1 | ||
| Появление | Белый твердый | ||
| Плотность | 4,040 г см −3 , твердый | ||
| Температура плавления | 117 ° C (243 ° F; 390 К) возвышенное [1] | ||
| Реагирует | |||
| Структура | |||
| Д 4 часа | |||
| квадратный плоский | |||
| 0 Д | |||
| Термохимия | |||
Стандартный моляр энтропия ( S ⦵ 298 ) | 146 Дж·моль −1 ·К −1 [2] | ||
Стандартная энтальпия образование (Δ f H ⦵ 298 ) | −251 кДж·моль −1 [2] | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Тетрафторид ксенона — химическое соединение с химической формулой XeF.
4 . Это было первое обнаруженное бинарное соединение благородного газа . [3] получают в результате химической реакции ксенона Его с фтором : [4] [5]
- Автомобиль + 2 Ж
2 → ХеФ
4
Эта реакция является экзотермической , с выделением энергии 251 кДж /моль. [3]
Тетрафторид ксенона — бесцветное кристаллическое вещество, сублимирующееся при 117 °C. Его структура была определена методами ЯМР-спектроскопии и рентгеновской кристаллографии в 1963 году. [6] [7] Структура плоско-квадратная , что подтверждено нейтронографическими исследованиями. [8] Согласно теории VSEPR , помимо четырех фторидных лигандов, центр ксенона имеет две неподеленные пары электронов. Эти одинокие пары взаимно трансгендерны .
Синтез
[ редактировать ]Тетрафторид ксенона получают нагреванием смеси ксенона и фтора в мольном соотношении 1:5 в никелевом контейнере до 400 °С. Некоторое количество дифторида ксенона ( XeF
2 ) и гексафторид ксенона ( XeF
6 ) также производится там, где повышенная температура или пониженная концентрация фтора в исходной смеси благоприятствуют XeF
2 производство, а пониженная температура или повышенная концентрация фтора благоприятствуют XeF.
6 . [9] [10] Никель не является катализатором этой реакции; используются никелевые контейнеры, поскольку они реагируют с фтором с образованием защитного, неотслаивающегося пассивационного слоя фторида никеля (II) NiF.
2 на их внутренних поверхностях. Низкая волатильность XeF
4 по сравнению с XeF
2 и XeF
6 позволяет очищать его фракционной сублимацией. [9]
Реакции
[ редактировать ]Тетрафторид ксенона гидролизуется при низких температурах с образованием элементарного ксенона , кислорода , плавиковой кислоты и водного триоксида ксенона : [11]
Он используется в качестве прекурсора для синтеза всех соединений четырехвалентного Хе. [9] Реакция с фторидом тетраметиламмония дает пентафтороксенат тетраметиламмония , который содержит пентагональный XeF. −
5 анион. XeF −
Анион 5 образуется также при реакции с фторидом цезия : [12]
- CsF + XeF
4 → CsXeF
5
Реакция с пентафторидом висмута ( BiF
5 ) образует XeF +
3 катион: [13]
- Биф
5 + ХеФ
4 → XeF 3 BiF 6
XeF +
Катион 3 в соли XeF 3 Sb 2 F 11 охарактеризован методом ЯМР-спектроскопии. [14]
При 400 °С XeF
4 реагирует с ксеноном с образованием XeF
2 : [10]
- XeF 4 + Xe → 2 XeF 2
Реакция тетрафторида ксенона с платиной дает тетрафторид платины и ксенон: [10]
- XeF 4 + Pt → PtF 4 + Xe
Приложения
[ редактировать ]Тетрафторид ксенона имеет мало применений. Было показано, что он разлагает силиконовую резину при анализе примесей металлов в резине. XeF
4 реагирует с силиконом с образованием простых газообразных продуктов, оставляя осадок металлических примесей. [15]
Ссылки
[ редактировать ]- ^ Холлеман, Арнольд Ф.; Виберг, Эгон (2001). Виберг, Нильс (ред.). Неорганическая химия . Перевод Иглсона, Мэри; Брюэр, Уильям. Академическая пресса. п. 394. ИСБН 0-12-352651-5 .
- ^ Перейти обратно: а б Зумдал, Стивен С. (2009). Химические принципы (6-е изд.). Компания Хоутон Миффлин. п. А23. ISBN 978-0-618-94690-7 .
- ^ Перейти обратно: а б Зумдал (2007). Химия . Бостон: Хоутон Миффлин. п. 243. ИСБН 978-0-618-52844-8 .
- ^ Клаассен, Х.Х.; Селиг, Х.; Мальм, Дж. Г. (1962). «Тетрафторид ксенона». Дж. Ам. хим. Соц. 84 (18): 3593. doi : 10.1021/ja00877a042 .
- ^ Черник, CL; Клаассен, Х.Х.; Филдс, PR; Хайман, Х.Х.; Мальм, Дж.Г.; Мэннинг, В.М.; Мэтисон, MS; Квартерман, Луизиана; Шрайнер, Ф.; Селиг, Х.Х.; Шефт, И.; Сигел, С.; Ленивец, EN; Штейн, Л.; Студиер, МХ; Уикс, Дж.Л.; Зирин, М.Х. (1962). «Фторсодержащие соединения ксенона и радона». Наука . 138 (3537): 136–138. Бибкод : 1962Sci...138..136C . дои : 10.1126/science.138.3537.136 . ПМИД 17818399 . S2CID 10330125 .
- ^ Браун, Томас Х.; Уиппл, Э.Б.; Вердье, Питер Х. (1963). «Тетрафторид ксенона: спектр магнитного резонанса высокого разрешения фтора-19». Наука . 140 (3563): 178. Бибкод : 1963Sci...140..178B . дои : 10.1126/science.140.3563.178 . ПМИД 17819836 . S2CID 35981023 .
- ^ Иберс, Джеймс А.; Гамильтон, Уолтер К. (1963). «Тетрафторид ксенона: кристаллическая структура». Наука . 139 (3550): 106–107. Бибкод : 1963Sci...139..106I . дои : 10.1126/science.139.3550.106 . ПМИД 17798707 . S2CID 42119788 .
- ^ Бернс, Джон Х.; Агрон, Пенсильвания; Леви, Анри А. (1963). «Молекула тетрафторида ксенона и ее тепловое движение: исследование дифракции нейтронов». Наука . 139 (3560): 1208–1209. Бибкод : 1963Sci...139.1208B . дои : 10.1126/science.139.3560.1208 . ПМИД 17757912 . S2CID 35858682 .
- ^ Перейти обратно: а б с Ханер, Джейми; Шробильген, Гэри Дж. (2015). «Химия ксенона (IV)». хим. Преподобный . 115 (2): 1255–1295. дои : 10.1021/cr500427p . ISSN 0009-2665 . ПМИД 25559700 .
- ^ Перейти обратно: а б с Бард, Аллен Дж.; Парсонс, Роджер; Джордан, Джозеф; Международный союз теоретической и прикладной химии (1985). Стандартные потенциалы в водных растворах . ЦРК Пресс. стр. 767–768 . ISBN 0-8247-7291-1 .
- ^ Уильямсон; Кох, CW (март 1963 г.). «Тетрафторид ксенона: реакция с водными растворами». Наука . 139 (3559): 1046–1047. Бибкод : 1963Sci...139.1046W . дои : 10.1126/science.139.3559.1046 . ISSN 0036-8075 . ПМИД 17812981 . S2CID 33320384 .
- ^ Хардинг, Чарли; Джонсон, Дэвид Артур; Джейнс, Роб (2002). Элементы p блока . Молекулярный мир. Том. 9. Королевское химическое общество. п. 93. ИСБН 0-85404-690-9 .
- ^ Сузуки, Хитоми; Матано, Ёсихиро (2001). Висмуторганическая химия . Эльзевир. п. 8. ISBN 0-444-20528-4 .
- ^ Гиллеспи, Р.Дж.; Ланда, Б.; Шробильген, Г.Дж. (1971). «Трифтороксенон(IV) µ -фторбиспентафторантимонат(V): XeF +
3 катион». Журнал Химического общества D: Chemical Communications (23): 1543–1544. doi : 10.1039/C29710001543 . - ^ Ригин, В.; Скворцов, НК; Ригин, В.В. (март 1997 г.). «Тетрафторид ксенона как агент разложения силиконового каучука для выделения и атомно-эмиссионного спектрометрического определения микроэлементов». Аналитика Химика Акта . 340 (1–3): 1–3. Бибкод : 1997AcAC..340....1R . дои : 10.1016/S0003-2670(96)00563-6 .