Фторид ртути(IV)
 | |
 | |
| Идентификаторы | |
|---|---|
3D model ( JSmol ) | |
| Характеристики | |
| ХгФ 4 | |
| Молярная масса | 276.58 g/mol |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Фторид ртути(IV) , HgF 4 , является первым соединением ртути, о котором сообщается, что ртуть находится в степени окисления +4 . Ртуть, как и другие элементы 12-й группы ( кадмий и цинк ), имеет s 2 д 10 электронной конфигурации и обычно образует связи только с участием его 6s-орбитали. Это означает, что наивысшая степень окисления ртути обычно равна +2, и по этой причине ее иногда считают постпереходным металлом, а не переходным металлом . Впервые о HgF 4 сообщалось в ходе экспериментов в 2007 году, но его существование остается спорным; эксперименты, проведенные в 2008 году, не смогли воспроизвести это соединение. [1] [2]
История
[ редактировать ]Спекуляции о более высоких степенях окисления ртути существовали с 1970-х годов, а теоретические расчеты 1990-х годов предсказывали, что она должна быть стабильной в газовой фазе с плоскоквадратной геометрией, соответствующей формальному закону d. 8 конфигурация. Однако экспериментальное доказательство оставалось неуловимым до 2007 года, когда HgF 4 был впервые получен с использованием твердого неона и аргона для матричной изоляции при температуре К. 4 Соединение было обнаружено с помощью инфракрасной спектроскопии . [3] [4] Анализ теории функционала плотности и расчеты связанных кластеров показали, что d-орбитали участвуют в связывании. Это привело к предположению, что ртуть все-таки следует считать переходным металлом (металлы группы 12 иногда не включаются в число переходных металлов, поскольку они не имеют степени окисления выше +2). [5] Однако этот вывод был оспорен Уильямом Б. Дженсеном, утверждавшим, что HgF 4 существует только в крайне атипичных неравновесных условиях и его лучше всего рассматривать как исключение. [6]
Объяснение
[ редактировать ]Теоретические исследования предполагают, что ртуть является уникальным среди природных элементов группы 12 по образованию тетрафторида , и связывают это наблюдение с релятивистскими эффектами . Согласно расчетам, тетрафториды «менее релятивистских» элементов кадмия и цинка нестабильны и отщепляют молекулу фтора F 2 с образованием дифторидного комплекса металла. С другой стороны, тетрафторид «более релятивистского» синтетического элемента 112, коперниция , по прогнозам, будет более стабильным. [7] Однако более поздние теоретические исследования ставят под сомнение возможное существование фторида ртути(IV) и даже коперниция(IV). [8]
Синтез и свойства
[ редактировать ]HgF 4 получается реакцией элементарной ртути с фтором :
- Hg + 2 F 2 → HgF 4
HgF 4 стабилен только в матричной изоляции при 4 К (-269 °С); при нагревании или при соприкосновении молекул HgF 4 друг с другом он разлагается на фторид ртути(II) и фтор:
- HgF 4 → HgF 2 + F 2
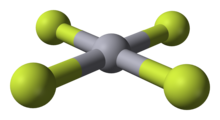
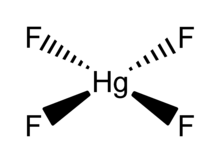
HgF 4 представляет собой диамагнитную плоскую квадратную молекулу. Атом ртути имеет формальный 6s. 2 5д 8 6р 6 электронная конфигурация и как таковая подчиняется правилу октетов , но не правилу 18 электронов . HgF 4 изоэлектронен аниону тетрафтораурата . AuF −
4 и является валентно изоэлектронным с тетрахлорауратом ( AuCl −
4 ), тетрабромаурат ( AuBr −
4 ) и тетрахлорплатинат ( PtCl 2−
4 ) анионы.
Ссылки
[ редактировать ]- ^ Является ли ртуть переходным металлом? Архивировано 12 октября 2016 г. в Wayback Machine.
- ^ Комнаты, Джон Ф.; Уилсон, Энтони В.; Харви, Ян; Бриджман, Адам Дж.; Янг, Найджел А. (2008). «Взаимодействия ртути и фтора: исследование матричной изоляции Hg···F 2 , HgF 2 и HgF 4 в матрицах аргона». Физ. хим. хим. Физ . 10 (31): 4594–4605. дои : 10.1039/B805608K . ПМИД 18665309 .
- ^ «Высокие степени окисления: синтезирован тетрафторид ртути» . Архивировано из оригинала 19 июля 2011 г. Проверено 26 июня 2008 г.
- ^ «Неуловимые виды Hg(IV) были синтезированы в криогенных условиях» . 12 октября 2007 г.
- ^ Ван, Сюэфан; Эндрюс, Лестер; Ридель, Себастьян; Каупп, Мартин (2007). «Ртуть — переходный металл: первое экспериментальное свидетельство существования HgF 4 ». Энджью. хим. Межд. Эд . 46 (44): 8371–8375. дои : 10.1002/anie.200703710 . ПМИД 17899620 .
- ^ Дженсен, Уильям Б. (2008). «Является ли Меркурий теперь переходным элементом?» . Дж. Хим. Образование . 85 (9): 1182–1183. Бибкод : 2008JChEd..85.1182J . дои : 10.1021/ed085p1182 .
- ^ Хоффман, Дарлин К.; Ли, Диана М.; Першина, Валерия (2006). «Трансактиниды и элементы будущего». В Морссе; Эдельштейн, Норман М.; Фугер, Жан (ред.). Химия актинидных и трансактинидных элементов (3-е изд.). Дордрехт, Нидерланды: Springer Science+Business Media . ISBN 1-4020-3555-1 .
- ^ Брендас, Эркки Дж.; Крячко, Евгений С. (09 марта 2013 г.). Фундаментальный мир квантовой химии: дань памяти Пер-Олову Лёвдину . Спрингер. ISBN 9789401704489 .