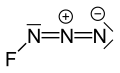Азид фтора
| |||
| Имена | |||
|---|---|---|---|
| Другие имена триазадиенилфторид | |||
| Идентификаторы | |||
3D model ( JSmol ) | |||
ПабХим CID | |||
Панель управления CompTox ( EPA ) | |||
| Характеристики | |||
| ФН 3 | |||
| Молярная масса | 61.019 g/mol | ||
| Появление | Желто-зеленый газ | ||
| Температура плавления | -139 ° C (-218 ° F; 134 К) | ||
| Точка кипения | -30 ° C (-22 ° F; 243 К) | ||
| Взрывоопасные данные | |||
| Чувствительность к ударам | Экстрим | ||
| Чувствительность к трению | Экстрим | ||
| Опасности | |||
| Безопасность и гигиена труда (OHS/OSH): | |||
Основные опасности | Чрезвычайно чувствительное взрывчатое вещество | ||
| NFPA 704 (огненный алмаз) | [ нужна ссылка ] | ||
| Родственные соединения | |||
Другие катионы | Гидрозойная кислота Азид хлора Азид брома Азид йода | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Азид фтора или триазадиенилфторид представляет собой желто-зеленый газ, состоящий из азота и фтора, с формулой ФН 3 . [1] Его свойства напоминают свойства КлН 3 , BrN 3 , и В 3 . [2] Связь между атомом фтора и азотом очень слабая, что делает это вещество очень нестабильным и склонным к взрыву. [3] Расчеты показывают, что угол F–N–N составляет около 102 ° с прямой линией из 3 атомов азота. [4]
Газ кипит при –30° и плавится при –139°С. [5]
Впервые его сделал Джон Ф. Халлер в 1942 году. [6]
Реакции
[ редактировать ]Азид фтора можно получить путем взаимодействия азотистоводородной кислоты или азида натрия с газообразным фтором. [5] [7]
- ХН 3 + Ф 2 → Н 3 Ф + ВЧ
- NaN 3 + F 2 → N 3 F + NaF
Азид фтора разлагается без взрыва при обычных температурах с образованием дифторида азота :
- 2 ФН 3 → Н 2 Ж 2 + 2 Н 2 . [1]
При более высоких температурах, например 1000 ° C, азид фтора распадается на монофторида азота : радикал [7]
- ФН 3 → НФ + Н 2
Сам ФН димеризуется при охлаждении.
- 2 НФ → Н 2 Ф 2
Твердый или жидкий FN 3 может взорваться, высвободив большое количество энергии. Тонкая пленка горит со скоростью 1,6 км/с. [8] Из-за опасности взрыва одновременно следует обращаться только с очень небольшими количествами этого вещества. [9]
FN 3 Аддукты могут образовываться с кислот Льюиса трифторидом бора ( BF 3 ) и пентафторид мышьяка ( AsF 5 ) при -196°С. Эти молекулы связываются с первым атомом азота фтора. [10]
Характеристики
[ редактировать ]Спектроскопия
[ редактировать ]| Параметр | Ценить [9] | Единица |
| А | 48131.448 | МГц |
| Б | 5713.266 | МГц |
| С | 5095.276 | МГц |
| мкм а | 1.1 | |
| мкм б | 0.7 |
Форма
[ редактировать ]Расстояния между атомами составляют F–N 0,1444 нм, FN=NN 0,1253 нм и FNN=N 0,1132 нм. [9]
Физический
[ редактировать ]ФН 3 имеет плотность 1,3 г/см. 3 . [11]
FN 3 адсорбируется на твердых поверхностях фторида калия , но не на фториде лития или фториде натрия . Это имущество расследовалось, чтобы FN 3 может повысить энергию твердого топлива. [11]
В ультрафиолетовом фотоэлектрическом спектре наблюдаются пики ионизации при 11,01, 13,72, 15,6, 15,9, 16,67, 18,2 и 19,7 эВ. Соответственно им присваиваются орбитали: π, n N или n F , n F , π F , n N или σ, π и σ. [3]
Ссылки
[ редактировать ]- ^ Jump up to: а б Гипштейн, Эдвард; Джон Ф. Халлер (1966). «Спектр поглощения азида фтора». Прикладная спектроскопия . 20 (6): 417–418. Бибкод : 1966ApSpe..20..417G . дои : 10.1366/000370266774386470 . ISSN 0003-7028 . S2CID 96337253 .
- ^ Саксена, ПБ (1 января 2007 г.). Химия межгалогенных соединений . Издательство Дискавери. п. 96. ИСБН 9788183562430 . Проверено 16 июня 2014 г.
- ^ Jump up to: а б Радемахер, Пауль; Андреас Дж. Биттнер; Габриэль Шэдоу; Хельге Виллнер (1988). «Фотоэлектронный спектр и электронная структура триазадиенилфторида, N3F». Химические отчеты . 121 (3): 555–557. дои : 10.1002/cber.19881210325 . ISSN 0009-2940 .
- ^ Питерс, Нэнси Дж.С.; Леланд С. Аллен ; Раймонд А. Файерстоун (1988). «Азид фтора и нитрат фтора: структура и связь». Неорганическая химия . 27 (4): 755–758. дои : 10.1021/ic00277a035 . ISSN 0020-1669 .
- ^ Jump up to: а б Голиванд, Ходайар; Габриэле Шатте; Хельге Виллнер (1987). «Свойства триазадиенилфторида, N3F». Неорганическая химия . 26 (13): 2137–2140. дои : 10.1021/ic00260a025 . ISSN 0020-1669 .
- ^ Лоу, Дерек (21 октября 2008 г.). «Вещи, с которыми я не буду работать: триазадиенилфторид» . В Трубопроводе . Проверено 15 июня 2014 г.
- ^ Jump up to: а б Бенард, диджей; БК Винкер; ТА Седер; Р. Х. Кон (1989). «Производство монофторида азота (a1Δ) диссоциацией азида фтора». Журнал физической химии . 93 (12): 4790–4796. дои : 10.1021/j100349a022 . ISSN 0022-3654 .
- ^ Седер, штат Техас; Диджей Бенард (1991). «Разложение конденсированной фазы азида фтора». Горение и пламя . 85 (3–4): 353–362. дои : 10.1016/0010-2180(91)90139-3 . ISSN 0010-2180 .
- ^ Jump up to: а б с Кристен, Дайнс; Х.Г. Мак; Г. Шатте; Х. Уиллнер (1988). «Структура триазадиенилфторида FN 3 с помощью микроволнового, инфракрасного и ab initio методов». Журнал Американского химического общества . 110 (3): 707–712. дои : 10.1021/ja00211a007 . ISSN 0002-7863 .
- ^ Тень, Г.; Х. Уиллнер (1991). «Взаимодействие N 3 F с кислотами Льюиса и HF. N 3 F как возможный предшественник для синтеза солей N 3 + = Взаимодействие N 3 F с кислотами Льюиса и HF•N 3 F как возможный предшественник для синтеза солей N 3 +» . Журнал Nature Research B (на немецком языке). 46 (4): 483–489. дои : 10.1515/znb-1991-0410 . ISSN 0932-0776 . S2CID 97045269 .
- ^ Jump up to: а б Бренер, Натан Э.; Кестнер, Нил Р.; Каллауэй, Джозеф (декабрь 1990 г.). Теоретические исследования высокоэнергетических материалов CBES: итоговый отчет за период со 2 марта 1987 г. по 31 мая 1987 г. (PDF) . Университет штата Луизиана, факультет физики и астрономии. стр. 21–27. Архивировано (PDF) из оригинала 3 марта 2016 г. Проверено 25 июня 2014 г.
Внешние ссылки
[ редактировать ] СМИ, связанные с азидом фтора, на Викискладе?
СМИ, связанные с азидом фтора, на Викискладе?