Азид рубидия
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Рубидий(1+);азид | |
| Другие имена Азид рубидия | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ХимическийПаук | |
ПабХим CID | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| СбН 3 | |
| Молярная масса | 127.49 g⋅mol −1 |
| Появление | Бесцветные иглы [1] |
| Плотность | 2.79 g⋅cm −3 [1] [2] |
| Температура плавления | 317–321 ° C (603–610 ° F; 590–594 К) [2] [4] |
| Точка кипения | Разлагается |
| |
| Растворимость | 0,182 г/100 г (16 °C, этанол ) [3] |
| Термохимия | |
Стандартная энтальпия образование (Δ f H ⦵ 298 ) | −0.1 kcal⋅mol −1 [2] |
| Опасности | |
| NFPA 704 (огненный алмаз) | |
| Родственные соединения | |
Другие анионы | Нитрат рубидия |
Другие катионы | Азид лития Азид натрия Азид калия Азид серебра Азид аммония |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Азид рубидия — неорганическое соединение формулы Рб N 3 . Это рубидиевая соль азотистоводородной кислоты. ХН 3 . Как и большинство азидов , он взрывоопасен. [4]
Подготовка
[ редактировать ]Азид рубидия можно получить в результате реакции между сульфатом рубидия и азидом бария , в результате которой образуется легко отделяемый нерастворимый сульфат бария : [3]
- Rb 2 SO 4 + Ba(N 3 ) 2 → 2 RbN 3 + BaSO 4
По крайней мере в одном исследовании азид рубидия был получен реакцией бутилнитрита , гидразина моногидрата и гидроксида рубидия в присутствии этанола :
- C 4 H 9 ONO + N 2 H 4 ·H 2 O + RbOH → RbN 3 + C 4 H 9 OH + 3 H 2 O
Эта формула обычно используется для синтеза азида калия из едкого поташа . [5]
Использование
[ редактировать ]Азид рубидия исследовался на предмет возможного использования в щелочных элементах, которые являются компонентами атомных часов , атомных магнитометров и атомных гироскопов . Азиды являются желательными исходными материалами, поскольку они разлагаются на металлический рубидий под воздействием УФ-излучения и газообразный азот . По данным одной публикации:
Среди различных методов, используемых для заполнения микрофабрикатов щелочных паров [так в оригинале] , УФ-разложение азида рубидия ( RbN 3 ) на металлический Rb и азот в Элементы с покрытием Al 2 O 3 представляют собой очень многообещающий подход для недорогого изготовления пластин. [6]
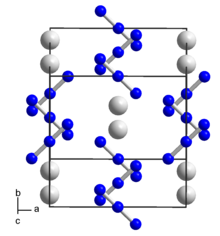
Структура
[ редактировать ]При комнатной температуре азид рубидия имеет ту же структуру, что и гидрофторид калия ; искаженная структура хлорида цезия . При 315 °C и давлении 1 атм азид рубидия переходит в нормальную структуру хлорида цезия. Температура перехода II/I азида рубидия находится в пределах 2 ° C от его температуры плавления. [4]
Азид рубидия имеет структурный переход при высоком давлении, который происходит при давлении около 4,8 килобар при 0 ° C. Границу перехода II/III перехода можно определить соотношением , где давление в килобарах и — температура в градусах Цельсия . [4]
Реакции
[ редактировать ]Как и все азиды, он разлагается и выделяет газообразный азот при нагревании или сильном ударе :
- 2 Сбн 3 → 2 Сбн + 3 Н 2
Разряд азида рубидия в газообразном азоте приведет к образованию нитрида рубидия . [7]
Опасности
[ редактировать ]При давлении 4,1 кбар и температуре около 460 °C азид рубидия разлагается со взрывом. [4] В обычных условиях он взрывается при температуре 395 °C. [2] Он также разлагается под воздействием ультрафиолета . [6]
Азид рубидия очень чувствителен к механическим ударам , его чувствительность к удару сравнима с тротилом . [8]
Как и все азиды, азид рубидия токсичен.
Ссылки
[ редактировать ]- ^ Перейти обратно: а б Перри, Дейл (17 мая 1995 г.). Справочник неорганических соединений . Онлайн. п. 333. ИСБН 9780849386718 . Проверено 31 января 2018 г.
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ) - ^ Перейти обратно: а б с д Харт, Уильям; Боймель, ОФ; Уэйли, Томас (22 октября 2013 г.). Химия лития, натрия, калия, рубидия, цезия и франция: пергамские тексты по неорганической химии . Онлайн: Пергамон Пресс. п. 438. ИСБН 9781483187570 . Проверено 31 января 2018 г.
- ^ Перейти обратно: а б с Хала, Иржи. «Серия данных о растворимости IUPAC-NIST. 79. Псевдогалогениды щелочных и щелочноземельных металлов» (PDF) . nist.gov . Архивировано из оригинала (PDF) 1 февраля 2018 года . Проверено 31 января 2018 г.
- ^ Перейти обратно: а б с д и Писториус, Карл WFT (27 декабря 1968 г.). «Фазовые диаграммы высоких давлений одновалентных азидов, принадлежащих пространственной группе D 4hI8-14/мкм» (PDF) . Онлайн. стр. 1, 4–5 . Проверено 1 февраля 2018 г.
- ^ Огден, Дж. Стивен; Дайк, Джон М.; Левасон, Уильям; Ферранте, Франческо; Гальярди, Лаура (2006). «Характеристика молекулярных азидов щелочных металлов» (PDF) . Химия - Европейский журнал . 12 (13): 3580–3586. дои : 10.1002/CHEM.200501101 . ПМИД 16491492 . S2CID 16007959 . Архивировано из оригинала (PDF) 3 февраля 2018 года . Проверено 2 февраля 2018 г.
- ^ Перейти обратно: а б Карлен, Сильвен; Гобе, Жан; Оверстольц, Томас; Хэслер, Жак; Лекомт, Стив (26 января 2017 г.). «Оценка срока службы атомно-паровых ячеек MEMS, заполненных RbN 3, Al 2 O 3 с покрытием » (PDF) . Оптика Экспресс . 25 (3): 2187–2194. Бибкод : 2017OExpr..25.2187K . дои : 10.1364/OE.25.002187 . ПМИД 29519066 . Проверено 17 марта 2018 г.
- ^ Х. Ваттенберг: «О двух формах образования нитрида натрия и нитрида калия» в Бер. д. Немецкая хим. Гес 1930 , 63 (7), стр. 1667-1672. два : 10.1002/cber.19300630708
- ^ Бабу, К. Рамеш; Вайтеесваран, Г. (2013). «Структура, упругие и динамические свойства KN3 и RbN3: исследование функционала плотности Ван-дер-Ваальса». Науки о твердом теле . 23 . Передовой центр исследований высокоэнергетических материалов (ACRHEM), Хайдарабадский университет: 17–25. arXiv : 1311.0979 . Бибкод : 2013SSSci..23...17R . CiteSeerX 10.1.1.768.1309 . doi : 10.1016/j.solidstatesciences.2013.05.017 . S2CID 94217260 .



