Азид йода
 | |
| Имена | |
|---|---|
| Название ИЮПАК Азид йода | |
| Другие имена Азидойод, Азид йода | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ХимическийПаук | |
ПабХим CID | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| В 3 | |
| Молярная масса | 168.92 g/mol |
| Появление | желтое твердое вещество |
| разлагается | |
| Давление пара | 2 Торр |
| Структура | |
| орторомбический | |
| Пбам, №55 | |
| Родственные соединения | |
Родственные соединения | Гидрозойная кислота Азид фтора Азид хлора Азид брома |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Азид йода ( В 3 ) — взрывчатое неорганическое соединение , которое в обычных условиях представляет собой твердое вещество желтого цвета. [1] Формально это интерпсевдогалоген .
Подготовка
[ редактировать ]Азид йода можно получить реакцией азида серебра и элементарного йода :
- AgN 3 + I 2 → ИН 3 + AgI
Поскольку с азидом серебра можно безопасно обращаться только во влажном состоянии, но даже небольшие следы воды вызывают разложение азида йода, этот синтез осуществляется путем суспендирования азида серебра в дихлорметане и добавления осушителя перед реакцией с йодом. Таким образом получается чистый раствор азида йода, который затем можно осторожно выпарить с образованием игольчатых золотых кристаллов. [2]
Эта реакция была использована при первоначальном синтезе азида йода в 1900 году, где он был получен в виде нестабильных растворов в эфире и нечистых кристаллов, загрязненных йодом. [3]
Азид йода также можно получить in situ путем реакции монохлорида йода и азида натрия в условиях, когда он не является взрывоопасным. [4]
Характеристики
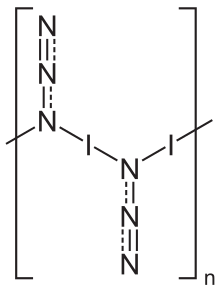
[ редактировать ]В твердом состоянии азид йода существует в виде одномерной полимерной структуры. [5] образуя две полиморфные модификации , обе из которых кристаллизуются в ромбической решетке с пространственной группой Pbam . [5] Газовая фаза существует в виде мономерных единиц. [6]
Азид йода проявляет как высокую реакционную способность, так и сравнительную стабильность, что является следствием полярности связи I–N. Группа N 3 , введенная путем замещения азидом йода, часто может вступать в последующие реакции из-за своей высокой энергосодержания.
Выделенное соединение очень чувствительно к ударам и трению . [7] Его взрывоопасность характеризуется следующим образом: [1]
| Нормальный объем газа | 265 л/кг |
| Тепло взрыва | 2091 кДж/кг |
| Рейтинг траузла | 14,0 см 3 /г |
Эти значения значительно ниже по сравнению с классическими взрывчатыми веществами, такими как тротил или гексоген , а также с пероксидом ацетона . С разбавленными растворами (< 3%) соединения в дихлорметане можно обращаться безопасно. [2]
Использование
[ редактировать ]Несмотря на свой взрывной характер, азид йода имеет множество практических применений в химическом синтезе. Подобно азиду брома , он может присоединяться по двойной связи алкена как по ионному, так и по радикальному механизму, обеспечивая антистереоселективность . Добавление ИН 3 до алкена с последующим восстановлением алюмогидридом лития является удобным методом синтеза азиридина . Азирины также можно синтезировать из продукта присоединения путем добавления основания для удаления HI с образованием винилазида. CH 2 =CHN 3 , который подвергается термолизу с образованием азирина . Другие радикальные способы реакционной способности включают радикальные замещения по слабым связям CH с образованием α-азидоэфиров, бензальцеталей и альдегидов, а также превращение альдегидов в ацилазиды . [4] [6]
Внешние ссылки
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б Бузек, Питер; Клапотке, Томас М.; Раге Шлейер, Поль; Торнипорт-Оттинг, Инис К.; Уайт, Питер С. (1993). «Йод Азид» . Международное издание «Прикладная химия» . 32 (2): 275–277. дои : 10.1002/anie.199302751 .
- ^ Jump up to: а б Денике, Курт (1979). «Химия азида йода» . Angewandte Chemie, международное издание . 18 (7): 507–514. дои : 10.1002/anie.197905071 .
- ^ Ханч, Артур (1900). «О йодном азоте N 3 » . Отчеты Немецкого химического общества . 33 (1): 522–527. дои : 10.1002/cber.19000330182 .
- ^ Jump up to: а б Маринеску, Лавиния; Тинггаард, Джейкоб; Томсен, Иб Б.; Болс, Микаэль (2003). «Радикальное азидонирование альдегидов» . Журнал органической химии . 68 (24): 9453–9455. дои : 10.1021/jo035163v . ПМИД 14629171 .
- ^ Jump up to: а б Лихс, Бенджамин; Блязер, Дитер; Вёльпер, Кристоф; Шульц, Стефан; Янсен, Георг (2012). «Сравнение твердотельных структур галогеназидов XN 3 (X = Cl, Br, I)» . Международное издание «Прикладная химия» . 51 (51): 12859–12863. дои : 10.1002/anie.201206028 . ПМИД 23143850 .
- ^ Jump up to: а б Хасснер, Альфред; Маринеску, Лавиния; Болс, Микаэль (2005). «Йод Азид». Энциклопедия реагентов для органического синтеза . дои : 10.1002/047084289X.ri007 . ISBN 0471936235 .
- ^ Урбен, П.Г. (1999). Справочник Бретерика по реактивным химическим опасностям . Том. 1 (6-е изд.). Баттерворт-Хайнеманн. ISBN 0-7506-3605-Х .