Кислота

Кислота , — это молекула или ион способные либо отдавать протон (т.е. ион водорода, H + ), известная как кислота Бренстеда-Лоури , или образующая ковалентную связь с электронной парой , известная как кислота Льюиса . [1]
К первой категории кислот относятся доноры протонов, или кислоты Бренстеда-Лоури . В частном случае водных растворов донорами протонов являются ионы гидроксония H 3 O. + и известны как кислоты Аррениуса . Брёнстед и Лоури обобщили теорию Аррениуса, включив в нее неводные растворители . Кислота Бренстеда или Аррениуса обычно содержит атом водорода, связанный с химической структурой, которая все еще энергетически выгодна после потери H. + .
Водные кислоты Аррениуса обладают характерными свойствами, которые дают практическое описание кислоты. [2] Кислоты образуют водные растворы с кислым вкусом, могут окрашивать синий лакмус в красный цвет и вступать в реакцию с основаниями и некоторыми металлами (например, кальцием ) с образованием солей . Слово кислота происходит от латинского acidus , что означает «кислый». [3] Водный раствор кислоты имеет pH менее 7 и в просторечии также называется «кислотой» (как «растворенная в кислоте»), тогда как строгое определение относится только к растворенному веществу . [1] Более низкий pH означает более высокую кислотность и, следовательно, более высокую концентрацию положительных ионов водорода в растворе. Химические вещества или вещества, обладающие свойствами кислоты, называются кислотными .
Обычные водные кислоты включают соляную кислоту (раствор хлористого водорода , который содержится в желудочной кислоте в желудке и активирует пищеварительные ферменты ), уксусную кислоту (уксус представляет собой разбавленный водный раствор этой жидкости), серную кислоту (используется в автомобильных аккумуляторах ), и лимонная кислота (содержится в цитрусовых). Как показывают эти примеры, кислоты (в просторечии) могут быть растворами или чистыми веществами, а могут быть получены из кислот (в строгом смысле слова). [1] смысле), которые представляют собой твердые тела, жидкости или газы. Сильные кислоты и некоторые концентрированные слабые кислоты вызывают коррозию , но есть исключения, такие как карбораны и борная кислота .
Вторая категория кислот — это кислоты Льюиса , образующие ковалентную связь с электронной парой. Примером является трифторид бора (BF 3 ), атом бора которого имеет вакантную орбиталь , которая может образовывать ковалентную связь путем совместного использования неподеленной пары электронов на атоме основания, например атоме азота в аммиаке (NH 3 ). Льюис рассматривал это как обобщение определения Брёнстеда, согласно которому кислота представляет собой химическую разновидность, которая принимает пары электронов либо напрямую , либо путем высвобождения протонов ( H + ) в раствор, который затем принимает электронные пары. Однако хлористый водород, уксусная кислота и большинство других кислот Бренстеда-Лоури не могут образовывать ковалентную связь с электронной парой и поэтому не являются кислотами Льюиса. [4] И наоборот, многие кислоты Льюиса не являются кислотами Аррениуса или Бренстеда-Лоури. В современной терминологии кислота неявно является кислотой Бренстеда, а не кислотой Льюиса, поскольку химики почти всегда явно называют кислоту Льюиса таковой. [4]
Определения и понятия
Современные определения касаются фундаментальных химических реакций, общих для всех кислот.
Большинство кислот, встречающихся в повседневной жизни, представляют собой водные растворы или могут быть растворены в воде, поэтому определения Аррениуса и Брёнстеда-Лоури являются наиболее актуальными.
Определение Брёнстеда-Лоури является наиболее широко используемым определением; если не указано иное, предполагается, что кислотно-основные реакции включают перенос протона ( H + ) от кислоты к основанию.
Ионы гидроксония являются кислотами по всем трем определениям. Хотя спирты и амины могут представлять собой кислоты Бренстеда-Лоури, они также могут функционировать как основания Льюиса благодаря неподеленным парам электронов на их атомах кислорода и азота.
Аррениусовые кислоты

В 1884 году Сванте Аррениус приписал свойства кислотности ионам водорода (H + ), позже описанные как протоны или гидроны . Аррениусовая кислота — вещество, которое при добавлении в воду увеличивает концентрацию H. + ионы в воде. [4] [5] Химики часто пишут Н + ( aq ) и ссылаются на ион водорода при описании кислотно-основных реакций, но свободное ядро водорода, протон , не существует отдельно в воде, оно существует как ион гидроксония (H 3 O + ) или других формах (H 5 O 2 + , OH9O4 + ). Таким образом, кислоту Аррениуса можно также охарактеризовать как вещество, повышающее концентрацию ионов гидроксония при добавлении в воду. Примеры включают молекулярные вещества, такие как хлористый водород и уксусная кислота.
Аррениуса С другой стороны, основание представляет собой вещество, которое увеличивает концентрацию гидроксида (OH − ) ионы при растворении в воде. При этом снижается концентрация гидроксония, поскольку ионы реагируют с образованием молекул H 2 O:
- H3H3O +
(водный) + ОН −
(водн.) ⇌ H 2 O (ж.) + H 2 O (ж.)
Благодаря такому равновесию любое увеличение концентрации гидроксония сопровождается уменьшением концентрации гидроксида. Таким образом, можно также сказать, что кислота Аррениуса снижает концентрацию гидроксида, а основание Аррениуса увеличивает ее.
В кислом растворе концентрация ионов гидроксония превышает 10 −7 моль на литр. Поскольку pH определяется как отрицательный логарифм концентрации ионов гидроксония, кислые растворы, таким образом, имеют pH менее 7.
Кислоты Бренстеда-Лоури

Хотя концепция Аррениуса полезна для описания многих реакций, она также весьма ограничена в своих возможностях. В 1923 году химики Йоханнес Николаус Бренстед и Томас Мартин Лоури независимо друг от друга признали, что кислотно-основные реакции включают перенос протона. Кислота Бренстеда-Лоури (или просто кислота Бренстеда) представляет собой разновидность, которая отдает протон основанию Бренстеда-Лоури. [5] Кислотно-основная теория Брёнстеда-Лоури имеет ряд преимуществ перед теорией Аррениуса. Рассмотрим следующие реакции уксусной кислоты (CH 3 COOH), органической кислоты , придающей уксусу характерный вкус:
- СН 3 СООН + Н 2 О ⇌ СН 3 СОО − + Н3О +
- СН 3 СООН + NH 3 ⇌ СН 3 СОО − + НХ + 4
Обе теории легко описывают первую реакцию: CH 3 COOH действует как кислота Аррениуса, поскольку выступает источником H 3 O. + при растворении в воде он действует как кислота Бренстеда, отдавая протон воде. Во втором примере CH 3 COOH претерпевает такое же превращение, в данном случае отдавая протон аммиаку (NH 3 ), но это не относится к определению кислоты по Аррениусу, поскольку в результате реакции не образуется гидроксоний. Тем не менее CH 3 COOH является одновременно кислотой Аррениуса и кислотой Бренстеда-Лоури.
Теория Бренстеда – Лоури может быть использована для описания реакций молекулярных соединений в неводном растворе или газовой фазе. Хлороводород (HCl) и аммиак соединяются в различных условиях с образованием хлорида аммония NH 4 Cl. В водном растворе HCl ведет себя как соляная кислота и существует в виде ионов гидроксония и хлорида. Следующие реакции иллюстрируют ограничения определения Аррениуса:
- H3H3O +
(водный раствор) + Cl −
(водный) + NH 3 → Cl −
(водн.) + NH +
4 (водн.) + Н 2 О - HCl (бензол) + NH 3(бензол) → NH 4 Cl (ы)
- HCl (г) + NH 3(г) → NH 4 Cl (т)
Как и в случае с реакциями с уксусной кислотой, оба определения подходят для первого примера, где вода является растворителем, а ион гидроксония образуется растворенным раствором HCl. Следующие две реакции не связаны с образованием ионов, но все же являются реакциями переноса протона. Во второй реакции хлористый водород и аммиак (растворенный в бензоле ) реагируют с образованием твердого хлорида аммония в бензольном растворителе, а в третьей реакции газообразные HCl и NH 3 объединяются с образованием твердого вещества.
кислоты Льюиса
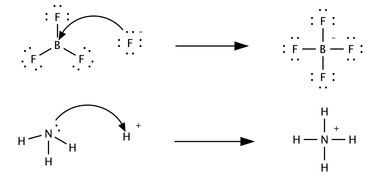
Третья, лишь незначительно связанная концепция была предложена в 1923 году Гилбертом Н. Льюисом и включает реакции с кислотно-основными характеристиками, которые не включают перенос протона. Кислота Льюиса — это разновидность, которая принимает пару электронов от другой разновидности; другими словами, это акцептор электронной пары. [5] Кислотно-основные реакции Бренстеда представляют собой реакции переноса протона, а кислотно-основные реакции Льюиса представляют собой переносы электронных пар. Многие кислоты Льюиса не являются кислотами Бренстеда-Лоури. Сравните, как следующие реакции описываются с точки зрения кислотно-основной химии:
В первой реакции ион фтора F − , отдает электронную пару с трифториду бора образованием тетрафторбората . Фторид «теряет» пару валентных электронов , поскольку электроны, общие в связи B—F, расположены в области пространства между двумя атомными ядрами и, следовательно, более удалены от ядра фторида, чем в одиночном ионе фторида. BF 3 является кислотой Льюиса, поскольку принимает электронную пару от фторида. Эту реакцию невозможно описать в рамках теории Брёнстеда, поскольку переноса протона в ней нет. Вторую реакцию можно описать с помощью любой теории. Протон переносится от неуказанной кислоты Бренстеда к аммиаку, основанию Бренстеда; альтернативно, аммиак действует как основание Льюиса и переносит неподеленную пару электронов, образуя связь с ионом водорода. Разновидностью, которая получает электронную пару, является кислота Льюиса; например, атом кислорода в H 3 O + приобретает пару электронов, когда одна из связей H—O разрывается и общие в связи электроны локализуются на кислороде. В зависимости от контекста кислоту Льюиса также можно описать как окислитель или электрофил . Органические кислоты Бренстеда, такие как уксусная, лимонная или щавелевая кислота, не являются кислотами Льюиса. [4] Они диссоциируют в воде с образованием кислоты Льюиса H. + , но в то же время также дают равное количество основания Льюиса (ацетат, цитрат или оксалат соответственно для упомянутых кислот). В этой статье речь идет в основном о кислотах Бренстеда, а не о кислотах Льюиса.
Диссоциация и равновесие
Реакции кислот часто обобщают в виде ХА ⇌ Ч + + А − , где HA представляет собой кислоту, а A − является сопряженным основанием . Эта реакция называется протолизом . Протонированную форму (НА) кислоты также иногда называют свободной кислотой . [6]
Пары кислотно-основных сопряжений различаются на один протон и могут взаимно превращаться путем добавления или удаления протона ( протонирование и депротонирование соответственно). Кислота может быть заряженной, а сопряженное основание может быть нейтральным, и в этом случае обобщенную схему реакции можно записать как ХА + ⇌ Ч + + А. В растворе существует равновесие между кислотой и сопряженным с ней основанием. Константа равновесия K является выражением равновесных концентраций молекул или ионов в растворе. В скобках указана концентрация, например, [H O ] означает концентрацию H 2 O. 2 Константу диссоциации кислоты K a обычно используют в контексте кислотно-основных реакций. Численное значение K a равно произведению ( умножению) концентраций продуктов, разделенному на концентрацию реагирующих веществ, где реагирующим веществом является кислота (HA), а продуктами - сопряженное основание и H. + .
Более сильная из двух кислот будет иметь более высокий K a, чем более слабая кислота; соотношение ионов водорода к кислоте будет выше для более сильной кислоты, поскольку более сильная кислота имеет большую тенденцию терять свой протон. Поскольку диапазон возможных значений K a охватывает многие порядки, управляемая константа p K a чаще используется более , где p K a = −log 10 K a . Более сильные кислоты имеют меньший p K a , чем более слабые кислоты. Экспериментально определенные значения p K a при 25 °С в водном растворе часто цитируются в учебниках и справочных материалах.
Номенклатура
Кислоты Аррениуса названы по их анионам . В классической системе именования ионный суффикс опускается и заменяется новым суффиксом, согласно следующей таблице. Приставка «гидро-» используется, когда кислота состоит только из водорода и еще одного элемента. Например, HCl является хлорид анионом , поэтому используется приставка гидро-, а суффикс -ide заставляет название принимать форму соляная кислота .
Классическая система именования:
| Анионный префикс | Анионный суффикс | Кислотный префикс | Кислотный суффикс | Пример |
|---|---|---|---|---|
| за | ел | за | ледяная кислота | хлорная кислота (HClO 4 ) |
| хлорная кислота (HClO 3 ) | ||||
| ите | кислая кислота | хлорноватая кислота (HClO 2 ) | ||
| гипо | ите | гипо | кислая кислота | хлорноватистая кислота (HClO) |
| это идет | гидро | ледяная кислота | соляная кислота (HCl) |
В системе наименования ИЮПАК к названию ионного соединения просто добавляется слово «водный». Таким образом, хлористый водород в виде раствора кислоты называется по ИЮПАК водному хлористому водороду.
Сила кислоты
Сила кислоты означает ее способность или склонность терять протон. Сильная кислота — это кислота, которая полностью диссоциирует в воде; другими словами, один моль сильной кислоты ГК растворяется в воде с образованием одного моля H. + и один моль сопряженного основания A − , и ни одной протонированной кислоты HA. Напротив, слабая кислота диссоциирует лишь частично, и в состоянии равновесия и кислота, и сопряженное основание находятся в растворе. Примерами сильных кислот являются соляная кислота (HCl), иодистоводородная кислота (HI), бромистоводородная кислота (HBr), хлорная кислота (HClO 4 ), азотная кислота (HNO 3 ) и серная кислота (H 2 SO 4 ). В воде каждый из них ионизируется на 100%. Чем сильнее кислота, тем легче она теряет протон, H + . Двумя ключевыми факторами, которые способствуют легкости депротонирования, являются полярность связи H—A и размер атома A, который определяет прочность связи H—A. Силу кислоты также часто обсуждают с точки зрения стабильности сопряженного основания.
Более сильные кислоты имеют большую константу диссоциации кислоты K a и более низкое p K a , чем более слабые кислоты.
Сульфоновые кислоты , являющиеся органическими оксикислотами, относятся к классу сильных кислот. Типичным примером является толуолсульфоновая кислота (тозиловая кислота). В отличие от самой серной кислоты, сульфоновые кислоты могут быть твердыми. Фактически, полистирол, функционализированный в полистиролсульфонат, представляет собой твердый сильнокислотный пластик, который можно фильтровать.
Суперкислоты – это кислоты более сильные, чем 100% серная кислота. Примерами суперкислот являются фторсурьмяная кислота , волшебная кислота и хлорная кислота . Самая сильная из известных кислот — ион гидрида гелия . [7] со сродством к протону 177,8 кДж/моль. [8] Суперкислоты могут постоянно протонировать воду с образованием ионных кристаллических гидроксония «солей» . Они также могут количественно стабилизировать карбокатионы .
В то время как K a измеряет силу кислотного соединения, сила водного раствора кислоты измеряется pH, который является показателем концентрации гидроксония в растворе. pH простого раствора кислотного соединения в воде определяется разбавлением соединения и его K a .
Сила кислоты Льюиса в неводных растворах
Кислоты Льюиса были классифицированы в модели ECW , и было показано, что не существует единого порядка силы кислот. [9] Относительная акцепторная сила кислот Льюиса по отношению к ряду оснований по сравнению с другими кислотами Льюиса может быть проиллюстрирована графиками CB . [10] [11] Было показано, что для определения порядка силы кислоты Льюиса необходимо учитывать как минимум два свойства. Пирсона Для качественной теории HSAB двумя свойствами являются твердость Драго и прочность, а для количественной модели ECW двумя свойствами являются электростатические и ковалентные.
Химические характеристики
Монопротонные кислоты
Монопротонные кислоты, также известные как одноосновные кислоты, — это те кислоты, которые способны отдавать один протон на молекулу во время процесса диссоциации (иногда называемой ионизацией), как показано ниже (обозначается HA):
- ГК (водн.) + H 2 O (ж) ⇌ H 3 O + (вод) + А − (вод) К а
Общие примеры монопротонных кислот в минеральных кислотах включают соляную кислоту (HCl) и азотную кислоту (HNO 3 ). С другой стороны, для органических кислот этот термин в основном указывает на наличие одной группы карбоновой кислоты , и иногда эти кислоты называют монокарбоновыми кислотами. Примеры органических кислот включают муравьиную кислоту (HCOOH), уксусную кислоту (CH 3 COOH) и бензойную кислоту (C 6 H 5 COOH).
Полипротонные кислоты
Полипротонные кислоты, также известные как многоосновные кислоты, способны отдавать более одного протона на молекулу кислоты, в отличие от монопротонных кислот, которые отдают только один протон на молекулу. Конкретные типы полипротонных кислот имеют более конкретные названия, такие как дипротонная (или двухосновная) кислота (два потенциальных протона для отдачи) и трипротонная (или трехосновная) кислота (три потенциальных протона для отдачи). Некоторые макромолекулы, такие как белки и нуклеиновые кислоты, могут иметь очень большое количество кислых протонов. [12]
Дипротонная кислота (здесь обозначенная H 2 A) может подвергаться одной или двум диссоциациям в зависимости от pH. Каждая диссоциация имеет свою константу диссоциации K a1 и K a2 .
- H 2 A (водн.) + H 2 O (ж) ⇌ H 3 O + (водн.) + ГК − (столько же) K a1
- ХА − (вод) + H 2 O (ж) ⇌ H 3 O + (вод) + А 2− (водн.) К а2
Первая константа диссоциации обычно больше второй (т.е. K a1 > K a2 ). Например, серная кислота (H 2 SO 4 ) может отдать один протон для образования бисульфат- аниона (HSO −
4 ), для которого K a1 очень велико; тогда он может отдать второй протон для образования сульфат- аниона (SO 2−
4 ), где K a2 имеет промежуточную прочность. Большое значение K a1 для первой диссоциации делает серную кислоту сильной кислотой. Подобным образом слабая нестабильная угольная кислота (H 2 CO 3 ) может потерять один протон с образованием бикарбонат- аниона (HCO −
3 ) и теряем секунду, образуя карбонат- анион (CO 2−
3 ). Оба значения K a малы, но K a1 > K a2 .
Трипротонная кислота (H 3 A) может претерпевать одну, две или три диссоциации и имеет три константы диссоциации, где K a1 > K a2 > K a3 .
- H 3 A (водн.) + H 2 O (ж) ⇌ H 3 O + (водн.) + Н 2 А − (столько же) K a1
- Ч 2 А − (вод) + H 2 O (ж) ⇌ H 3 O + (водн.) + ГК 2− (водн.) К а2
- ХА 2− (вод) + H 2 O (ж) ⇌ H 3 O + (вод) + А 3− (вод) К а3
Неорганическим фосфорной примером трипротонной кислоты является ортофосфорная кислота (H 3 PO 4 ), обычно называемая просто кислотой . Все три протона могут быть последовательно потеряны с образованием H 2 PO. −
4 , затем ГПО 2−
4 и, наконец, ПО 3−
4 , ортофосфат-ион, обычно называемый просто фосфатом . Несмотря на то, что положения трех протонов в исходной молекуле фосфорной кислоты эквивалентны, последовательные значения K a различаются, поскольку энергетически менее выгодно терять протон, если сопряженное основание имеет более отрицательный заряд. Органическим , которая примером трипротонной кислоты является лимонная кислота может последовательно терять три протона с образованием цитрат- иона.
Хотя последующая потеря каждого иона водорода менее благоприятна, все сопряженные основания присутствуют в растворе. фракционную концентрацию α Можно рассчитать (альфа) для каждого вида. Например, генерическая дипротонная кислота в растворе образует 3 вида: H 2 A, HA. − , и А 2− . Дробные концентрации можно рассчитать, как показано ниже, если задан либо pH (который можно преобразовать в [H + ]) или концентрации кислоты со всеми сопряженными с ней основаниями:
График зависимости этих фракционных концентраций от pH для заданных K 1 и K 2 известен как график Бьеррума . В приведенных выше уравнениях наблюдается закономерность, которую можно расширить до общей n -протонной кислоты, которая была депротонирована i -кратно:
где K 0 = 1, а остальные K-члены являются константами диссоциации кислоты.
Нейтрализация

Нейтрализация — это реакция между кислотой и основанием, в результате которой образуется соль и нейтрализованное основание; например, соляная кислота и гидроксид натрия образуют хлорид натрия и воду:
- HCl (водн.) + NaOH (водн.) → H 2 O (ж) + NaCl (водн.)
Нейтрализация является основой титрования , когда индикатор pH показывает точку эквивалентности, когда к кислоте добавляется эквивалентное количество молей основания. Часто ошибочно полагают, что в результате нейтрализации должен получиться раствор с pH 7,0, что имеет место только в случае одинаковой силы кислоты и основания во время реакции.
Нейтрализация основанием, более слабым, чем кислота, приводит к образованию слабокислой соли. Примером является слабокислый хлорид аммония , который получают из сильнокислого хлористого водорода и слабоосновного аммиака . И наоборот, нейтрализация слабой кислоты сильным основанием дает слабоосновную соль (например, фторид натрия из фторида водорода и гидроксида натрия ).
Равновесие слабой кислоты и слабого основания
Чтобы протонированная кислота потеряла протон, pH системы должен подняться выше значения p K a кислоты. Снижение концентрации H + в этом основном растворе равновесие смещается в сторону сопряженной основной формы (депротонированной формы кислоты). В растворах с более низким pH (более кислых) наблюдается достаточно высокий уровень H. + концентрация в растворе, при которой кислота остается в протонированной форме.
Растворы слабых кислот и солей сопряженных с ними оснований образуют буферные растворы .
Титрование
Для определения концентрации кислоты в водном растворе обычно проводят кислотно-основное титрование. Для нейтрализации раствора кислоты в зависимости от изменения цвета индикатора при добавлении количества основания добавляют раствор сильного основания известной концентрации, обычно NaOH или КОН. [13] Кривая титрования кислоты, титруемой основанием, имеет две оси: объем основания на оси x и значение pH раствора на оси y. По мере добавления основания pH раствора всегда повышается.
Пример: дипротоновая кислота

Для каждой кривой титрования дипротонной кислоты слева направо имеются две средние точки, две точки эквивалентности и две буферные области. [15]
Точки эквивалентности
Из-за последовательных процессов диссоциации на кривой титрования дипротонной кислоты имеются две точки эквивалентности. [16] Первая точка эквивалентности возникает, когда титруются все первые ионы водорода от первой ионизации. [17] Другими словами, количество OH − добавленное равно исходному количеству H 2 A в первой точке эквивалентности. Вторая точка эквивалентности возникает, когда титруются все ионы водорода. Следовательно, количество OH − добавленное в это время равно удвоенному количеству H 2 A. Для слабой дипротонной кислоты, титрованной сильным основанием, вторая точка эквивалентности должна возникать при pH выше 7 из-за гидролиза образующихся солей в растворе. [17] В любой точке эквивалентности добавление капли основания приведет к резкому повышению значения pH в системе.
Буферные регионы и средние точки
Кривая титрования дипротонной кислоты содержит две средние точки, где pH = pKa . Поскольку существуют два разных значения K a , первая средняя точка возникает при pH=pK a1 , а вторая – при pH=pK a2 . [18] Каждый сегмент кривой, содержащий среднюю точку в центре, называется буферной областью. Поскольку буферные области состоят из кислоты и сопряженного с ней основания, они могут противостоять изменениям pH при добавлении основания до следующих эквивалентных точек. [5]
Применение кислот
В промышленности
Кислоты являются основными реагентами практически во всех процессах современной промышленности. Серная кислота, дипротонная кислота, является наиболее широко используемой кислотой в промышленности, а также самым производимым промышленным химикатом в мире. В основном он используется при производстве удобрений, моющих средств, аккумуляторов и красителей, а также при обработке многих продуктов, например, при удалении примесей. [19] По данным статистики, в 2011 году годовое производство серной кислоты в мире составило около 200 миллионов тонн. [20] Например, фосфатные минералы реагируют с серной кислотой с образованием фосфорной кислоты для производства фосфорных удобрений, а цинк получают путем растворения оксида цинка в серной кислоте, очистки раствора и электролиза.
В химической промышленности кислоты вступают в реакции нейтрализации с образованием солей. Например, азотная кислота реагирует с аммиаком с образованием нитрата аммония — удобрения. Кроме того, карбоновые кислоты можно этерифицировать спиртами с образованием сложных эфиров .
Кислоты часто используются для удаления ржавчины и других видов коррозии с металлов в процессе, известном как травление . Их можно использовать в качестве электролита в аккумуляторе с мокрыми элементами , например серную кислоту в автомобильном аккумуляторе .
В еде

Винная кислота является важным компонентом некоторых часто используемых продуктов, таких как незрелые манго и тамаринд. Натуральные фрукты и овощи также содержат кислоты. Лимонная кислота присутствует в апельсинах, лимонах и других цитрусовых. Щавелевая кислота присутствует в томатах, шпинате и особенно в карамболе и ревене ; листья ревеня и незрелая карамбола токсичны из-за высокой концентрации щавелевой кислоты. Аскорбиновая кислота (витамин С) является важным витамином для человеческого организма и присутствует в таких продуктах, как амла ( индийский крыжовник ), лимон, цитрусовые и гуава.
Многие кислоты можно найти в различных видах продуктов питания в качестве добавок, поскольку они изменяют их вкус и служат консервантами. Фосфорная кислота , например, является компонентом напитков типа колы . Уксусная кислота используется в повседневной жизни как уксус. Лимонная кислота используется в качестве консерванта в соусах и соленьях.
Угольная кислота — одна из наиболее распространенных кислотных добавок, которые широко добавляют в безалкогольные напитки . В процессе производства CO 2 обычно находится под давлением, чтобы раствориться в этих напитках и образовать углекислоту. Угольная кислота очень нестабильна и имеет тенденцию разлагаться на воду и CO 2 при комнатной температуре и давлении. Поэтому, когда бутылки или банки с такими безалкогольными напитками открываются, безалкогольные напитки шипят и шипят, когда CO 2 . выходят пузырьки [21]
Некоторые кислоты используются в качестве лекарств. Ацетилсалициловая кислота (аспирин) используется как обезболивающее и для снижения температуры.
В человеческих телах
Кислоты играют важную роль в организме человека. Соляная кислота, присутствующая в желудке, способствует пищеварению, расщепляя большие и сложные молекулы пищи. Аминокислоты необходимы для синтеза белков, необходимых для роста и восстановления тканей организма. Жирные кислоты также необходимы для роста и восстановления тканей организма. Нуклеиновые кислоты важны для производства ДНК и РНК и передачи признаков потомству через гены. Угольная кислота важна для поддержания баланса pH в организме.
Человеческие тела содержат множество органических и неорганических соединений, среди которых дикарбоновые кислоты играют важную роль во многих биологических процессах. Многие из этих кислот представляют собой аминокислоты , которые в основном служат материалом для синтеза белков. [22] Другие слабые кислоты служат буферами для сопряженных с ними оснований, предохраняя pH организма от крупномасштабных изменений, которые были бы вредны для клеток. [23] Остальные дикарбоновые кислоты также участвуют в синтезе различных биологически важных соединений в организме человека.
Кислотный катализ
Кислоты используются в качестве катализаторов в промышленной и органической химии; например, серная кислота используется в очень больших количествах в процессе алкилирования для производства бензина. Некоторые кислоты, такие как серная, фосфорная и соляная кислоты, также вызывают дегидратации и реакции конденсации . В биохимии многие ферменты используют кислотный катализ. [24]
Биологическое явление
Многие биологически важные молекулы представляют собой кислоты. Нуклеиновые кислоты , содержащие кислые фосфатные группы , включают ДНК и РНК . Нуклеиновые кислоты содержат генетический код, определяющий многие характеристики организма, и передаются от родителей потомству. ДНК содержит химическую схему синтеза белков , которые состоят из аминокислотных субъединиц. Клеточные мембраны содержат жирных кислот сложные эфиры , такие как фосфолипиды .
α-аминокислота имеет центральный углерод (α или альфа- углерод ), который ковалентно связан с карбоксильной группой (таким образом, они представляют собой карбоновые кислоты ), аминогруппу , атом водорода и переменную группу. Вариабельная группа, также называемая группой R или боковой цепью, определяет идентичность и многие свойства конкретной аминокислоты. В глицине , самой простой аминокислоте, группа R представляет собой атом водорода, но во всех других аминокислотах она содержит один или несколько атомов углерода, связанных с атомами водорода, и может содержать другие элементы, такие как сера, кислород или азот. За исключением глицина, встречающиеся в природе аминокислоты хиральны и почти всегда встречаются в L -конфигурации . Пептидогликан , обнаруженный в клеточных стенках некоторых бактерий, содержит некоторое количество D -аминокислот. При физиологическом pH, обычно около 7, свободные аминокислоты существуют в заряженной форме, где кислая карбоксильная группа (-COOH) теряет протон (-COO). − ) и основная аминогруппа (-NH 2 ) приобретает протон (-NH +
3 ). Вся молекула имеет чистый нейтральный заряд и представляет собой цвиттер-ион , за исключением аминокислот с основными или кислотными боковыми цепями. Аспарагиновая кислота , например, содержит одну протонированную аминную и две депротонированные карбоксильные группы, что дает суммарный заряд -1 при физиологическом pH.
Жирные кислоты и производные жирных кислот — еще одна группа карбоновых кислот, играющая значительную роль в биологии. Они содержат длинные углеводородные цепи и группу карбоновой кислоты на одном конце. Клеточная мембрана почти всех организмов в основном состоит из фосфолипидного бислоя , мицеллы гидрофобных эфиров жирных кислот с полярными гидрофильными фосфатными «головными» группами. Мембраны содержат дополнительные компоненты, некоторые из которых могут участвовать в кислотно-основных реакциях.
У людей и многих других животных соляная кислота является частью желудочной кислоты, в желудке и помогающей гидролизовать белки и полисахариды , а также превращать неактивный профермент пепсиноген в фермент пепсин секретируемой . Некоторые организмы производят кислоты для защиты; например, муравьи производят муравьиную кислоту .
Кислотно-щелочное равновесие играет решающую роль в регуляции дыхания млекопитающих . Газообразный кислород (O 2 ) управляет клеточным дыханием – процессом, посредством которого животные высвобождают химическую потенциальную энергию, хранящуюся в пище, с образованием углекислого газа (CO 2 ) в качестве побочного продукта. происходит обмен кислорода и углекислого газа В легких , и организм реагирует на изменение потребности в энергии, регулируя скорость вентиляции . Например, во время физических нагрузок организм быстро расщепляет накопленные углеводы и жиры, выделяя CO 2 в кровоток. В водных растворах, таких как кровь, CO 2 существует в равновесии с угольной кислотой и бикарбоната ионом .
- CO 2 + H 2 O ⇌ H 2 CO 3 ⇌ H + + ОХС − 3
Именно снижение pH сигнализирует мозгу о необходимости дышать быстрее и глубже, вытесняя избыток CO 2 и пополняя клетки O 2 .

Клеточные мембраны обычно непроницаемы для заряженных или крупных полярных молекул из-за липофильных жирных ацильных цепей, составляющих их внутреннюю часть. Многие биологически важные молекулы, включая ряд фармацевтических агентов, представляют собой органические слабые кислоты, которые могут проникать через мембрану в протонированной незаряженной форме, но не в заряженной форме (т. е. в виде сопряженного основания). По этой причине активность многих лекарств может быть усилена или подавлена применением антацидов или кислых продуктов. Однако заряженная форма часто более растворима в крови и цитозоле , т.е. в водной среде. Когда внеклеточная среда более кислая, чем нейтральный pH внутри клетки, определенные кислоты будут существовать в нейтральной форме и будут растворимы в мембранах, что позволит им проникать через фосфолипидный бислой. Кислоты, которые теряют протон при внутриклеточном pH, будут существовать в растворимой заряженной форме и, таким образом, способны диффундировать через цитозоль к своей мишени. Ибупрофен , аспирин и пенициллин являются примерами препаратов, являющихся слабыми кислотами.
Общие кислоты
Минеральные кислоты (неорганические кислоты)
- Галогеноводороды и их растворы: плавиковая кислота (HF), соляная кислота (HCl), бромистоводородная кислота (HBr), иодистоводородная кислота (HI).
- Галогеноксокислоты: хлорноватистая кислота (HClO), хлористая кислота (HClO 2 ), хлорная кислота (HClO 3 ), хлорная кислота (HClO 4 ) и соответствующие аналоги брома и йода.
- Гипофтористая кислота (HFO), единственная известная оксокислота, содержащая фтор.
- Серная кислота (H 2 SO 4 )
- Фторсерная кислота (HSO 3 F)
- Азотная кислота (HNO 3 )
- Фосфорная кислота (H 3 PO 4 )
- Фторантимоновая кислота (HSbF 6 )
- Фторборная кислота (HBF 4 )
- Гексафторфосфорная кислота (HPF 6 )
- Хромовая кислота (H 2 CrO 4 )
- Борная кислота (H 3 BO 3 )
Сульфоновые кислоты
Сульфоновая кислота имеет общую формулу RS(=O) 2 –OH, где R – органический радикал.
- Метансульфоновая кислота (или мезиловая кислота, CH 3 SO 3 H)
- Этансульфоновая кислота (или этиловая кислота, CH 3 CH 2 SO 3 H)
- Бензолсульфокислота (или безиловая кислота, C 6 H 5 SO 3 H)
- п-Толуолсульфокислота (или тозиловая кислота, CH 3 C 6 H 4 SO 3 H)
- Трифторметансульфокислота (или трифликовая кислота, CF 3 SO 3 H)
- Полистиролсульфоновая кислота (сульфированный полистирол , [CH 2 CH(C 6 H 4 )SO 3 H] n )
Карбоновые кислоты
Карбоновая кислота имеет общую формулу RC(O)OH, где R — органический радикал. Карбоксильная группа -C(O)OH содержит карбонильную группу C=O и гидроксильную группу OH.
- Уксусная кислота (CH 3 COOH)
- Лимонная кислота (C 6 H 8 O 7 )
- Муравьиная кислота (HCOOH)
- Глюконовая кислота HOCH 2 -(CHOH) 4 -COOH
- Молочная кислота (СН 3 -СНОН-СООН)
- Щавелевая кислота (HOOC-COOH)
- Винная кислота (HOOC-CHOH-CHOH-COOH)
Галогенированные карбоновые кислоты
Галогенирование в альфа-положении увеличивает силу кислоты, поэтому все следующие кислоты сильнее уксусной кислоты.
- Фторуксусная кислота
- Трифторуксусная кислота
- Хлороуксусная кислота
- Дихлоруксусная кислота
- Трихлоруксусная кислота
Виниловые карбоновые кислоты
Обычные карбоновые кислоты представляют собой прямое соединение карбонильной группы и гидроксильной группы. В винилологических карбоновых кислотах двойная связь углерод-углерод разделяет карбонильную и гидроксильную группы.
Нуклеиновые кислоты
Ссылки
- ↑ Перейти обратно: Перейти обратно: а б с Золотая книга ИЮПАК – кислота
- ^ Петруччи, Р.Х.; Харвуд, РС; Сельдь, ФГ (2002). Общая химия: принципы и современные приложения (8-е изд.). Прентис Холл. п. 146. ИСБН 0-13-014329-4 .
- ^ Интернет-словарь Мерриам-Вебстера: кислота
- ↑ Перейти обратно: Перейти обратно: а б с д Отоксби, Д.В.; Гиллис, HP; Батлер, ЖЖ (2015). Принципы современной химии (8-е изд.). Брукс Коул. п. 617. ИСБН 978-1305079113 .
- ↑ Перейти обратно: Перейти обратно: а б с д Эббинг, Даррелл; Гаммон, Стивен Д. (1 января 2016 г.). Общая химия (11-е изд.). Cengage Обучение. ISBN 9781305887299 .
- ^ Шталь П.Х., Накамо М. (2008). «Фармацевтические аспекты солевой формы» . В Stahl PH, Warmth CG (ред.). Справочник фармацевтических солей: свойства, выбор и использование . Вайнхайм: Wiley-VCH. стр. 92–94. ISBN 978-3-906390-58-1 .
- ^ «Гидридогелий (CHEBI:33689)» . Химические соединения биологического интереса (ХЭБИ) . Европейский институт биоинформатики.
- ^ Лиас, СГ; Либман, Дж. Ф.; Левин, Р.Д. (1984). «Оценка основности газовой фазы и сродства молекул к протону; теплоты образования протонированных молекул». Журнал физических и химических справочных данных . 13 (3): 695. Бибкод : 1984JPCRD..13..695L . дои : 10.1063/1.555719 .
- ^ Фогель Г.К.; Драго, РС (1996). «Модель ECW». Журнал химического образования . 73 (8): 701–707. Бибкод : 1996ЖЧЭд..73..701В . дои : 10.1021/ed073p701 .
- ^ Лоуренс, К. и Гал, Дж.Ф. Шкалы основности и сродства Льюиса, данные и измерения, (Wiley 2010), стр. 50–51, ISBN 978-0-470-74957-9
- ^ Крамер, Р.Э.; Бопп, Т.Т. (1977). «Графическое отображение энтальпий образования аддуктов кислот и оснований Льюиса». Журнал химического образования . 54 : 612–613. дои : 10.1021/ed054p612 . На графиках, показанных в этой статье, использовались более старые параметры. Улучшенные параметры E&C перечислены в модели ECW .
- ^ Вайман, Джеффрис; Тайлстон Эдсолл, Джон. «Глава 9: Многоосновные кислоты, основания и амфолиты, включая белки». Биофизическая химия - Том 1 . п. 477.
- ^ де Леви, Роберт (1999). Водные кислотно-основные равновесия и титрование . Нью-Йорк: Издательство Оксфордского университета.
- ^ Джеймсон, Реджинальд Ф. (1978). «Определение констант ассоциации протонов для 3-(3,4-дигидроксифенил)аланина (L-допа)». Журнал Химического общества, Dalton Transactions (1): 43–45. дои : 10.1039/DT9780000043 .
- ^ Хельферих, Фридрих Г. (1 января 1962 г.). Ионный обмен . Курьерская компания. ISBN 9780486687841 .
- ^ «Титрование дипротоновой кислоты» . dwb.unl.edu . Архивировано из оригинала 7 февраля 2016 года . Проверено 24 января 2016 г.
- ↑ Перейти обратно: Перейти обратно: а б Коц, Джон К.; Трейчел, Пол М.; Таунсенд, Джон; Трейхель, Дэвид (24 января 2014 г.). Химия и химическая реакционная способность . Cengage Обучение. ISBN 9781305176461 .
- ^ Ленинджер, Альберт Л.; Нельсон, Дэвид Л.; Кокс, Майкл М. (1 января 2005 г.). Ленингерские принципы биохимии . Макмиллан. ISBN 9780716743392 .
- ^ «10 лучших промышленных химикатов – для чайников» . dummies.com . Проверено 5 февраля 2016 г.
- ^ «Серная кислота» . Essentialchemicalindustry.org . Проверено 6 февраля 2016 г.
- ^ Макмиллин, Джон Р.; Трейси, Джин А.; Харвилл, Уильям А.; Кредл, Уильям С. младший (8 декабря 1981 г.), Способ и устройство для изготовления и раздачи газированных напитков с использованием пропеллента диоксида углерода для газирования , получено 6 февраля 2016 г.
- ^ Барретт, GC; Элмор, DT (июнь 2012 г.). 8. Биологическая роль аминокислот и пептидов. Интернет-издание университета . дои : 10.1017/CBO9781139163828 . ISBN 9780521462921 . Архивировано из оригинала 2 марта 2016 года.
- ^ Грэм, Тимур (2006). «Кислотная буферизация» . Онлайн-руководство по кислотной основе . Университет Коннектикута. Архивировано из оригинала 13 февраля 2016 года . Проверено 6 февраля 2016 г.
- ^ Фут, Джудит Г.; Воэт, Дональд (2004). Биохимия . Нью-Йорк: Дж. Уайли и сыновья. стр. 496–500 . ISBN 978-0-471-19350-0 .
- Перечень сильных сторон распространенных кислот и оснований
- Зумдал, Стивен С. (1997). Химия (4-е изд.). Бостон: Хоутон Миффлин. ISBN 9780669417944 .
- Павия, ДЛ; Лэмпман, генеральный директор; Криз, Г.С. (2004). Органическая химия, том I. Мейсон, Огайо: Cengage Learning. ISBN 0759347271 .
Внешние ссылки
- Curtipot : диаграммы кислотно-щелочного равновесия, pH расчет титрования , моделирование и анализ кривых – бесплатное ПО.

![{\displaystyle K_{a}={\frac {{\what {[H+] [A^{-}]}}}{{\what {[HA]}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5ad1f54a70a45ea863263baa691826f3ee6cfb58)
![{\displaystyle {\begin{aligned}\alpha _{{\ce {H2A}}}&={\frac {{\ce {[H+]^2}}}{{\ce {[H+]^2} }+[{\what {H+}}]K_{1}+K_{1}K_{2}}}={\frac {{\what {[H2A]}}}{{\what {{[H2A] }}}+[HA^{-}]+[A^{2-}]}}\\\alpha _{{\ce {HA^-}}}&={\frac {[{\ce {H+ }}]K_{1}}{{\what {[H+]^2}}+[{\what {H+}}]K_{1}+K_{1}K_{2}}}={\frac { {\what {[HA^-]}}}{{\what {[H2A]}}+{[HA^{-}]}+{[A^{2-}]}}}\\\alpha _ {{\what {A^{2-}}}}&={\frac {K_{1}K_{2}}{{\what {[H+]^2}}+[{\what {H+}} ]K_{1}+K_{1}K_{2}}}={\frac {{\ce {[A^{2-}]}}}{{\ce {{[H2A]}}}+{ [HA^{-}]}+{[A^{2-}]}}}\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8e09f46996e12e5d2c821158e6bc6f70f54edbe7)
![{\displaystyle \alpha _{{\ce {H}}_{ni}A^{i-}}={{[{\ce {H+}}]^{ni}\displaystyle \prod _{j=0 }^{i}K_{j}} \over {\displaystyle \sum _{i=0}^{n}{\Big [}[{\ce {H+}}]^{ni}\displaystyle \prod _ {j=0}^{i}K_{j}}{\Big ]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5a82c39009cacb7d891f1f06a46a6558c3c91e76)