Карбокатион



Карбокатион – это ион с положительно заряженным углерода атомом . Среди простейших примеров - метений CH. +
3 , метан CH +
5 и винил С
22Ч +
3 катиона. Иногда встречаются также карбокатионы, несущие более одного положительно заряженного атома углерода (например, этилендикат С
22Ч 2+
4 ). [1]
До начала 1970-х годов все карбокатионы назывались ионами карбония . [2] В современном определении ИЮПАК карбокатион — это любой катион с четными электронами и значительным частичным положительным зарядом на атоме углерода. Далее они подразделяются на две основные категории в зависимости от координационного числа заряженного углерода: три у ионов карбения и пять у ионов карбония . Эта номенклатура была предложена Г. А. Олахом . [3] Ионы карбония, как первоначально определил Ола, характеризуются трехцентровой двухэлектронной схемой делокализованной связи и по сути являются синонимами так называемых « неклассических карбокатионов », которые представляют собой карбокатионы, содержащие мостиковые C–C или C–H. σ-связи. Однако другие более узко определили термин «ион карбония» как формально протонированные или алкилированные алканы ( CR +
5 , где R представляет собой H или алкил), за исключением неклассических карбокатионов, таких как 2-норборнильный катион . [4]
Определения [ править ]
Согласно ИЮПАК , карбокатион — это любой катион, содержащий четное число электронов, в котором значительная часть положительного заряда находится на атоме углерода. [5] До наблюдения Олахом и его коллегами пятикоординированных карбокатионов карбокатион и ион карбония использовались как взаимозаменяемые. Олах предложил переопределить ион карбония как карбокатион с любым типом трехцентровой двухэлектронной связи, в то время как ион карбения был недавно введен для обозначения карбокатиона, содержащего только двухцентровые двухэлектронные связи с трехкоординационным положительным углеродом. . Впоследствии другие использовали термин ион карбония более узко для обозначения видов, которые образуются (по крайней мере формально) в результате электрофильной атаки H. + или Р + на алкане, по аналогии с другими видами ониума основной группы , тогда как карбокатион, содержащий любой тип трехцентровой связи, называется неклассическим карбокатионом . При таком использовании катион 2-норборнила не является ионом карбония, поскольку формально он образуется в результате протонирования алкена (норборнена), а не алкана, хотя из-за своей мостиковой структуры он является неклассическим карбокатионом. ИЮПАК признает три различных определения иона карбония и призывает с осторожностью использовать этот термин. В оставшейся части статьи термин « ион карбония» будет использоваться в этом последнем ограниченном смысле, тогда как неклассический карбокатион будет использоваться для обозначения любого карбокатиона с σ-связями C–C и/или C–H, делокализованными посредством мостиков.
С конца 1990-х годов в большинстве учебников перестали использоваться термин «ион карбония» для обозначения классического трехкоординационного карбокатиона. Однако в некоторых учебниках университетского уровня термин «карбокатион» продолжает использоваться как синоним иона карбения. [6] [7] или обсуждать карбокатионы, лишь мимолетно упомянув старую терминологию ионов карбония. [8] или ионы карбения и карбония. [9] В одном учебнике по сей день сохраняется старое название ион карбония для иона карбения, а используется фраза «ион гипервалентного карбония». для CH +
5 . [10]
Карбокатион с двухкоординационным положительным углеродом, полученный в результате формального удаления гидрид-иона ( H − ) из алкена известен как виниловый катион . В отсутствие геометрических ограничений большинство замещенных винильных катионов несут формальный положительный заряд на sp-гидридизированном атоме углерода линейной геометрии. Двухкоординатное приближение sp 2 -гибридизированный катион, образующийся в результате формального удаления гидрид-иона из арена, называется арильным катионом . Эти карбокатионы относительно нестабильны (особенно арильные катионы) и встречаются нечасто. Следовательно, их часто исключают из учебников вводного и среднего уровня. Определение ИЮПАК предусматривает, что карбокатионы представляют собой разновидности с четными электронами; следовательно, катион-радикалы, такие как CH •+
4 , часто встречающиеся в масс-спектрометрии, не считаются карбокатионами.
История [ править ]
История карбокатионов восходит к 1891 году, когда Г. Мерлинг [11] сообщил, что он добавил бром к тропилидену ( циклогептатриену ), а затем нагрел продукт, чтобы получить кристаллический водорастворимый материал C.
7 ч.
7 Бр . Он не предложил для этого структуру; однако Деринг и Нокс [12] убедительно показало, что это бромид тропилия (циклогептатриенилия). этот ион будет ароматическим Согласно правилу Хюкеля, .
В 1902 году Норрис и Керман независимо друг от друга обнаружили, что бесцветный трифенилметанол дает темно-желтые растворы в концентрированной серной кислоте . Трифенилметилхлорид аналогичным образом образует оранжевые комплексы с хлоридами алюминия и олова. В 1902 году Адольф фон Байер признал солевой характер образующихся соединений. Тритилкарбокатион (показан ниже) представляет собой стабильную карбокатионную систему, которая использовалась в качестве гомогенного органокатализатора в органическом синтезе. [13] например, в форме тритилгексафторфосфата . [14]
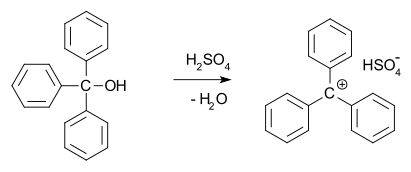
Он назвал связь между цветом и образованием соли галохромией которой является малахитовый зеленый , ярким примером .
Карбокатионы являются реакционноспособными промежуточными соединениями во многих органических реакциях. Эта идея, впервые предложенная Юлиусом Штиглицем в 1899 году, [15] был далее развит Гансом Меервейном в его исследовании 1922 года. [16] [17] перегруппировки Вагнера -Меервейна . Было также обнаружено участие карбокатионов в реакции SN таких 1 , реакции E1 и в реакциях перегруппировки, как сдвиг Уитмора 1,2 . Химический истеблишмент неохотно принимал идею карбокатионов, и долгое время Журнал Американского химического общества отказывался публиковать статьи, в которых они упоминались.
Первый ЯМР-спектр стабильного карбокатиона в растворе был опубликован Doering et al. [18] Это был ион гептаметилбензола , полученный обработкой гексаметилбензола метилхлоридом в 1958 году . и хлоридом алюминия . Стабильный 7-норборнадиенильный катион был получен Story et al. в 1960 году [19] путем реакции норборнадиенилхлорида с тетрафторборатом серебра в диоксиде серы при -80 ° C. Спектр ЯМР установил, что он не имеет классических мостиков (первый наблюдаемый стабильный неклассический ион ).
В 1962 году Ола непосредственно наблюдал трет - бутилкарбокатион с помощью ядерного магнитного резонанса как стабильную разновидность при растворении трет -бутилфторида в волшебной кислоте . ЯМР норборнильного катиона впервые был описан Schleyer et al. [20] и Сондерс и др. показали, что он подвергается перебору протонов через барьер. [21]
Структура и свойства [ править ]
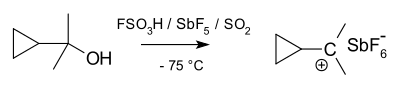
Ионы карбония можно рассматривать как протонированные алканы. Хотя алканы обычно считаются инертными, в сверхкислотных условиях (например, HF·SbF 5 ), сигма-связь CH может выступать донором ЧАС + . В результате образуется разновидность, содержащая связь 3c-2e между углеродом и двумя атомами водорода, тип связи, распространенный в химии бора, но относительно редкий для углерода. С альтернативной точки зрения связь 3c-2e ионов карбония можно рассматривать как молекулу H 2 координирован с ионом карбения ( см. ниже ). Действительно, ионы карбония часто разлагаются за счет потери молекулярного водорода с образованием соответствующего иона карбения. Структурно ион метана CH + 5 Вычислено, что имеет минимальную энергетическую структуру симметрии C s . Однако различные возможные структуры иона близки по энергии и разделены неглубокими барьерами. Поэтому структуру иона часто называют флюксиальной . Хотя кажется, что в ионах карбония имеется пять связей с углеродом, они не являются гипервалентными , поскольку число электронов вокруг центрального углерода составляет только восемь из-за связи 3c-2e.
Напротив, по крайней мере в формальном смысле, ионы карбения образуются в результате протонирования (присоединения ЧАС + ) или алкилирование (присоединение Р + ) карбена или алкена . Таким образом, по крайней мере в одном из их резонансных изображений они обладают атомом углерода, несущим формальный положительный заряд, который окружен секстетом электронов (шестью валентными электронами ) вместо обычного октета, необходимого для заполнения валентной оболочки углерода ( правило октета). ). Следовательно, ионы карбения (и карбокатионы в целом) часто являются реактивными, стремясь заполнить октет валентных электронов, а также восстановить нейтральный заряд . В соответствии с VSEPR и правилом Бента , если геометрически не ограничено пирамидальной формой (например, 1-адамантильный катион), 3-координационные ионы карбения обычно являются тригонально-планарными, с пустой орбиталью чистого p-символа в качестве нижней незанятой молекулярной орбитали (LUMO) и Связи CH/CC, образованные из C(sp 2 ) орбитали. Прототипическим примером является метиловый катион, СН + 3 . По тем же причинам двухкоординатные карбокатионы (виниловые катионы) обычно имеют линейную геометрию, со связями CH/CC, образованными из орбиталей C (sp).

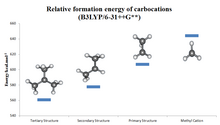
Алкилзамещенные карбокатионы по стабильности следуют порядку 3° > 2° > 1° > метила , о чем можно судить по значениям сродства к гидрид-иону (231, 246, 273 и 312 ккал/моль для (СН 3 ) 3 С + , ( СН3 ) 2СН + , СН 3 СН + 2 и СН + 3 ). [22] Эффект алкилзамещения является сильным: третичные катионы стабильны, и многие из них непосредственно наблюдаются в суперкислотных средах, но вторичные катионы обычно временны, и только изопропиловый, втор -бутильный и циклопентильный катионы. в растворе наблюдаются [23] Редко имеется какое-либо экспериментальное подтверждение существования первичных карбокатионов в фазе раствора, даже в качестве временных промежуточных продуктов (этиловый катион был предложен для реакций в 99,9% серной кислоте и в ФСО 2 OH·SbF 5 ), [24] а метил-катион однозначно идентифицирован только в газовой фазе. В большинстве, если не во всех случаях, основное состояние предполагаемых первичных карбокатионов состоит из мостиковых структур, в которых положительный заряд разделяется двумя или более атомами углерода, и их лучше описывать как алкены, протонированные по бокам, протонированные по краям циклопропаны или протонированные по углам. циклопропаны, а не истинные первичные катионы. [25] [26] Даже простой этиловый катион, C 2 H + 5 , как было показано экспериментально и расчетно, является мостиком [27] и его можно рассматривать как симметрично протонированную молекулу этилена. То же самое верно и для высших гомологов, таких как катионы 1-пропила и 1-бутила. [28] Считается, что производные неопентила ионизируются с сопутствующей миграцией метильной группы ( анхимерная помощь ); таким образом, в большинстве, если не во всех случаях, считается, что дискретный неопентильный катион не участвует. [29]
Стабилизация алкильными группами объясняется гиперконъюгацией . [30] Передача электронной плотности от связи β CH или CC на незанятую p-орбиталь карбокатиона (σ CH/CC → p-взаимодействие) позволяет делокализовать положительный заряд.
Судя по сродству к гидрид-иону, материнский виниловый катион менее стабилен, чем даже первичный sp. 2 -гибридизированный карбокатион, тогда как α-алкилзамещенный виниловый катион обладает сравнимой с последним стабильностью. Следовательно, виниловые катионы являются относительно редкими промежуточными соединениями. Их можно получить путем ионизации винилового электрофила при условии, что уходящая группа достаточно хорошая (например, ТфО − , IPh или № 2 ). Они участвуют в качестве промежуточных продуктов в некоторых реакциях винилового замещения (обозначенных как SN 1 (винил)) и в качестве промежуточных продуктов в реакциях электрофильного присоединения арилалкинов. За исключением исходного винилового катиона, который, как полагают, представляет собой мостиковую разновидность, и геометрически ограниченных циклических виниловых катионов, большинство виниловых катионов подвергаются sp-гибридизации и являются линейными.
Арильные катионы более нестабильны, чем виниловые катионы, из-за искажения нелинейной геометрии, вызванного кольцом, и примерно sp 2 -характер незанятой орбитали. Только N 2 в солях арилдиазония является достаточно хорошей уходящей группой для химического образования арильных катионов. [31]
Алкинильные катионы крайне нестабильны, гораздо менее стабильны, чем даже CH. +
3 (сродство к гидрид-иону 386 ккал/моль против 312 ккал/моль для CH +
3 ) и не может быть получен чисто химическим путем. Однако они могут быть получены радиохимическим путем посредством распада трития бета - : [32]

Что касается реакционной способности, карбокатионы подвержены атаке нуклеофилов , таких как вода, спирты, карбоксилаты, азид и галогенид-ионы, с образованием продукта присоединения. Сильноосновные нуклеофилы, особенно затрудненные, предпочитают отщепление, а не присоединение. Поскольку даже слабые нуклеофилы будут реагировать с карбокатионами, большинство из них можно непосредственно наблюдать или выделить только в ненуклеофильных средах, таких как суперкислоты . [33]
Карбокатионы обычно подвергаются реакциям перегруппировки из менее стабильных структур в столь же стабильные или более стабильные путем миграции алкильной группы или водорода к катионному центру с образованием нового карбокатионного центра. [34] Это часто происходит при константах скорости, превышающих 10. 10 с −1 при температуре окружающей среды и по-прежнему происходит быстро (по сравнению с временной шкалой ЯМР) при таких низких температурах, как -120 ° C ( см. сдвиг Вагнера-Меервейна ). В особенно благоприятных случаях, таких как 2-норборнильный катион, водородные сдвиги все еще могут происходить с достаточно высокой скоростью, чтобы мешать рентгеновской кристаллографии при 86 К (-187 ° C). [35] Обычно карбокатионы перегруппировываются с образованием третичного изомера. Например, все изомеры C 6 H + 11 быстро перегруппировывается с образованием 1-метил-1-циклопентильного катиона. Этот факт часто усложняет синтетические пути. Например, при нагревании 3-пентанола с водной HCl первоначально образовавшийся 3-пентилкарбокатион перегруппировывается в статистическую смесь 3-пентила и 2-пентила. Эти катионы реагируют с ионами хлорида с образованием примерно одной трети 3-хлорпентана и двух третей 2-хлорпентана. Алкилирование Фриделя -Крафтса страдает этим ограничением; по этой причине ацилирование (с последующим восстановлением Вольфа-Кишнера или Клемменсена чаще применяется с получением алкилированного продукта).
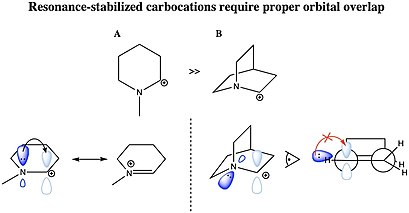
Карбокатион может быть стабилизирован резонансом двойной связи углерод-углерод или неподеленной парой гетероатома, соседнего с ионизированным углеродом. Чтобы карбокатион был резонансно стабилизирован, молекулярная орбиталь донорной группы должна иметь правильную симметрию, ориентацию и энергетический уровень для взаимодействия с пустой 2p-орбиталью карбокатиона. Такие катионы, как аллильный катион CH 2 =CH−CH + 2 и бензильный катион C 6 H 5 −CH + 2 более стабильны, чем большинство других карбокатионов, за счет передачи электронной плотности от π-систем катионному центру. [36] Кроме того, карбокатионы, присутствующие в ароматических молекулах, особенно стабилизированы, во многом благодаря делокализованным π-электронам, характерным для ароматических колец. [37] Особенно реакционноспособны молекулы, способные образовывать аллил- или бензилкарбокатионы. Эти карбокатионы, где С + соседствует с другим атомом углерода, имеющим двойную или тройную связь, обладает дополнительной стабильностью из-за перекрытия пустой р-орбитали карбокатиона с р-орбиталями π-связи. Такое перекрытие орбиталей позволяет рассеять положительный заряд и разделить электронную плотность из π-системы с электронодефицитным центром, что приводит к стабилизации. Особенно стабильны дважды- и трибензильные карбокатионы, дифенилкарбениевый и трифенилкарбениевый (тритиловый) катионы. По тем же причинам частичный p-характер напряженных связей C–C в циклопропильных группах также позволяет жертвовать электронную плотность [38] и стабилизирует катион циклопропилметила (циклопропилкарбинила).
Порядок стабильности карбокатионов, от наиболее стабильного до наименее стабильного, что отражается значениями сродства к гидрид-иону (HIA), следующий (значения HIA в ккал/моль в скобках):
| Карбокатион | в -С 7 Н + 7 (наиболее устойчивый) | (С 6 Н 5 ) 3 С + | в -С 3 Н + 3 | (С 6 Н 5 ) 2 СН + | 2-норборнил + | т -С 4 Н + 9 | С 6 Ч 5 СН + 2 | я -С 3 Н + 7 |
|---|---|---|---|---|---|---|---|---|
| ОВЗ (ккал/моль) | 201 | 215 | 221 | 222 | 231 | 231 | 234 | 246 |
| Карбокатион | в -С 3 Н 5 СН + 2 | СН 2 =СН-СН + 2 | в -С 5 Н + 5 | СН≡С−СН + 2 | С 2 Н + 5 | С 2 Н + 3 | С 6 Ч + 5 | CH + 3 (наименее стабильный) |
| ОВЗ (ккал/моль) | 249 | 256 | 258 | 270 | 273 | 287 | 298 | 312 |
Как отмечено в разделе истории, катион тропилия ( C 7 H + 7 ) был одним из первых открытых карбокатионов благодаря своей ароматической стабильности. Этот карбокатион настолько стабилизирован, что его молекулу можно выделить и продать в виде соли. С другой стороны, антиароматический циклопентадиенильный катион ( C 5 H + 5 ) дестабилизируется примерно на 40 ккал/моль. Катион циклопропения ( C 3 H + 3 ), хотя и несколько дестабилизирован угловой деформацией, все же явно стабилизируется по ароматичности по сравнению со своим аналогом с открытой цепью, аллильным катионом. Эти различные стабильности катионов, зависящие от количества π-электронов в кольцевой системе, могут, кроме того, быть решающими факторами в кинетике реакции. Образование ароматического карбокатиона происходит намного быстрее, чем образование антиароматического карбокатиона или карбокатиона с открытой цепью. Учитывая роль карбокатионов во многих реакционных схемах, таких как, например, S N 1 , выбор конъюгации исходных материалов может быть мощным методом придания кинетической благоприятности или неблагоприятности, поскольку константа скорости для любой данной стадии зависит от активации стадии. энергия по уравнению Аррениуса .
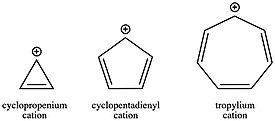
Эффект гиперконъюгации является сильным стабилизирующим для карбокатионов: гиперконъюгирование с алкильными заместителями часто является таким же или даже более стабилизирующим, чем конъюгация с π-системой. Хотя конъюгация с ненасыщенными группами приводит к значительной стабилизации за счет мезомерного эффекта (резонанса), польза частично нивелируется наличием более электроотрицательного sp. 2 или sp углерод рядом с карбокатионным центром. Таким образом, как показывает сродство к гидрид-иону, вторичный карбокатион более стабилен, чем аллильный катион, тогда как третичный карбокатион более стабилизирован, чем бензильный катион — результаты, которые на первый взгляд могут показаться нелогичными.
Ионы оксокарбения и иминия имеют важные вторичные канонические формы (резонансные структуры), в которых углерод несет положительный заряд. По существу, они являются карбокатионами согласно определению ИЮПАК, хотя некоторые химики не считают их «настоящими» карбокатионами, поскольку их наиболее важные вкладчики в резонанс несут формальный положительный заряд на атоме кислорода или азота соответственно.
Неклассические ионы [ править ]
Некоторые карбокатионы, такие как 2-норборнильный катион, демонстрируют более или менее симметричную трехцентровую двухэлектронную связь. Такие структуры, называемые неклассическими карбокатионами , предполагают делокализацию связей, входящих в σ-каркас молекулы, в результате чего образуются связи C–C и C–H дробного порядка связи. [39] [40] Эта делокализация приводит к дополнительной стабилизации катиона. Например, 2-норборнильный катион, изображенный как классический ион карбения, по-видимому, является вторичным карбокатионом. Однако он более стабилен, чем типичный «вторичный» карбокатион, и примерно так же стабилен, как третичный карбокатион, такой как трет -бутил-катион, в зависимости от сродства к гидрид-иону.
Существование неклассических карбокатионов когда-то было предметом больших споров. На противоположных сторонах стоял Герберт К. Браун , который считал, что то, что казалось неклассическим карбокатионом, представляет собой среднее значение двух быстро уравновешивающихся классических видов (или, возможно, двух структур, демонстрирующих некоторую степень мостиков или наклонов, но, тем не менее, не симметричных) и что истинная неклассическая структура — это переходное состояние между двумя минимумами потенциальной энергии, и Сол Уинштейн , который считал, что неклассическая структура, обладающая плоскостью симметрии, является единственным минимумом потенциальной энергии и что классические структуры — это всего лишь два способствующих резонанса. формы этого неклассического вида. Открытие Джорджем Олахом сверхкислотных сред, позволяющих напрямую наблюдать карбокатионы, а также очень чувствительный метод ЯМР, разработанный Мартином Сондерсом для различения этих двух сценариев, сыграли важную роль в разрешении этого противоречия. [41] [42] По крайней мере, что касается самого 2-норборнильного катиона, спор был решен в подавляющем большинстве в пользу Уинштейна, без каких-либо признаков предполагаемых взаимопревращающихся классических частиц, даже при таких низких температурах, как 6 К, и кристаллической структуры 2013 года, демонстрирующей явно неклассическую структуру. структура. [43] [35] В настоящее время считается, что различные карбокатионы (например, этил-катион, см. выше ) принимают неклассические структуры. Однако во многих случаях разница в энергии между двумя возможными «классическими» структурами и «неклассической» очень мала, и экспериментально отличить эти две возможности может быть трудно.
Специфические карбокатионы [ править ]
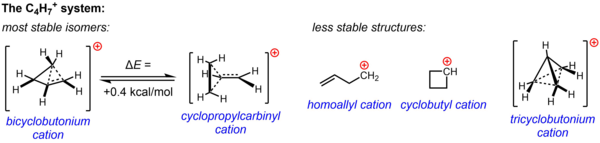
Неклассическая структура для C
44ч +
7 подтверждается существенными экспериментальными данными из экспериментов по сольволизу и исследований ЯМР, проведенных в ненуклеофильных средах. Одна или обе из двух структур, катион циклопропилкарбинила и катион бициклобутония, использовались для объяснения наблюдаемой реакционной способности в различных экспериментах, в то время как данные ЯМР указывают на сильно текучую систему, которая претерпевает быструю перегруппировку, давая усредненный спектр, состоящий только из двух 13 Сигналы ЯМР С даже при таких низких температурах, как -132 ° C. Расчетами было подтверждено, что энергетический ландшафт C
44ч +
Система 7 очень плоская, и что два изомера, постулированные на основе экспериментальных данных, очень близки по энергии, при этом структура бициклобутония, по расчетам, всего на 0,4 ккал/моль более стабильна, чем структура циклопропилкарбинила. В фазе раствора (SbF 5 ·SO 2 ClF ·SO 2 F 2 , при этом SbF –
6 в качестве противоиона) структура бициклобутония преобладает над структурой циклопропилкарбинила в соотношении 84:16 при -61 °C.
Теперь известно, что три другие возможные структуры, две классические структуры (гомоаллильный катион и циклобутиловый катион) и более делокализованная неклассическая структура (ион трициклобутония), являются менее стабильными изомерами (или просто переходным состоянием, а не минимумом энергии). в случае циклобутильного катиона). [44]
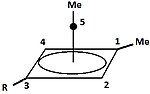
Замещенные циклопропилкарбинильные катионы также были изучены методом ЯМР: [45] [46]
В спектре ЯМР диметилпроизводного обнаруживаются два неэквивалентных сигнала для двух метильных групп, что указывает на то, что молекулярная конформация этого катиона не перпендикулярна (как в А), имеющая зеркальную плоскость, а разделена пополам (как в Б). ) с пустой p-орбиталью, параллельной циклопропильной кольцевой системе:
С точки зрения теории изогнутых связей это предпочтение объясняется предположением о благоприятном перекрытии орбиталей между заполненными изогнутыми связями циклопропана и пустой p-орбиталью. [47]
Пирамидальный карбокатион [ править ]
| Пирамидальные карбокатионы | ||
|---|---|---|
 | 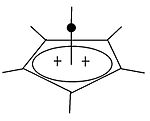 | Помимо классических и неклассических карбокатионов, можно выделить третий класс: пирамидальные карбокатионы . В этих ионах один атом углерода парит над четырех- или пятисторонним многоугольником , фактически образуя пирамиду . Квадратно -пирамидальный ион будет нести заряд +1, пятиугольный пирамидальный ион будет нести +2. Стабильная гексагонально-пирамидальная конфигурация трикатиона тропилия (C 7 H 7 ). 3+ , также было предсказано. [48] При этом координационное число углерода достигает семи. Кристаллическая структура [C 6 (CH 3 ) 6 ][SbF 6 ] 2 ·HSO 3 F подтверждает пентагонально-пирамидальную форму гексаметилбензолдикатиона. [49] |
| Пример одновалентного карбокатиона | Пример двухвалентного карбокатиона |
См. также [ править ]
Ссылки [ править ]
- ^ Грюцмахер, Хансйорг; Маршан, Кристина М. (1997). «Ионы карбения, стабилизированные гетероатомом». Коорд. хим. Преподобный . 163 : 287–344. дои : 10.1016/S0010-8545(97)00043-X .
- ^ Роберт Б. Гроссман (31 июля 2007 г.). Искусство написания разумных механизмов органических реакций . Springer Science & Business Media. стр. 105 . ISBN 978-0-387-95468-4 .
- ^ Ола, Джордж А. (1972). «Стабильные карбокатионы. CXVIII. Общее понятие и строение карбокатионов, основанное на дифференциации трехвалентных (классических) ионов карбения от трехцентросвязанных пента- или тетракоординированных (неклассических) ионов карбония. Роль карбокатионов в электрофильных реакциях». Журнал Американского химического общества . 94 (3): 808–820. дои : 10.1021/ja00758a020 .
- ^ Соммер, Дж.; Йост, Р. (1 января 2000 г.). «Карбений и ионы карбония в активации малых алканов, катализируемой жидкостью и твердой суперкислотой» . Чистая и прикладная химия . 72 (12): 2309–2318. дои : 10.1351/pac200072122309 . ISSN 1365-3075 .
- ^ «Карбокатион» , Сборник химической терминологии ИЮПАК , Международный союз прикладной химии, 2009, doi : 10.1351/goldbook.C00817 , ISBN 978-0967855097 , получено 3 ноября 2018 г.
- ^ Макмерри, Джон (август 1999 г.). Органическая химия (5-е изд.). Брукс Коул. ISBN 978-0-534-37617-8 .
- ^ Воллхардт, К. Питер К.; Шор, Нил Эрик (2018). Органическая химия: Структура и функции (8-е изд.). Нью-Йорк. ISBN 9781319079451 . OCLC 1007924903 .
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ) - ^ Юрканис Брюс, Паула (2004). Органическая химия (4-е изд.). Пирсон/Прентис Холл. ISBN 978-0-13-140748-0 .
- ^ Клейден, Джонатан ; Гривз, Ник; Уоррен, Стюарт ; Уотерс, Питер (2001). Органическая химия (1-е изд.). Издательство Оксфордского университета. ISBN 978-0-19-850346-0 .
- ^ Фокс, Мэри Энн; Уайтселл, Джеймс К. (1997). Органическая химия . Джонс и Бартлетт. ISBN 978-0-7637-0413-1 .
- ^ Мерлинг, Г. (1891). «О Тропине». Отчеты Немецкого химического общества . 24 (2): 3108–3126. дои : 10.1002/cber.189102402151 . ISSN 0365-9496 .
- ^ Деринг, В. фон Э.; Нокс, Л.Х. (1954). «Ион циклогептатриенилия (тропилия)». Журнал Американского химического общества . 76 (12): 3203–3206. дои : 10.1021/ja01641a027 .
- ^ «Открытие карбокатионовой системы in situ с использованием тритилхлорида в качестве гомогенного органокатализатора». Тетраэдр . 69 : 212–218. 2013. doi : 10.1016/j.tet.2012.10.042 .
- ^ Урч, К. (2001). «Трифенилметилгексафторфосфат». Энциклопедия реагентов для органического синтеза . дои : 10.1002/047084289X.rt363f . ISBN 0471936235 .
- ^ «О составе солей имидоэфиров и других производных карбимидов». Американский химический журнал . 21 : 101. ISSN 0096-4085 .
- ^ Меервейн, Х.; Эмстер, К. ван (1922). «О равновесной изомерии борнилхлорида, изоборнилхлорида и хлоргидрата камфена». Берихте . 55 : 2500.
- ^ Рзепа, ХС; Аллан, CSM (2010). «Рацемизация изоборнилхлорида посредством карбокатионов: неклассический взгляд на классический механизм». Журнал химического образования . 87 (2): 221. Бибкод : 2010JChEd..87..221R . дои : 10.1021/ed800058c .
- ^ Деринг, В. фон Э.; Сондерс, М.; Бойтон, ХГ; Эрхарт, HW; Уодли, EF; Эдвардс, WR; Лабер, Г. (1958). «Ион 1,1,2,3,4,5,6-гептаметилбензенония». Тетраэдр . 4 (1–2): 178–185. дои : 10.1016/0040-4020(58)88016-3 .
- ^ История, Пол Р.; Сондерс, Мартин (1960). «7-норборнадиенилкарбоний-ион». Журнал Американского химического общества . 82 (23): 6199. doi : 10.1021/ja01508a058 .
- ^ Шлейер, Пауль фон Р.; Уоттс, Уильям Э.; Форт, Раймонд К.; Комисаров, Мелвин Б.; Ола, Джордж А. (1964). «Стабильные ионы карбония. X.1 Наблюдение 2-норборнильного катиона методом прямого ядерного магнитного резонанса». Журнал Американского химического общества . 86 (24): 5679–5680. дои : 10.1021/ja01078a056 .
- ^ Сондерс, Мартин; Шлейер, Пауль фон Р.; Ола, Джордж А. (1964). «Стабильные ионы карбония. XI.1 Скорость гидридных сдвигов в 2-норборнильном катионе». Журнал Американского химического общества . 86 (24): 5680–5681. дои : 10.1021/ja01078a057 .
- ^ Анслин, Эрик В.; Догерти, Деннис А. (2000). Современная физико-органическая химия . Саусалито, Калифорния: Университетские научные книги. ISBN 978-1891389313 .
- ^ Кэрролл, Феликс А. (2010). Взгляды на структуру и механизм органической химии (2-е изд.). Хобокен, Нью-Джерси: Джон Уайли. ISBN 9780470276105 . OCLC 286483846 .
- ^ Ола, Джордж А.; О'Брайен, Дэниел Х.; Уайт, Энтони Мэллинсон. (октябрь 1967 г.). «Стабильные ионы карбония. ЛII. Протонированные эфиры и их расщепление в растворе фторсульфоновой кислоты-пентафторида сурьмы». Журнал Американского химического общества . 89 (22): 5694–5700. дои : 10.1021/ja00998a036 . ISSN 0002-7863 .
- ^ Кэри, Фрэнсис А. (2007). Передовая органическая химия . Сундберг, Ричард Дж. (5-е изд.). Нью-Йорк: Спрингер. ISBN 9780387448978 . OCLC 154040953 .
- ^ Лоури, Томас Х. (1987). Механизм и теория в органической химии . Ричардсон, Кэтлин Шуллер. (3-е изд.). Нью-Йорк: Харпер и Роу. ISBN 0060440848 . OCLC 14214254 .
- ^ Кэри, Фрэнсис А. (2007). Продвинутая органическая химия: Часть A: Структура и механизмы . Сундберг, Ричард Дж. (5-е изд.). Нью-Йорк: Спрингер. п. 300-301. ISBN 9780387448978 . OCLC 154040953 .
- ^ Шульц, Джоселин К.; Хоул, ФА; Бошан, JL (июль 1984 г.). «Фотоэлектронная спектроскопия 1-пропильных, 1-бутильных, изобутильных, неопентильных и 2-бутильных радикалов: предшественники свободных радикалов высокоэнергетических изомеров ионов карбония». Журнал Американского химического общества . 106 (14): 3917–3927. дои : 10.1021/ja00326a006 . ISSN 0002-7863 .
- ^ Яматака, Хироши; Андо, Такаши; Нагасе, Сигэру; Ханамура, Мицуясу; Морокума, Кейджи (февраль 1984 г.). «Ab initio MO расчеты изотопных эффектов в модельных процессах сольволиза неопентилового эфира». Журнал органической химии . 49 (4): 631–635. дои : 10.1021/jo00178a010 . ISSN 0022-3263 .
- ^ Кэри, Фрэнсис А. (2007). Продвинутая органическая химия: Часть A: Структура и механизмы . Сундберг, Ричард Дж. (5-е изд.). Нью-Йорк: Спрингер. п. 300-301. ISBN 9780387448978 . OCLC 154040953 .
- ^ Кэри, Фрэнсис А. (2007). Продвинутая органическая химия: Часть A: Структура и механизмы . Сундберг, Ричард Дж. (5-е изд.). Нью-Йорк: Спрингер. п. 436. ИСБН 9780387448978 . OCLC 154040953 .
- ^ Анджелини, Джанкарло; Ханак, Майкл; Вермерен, Ян; Сперанца, Маурицио (17 февраля 1988 г.). «Генерация и захват алкинильного катиона». Журнал Американского химического общества . 110 (4): 1298–1299. дои : 10.1021/ja00212a052 . ISSN 0002-7863 .
- ^ Кэри, Фрэнсис А. (2007). Продвинутая органическая химия: Часть A: Структура и механизмы . Сундберг, Ричард Дж. (5-е изд.). Нью-Йорк: Спрингер. п. 436. ИСБН 9780387448978 . OCLC 154040953 .
- ^ Кэри, Фрэнсис А. (2007). Продвинутая органическая химия: Часть A: Структура и механизмы . Сундберг, Ричард Дж. (5-е изд.). Нью-Йорк: Спрингер. п. 440. ИСБН 9780387448978 . OCLC 154040953 .
- ^ Jump up to: Перейти обратно: а б Шольц, Ф.; Химмель, Д.; Хайнеманн, ФРВ; Шлейер, П. против Р.; Мейер, К.; Кроссинг, И. (5 июля 2013 г.). «Определение кристаллической структуры неклассического 2-норборнильного катиона». Наука . 341 (6141): 62–64. Бибкод : 2013Sci...341...62S . дои : 10.1126/science.1238849 . ISSN 0036-8075 . ПМИД 23828938 . S2CID 206549219 .
- ^ Кэри, Фрэнсис А. (2007). Продвинутая органическая химия: Часть A: Структура и механизмы . Сундберг, Ричард Дж. (5-е изд.). Нью-Йорк: Спрингер. п. 300-301. ISBN 9780387448978 . OCLC 154040953 .
- ^ Ауэ, Дональд Х. (2011). «Карбокатионы» . WIREs Вычислительная молекулярная наука . 1 (4): 487–508. дои : 10.1002/wcms.12 . ISSN 1759-0884 . S2CID 222190636 .
- ^ Кэри, Фрэнсис А. (2007). Продвинутая органическая химия: Часть A: Структура и механизмы . Сундберг, Ричард Дж. (5-е изд.). Нью-Йорк: Спрингер. п. 426-427. ISBN 9780387448978 . OCLC 154040953 .
- ^ Строго говоря, гиперконъюгативная стабилизация алкилзамещенных карбокатионов представляет собой тип трехцентровой связи. Геометрически наблюдается (или рассчитывается), что связи C–H, участвующие в гиперконъюгации, в результате слегка «наклоняются» к карбокатионному центру (т. е. + Валентный угол C–C–H несколько уменьшается). Тем не менее, атом водорода по-прежнему в основном связан с углеродом α и катионным углеродом. Чтобы квалифицироваться как неклассический карбокатион, двухэлектронная трехцентровая связь должна содержать группу, в равной степени (или почти поровну) связанную с двумя электронодефицитными центрами. На практике существует континуум возможных схем связывания: от незначительного участия соседней группы (слабая гиперконъюгация) до равного распределения группы между соседними центрами (полностью неклассическая связь).
- ^ Кэри, Фрэнсис А. (2007). Продвинутая органическая химия: Часть A: Структура и механизмы . Сундберг, Ричард Дж. (5-е изд.). Нью-Йорк: Спрингер. п. 447-450. ISBN 9780387448978 . OCLC 154040953 .
- ^ Ола, Джордж А.; Пракаш, Г.К. Сурья; Сондерс, Мартин (май 2002 г.). «Заключение классического и неклассического ионного спора на основе структурного исследования 2-норборнильного катиона». Отчеты о химических исследованиях . 16 (12): 440–448. дои : 10.1021/ar00096a003 .
- ^ Джордж А. Ола - Нобелевская лекция
- ^ Яннони, CS; Мире, ПК; Уэбб, Гретхен Г. (ноябрь 1990 г.). «Ядерный магнитный резонанс с вращением под магическим углом вблизи гелиевых температур. CPMAS-спектры 2-норборнильного катиона при переменной температуре до 6 К». Журнал Американского химического общества . 112 (24): 8991–8992. дои : 10.1021/ja00180a060 . ISSN 0002-7863 .
- ^ Ола, Джордж А.; Сурья Пракаш, ГК; Расул, Голам (июль 2008 г.). «Ab Initio/GIAO-CCSD(T) Исследование структур, энергий и 13 Химические сдвиги C ЯМР C
44ч +
7 и С
55Ч +
9 ионов: относительная стабильность и динамические аспекты циклопропилкарбинила по сравнению с ионами бициклобутония» . Журнал Американского химического общества . 130 (28): 9168–9172. doi : 10.1021/ja802445s . ISSN 0002-7863 . PMID 18570420 . - ^ Кабаков, Дэвид С.; Наманворт, Эли (1970). «Исследование диметилциклопропилкарбинильного катиона методом двойного ядерного магнитного резонанса. Измерение барьера вращения». Журнал Американского химического общества . 92 (10): 3234–3235. дои : 10.1021/ja00713a080 .
- ^ Питтман-младший, Чарльз У.; Ола, Джордж А. (1965). «Стабильные ионы карбония. XVII.1a Ионы циклопропилкарбония и протонированные циклопропилкетоны». Журнал Американского химического общества . 87 (22): 5123–5132. дои : 10.1021/ja00950a026 .
- ^ Кэри, ФА; Сундберг, Р. Дж. Продвинутая органическая химия, часть A (2-е изд.).
- ^ Ван, Джордж; Рахман, А.К. Фазлур; Ван, Бин (май 2018 г.). «Ab initio расчеты ионных углеводородных соединений с гептакоординированным углеродом». Журнал молекулярного моделирования . 24 (5): 116. doi : 10.1007/s00894-018-3640-9 . ISSN 1610-2940 . ПМИД 29696384 . S2CID 13960338 .
- ^ Малишевский, Мориц; Зеппельт, К. (25 ноября 2016 г.). «Определение кристаллической структуры пятиугольно-пирамидального дикатиона гексаметилбензола C».
6 (СН
3 ) 2+
6 ". Applied Chemistry International Edition . 56 (1): 368–370. doi : 10.1002/anie.201608795 . ISSN 1433-7851 . PMID 27885766 .
Внешние ссылки [ править ]
 СМИ, связанные с карбокатионами, на Викискладе?
СМИ, связанные с карбокатионами, на Викискладе? - Пресс-релиз Нобелевская премия по химии 1994 года». Nobelprize.org. 9 июня 2010 г.
![{\displaystyle {\ce {RC#CT -> [RC#C^3 He]+ + e-}}+{\bar {\nu }}_{e}\longrightarrow {\ce {RC#C+ + ^ {3}He + e-}}+{\bar {\nu }}_{e}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b407467d1926148009140dc78110535945708543)