Правило Бента

В химии правило Бента связь между орбитальной гибридизацией и электроотрицательностью заместителей описывает и объясняет . [ 1 ] [ 2 ] Правило было сформулировано Генри А. Бентом следующим образом: [ 2 ]
Характер атома концентрируется на орбиталях, направленных к электроположительным заместителям.
Теория валентных связей дает хорошее приближение молекулярной структуры. Правило Бента устраняет различия между наблюдаемой и идеализированной геометрией. [ 3 ] Согласно правилу Бента, центральный атом, связанный с несколькими группами, будет регибридизироваться так, что орбитали с большим количеством s-характера будут направлены к электроположительным группам, а орбитали с большим количеством p-характера будут направлены к более электроотрицательным группам . Устранив предположение об эквивалентности всех гибридных орбиталей, правило Бента приводит к улучшению предсказаний молекулярной геометрии и прочности связей. [ 4 ] [ 5 ] Правило Бента можно обосновать относительными уровнями энергии s- и p- орбиталей. Правило Бента представляет собой модификацию теории VSEPR для молекул с симметрией ниже идеальной. [ 6 ] Для связей с более крупными атомами из более низких периодов тенденции орбитальной гибридизации сильно зависят как от электроотрицательности, так и от размера орбитали.
История
[ редактировать ]В начале 1930-х годов, вскоре после первоначального развития квантовой механики , эти теории начали применяться к молекулярной структуре Полингом . [ 7 ] Слейтер , [ 8 ] Коулсон , [ 9 ] и другие. В частности, Полинг ввел концепцию гибридизации , при которой атомные s- и p-орбитали объединяются, образуя гибридные sp, sp. 2 и сп 3 орбитали. Гибридные орбитали оказались мощным средством объяснения молекулярной геометрии простых молекул, таких как метан, который является тетраэдрическим с sp. 3 атом углерода и валентные углы 109,5° между четырьмя эквивалентными связями CH. Однако небольшие отклонения от этой идеальной геометрии стали очевидными в 1940-х годах. [ 10 ] Особенно известным примером является вода , где угол между двумя связями ОН составляет всего 104,5°. Чтобы объяснить такие расхождения, было предложено, что гибридизация может привести к образованию орбиталей с неравным характером s и p. А.Д. Уолш описал в 1947 г. [ 10 ] связь между электроотрицательностью групп, связанных с углеродом, и гибридизацией указанного атома углерода. Наконец, в 1961 году Бент опубликовал обширный обзор литературы, посвященной молекулярной структуре, гибридизации центрального атома и электроотрицательности заместителей. [ 2 ] и именно в связи с этой работой правило Бента получило свое название.
В оригинальной статье Бента считается, что групповая электроотрицательность метильной группы меньше, чем у атома водорода, поскольку замещение метила снижает константы кислотной диссоциации муравьиной кислоты и уксусной кислоты. [ 2 ]
Несвязывающие орбитали
[ редактировать ]Правило Бента также можно расширить, чтобы рационализировать гибридизацию несвязывающих орбиталей. С одной стороны, неподеленную пару (занятую несвязывающую орбиталь) можно рассматривать как предельный случай электроположительного заместителя с электронной плотностью, полностью поляризованной по направлению к центральному атому. Правило Бента предсказывает, что для стабилизации неподеленных, тесно удерживаемых несвязывающих электронов неподеленные парные орбитали должны принять характер высокого s . С другой стороны, незанятую (пустую) несвязывающую орбиталь можно рассматривать как предельный случай электроотрицательного заместителя, с электронной плотностью, полностью поляризованной в сторону лиганда и вдали от центрального атома. Правило Бента предсказывает, что для того, чтобы оставить как можно больше s-характера для оставшихся занятых орбиталей, незанятые несвязывающие орбитали должны максимизировать p-символ .
Экспериментально первый вывод соответствует уменьшению валентных углов молекул с неподеленными парами, таких как вода или аммиак, по сравнению с метаном, а второй вывод согласуется с планарной структурой молекул с незанятыми несвязывающими орбиталями, такими как мономерные ионы борана и карбения .
Последствия
[ редактировать ]Правило Бента можно использовать для объяснения тенденций как в молекулярной структуре, так и в реакционной способности. Определив, как гибридизация центрального атома должна повлиять на определенное свойство, можно проверить электроотрицательность заместителей, чтобы увидеть, выполняется ли правило Бента.
Валентные углы: теория VSEPR и правило Бента
[ редактировать ]Теория валентных связей предсказывает, что метан тетраэдрический, а этилен плоский. В воде и аммиаке ситуация сложнее, поскольку валентные углы составляют 104,5° и 107° соответственно, что меньше ожидаемого тетраэдрического угла 109,5°. Одним из объяснений этих отклонений является теория VSEPR , в которой предполагается, что валентные электроны лежат в локализованных областях, а неподеленные пары отталкивают друг друга в большей степени, чем связывающие пары. Правило Бента дает альтернативное объяснение.

Теория отталкивания электронных пар валентной оболочки (VSEPR) предсказывает геометрию молекул. [ 11 ] [ 12 ] VSEPR предсказывает, что молекулярная геометрия принимает конфигурацию, которая позволяет электронным парам быть максимально разнесенными. [ 11 ] [ 12 ] Такая максимизация расстояния между электронами позволяет достичь наиболее стабильного распределения электронов. [ 11 ] [ 12 ] Результатом теории VSEPR является возможность точно предсказывать валентные углы. Согласно теории VSEPR, геометрию молекулы можно предсказать, подсчитав, сколько электронных пар и атомов связано с центральным атомом. [ 11 ] [ 12 ] Правило Бента гласит: «Характер [А]томика концентрируется на орбиталях, направленных к электроположительным заместителям». [ 2 ] Правило Бента подразумевает, что валентные углы будут отклоняться от валентного угла, предсказанного теорией VSEPR; относительная электроотрицательность атомов, окружающих центральный атом, будет влиять на геометрию молекулы. [ 5 ] Теория VSEPR предлагает способ точно предсказать форму молекулы, используя простые правила. [ 13 ] Однако теория VSEPR лишь приблизительно предсказывает наблюдаемые молекулярные валентные углы. [ 13 ] [ 14 ] С другой стороны, правило Бента более точное. [ 5 ] Более того, было показано, что правило Бента подтверждает квантово-механические вычисления при описании геометрии молекул. [ 15 ]
| Молекула | Угол связи между заместителями | 3D-изображения с валентными углами |
|---|---|---|
 Диметиловый эфир
|
111.5° ± 1.5° [ 16 ]
|
 |
 Метанол
|
108.5° ± 2° [ 17 ]
|
 |
 Вода
|
104.5° [ 18 ]
|
 |
 Дифторид кислорода
|
104.2° [ 19 ]
|
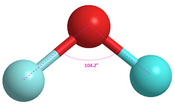 |
В таблице выше показаны различия между валентными углами, предсказанными теорией VSEPR, и их реальными углами. Согласно теории VSEPR, диэтиловый эфир, метанол, вода и дифторид кислорода должны иметь валентный угол 109,5. тот . [ 12 ] Согласно теории VSEPR, все эти молекулы должны иметь одинаковый валентный угол, поскольку они имеют одинаковую «изогнутую» форму. [ 12 ] Тем не менее, очевидно, что валентные углы между всеми этими молекулами по-разному отклоняются от своей идеальной геометрии. Правило Бента может помочь прояснить эти очевидные несоответствия. [ 5 ] [ 20 ] [ 21 ] Электроотрицательные заместители будут иметь более р- характер. [ 5 ] [ 20 ] Угол связи имеет пропорциональную зависимость от символа s и обратную зависимость от символа p . [ 5 ] Таким образом, по мере того как заместители становятся более электроотрицательными, валентный угол молекулы должен уменьшаться. Диметиловый эфир, метанол, вода и дифторид кислорода следуют этой тенденции, как и ожидалось (как показано в таблице выше). Две метильные группы являются заместителями, присоединенными к центральному кислороду в диэтиловом эфире. Поскольку две метильные группы являются электроположительными, будет наблюдаться больший s- характер, а реальный валентный угол больше, чем идеальный валентный угол, равный 109,5. тот . Метанол имеет один электроположительный метильный заместитель и один электроотрицательный водородный заместитель. Следовательно, меньший s- наблюдается характер, чем у диметилового эфира. При наличии двух водородных заместителей угол уменьшается еще больше с увеличением электроотрицательности и p- характера. Наконец, когда в дифториде кислорода оба водородных заместителя заменяются на фтор, происходит еще одно уменьшение валентного угла. Фтор обладает высокой электроотрицательностью, что приводит к значительному уменьшению валентного угла.
При прогнозировании валентного угла воды правило Бента предполагает, что гибридные орбитали с большим характером s должны быть направлены к неподеленным парам, в то время как это оставляет орбитали с большим характером p, направленными к атомам водорода, что приводит к отклонению от идеализированного O (sp 3 ) гибридные орбитали с 25% s-характером и 75% p-характером. В случае воды с углом HOH 104,5° связывающие орбитали OH состоят из O(~sp 4.0 ) орбиталей (~20% s, ~80% p), а неподеленные пары состоят из O(~sp 2.3 ) орбитали (~30% s, ~70% p). Как обсуждалось в обосновании выше, неподеленные пары ведут себя как очень электроположительные заместители и имеют избыточный s-характер. В результате связывающие электроны имеют повышенный p-характер. Этот увеличенный характер p на этих орбиталях уменьшает валентный угол между ними до значения меньше тетраэдрического 109,5 °. Ту же логику можно применить к аммиаку (валентный угол 107,0 ° HNH, с тремя N(~sp 3.4 или 23% с) связывающие орбитали и одна N(~sp 2.1 или 32% с) неподеленная пара), другой канонический пример этого явления.
Та же тенденция сохраняется и для азотсодержащих соединений. Вопреки ожиданиям теории VSEPR, но в соответствии с правилом Бента, валентные углы аммиака (NH 3 ) и трифторида азота (NF 3 ) составляют 107° и 102° соответственно.
В отличие от теории VSEPR , теоретические основы которой сейчас кажутся шаткими, правило Бента по-прежнему считается важным принципом в современных подходах к связи. [ 5 ] [ 22 ] Например, модификация этого анализа все еще жизнеспособна, даже если неподеленные пары H 2 O считаются неэквивалентными в силу их симметрии (т. е. только s, а кислородные АО p x и p y в плоскости гибридизованы. с образованием двух связывающих орбиталей OH σ OH и неподеленной пары n O (с) , в то время как p z становится неэквивалентной неподеленной парой чистых p-символов n O (п) ), как и в случае неподеленных пар, возникающих в результате методов естественных орбитальных связей .
Для тетраэдрической молекулы, такой как дифторметан, с атомами двух типов, связанными с центральным атомом, связь CF с более электроотрицательным заместителем (F) будет включать углеродную орбиталь с меньшим s-характером, чем связь CH, так что угол между CF связей меньше тетраэдрического валентного угла , равного 109,5°. [ 15 ] [ 23 ]
Молекулы тригональной бипирамиды имеют как осевое, так и экваториальное положение. Если есть два типа заместителей, более электроотрицательный заместитель будет отдавать предпочтение аксиальному положению, поскольку между аксиальными и электроотрицательными заместителями валентные углы меньшие, чем между двумя экваториальными заместителями. [ 23 ]
Длина связи
[ редактировать ]Подобно валентным углам, гибридизация атома может быть связана с длиной образуемых им связей. [ 2 ] По мере увеличения s-характера связывающих орбиталей длина σ-связи уменьшается.
| Молекула | Средняя длина связи углерод-углерод |
|---|---|
 |
1,54 Å |
 |
1,50 Å |
 |
1,46 Å |
Добавляя электроотрицательные заместители и изменяя гибридизацию центральных атомов, можно манипулировать длиной связей. Если молекула содержит структуру XA--Y, замена заместителя X на более электроотрицательный атом изменяет гибридизацию центрального атома A и укорачивает соседнюю связь A--Y.
| Молекула | Средняя длина связи углерод-фтор |
|---|---|
 Фторметан |
1388 Å |
 Дифторметан |
1,358 Å |
 Трифторметан |
1,329 Å |
 Тетрафторметан |
1,323 Å |
Связь между элементами разной электроотрицательности будет полярной , и электронная плотность в таких связях будет смещена в сторону более электроотрицательного элемента. Применение этой идеи к молекуле фторметана иллюстрирует силу правила Бента. Поскольку углерод более электроотрицательен , чем водород, электронная плотность в связи CH уменьшится, а связь CF удлинится.
Та же тенденция сохраняется и для хлорированных аналогов метана, хотя эффект менее драматичен, поскольку хлор менее электроотрицательен, чем фтор. [ 2 ]
| Молекула | Средняя длина связи углерод-хлор |
|---|---|
 хлорметан |
1783 Å |
 дихлорметан |
1772 Å |
 Трихлорметан |
1767 Å |
 Тетрахлорметан |
1766 Å |
Вышеупомянутые случаи, по-видимому, демонстрируют, что размер хлора менее важен, чем его электроотрицательность. Прогноз, основанный только на стерических свойствах, привел бы к противоположной тенденции, поскольку большие заместители хлора были бы более выгодными, если бы они находились далеко друг от друга. Поскольку стерическое объяснение противоречит результатам эксперимента, правило Бента, вероятно, играет первостепенную роль в определении структуры.
J CH Константы связи
[ редактировать ]Возможно, наиболее прямое измерение s-характера на связующей орбитали между водородом и углеродом осуществляется с помощью 1 Н- 13 Константы взаимодействия C, определенные по спектрам ЯМР . Теория предсказывает, что значения J CH коррелируют с характером s. [ 24 ] В частности, одна облигация 13 С- 1 H константа связи 1 J 13C-1H связан с дробным характером s углеродной гибридной орбитали, используемой для образования связи, посредством эмпирического соотношения , где это персонаж s. (Например, чистый sp 3 Гибридная атомная орбиталь, обнаруженная в связи CH метана, будет иметь 25% s-характеристику, что приведет к ожидаемой константе связи 500 Гц × 0,25 = 125 Гц, что прекрасно согласуется с экспериментально определенным значением.)
| Молекула | J CH (метильных протонов) |
|---|---|
 Метан |
125 Гц |
 ацетальдегид |
127 Гц |
 1,1,1–Трихлорэтан |
134 Гц |
 Метанол |
141 Гц |
 Фторметан |
149 Гц |
По мере увеличения электроотрицательности заместителя увеличивается и количество p-символа, направленного к заместителю. Это оставляет более s-характер связей с метиловыми протонами, что приводит к увеличению констант взаимодействия J CH .
Индуктивный эффект
[ редактировать ]Индуктивный эффект можно объяснить правилом Бента. [ 25 ] Индуктивный эффект заключается в передаче заряда через ковалентные связи, и правило Бента обеспечивает механизм таких результатов за счет различий в гибридизации. В таблице ниже, [ 26 ] поскольку группы, связанные с центральным углеродом, становятся более электроотрицательными, центральный углерод становится более электроноакцепторным, что измеряется константой полярного заместителя . Константы полярного заместителя в принципе аналогичны значениям σ из уравнения Гаммета , поскольку возрастающее значение соответствует большей электроноакцепторной способности. Правило Бента предполагает, что по мере увеличения электроотрицательности групп все больше символов p отклоняется в сторону этих групп, в результате чего в связи между центральным углеродом и группой R остается больше символов s. Поскольку s-орбитали имеют большую электронную плотность ближе к ядру, чем p-орбитали, электронная плотность в связи C-R будет больше смещаться в сторону углерода по мере увеличения s-характера. Это сделает центральный углерод более электроноакцепторным к R-группе. [ 10 ] Таким образом, электроноакцепторная способность заместителей переносится на соседний углерод, как и предсказывает индуктивный эффект.
| заместитель | Константа полярного заместителя (большие значения подразумевают большее электроноакцепторная способность) |
|---|---|
 т – Бутил |
−0.30 |
 Метил |
0.00 |
 хлорметил |
1.05 |
 Дихлорметил |
1.94 |
 Трихлорметил |
2.65 |
Формальная теория
[ редактировать ]Правило Бента обеспечивает дополнительный уровень точности теории валентных связей . Теория валентной связи предполагает, что ковалентные связи состоят из двух электронов, лежащих на перекрывающихся, обычно гибридизированных, атомных орбиталях двух связывающих атомов. Предположение о том, что ковалентная связь представляет собой линейную комбинацию атомных орбиталей только двух связывающих атомов, является приближением (см. Теорию молекулярных орбиталей ), но теория валентных связей достаточно точна, поэтому она оказала и продолжает оказывать большое влияние на то, как связь понятно. [ 1 ]
В теории валентной связи каждый из двух атомов вносит свой вклад в атомную орбиталь, а электроны на перекрывающихся орбиталях образуют ковалентную связь. Атомы обычно не образуют чистую водородоподобную орбиталь . в связях [ 7 ] Если бы атомы могли вносить только водородоподобные орбитали, то экспериментально подтвержденная тетраэдрическая структура метана была бы невозможна, поскольку 2s- и 2p-орбитали углерода не имеют такой геометрии. Это и другие противоречия привели к предложению орбитальной гибридизации . В этой системе атомным орбиталям разрешено смешиваться, образуя эквивалентное количество орбиталей различной формы и энергии. В вышеупомянутом случае метана 2s- и три 2p-орбитали углерода гибридизируются с образованием четырех эквивалентных sp-орбиталей. 3 орбиталей, что устраняет структурное несоответствие. Орбитальная гибридизация позволила теории валентных связей успешно объяснить геометрию и свойства огромного числа молекул.
В традиционной теории гибридизации все гибридные орбитали эквивалентны. [ 12 ] [ 27 ] А именно, атомные s и p-орбитали объединяются, образуя четыре sp i 3 = 1 ⁄ √ 4 ( s + √ 3 p i ) орбитали, три sp i 2 = 1 ⁄ √ 3 ( s + √ 2 p i ) орбитали или две sp i = 1 ⁄ √ 2 ( s + p i ) орбиталей. Эти комбинации выбираются с учетом двух условий. Во-первых, общая сумма вкладов s- и p-орбиталей должна быть эквивалентной до и после гибридизации. Во-вторых, гибридные орбитали должны быть ортогональны друг другу. [ 27 ] [ 28 ] Если бы две гибридные орбитали не были ортогональными, по определению они имели бы ненулевое перекрытие орбиталей. Электроны на этих орбиталях будут взаимодействовать, и если одна из этих орбиталей будет вовлечена в ковалентную связь, другая орбиталь также будет иметь ненулевое взаимодействие с этой связью, что нарушает принцип теории валентных связей «два электрона на связь».
Чтобы построить гибридные s и p-орбитали, пусть первая гибридная орбиталь задается выражением s + √ λ i p i , где pi направлена к связывающей группе, а λ i определяет количество p-характера, которое имеет эта гибридная орбиталь. Это взвешенная сумма волновых функций. Теперь выберите вторую гибридную орбиталь s + √ λ j p j , где p j направлен каким-то образом, а λ j — количество символов p на этой второй орбитали. Значение λ j и направление p j необходимо определить так, чтобы полученную орбиталь можно было нормализовать и чтобы она была ортогональна первой гибридной орбитали. Гибрид, безусловно, можно нормализовать, поскольку он представляет собой сумму двух нормированных волновых функций. Ортогональность должна быть установлена так, чтобы две гибридные орбитали могли участвовать в отдельных ковалентных связях. Внутренний продукт ортогональных орбиталей должен быть равен нулю, и вычисление внутреннего продукта построенных гибридов дает следующий расчет.
S-орбиталь нормирована, поэтому скалярное произведение ⟨ s | с ⟩ знак равно 1 . Кроме того, орбиталь s ортогональна орбиталям pi и . pj нулю , что приводит к тому, что два члена в приведенном выше примере равны Наконец, последний член представляет собой скалярное произведение двух нормализованных функций, находящихся под углом ω ij друг к другу, что дает cos ω ij по определению . Однако ортогональность связывающих орбиталей требует, чтобы 1 + √ λ i λ j cos ω ij = 0 , поэтому в результате мы получаем теорему Коулсона: [ 27 ] [ 29 ]
Это означает, что четыре атомные орбитали s и p могут быть гибридизированы в произвольных направлениях при условии, что все коэффициенты λ попарно удовлетворяют вышеуказанному условию, чтобы гарантировать ортогональность полученных орбиталей.
Правило Бента, согласно которому центральные атомы направляют орбитали с большим p-характером в сторону более электроотрицательных заместителей, легко применимо к вышеизложенному, если отметить, что увеличение коэффициента λ i увеличивает p-характер гибридной орбитали s + √ λ i p i . Таким образом, если центральный атом A связан с двумя группами X и Y, а Y более электроотрицательен, чем X, то A будет гибридизоваться так, что λ X < λ Y . Для точного предсказания молекулярной геометрии на основе основных принципов необходимы более сложные теоретические и вычислительные методы, выходящие за рамки правила Бента, но правило Бента обеспечивает превосходную эвристику при объяснении молекулярных структур.
Генри Бент первоначально предложил свое правило в 1960 году на эмпирических основаниях, но несколько лет спустя оно было подтверждено расчетами молекулярных орбиталей Рассела Драго . [ 23 ]
Применение правила Бента
[ редактировать ]Правило Бента позволяет точно охарактеризовать геометрию молекул. [ 11 ] [ 5 ] Правило Бента обеспечивает надежную и надежную основу для прогнозирования валентных углов молекул. Точность и точность правила Бента в предсказании геометрии реальных молекул продолжает демонстрировать свою достоверность. [ 5 ] [ 15 ] Помимо прогнозирования валентного угла, правило Бента имеет несколько важных приложений и представляет значительный интерес для химиков. [ 11 ] [ 5 ] [ 14 ] [ 21 ] [ 30 ] Правило Бента можно применять для анализа связывающих взаимодействий и молекулярного синтеза.
Правило Бента можно использовать для прогнозирования того, какие продукты будут предпочтительными в органическом синтезе в зависимости от исходных материалов. [ 14 ] [ 30 ] Ван и др. ал. рассмотрел, как заместители влияют на равновесие силабензолов, и обнаружил, что правило Бента сыграло значительную роль в результатах. [ 14 ] Исследование, проведенное Wang et. ал. демонстрирует, как правило Бента можно использовать для прогнозирования пути синтеза и стабильности продуктов. [ 14 ] Показав аналогичное применение, Dubois et. Все смогли обосновать некоторые из своих выводов, используя правило Бента, когда обнаружили, что реакция необратима. [ 30 ] Оба эти исследования показывают, как правило Бента можно использовать в синтетической химии. Знание того, насколько точно молекулярная геометрия благодаря правилу Бента, позволяет химикам-синтетикам прогнозировать относительную стабильность продукта. [ 14 ] [ 30 ] Кроме того, правило Бента может помочь химикам выбрать исходные материалы для реакции на конкретный продукт. [ 14 ] Следовательно, правило Бента позволяет химикам-синтетикам лучше контролировать интересующие реакции.
См. также
[ редактировать ]- Теория молекулярных орбиталей
- Орбитальная гибридизация
- Молекулярная геометрия
- Линейная комбинация атомных орбиталей
Ссылки
[ редактировать ]- ^ Jump up to: а б Вайнхольд, Ф.; Лэндис, CL (2005), Валентность и связь: взгляд на естественный донор-акцептор (1-е изд.), Кембридж: Cambridge University Press, ISBN 978-0-521-83128-4
- ^ Jump up to: а б с д и ж г Бент, HA (1961), "Оценка структур валентных связей и гибридизации в соединениях элементов первого ряда", Chem. Rev. , 61 (3): 275–311, doi : 10.1021/cr60211a005.
- ^ Фостер, JP; Вейнхольд, Ф. (1980), «Естественные гибридные орбитали», J. Am. хим. Соц. , 102 (24): 7211–7218, doi : 10.1021/ja00544a007
- ^ Алабугин, И.В.; Бреш, С.; Гомес, врач общей практики (2015). «Орбитальная гибридизация: ключевой электронный фактор в контроле структуры и реакционной способности». Дж. Физ. Орг. Хим . 28 (2): 147–162. дои : 10.1002/poc.3382 .
- ^ Jump up to: а б с д и ж г час я дж Йонас, В.; Беме, К.; Френкинг, Г. (1 января 1996 г.). «Правило Бента и строение соединений переходных металлов» . Неорганическая химия . 35 (7): 2097–2099. дои : 10.1021/ic951397o . ISSN 0020-1669 .
- ^ Алабугин, И.В.; Бреш, С.; Манохаран, М. (2014). «Тенденции гибридизации элементов основных групп и расширение правила Бента за пределы углерода: больше, чем электроотрицательность» . Дж. Физ. хим. А. 118 (20): 3663–3677. Бибкод : 2014JPCA..118.3663A . дои : 10.1021/jp502472u . ПМИД 24773162 .
- ^ Jump up to: а б Полинг, Л. (1931), «Природа химической связи. Применение результатов, полученных из квантовой механики и теории парамагнитной восприимчивости к структуре молекул», J. Am. хим. Соц. , 53 (4): 1367–1400, doi : 10.1021/ja01355a027
- ^ Слейтер, Дж. К. (1931), "Направленная валентность в многоатомных молекулах", Phys. Rev. , 37 (5): 481–489, Bibcode : 1931PhRv...37..481S , doi : 10.1103/PhysRev.37.481
- ^ Коулсон, Калифорния (1961), Валенс (2-е изд.), Оксфорд: Clarendon Press
- ^ Jump up to: а б с Уолш, А.Д. (1947), "Свойства связей с участием углерода", Обсудить. Фарадей Соц. , 2 : 18–25, doi : 10.1039/DF9470200018
- ^ Jump up to: а б с д и ж Болл, Д.В.; Ки, Дж. А. «Молекулярные формы и полярность» .
{{cite web}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Jump up to: а б с д и ж г Эссельман, Брайан Дж.; Блок, Стивен Б. (08 января 2019 г.). «VSEPR-Plus: правильные молекулярные и электронные структуры могут привести к улучшению студенческих концептуальных моделей» . Журнал химического образования . 96 (1): 75–81. doi : 10.1021/acs.jchemed.8b00316 . ISSN 0021-9584 .
- ^ Jump up to: а б Гиллеспи, Р.Дж. (1 июля 2008 г.). «Пятьдесят лет модели ВСЕПР» . Обзоры координационной химии . 252 (12): 1315–1327. дои : 10.1016/j.ccr.2007.07.007 . ISSN 0010-8545 .
- ^ Jump up to: а б с д и ж г Ван, Сюэруй; Хуан, Ин; Ан, Ке; Фан, Цзинлань; Чжу, Цзюнь (ноябрь 2014 г.). «Теоретическое исследование взаимного превращения силабензолов и их моноциклических неароматических изомеров посредством [1,3]-сдвига заместителя: взаимодействие ароматичности и правила Бента» . Журнал металлоорганической химии . 770 : 146–150. дои : 10.1016/j.jorganchem.2014.08.018 .
- ^ Jump up to: а б с Гош, Дулал К.; Бхаттачарья, Сома (январь 2005 г.). «Расчет квантово-механической гибридизации и дипольной корреляции электронной структуры супермолекулы F 3 B–NH 3» . Международный журнал квантовой химии . 105 (3): 270–279. дои : 10.1002/qua.20690 . ISSN 0020-7608 .
- ^ Кимура, Кацуми; Кубо, Масаджи (1 января 1959 г.). «Структуры диметилового эфира и метилового спирта» . Журнал химической физики . 30 (1): 151–158. дои : 10.1063/1.1729867 . ISSN 0021-9606 .
- ^ Венкатешварлу, Путча; Горди, Уолтер (1 июля 1955 г.). «Метиловый спирт. II. Молекулярная структура» . Журнал химической физики . 23 (7): 1200–1202. дои : 10.1063/1.1742240 . ISSN 0021-9606 .
- ^ Хэнкинс, Д.; Московиц, JW; Стиллингер, Ф.Х. (15 декабря 1970 г.). «Взаимодействие молекул воды» . Журнал химической физики . 53 (12): 4544–4554. дои : 10.1063/1.1673986 . ISSN 0021-9606 .
- ^ Хилтон, А. Рэй; Хаш, Альберт В.; Бил, Джеймс Б.; Хендерсон, Уильям Д.; Робинсон, Р.Дж. (1 апреля 1961 г.). «Миллиметровый волновой спектр и молекулярная структура дифторида кислорода» . Журнал химической физики . 34 (4): 1137–1141. дои : 10.1063/1.1731711 . ISSN 0021-9606 .
- ^ Jump up to: а б «1.2: Теория ВСЕПР и ее полезность» . Химия LibreTexts . 15 августа 2019 г. Проверено 6 декабря 2023 г.
- ^ Jump up to: а б Грабовский, Славомир Ю. (10 ноября 2011 г.). «Галогенная связь и ее аналоги: правило Бента объясняет образование несвязывающих взаимодействий» . Журнал физической химии А. 115 (44): 12340–12347. дои : 10.1021/jp205019s . ISSN 1089-5639 .
- ^ Вайнхольд, Ф.; Лэндис, Кларк Р. (2012). Открытие химии с помощью естественных орбиталей связи . Хобокен, Нью-Джерси: Уайли. стр. 67–68. ISBN 9781118119969 .
- ^ Jump up to: а б с Хахи, Джеймс Э. (1983). Неорганическая химия (3-е изд.). п. 230. ИСБН 0-06-042987-9 .
- ^ Х. Фриболин (2008). Основы одно- и двумерной ЯМР-спектроскопии (4-е изд.). ВЧ. ISBN 978-3-527-31233-7 .
- ^ Бент, Х.А. (1960), «Распределение атомных свойств в молекулах и его химические последствия», J. Chem. Образование. , 37 (12): 616–624, Бибкод : 1960JChEd..37..616B , doi : 10.1021/ed037p616
- ^ Тафт-младший, Р.В. (1957), «Относительно электрона - оттягивающая способность и электроотрицательность групп», J. Chem. Физ. , 26 (1): 93–96, Бибкод : 1957JChPh..26...93T , doi : 10.1063/1.1743270
- ^ Jump up to: а б с Коулсон, Калифорния (1961), Валенс (2-е изд.), Оксфорд: Clarendon Press, стр. 203–5. Неэквивалентные гибриды.
- ^ Чжун, Жунлинь; Чжан, Мин; Сюй, Хунлян; Су, Чжунминь (2016). «Скрытая гармония в диуглероде между теориями VB и MO посредством ортогональной гибридизации 3σ g и 2σ u» . Химическая наука . 7 (2): 1028–1032. дои : 10.1039/C5SC03437J . ISSN 2041-6520 . ПМЦ 5954846 . ПМИД 29896370 .
- ^ Пфенниг, Брайан В. (2015). «10» . Основы неорганической химии . Джон Уайли и сыновья. ISBN 9781118859018 . Проверено 11 августа 2023 г.
Уравнение (10.11) также известно как теорема Коулсона.
- ^ Jump up to: а б с д Дюбуа, Марин А.Дж.; Рохас, Хуан Дж.; Стерлинг, Алистер Дж.; Бродерик, Ханна К.; Смит, Майло А.; Уайт, Эндрю Дж. П.; Миллер, Филип В.; Чой, Чулхо; Муссо, Джеймс Дж.; Дуарте, Фернанда; Булл, Джеймс А. (19 мая 2023 г.). «Фоторедокс-катализируемое видимым светом декарбоксилирующее алкилирование 3-арил-оксетанов и азетидинов через бензильные третичные радикалы и последствия стабильности бензильных радикалов» . Журнал органической химии . 88 (10): 6476–6488. дои : 10.1021/acs.joc.3c00083 . ISSN 0022-3263 . ПМЦ 10204094 . ПМИД 36868184 .


![{\displaystyle {\begin{aligned}\left\long s+{\sqrt {\lambda_{i}}}p_ {i}{\Big \vert }s+{\sqrt {\lambda_{j}}}p_ {j }\right\range &=\angle s\mid s\rangle +{\sqrt {\lambda _{i}}}\longle s\mid p_{i}\rangle +{\sqrt {\lambda _{j}}}\longle s\mid p_{j}\rangle +{\sqrt {\lambda _{ i}\lambda _{j}}}\range p_{i}\mid p_{j}\range \\[4pt]&=1+0+0+{\sqrt{\lambda_{i}\lambda_{j}}}\cos \omega_{ij}=1+{\sqrt{\lambda_{ i}\lambda_ {j}}}\cos\omega_{ij}\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a9a0eccf9438e2d82c4e98622999feded965adac)
