Электроотрицательность

Электроотрицательность , обозначаемая как χ , представляет собой тенденцию атома данного химического элемента притягивать общие электроны (или электронную плотность ) при образовании химической связи . [1] На электроотрицательность атома влияет как его атомный номер , так и расстояние, на котором его валентные электроны находятся от заряженного ядра. Чем выше связанная электроотрицательность, тем больше атом или группа заместителя притягивает электроны. Электроотрицательность служит простым способом количественной оценки энергии связи связи , а также знака и величины химической полярности , которая характеризует связь в непрерывном масштабе от ковалентной до ионной связи . Свободно определенный термин электроположительность является противоположностью электроотрицательности: он характеризует склонность элемента отдавать валентные электроны.
На самом базовом уровне электроотрицательность определяется такими факторами, как заряд ядра (чем больше протонов имеет атом, тем большее «притяжение» он оказывает на электроны), а также число и расположение других электронов в атомных оболочках (чем больше электронов находится в атомных оболочках). имеет атом, тем дальше от ядра будут находиться валентные электроны и, как следствие, тем меньший положительный заряд они будут испытывать - как из-за их увеличенного расстояния от ядра, так и из-за того, что другие электроны на орбиталях ядра с более низкой энергией будут действовать для защиты валентных электронов от положительно заряженного ядра).
Термин «электроотрицательность» был введен Йонсом Якобом Берцелиусом в 1811 году. [2] хотя эта концепция была известна и раньше и изучалась многими химиками, включая Авогадро . [2] Несмотря на свою долгую историю, точная шкала электроотрицательности не была разработана до 1932 года, когда Лайнус Полинг предложил шкалу электроотрицательности, которая зависит от энергии связи, как развитие теории валентных связей . [3] Было показано, что он коррелирует с рядом других химических свойств. Электроотрицательность не может быть измерена напрямую и должна рассчитываться на основе других атомных или молекулярных свойств. Было предложено несколько методов расчета, и хотя в числовых значениях электроотрицательности могут быть небольшие различия, все методы показывают одни и те же периодические тенденции между элементами . [4]
Наиболее часто используемый метод расчета — метод, первоначально предложенный Лайнусом Полингом. Это дает безразмерную величину , обычно называемую шкалой Полинга ( χr ) , в относительной шкале от 0,79 до 3,98 ( водород = 2,20). При использовании других методов расчета принято (хотя и не обязательно) приводить результаты в шкале, охватывающей тот же диапазон числовых значений: это известно как электроотрицательность в единицах Полинга .
Как обычно рассчитывают, электроотрицательность — это не свойство только атома, а скорее свойство атома в молекуле . [5] Несмотря на это, электроотрицательность атома сильно коррелирует с первой энергией ионизации . Электроотрицательность слегка отрицательно коррелирует (для меньших значений электроотрицательности) и довольно сильно положительно коррелирует (для большинства и больших значений электроотрицательности) со сродством к электрону . [6] Следует ожидать, что электроотрицательность элемента будет меняться в зависимости от его химического окружения. [7] но обычно считается передаваемым имуществом , то есть аналогичные ценности будут действительны в различных ситуациях.
Цезий — наименее электроотрицательный элемент (0,79); фтора больше всего (3,98).
Методы расчета [ править ]
Полинга Электроотрицательность
Полинг первым предложил [3] концепция электроотрицательности в 1932 году, чтобы объяснить, почему ковалентная связь между двумя разными атомами (A–B) сильнее, чем в среднем связи A–A и B–B. Согласно теории валентной связи , видным сторонником которой был Полинг, эта «дополнительная стабилизация» гетероядерной связи происходит за счет вклада ионных канонических форм в связь .
Разница в электроотрицательности между атомами A и B определяется выражением:
Поскольку определяются только различия в электроотрицательности, для построения шкалы необходимо выбрать произвольную точку отсчета. В качестве эталона был выбран водород, так как он образует ковалентные связи с большим разнообразием элементов: его электроотрицательность была зафиксирована первой. [3] в 2.1, позже исправлено [8] до 2.20. Также необходимо решить, какой из двух элементов более электроотрицательный (что эквивалентно выбору одного из двух возможных знаков квадратного корня). Обычно это делается с помощью «химической интуиции»: в приведенном выше примере бромистый водород растворяется в воде с образованием H. + и Бр − ионы, поэтому можно предположить, что бром более электроотрицательен, чем водород. Однако в принципе, поскольку для любых двух связующих соединений должна быть получена одинаковая электроотрицательность, данные фактически переопределены, и знаки уникальны, как только опорная точка определена (обычно для H или F).
Для расчета электроотрицательности Полинга элемента необходимо иметь данные об энергиях диссоциации как минимум двух типов ковалентных связей, образуемых этим элементом. А. Л. Оллред обновил первоначальные значения Полинга в 1961 году, чтобы принять во внимание большую доступность термодинамических данных. [8] и именно эти «пересмотренные полинговские» значения электроотрицательности используются чаще всего.
Существенным моментом электроотрицательности Полинга является то, что существует основная, довольно точная, полуэмпирическая формула для энергий диссоциации, а именно:
Это приблизительные уравнения, но они выполняются с хорошей точностью. Полинг получил первое уравнение, заметив, что связь можно приближенно представить как квантовомеханическую суперпозицию ковалентной связи и двух ионных состояний связи. Ковалентная энергия связи, согласно квантово-механическим расчетам, является приблизительным средним геометрическим двух энергий ковалентных связей одних и тех же молекул, и существует дополнительная энергия, которая возникает из-за ионных факторов, т.е. полярного характера связи.
Среднее геометрическое примерно равно среднему арифметическому , которое применяется в первой формуле выше, когда энергии имеют одинаковое значение, например, за исключением сильно электроположительных элементов, где существует большая разница в две энергии диссоциации; среднее геометрическое более точно и почти всегда дает положительную избыточную энергию из-за ионной связи. Квадратный корень из этой избыточной энергии, как отмечает Полинг, приблизительно аддитивен, и, следовательно, можно ввести электроотрицательность. Таким образом, именно эти полуэмпирические формулы для энергии связи лежат в основе концепции электроотрицательности Полинга.
Формулы приблизительны, но это грубое приближение на самом деле относительно хорошее и дает правильную интуицию, имея представление о полярности связи и некоторые теоретические знания в области квантовой механики. Затем определяются электроотрицательности, которые наилучшим образом соответствуют данным.
В более сложных соединениях возникает дополнительная ошибка, поскольку электроотрицательность зависит от молекулярного окружения атома. Кроме того, оценку энергии можно использовать только для одинарных, а не для кратных связей. Энтальпию образования молекулы, содержащей только одинарные связи, можно впоследствии оценить по таблице электроотрицательностей, и она зависит от составляющих и суммы квадратов разностей электроотрицательностей всех пар связанных атомов. Такая формула для оценки энергии обычно имеет относительную погрешность порядка 10%, но ее можно использовать для получения грубого качественного представления и понимания молекулы.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Группа → | |||||||||||||||||||
| ↓ Период | |||||||||||||||||||
| 1 | ЧАС 2.20 | Он | |||||||||||||||||
| 2 | Что 0.98 | Быть 1.57 | Б 2.04 | С 2.55 | Н 3.04 | ТО 3.44 | Ф 3.98 | Ne | |||||||||||
| 3 | Уже 0.93 | мг 1.31 | Ал 1.61 | И 1.90 | П 2.19 | С 2.58 | кл. 3.16 | С | |||||||||||
| 4 | К 0.82 | Что 1.00 | наук 1.36 | Из 1.54 | V 1.63 | Кр 1.66 | Мин. 1.55 | Фе 1.83 | Ко 1.88 | В 1.91 | С 1.90 | Зн 1.65 | Здесь 1.81 | Ге 2.01 | Как 2.18 | Се 2.55 | Бр 2.96 | НОК 3.00 | |
| 5 | руб. 0.82 | старший 0.95 | И 1.22 | Зр 1.33 | Нб 1.6 | Мо 2.16 | Тс 1.9 | Ру 2.2 | резус 2.28 | ПД 2.20 | В 1.93 | компакт-диск 1.69 | В 1.78 | Сн 1.96 | Сб 2.05 | Te 2.1 | я 2.66 | Машина 2.60 | |
| 6 | Cs 0.79 | Нет 0.89 | Лу 1.27 | хф 1.3 | Облицовка 1.5 | В 2.36 | Ре 1.9 | Ты 2.2 | И 2.20 | Пт 2.28 | В 2.54 | ртуть 2.00 | Тл 1.62 | Pb 1.87 | С 2.02 | Po 2.0 | В 2.2 | Рн 2.2 | |
| 7 | Пт >0,79 [в 1] | Солнце 0.9 | лр 1.3 [в 2] | РФ | ДБ | Сг | Бх | Хс | гора | Дс | Рг | Сп | Нх | В | Мак | Лев | Ц | И | |
| La 1.1 | Этот 1.12 | Пр 1.13 | Нд 1.14 | вечера – | см 1.17 | Евросоюз – | Б-г 1.2 | Тб 1.1 | Те 1.22 | К 1.23 | Является 1.24 | Тм 1.25 | Ыб – | ||||||
| И 1.1 | че 1.3 | Хорошо 1.5 | В 1.38 | Например 1.36 | Мог 1.28 | Являюсь 1.13 | См 1.28 | Бк 1.3 | См. 1.3 | Является 1.3 | Фм 1.3 | Мэриленд 1.3 | Нет 1.3 | ||||||
См. Также: Электроотрицательность элементов (страница данных)
Надежных источников Pm, Eu и Yb, кроме диапазона 1,1–1,2, нет; см. Полинг, Лайнус (1960). Природа химической связи. 3-е изд., Издательство Корнельского университета, стр. 93.
- ^ Электроотрицательность франция была выбрана Полингом равной 0,7, близкой к электроотрицательности цезия (на тот момент также оцененной как 0,7). Позднее базовое значение водорода было увеличено на 0,10, а электроотрицательность цезия была позже уточнена до 0,79; однако для франция никаких уточнений не проводилось, поскольку эксперименты не проводились. Однако ожидается, что франций в некоторой степени является более электроотрицательным, чем цезий. см . во франции . Подробности
- ^ См. Браун, Джеффри (2012). Недоступная Земля: комплексный взгляд на ее структуру и состав . Springer Science & Business Media. п. 88. ИСБН 9789401115162 .
Малликена Электроотрицательность

Роберт С. Малликен предположил, что среднее арифметическое первой энергии ионизации (E i ) и сродства к электрону (E ea ) должно быть мерой склонности атома притягивать электроны: [9] [10]
Поскольку это определение не зависит от произвольной относительной шкалы, его также называют абсолютной электроотрицательностью . [11] с единицами килоджоулей на моль или электронвольтами . Однако чаще используется линейное преобразование для преобразования этих абсолютных значений в значения, напоминающие более знакомые значения Полинга. Для энергий ионизации и сродства к электрону в электронвольтах: [12]
Электроотрицательность Малликена можно рассчитать только для элемента, сродство к электрону которого известно. Измеренные значения доступны приблизительные значения . оценены или рассчитаны для 72 элементов, а для остальных элементов [ нужна ссылка ]
Иногда говорят, что электроотрицательность атома по Малликену является отрицательной величиной химического потенциала . [14] Вставляя энергетические определения потенциала ионизации и сродства к электрону в электроотрицательность Малликена, можно показать, что химический потенциал Малликена представляет собой аппроксимацию конечной разности электронной энергии по отношению к числу электронов., т.е.
Электроотрицательность – Оллреда Рохова

А. Луи Оллред и Юджин Г. Рочоу считали [15] эта электроотрицательность должна быть связана с зарядом, который испытывает электрон на «поверхности» атома: чем выше заряд на единицу площади атомной поверхности, тем больше склонность этого атома притягивать электроны. Эффективный заряд ядра , Z eff испытываемый валентными электронами , можно оценить с помощью Слейтера , а площадь поверхности атома в молекуле можно принять пропорциональной квадрату ковалентного радиуса r правил cov . Когда r cov выражается в пикометрах , [16]
Сандерсона электроотрицательности Уравнивание

Р.Т. Сандерсон также отметил связь между электроотрицательностью Малликена и размером атома и предложил метод расчета, основанный на обратной величине атомного объема. [17] Зная длины связей, модель Сандерсона позволяет оценить энергии связей в широком диапазоне соединений. [18] Модель Сандерсона также использовалась для расчета геометрии молекул, энергии s -электронов, констант спин-спинового взаимодействия ЯМР и других параметров органических соединений. [19] [20] Эта работа лежит в основе концепции выравнивания электроотрицательности , которая предполагает, что электроны распределяются вокруг молекулы, чтобы минимизировать или выровнять электроотрицательность Малликена. [21] Такое поведение аналогично выравниванию химического потенциала в макроскопической термодинамике. [22]
Аллена Электроотрицательность

Возможно, самое простое определение электроотрицательности дано Леландом К. Алленом, который предположил, что она связана со средней энергией валентных электронов в свободном атоме: [23] [24] [25]
где ε s,p — одноэлектронные энергии s- и p-электронов в свободном атоме, n s,p — число s- и p-электронов в валентной оболочке. Обычно применяется масштабный коэффициент 1,75×10. −3 для энергий, выраженных в килоджоулях на моль, или 0,169 для энергий, измеряемых в электронвольтах, чтобы дать значения, численно аналогичные электроотрицательности Полинга. [ нужна ссылка ]
Одноэлектронные энергии могут быть определены непосредственно из спектроскопических данных , поэтому электроотрицательности, рассчитанные этим методом, иногда называют спектроскопическими электроотрицательностями . Необходимые данные доступны почти для всех элементов, и этот метод позволяет оценить электроотрицательность элементов, которые не могут быть обработаны другими методами, например франция , электроотрицательность которого по Аллену равна 0,67. [26] Однако неясно, что следует считать валентными электронами для элементов d- и f-блока, что приводит к неоднозначности их электроотрицательностей, рассчитанных методом Аллена.
По этой шкале неон имеет самую высокую электроотрицательность среди всех элементов, за ним следуют фтор , гелий и кислород .
| Группа → | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ↓ Период | ||||||||||||||||||
| 1 | ЧАС 2.300 | Он 4.160 | ||||||||||||||||
| 2 | Что 0.912 | Быть 1.576 | Б 2.051 | С 2.544 | Н 3.066 | ТО 3.610 | Ф 4.193 | Ne 4.787 | ||||||||||
| 3 | Уже 0.869 | мг 1.293 | Ал 1.613 | И 1.916 | П 2.253 | С 2.589 | кл. 2.869 | С 3.242 | ||||||||||
| 4 | К 0.734 | Что 1.034 | наук 1.19 | Из 1.38 | V 1.53 | Кр 1.65 | Мин. 1.75 | Фе 1.80 | Ко 1.84 | В 1.88 | С 1.85 | Зн 1.588 | Здесь 1.756 | Ге 1.994 | Как 2.211 | Се 2.424 | Бр 2.685 | НОК 2.966 |
| 5 | руб. 0.706 | старший 0.963 | И 1.12 | Зр 1.32 | Нб 1.41 | Мо 1.47 | Тс 1.51 | Ру 1.54 | резус 1.56 | ПД 1.58 | В 1.87 | компакт-диск 1.521 | В 1.656 | Сн 1.824 | Сб 1.984 | Te 2.158 | я 2.359 | Машина 2.582 |
| 6 | Cs 0.659 | Нет 0.881 | Лу 1.09 | хф 1.16 | Облицовка 1.34 | В 1.47 | Ре 1.60 | Ты 1.65 | И 1.68 | Пт 1.72 | В 1.92 | ртуть 1.765 | Тл 1.789 | Pb 1.854 | С 2.01 | Po 2.19 | В 2.39 | Рн 2.60 |
| 7 | Пт 0.67 | Солнце 0.89 | ||||||||||||||||
| См. Также: Электроотрицательность элементов (страница данных) | ||||||||||||||||||
Корреляция электроотрицательности с другими свойствами [ править ]

Широкое разнообразие методов расчета электроотрицательности, которые дают результаты, хорошо коррелирующие друг с другом, является одним из показателей количества химических свойств, на которые может влиять электроотрицательность. Наиболее очевидным применением электроотрицательности является обсуждение полярности связи , для которой эту концепцию ввел Полинг. В общем, чем больше разница в электроотрицательности между двумя атомами, тем более полярная связь образуется между ними, при этом атом, имеющий более высокую электроотрицательность, находится на отрицательном конце диполя. Полинг предложил уравнение, связывающее «ионный характер» связи с разницей в электроотрицательности двух атомов: [5] хотя это несколько вышло из употребления.
Было показано несколько корреляций между частотами инфракрасного растяжения определенных связей и электроотрицательностью участвующих атомов: [27] однако это неудивительно, поскольку такие частоты растяжения частично зависят от силы связи, которая учитывается при расчете электроотрицательности Полинга. Более убедительными являются корреляции между электроотрицательностью и химическими сдвигами в ЯМР-спектроскопии. [28] или изомерные сдвиги в мессбауэровской спектроскопии [29] (см. рисунок). Оба этих измерения зависят от плотности s-электронов в ядре и поэтому являются хорошим показателем того, что различные меры электроотрицательности действительно описывают «способность атома в молекуле притягивать к себе электроны». [1] [5]
Тенденции электроотрицательности
тенденции Периодические
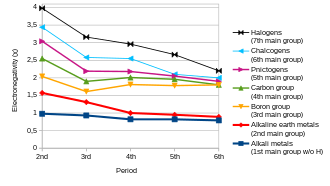
В общем случае электроотрицательность увеличивается при движении слева направо по периоду и уменьшается при уменьшении группы. Следовательно, фтор — наиболее электроотрицательный из элементов (не считая благородных газов ), тогда как цезий — наименее электроотрицательный, по крайней мере, из тех элементов, по которым имеются существенные данные. [26] Это заставило бы поверить в то, что фторид цезия — это соединение , связь которого имеет наиболее ионный характер. [ нужна ссылка ]
Из этого общего правила есть некоторые исключения. Галлий и германий имеют более высокую электроотрицательность, чем алюминий и кремний соответственно, из-за сжатия d-блока . Элементы четвертого периода сразу после первого ряда переходных металлов имеют необычно малые атомные радиусы, поскольку 3d-электроны неэффективны для экранирования увеличенного ядерного заряда, а меньший размер атома коррелирует с более высокой электроотрицательностью (см. Электроотрицательность Оллреда-Рочова и Сандерсона) . электроотрицательность выше). Аномально высокая электроотрицательность свинца , особенно по сравнению с таллием и висмутом , является артефактом электроотрицательности, меняющейся в зависимости от степени окисления: его электроотрицательность лучше соответствует тенденциям, если его указывать для состояния +2 со значением Полинга 1,87 вместо +4 состояние.
Изменение электроотрицательности в зависимости от степени окисления [ править ]
В неорганической химии принято считать, что одно значение электроотрицательности справедливо для большинства «нормальных» ситуаций. Хотя этот подход имеет преимущество простоты, ясно, что электроотрицательность элемента не является неизменным свойством атома и, в частности, увеличивается с увеличением степени окисления элемента. [30]
Оллред использовал метод Полинга для расчета отдельных электроотрицательностей для различных степеней окисления нескольких элементов (включая олово и свинец), для которых было доступно достаточно данных. [8] Однако для большинства элементов недостаточно различных ковалентных соединений, для которых известны энергии диссоциации связей, чтобы сделать этот подход осуществимым. Это особенно верно в отношении переходных элементов, для которых указанные значения электроотрицательности обычно по необходимости усредняются по нескольким различным степеням окисления, и в результате тенденции в электроотрицательности увидеть труднее. [ нужна ссылка ]
| Кислота | Формула | хлор окисление состояние | п К а |
|---|---|---|---|
| Хлорноватистая кислота | HClO | +1 | +7.5 |
| Хлористая кислота | HClO 2 | +3 | +2.0 |
| Хлорная кислота | HClO3 | +5 | −1.0 |
| Хлорная кислота | HClO 4 | +7 | −10 |
Химические эффекты этого увеличения электроотрицательности можно увидеть как в структуре оксидов и галогенидов, так и в кислотности оксидов и оксокислот. Следовательно, CrO 3 и Mn 2 O 7 — кислые оксиды с низкой температурой плавления , Cr 2 O 3 — амфотерен , а Mn 2 O 3 — полностью основной оксид .
хорошо виден на константах p K a оксокислот Эффект также хлора . диссоциации Эффект намного сильнее, чем можно было бы объяснить тем, что отрицательный заряд распределяется среди большего числа атомов кислорода, что привело бы к разнице в p K a, равной log 10 ( 1 ⁄ 4 ) = –0,6 между хлорноватистой кислотой и хлорной кислотой . По мере увеличения степени окисления центрального атома хлора большая электронная плотность переносится с атомов кислорода на хлор, уменьшая частичный отрицательный заряд отдельных атомов кислорода. В то же время положительный частичный заряд водорода увеличивается с повышением степени окисления. Этим объясняется наблюдаемое повышение кислотности с увеличением степени окисления в оксокислотах хлора.
и гибридизации схема Электроотрицательность
Электроотрицательность атома меняется в зависимости от гибридизации орбитали, участвующей в связи. Электроны на s-орбиталях удерживаются более прочно, чем электроны на p-орбиталях. Следовательно, связь с атомом, использующим sp х Гибридная орбиталь для связи будет более сильно поляризована по отношению к этому атому, если гибридная орбиталь имеет более s-характер. То есть при сравнении электроотрицательностей для разных схем гибридизации данного элемента порядок χ(sp 3 ) < χ(sp 2 ) < χ(sp) (эта тенденция должна распространяться на нецелые индексы гибридизации и ). Хотя в принципе это справедливо для любого элемента основной группы, значения электроотрицательности, специфичной для гибридизации, чаще всего приводятся для углерода. В органической химии эта электроотрицательность часто используется для предсказания или объяснения полярности связей в органических соединениях, содержащих двойные и тройные связи с углеродом. [ нужна ссылка ]
| Гибридизация | χ (Полинг) [31] |
|---|---|
| C(sp 3 ) | 2.3 |
| C(sp 2 ) | 2.6 |
| С(сп) | 3.1 |
| 'общий' С | 2.5 |
Групповая электроотрицательность [ править ]
В органической химии электроотрицательность связана больше с различными функциональными группами, чем с отдельными атомами. Термины групповая электроотрицательность и электроотрицательность заместителя используются как синонимы. Однако принято различать индуктивный эффект и резонансный эффект , которые можно описать как σ- и π-электронотрицательности соответственно. Существует ряд линейных соотношений свободной энергии , которые использовались для количественной оценки этих эффектов, из которых уравнение Хэммета наиболее известно . Параметры Кабачника представляют собой групповые электроотрицательности для использования в фосфорорганической химии .
Электроположительность [ править ]
Электроположительность — это мера способности элемента отдавать электроны и, следовательно, образовывать положительные ионы ; таким образом, это антипод электроотрицательности.
В основном это свойство металлов , а это означает, что, как правило, чем больше металлический характер элемента, тем больше его электроположительность. Следовательно, щелочные металлы являются наиболее электроположительными из всех. Это потому, что у них есть единственный электрон во внешней оболочке, и, поскольку она находится относительно далеко от ядра атома, он легко теряется; другими словами, эти металлы имеют низкую энергию ионизации . [32]
В то время как электроотрицательность увеличивается по периодам в таблице Менделеева и уменьшается по группам , электроположительность уменьшается по периодам (слева направо) и увеличивается по группам. Это означает, что элементы в правом верхнем углу периодической таблицы элементов (кислород, сера, хлор и т. д.) будут иметь наибольшую электроотрицательность, а элементы в левом нижнем углу (рубидий, цезий и франций) — наибольшую электроположительность.
См. также [ править ]
- Химическая полярность
- Сродство к электрону
- Электроотрицательности элементов (страница данных)
- Энергия ионизации
- Металлическое соединение
- Модель Мидемы
- Орбитальная гибридизация
- Степень окисления
- Периодическая таблица
Ссылки [ править ]
- ^ Jump up to: Перейти обратно: а б ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Интернет-исправленная версия: (2006–) « Электроотрицательность ». doi : 10.1351/goldbook.E01990
- ^ Jump up to: Перейти обратно: а б Дженсен, ВБ (1996). «Электроотрицательность от Авогадро до Полинга: Часть 1: Истоки концепции электроотрицательности». Журнал химического образования . 73 (1): 11–20. Бибкод : 1996JChEd..73...11J . дои : 10.1021/ed073p11 .
- ^ Jump up to: Перейти обратно: а б с Полинг, Л. (1932). «Природа химической связи. IV. Энергия одинарных связей и относительная электроотрицательность атомов». Журнал Американского химического общества . 54 (9): 3570–3582. дои : 10.1021/ja01348a011 .
- ^ Спроул, Гордон Д. (26 мая 2020 г.). «Оценка шкал электроотрицательности» . АСУ Омега . 5 (20): 11585–11594. дои : 10.1021/acsomega.0c00831 . ПМЦ 7254809 . ПМИД 32478249 .
- ^ Jump up to: Перейти обратно: а б с Полинг, Лайнус (1960). Природа химической связи . Издательство Корнельского университета. стр. 88–107 . ISBN 978-0-8014-0333-0 .
- ^ « PubChem ElectroNegativity », загружено, построено на графике и сопоставлено «Электроотрицательность» с «ElectronAffinity», что показывает довольно сильную положительную корреляцию «0,712925965». (Посещение связанного сайта 16 сентября 2023 г.)
- ^ Гринвуд, штат Нью-Йорк; Эрншоу, А. (1984). Химия элементов . Пергамон. п. 30. ISBN 978-0-08-022057-4 .
- ^ Jump up to: Перейти обратно: а б с Оллред, Алабама (1961). «Значения электроотрицательности по термохимическим данным». Журнал неорганической и ядерной химии . 17 (3–4): 215–221. дои : 10.1016/0022-1902(61)80142-5 .
- ^ Малликен, Р.С. (1934). «Новая шкала электроаффинности; вместе с данными о валентных состояниях, потенциалах валентной ионизации и сродстве к электрону». Журнал химической физики . 2 (11): 782–793. Бибкод : 1934ЖЧФ...2..782М . дои : 10.1063/1.1749394 .
- ^ Малликен, Р.С. (1935). «Электронные структуры молекул XI. Электросродство, молекулярные орбитали и дипольные моменты». Дж. Хим. Физ. 3 (9): 573–585. Бибкод : 1935ЖЧФ...3..573М . дои : 10.1063/1.1749731 .
- ^ Пирсон, Р.Г. (1985). «Абсолютная электроотрицательность и абсолютная жесткость кислот и оснований Льюиса». Дж. Ам. хим. Соц. 107 (24): 6801–6806. дои : 10.1021/ja00310a009 .
- ^ Хьюи, Дж. Э.; Кейтер, Э.А.; Кейтер, Р.Л. (1 декабря 2008 г.) [1978]. «17». В Кауфмане, ГБ (ред.). Неорганическая химия: принципы структуры и реакционной способности (оцифрованная версия) (3-е изд.). Нью-Йорк (опубликовано в 1900 г.). п. 167. дои : 10.1021/ed050pA379.1 . ISBN 9780060429874 . OCLC 770736023 . химик-неорганик00huhe_0. Архивировано из оригинала 8 сентября 2019 года . Проверено 15 декабря 2020 г. - через Oxford University Press.
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ) Альтернативный URL - ^ Это второе соотношение было пересчитано с использованием лучших значений первых энергий ионизации и сродства к электрону, доступных в 2006 году.
- ^ Франко-Перес, Марко; Газкес, Хосе Л. (31 октября 2019 г.). «Электроотрицательности Полинга и Малликена в теории функционала плотности». Журнал физической химии А. 123 (46): 10065–10071. Бибкод : 2019JPCA..12310065F . дои : 10.1021/acs.jpca.9b07468 . ПМИД 31670960 . S2CID 207814569 .
- ^ Оллред, Алабама; Рохов, Э.Г. (1958). «Шкала электроотрицательности, основанная на электростатической силе». Журнал неорганической и ядерной химии . 5 (4): 264–268. дои : 10.1016/0022-1902(58)80003-2 .
- ^ Хаускрофт, CE; Шарп, AG (1 ноября 1993 г.). Неорганическая химия (электронная книга). Том. 3 (15-е изд.). Швейцария: Пирсон Прентис-Холл. п. 38. дои : 10.1021/ed070pA304.1 . ISBN 9780273742753 – через Базельский университет. Альтернативный URL
- ^ Сандерсон, RT (1983). «Электроотрицательность и энергия связи». Журнал Американского химического общества . 105 (8): 2259–2261. дои : 10.1021/ja00346a026 .
- ^ Сандерсон, RT (1983). Полярная ковалентность . Нью-Йорк: Академическая пресса. ISBN 978-0-12-618080-0 .
- ^ Зефиров Н.С.; Кирпиченок, М.А.; Измайлов, Ф.Ф.; Трофимов, М.И. (1987). «Схемы расчета атомной электроотрицательности в молекулярных графах в рамках принципа Сандерсона». Доклады Академии наук СССР . 296 : 883–887.
- ^ Трофимов М.И.; Смоленский, Е.А. (2005). «Применение показателей электроотрицательности органических молекул к задачам химической информатики». Российский химический вестник . 54 (9): 2235–2246. дои : 10.1007/s11172-006-0105-6 . S2CID 98716956 .
- ^ SW Рик; С. Дж. Стюарт (2002). «Модели выравнивания электроотрицательности» . У Кенни Б. Липковица; Дональд Б. Бойд (ред.). Обзоры по вычислительной химии . Уайли. п. 106. ИСБН 978-0-471-21576-9 .
- ^ Роберт Г. Парр; Вэйтао Ян (1994). Теория функционала плотности атомов и молекул . Издательство Оксфордского университета. п. 91. ИСБН 978-0-19-509276-9 .
- ^ Аллен, Лиланд К. (1989). «Электроотрицательность - это средняя одноэлектронная энергия электронов валентной оболочки в свободных атомах в основном состоянии». Журнал Американского химического общества . 111 (25): 9003–9014. дои : 10.1021/ja00207a003 .
- ^ Манн, Джозеф Б.; Мик, Терри Л.; Аллен, Лиланд К. (2000). «Энергии конфигурации основных элементов группы». Журнал Американского химического общества . 122 (12): 2780–2783. дои : 10.1021/ja992866e .
- ^ Манн, Джозеф Б.; Мик, Терри Л.; Найт, Юджин Т.; Капитани, Джозеф Ф.; Аллен, Лиланд К. (2000). «Энергии конфигурации элементов d-блока». Журнал Американского химического общества . 122 (21): 5132–5137. дои : 10.1021/ja9928677 .
- ^ Jump up to: Перейти обратно: а б Широко цитируемая электроотрицательность Полинга, равная 0,7 для франция, представляет собой экстраполированное значение неопределенного происхождения. Электроотрицательность цезия по Аллену равна 0,66.
- ^ См., например, Беллами, LJ (1958). Инфракрасные спектры сложных молекул . Нью-Йорк: Уайли. п. 392 . ISBN 978-0-412-13850-8 .
- ^ Шписеке, Х.; Шнайдер, WG (1961). «Влияние электроотрицательности и магнитной анизотропии заместителей на химические сдвиги C13 и H1 в соединениях CH3X и CH3CH2X». Журнал химической физики . 35 (2):722. Бибкод : 1961ЖЧФ..35..722С . дои : 10.1063/1.1731992 .
- ^ Класен, Калифорния; Хорошо, МЛ (1970). «Интерпретация мессбауэровских спектров смешанно-гексагалокомплексов олова(IV)». Неорганическая химия . 9 (4): 817–820. дои : 10.1021/ic50086a025 .
- ^ Ли, Кеян; Сюэ, Дунфэн (01 октября 2006 г.). «Оценка значений электроотрицательности элементов в разных валентных состояниях» . Журнал физической химии А. 110 (39): 11332–11337. Бибкод : 2006JPCA..11011332L . дои : 10.1021/jp062886k . ISSN 1089-5639 . ПМИД 17004743 .
- ^ Флеминг, Ян (2009). Молекулярные орбитали и органические химические реакции (Студенческая ред.). Чичестер, Западный Суссекс, Великобритания: Wiley. ISBN 978-0-4707-4660-8 . OCLC 424555669 .
- ^ « Электроположительность », Интернет-энциклопедия Microsoft Encarta , 2009 г. (Архивировано 31 октября 2009 г.).
Библиография [ править ]
- Джолли, Уильям Л. (1991). Современная неорганическая химия (2-е изд.). Нью-Йорк: МакГроу-Хилл . стр. 71–76. ISBN 978-0-07-112651-9 .
- Маллей, Дж. (1987). «Оценка атомной и групповой электроотрицательности». Электроотрицательность . Структура и связь. Том. 66. стр. 1–25. дои : 10.1007/BFb0029834 . ISBN 978-3-540-17740-1 .
Внешние ссылки [ править ]
 СМИ, связанные с электроотрицательностью, на Викискладе?
СМИ, связанные с электроотрицательностью, на Викискладе? - WebElements перечисляет значения электроотрицательности, полученные различными методами расчета.
- Видео, объясняющее электроотрицательность
- Диаграмма электроотрицательности , сводный список электроотрицательности каждого элемента вместе с интерактивной таблицей Менделеева.








