Триоксид хрома
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Триоксид хрома | |
| Другие имена Хромовый ангидрид, оксид хрома(VI), хромовая кислота ( неправильный термин ) | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ЧЭБИ | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.014.189 |
ПабХим CID | |
| номер РТЭКС |
|
| НЕКОТОРЫЙ | |
| Число | 1463 |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| Кр О 3 | |
| Молярная масса | 99.993 g·mol −1 |
| Появление | Темно-красное зернистое твердое вещество, расплывающееся |
| Запах | Без запаха |
| Плотность | 2,7 г/см 3 (20 °С) [1] |
| Температура плавления | 197 ° С (387 ° F; 470 К) [1] |
| Точка кипения | 250 ° С (482 ° F; 523 К) разлагается [1] |
| Растворимость | Растворим в Н 2 SO 4 , ХНО3 , (СН 3 СН 2 ) 2 О , СН 3 СООН , ( СН3 ) 2СО |
| +40·10 −6 см 3 /моль [1] | |
| Термохимия | |
Стандартный моляр энтропия ( S ⦵ 298 ) | 73,2 Дж/(моль·К) [3] |
Стандартная энтальпия образование (Δ f H ⦵ 298 ) | −589,3 кДж/моль [4] |
| Опасности | |
| СГС Маркировка : | |
     [5] [5] | |
| Опасность | |
| H271 , H301+H311 , H314 , H317 , H330 , H334 , H335 , H340 , H350 , H361f , H372 , H410 [5] | |
| P210 , P260 , P280 , P303+P361+P353 , P304+P340+P310 , P305+P351+P338 [5] | |
| NFPA 704 (огненный алмаз) | |
| Летальная доза или концентрация (LD, LC): | |
ЛД 50 ( средняя доза ) | 80 мг/кг (крысы, перорально) [6] |
| Паспорт безопасности (SDS) | КМГС 1194 |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Триоксид хрома (также известный как оксид хрома (VI) или хромовый ангидрид ) представляет собой неорганическое соединение с формулой КрО 3 . Это кислотный ангидрид , хромовой кислоты который иногда продается под тем же названием. [6] Это соединение представляет собой темно-фиолетовое твердое вещество в безводных условиях и ярко-оранжевое во влажном состоянии. Вещество растворяется в воде с гидролизом. [ нужны разъяснения ] Ежегодно производятся миллионы килограммов, в основном для гальванотехники . [7] Триоксид хрома — мощный окислитель, мутаген и канцероген . [8]
Производство, строение и основные реакции
[ редактировать ]Триоксид хрома получают путем обработки бихромата натрия кислотой серной : [6]
- H 2 SO 4 + Na 2 Cr 2 O 7 → 2 CrO 3 + Na 2 SO 4 + H 2 O
По этому или аналогичным маршрутам ежегодно добывается около 100 000 тонн. [7]
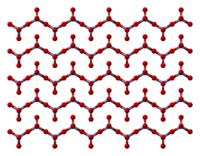
Твердое тело состоит из цепочек тетраэдрически координированных атомов хрома, имеющих общие вершины. Таким образом, каждый хромовый центр разделяет с соседями два кислородных центра. Два атома кислорода не являются общими, что дает общую стехиометрию 1:3. [9] [10]

Строение мономерного CrO 3 был рассчитан с использованием теории функционала плотности и, по прогнозам, будет пирамидальным ( точечная группа C 3v ), а не плоским (точечная группа D 3h ). [11]
Триоксид хрома разлагается при температуре выше 197 °C, выделяя кислород и в конечном итоге давая Cr2O3 2O:
- 4 CrO 3 → 2 Cr 2 O 3 + 3 O 2
Применяется в органическом синтезе в качестве окислителя, часто в виде раствора в уксусной кислоте . [9] или ацетон в случае окисления Джонса . В ходе этих окислений Cr(VI) превращает первичные спирты в соответствующие карбоновые кислоты , а вторичные спирты — в кетоны . Реакции показаны ниже:
- Первичные спирты в карбоновые кислоты
- 4 CrO 3 + 3 RCH 2 OH + 12 H + → 3 RCOOH + 4 Cr 3+ + 9 Н 2 О
- Вторичные спирты в кетоны
- 2 CrO 3 + 3 R 2 CHOH + 6 H + → 3 R 2 C=O + 2 Cr 3+ + 6 Н 2 О
Приложения
[ редактировать ]Триоксид хрома в основном используется при хромировании . Обычно его используют с добавками, которые влияют на процесс нанесения покрытия, но не вступают в реакцию с триоксидом. Триоксид реагирует с кадмием , цинком и другими металлами с образованием пассивирующих хроматных пленок, устойчивых к коррозии . Он также используется в производстве синтетических рубинов . Раствор хромовой кислоты также используется при нанесении анодных покрытий на алюминий , которые в основном используются в аэрокосмической промышленности. На Международной космической станции он используется для контроля роста бактерий в резервуаре для хранения сточных вод. Раствор хромовой/ фосфорной кислоты также является предпочтительным средством для удаления анодных покрытий всех типов.
Безопасность
[ редактировать ]Триоксид хрома высокотоксичен, едок и канцерогенен. [12] Это главный пример шестивалентного хрома , опасного для окружающей среды . [13] Родственные производные хрома (III) не особенно опасны; таким образом, восстановители используются для разрушения образцов хрома (VI).
воспламеняет органические материалы, такие как спирты Триоксид хрома, будучи мощным окислителем, при контакте .
Изображения
[ редактировать ]- Концентрированный раствор дихромата калия в воде.
- Добавление серной кислоты в раствор.
- Кристаллизация триоксида хрома в результате реакции.
- Реакция триоксида хрома и этанола
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с д и Лиде, Дэвид Р., изд. (2009). Справочник CRC по химии и физике (90-е изд.). Бока-Ратон, Флорида : CRC Press . ISBN 978-1-4200-9084-0 .
- ^ Зейделл, Атертон; Линке, Уильям Ф. (1919). Растворимость неорганических и органических соединений (2-е изд.). Компания Д. Ван Ностранда. п. 250 .
- ^ «оксид хрома(VI)» . chemister.ru .
- ^ Прадьот, Патнаик (2003). Справочник неорганических химикатов . McGraw-Hill Companies, Inc. ISBN компании 0-07-049439-8 .
- ^ Перейти обратно: а б с Sigma-Aldrich Co. , Оксид хрома(VI) . Получено 22 ноября 2021 г.
- ^ Перейти обратно: а б с д «Триоксид хрома» . Chemicalland21.com . АроКор Холдингс Инк . Проверено 15 июня 2014 г.
- ^ Перейти обратно: а б Гнев, Г.; Хальстенберг, Дж.; Хохгешвендер, К.; Шерхаг, К.; Кораллус, У.; Кнопф, Х.; Шмидт, П.; Олингер, М. (2000). «Соединения хрома». Энциклопедия промышленной химии Ульмана . дои : 10.1002/14356007.a07_067 . ISBN 3527306730 .
- ^ Мамырбаев Арстан Абдраманович; Джаркенов Тимур Агатаевич; Имангазина Зина Амангалиевна; Сатыбалдиева Умит Абулхаировна (16.04.2015). «Мутагенное и канцерогенное действие хрома и его соединений» . Гигиена окружающей среды и профилактическая медицина . 20 (3). ООО «Спрингер Сайенс энд Бизнес Медиа»: 159–167. дои : 10.1007/s12199-015-0458-2 . ISSN 1342-078X . ПМЦ 4434237 . ПМИД 25877777 .
- ^ Перейти обратно: а б Коттон, Ф. Альберт ; Уилкинсон, Джеффри ; Мурильо, Карлос А.; Бохманн, Манфред (1999), Передовая неорганическая химия (6-е изд.), Нью-Йорк: Wiley-Interscience, ISBN 0-471-19957-5
- ^ Стивенс, Дж. С.; Круикшанк, DWJ (1970). «Кристаллическая структура (CrO 3 ) ∞ ». Acta Crystallographica Раздел B. 26 (3): 222. дои : 10.1107/S0567740870002182 .
- ^ Чжай, HJ; Ли, С.; Диксон, Д.А.; Ван, Л.С. (2008). «Исследование электронных и структурных свойств кластеров оксида хрома (CrO
3 ) −
n и (CrO 3 ) n ( n = 1–5): Фотоэлектронная спектроскопия и расчеты функциональной плотности». Журнал Американского химического общества . 130 (15): 5167–77. doi : 10.1021/ja077984d . PMID 18327905 . - ^ «Триоксид хрома (MSDS)» . Джей Ти Бейкер. Архивировано из оригинала 12 января 2015 г. Проверено 13 сентября 2007 г.
- ^ Воздействие шестивалентного хрома на окружающую среду послужило вдохновением для создания биографического голливудского фильма 2000 года «Эрин Брокович» .







