Диоксид свинца
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Оксид свинца(IV) | |
| Другие имена Оксид свинца Платтнериты | |
| Идентификаторы | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.013.795 |
| Номер ЕС |
|
ПабХим CID | |
| номер РТЭКС |
|
| НЕКОТОРЫЙ | |
| Число | 1872 |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| PbO 2 | |
| Молярная масса | 239.1988 g/mol |
| Появление | темно-коричневый, черный порошок |
| Плотность | 9,38 г/см 3 |
| Температура плавления | 290 ° C (554 ° F; 563 К) разлагается. |
| нерастворимый | |
| Растворимость | растворим в уксусной кислоте нерастворим в спирте |
Показатель преломления ( n D ) | 2.3 |
| Структура | |
| шестиугольный | |
| Опасности | |
| СГС Маркировка : | |
    | |
| Опасность | |
| Х272 , Х302 , Х332 , Х360 , Х372 , Х373 , Х410 | |
| P201 , P202 , P210 , P220 , P221 , P260 , P261 , P264 , P270 , P271 , P273 , P280 , P281 , P301+P312 , P304+P312 , P304+P340 , P308+P313 , P 312 , П314 , П330 , П370+ П378 , П391 , П405 , П501 | |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | Невоспламеняющийся |
| Паспорт безопасности (SDS) | Внешний паспорт безопасности материалов |
| Родственные соединения | |
Другие катионы | Углекислый газ Диоксид кремния диоксид германия Диоксид олова |
| Оксид свинца(II) Оксид свинца(II,IV) | |
Родственные соединения | Оксид таллия(III) Оксид висмута(III) |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Оксид свинца(IV) , широко известный как диоксид свинца , представляет собой неорганическое соединение с химической формулой ПбО 2 . Это оксид , в котором свинец находится в степени окисления +4. [1] Это темно-коричневое твердое вещество, нерастворимое в воде. [2] Он существует в двух кристаллических формах. Он имеет несколько важных применений в электрохимии , в частности, в качестве положительной пластины свинцово-кислотных аккумуляторов .
Характеристики
[ редактировать ]Физический
[ редактировать ]
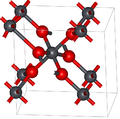
Диоксид свинца имеет две основные полиморфные модификации: альфа и бета, которые встречаются в природе в виде редких минералов скрутиниита и платтнерита соответственно. Хотя бета-форма была обнаружена в 1845 году, [3] а- PbO 2 был впервые идентифицирован в 1946 году и обнаружен как природный минерал в 1988 году. [4]
Альфа-форма имеет ромбическую симметрию, пространственная группа Pbcn (№ 60), символ Пирсона oP 12, постоянные решетки a = 0,497 нм, b = 0,596 нм, c = 0,544 нм, Z = 4 (четыре формульные единицы на элементарную ячейку). [4] Атомы свинца шестикоординатны.
Симметрия бета-формы тетрагональная , пр. гр. Р4 2 /мнм (№ 136), символ Пирсона tP 6, постоянные решетки а = 0,491 нм, с = 0,3385 нм, Z = 2. [5] и связан со структурой рутила и может рассматриваться как содержащий столбцы октаэдров, имеющие общие противоположные ребра и соединенные углами с другими цепочками. Это контрастирует с альфа-формой, где октаэдры соединены соседними краями, образуя зигзагообразные цепочки. [4]
Химическая
[ редактировать ]Диоксид свинца при нагревании на воздухе разлагается следующим образом:
- 24 PbO 2 → 2 Pb 12 O 19 + 5 O 2
- Pb 12 O 19 → Pb 12 O 17 + O 2
- 2 Pb 12 O 17 → 8 Pb 3 O 4 + O 2
- 2 Pb 3 O 4 → 6 PbO + O 2
Стехиометрию конечного продукта можно контролировать, изменяя температуру — например, в приведенной выше реакции первая стадия происходит при 290 °С, вторая — при 350 °С, третья — при 375 °С и четвертая — при 600 °С. Кроме того, Pb 2 O 3 можно получить разложением PbO 2 при 580–620 °С и давлении кислорода 1400 атм (140 МПа). Поэтому термическое разложение диоксида свинца является распространенным способом получения различных оксидов свинца. [6]
Диоксид свинца — амфотерное соединение с преобладающими кислотными свойствами. Растворяется в сильных основаниях с образованием гидроксиплюмбата - иона. [Pb(OH) 6 ] 2− : [2]
- PbO 2 + 2 NaOH + 2 H 2 O → Na 2 [Pb(OH) 6 ]
Он также реагирует с основными оксидами в расплаве, образуя ортоплюмбаты. М 4 [PbO 4 ] .
Из-за нестабильности своего Pb 4+ катион, диоксид свинца реагирует с горячими кислотами, превращаясь в более стабильные Pb 2+ состояние и выделение кислорода: [6]
- 2 PbO 2 + 2 H 2 SO 4 → 2 PbSO 4 + 2 H 2 O + O 2
- 2 PbO 2 + 4 HNO 3 → 2 Pb(NO 3 ) 2 + 2 H 2 O + O 2
- PbO 2 + 4 HCl → PbCl 2 + 2 H 2 O + Cl 2
Однако эти реакции медленны.
Диоксид свинца хорошо известен как хороший окислитель . Примеры реакций приведены ниже: [7]
- 2 MnSO 4 + 5 PbO 2 + 6 HNO 3 → 2 HMnO 4 + 2 PbSO 4 + 3 Pb(NO 3 ) 2 + 2 H 2 O
- 2 Cr(OH) 3 + 10 KOH + 3 PbO 2 → 2 K 2 CrO 4 + 3 K 2 PbO 2 + 8 H 2 O
Электрохимический
[ редактировать ]Хотя формула диоксида свинца номинально задается как PbO 2 , фактическое соотношение кислорода и свинца варьируется от 1,90 до 1,98 в зависимости от метода приготовления. Дефицит кислорода (или избыток свинца) приводит к характерной металлической проводимости диоксида свинца с удельным сопротивлением всего 10. −4 Ом·см и который используется в различных электрохимических приложениях. Как и металлы, диоксид свинца имеет характерный электродный потенциал , а в электролитах может поляризоваться как анодно, так и катодно . Электроды из диоксида свинца имеют двойное действие, то есть в электрохимических реакциях участвуют и ионы свинца, и кислорода. [8]
Производство
[ редактировать ]Химические процессы
[ редактировать ]Диоксид свинца в промышленных масштабах производят несколькими методами, к которым относится окисление свинцового сурика ( Pb 3 O 4 ) в щелочной суспензии в атмосфере хлора, [6] реакция ацетата свинца(II) с «хлоридом извести» ( гипохлоритом кальция ), [9] [10] Реакция Pb 3 O 4 с азотной кислотой также дает диоксид: [2] [11]
- Pb 3 O 4 + 4 HNO 3 → PbO 2 + 2 Pb(NO 3 ) 2 + 2 H 2 O
PbO 2 реагирует с гидроксидом натрия с образованием иона гексагидроксоплюмбата(IV). [Pb(OH) 6 ] 2− , растворим в воде.
Электролиз
[ редактировать ]Альтернативный метод синтеза — электрохимический : диоксид свинца образуется на чистом свинце в разбавленной серной кислоте при анодной поляризации при электродном потенциале около +1,5 В при комнатной температуре. Эта процедура используется для крупномасштабного промышленного производства PbO 2 аноды. Свинцовый и медный электроды погружают в серную кислоту со скоростью 5–10 л/мин. Электроосаждение осуществляется гальваностатически , путем подачи тока около 100 А/м. 2 около 30 минут.
Недостатком этого способа производства анодов из диоксида свинца является его мягкость, особенно по сравнению с твердыми и хрупкими. PbO 2 имеет твердость по шкале Мооса 5,5. [12] Такое несоответствие механических свойств приводит к отслаиванию покрытия, что предпочтительно для объемных работ. PbO2 Производство . Поэтому альтернативным методом является использование более твердых подложек, таких как титан , ниобий , тантал или графит, и нанесение покрытия. PbO 2 на них из нитрата свинца(II) в статической или проточной азотной кислоте. Перед нанесением подложка обычно подвергается пескоструйной очистке для удаления поверхностного оксида и загрязнений, а также для повышения шероховатости поверхности и адгезии покрытия. [13]
Приложения
[ редактировать ]Диоксид свинца используется в производстве спичек , пиротехники , красителей , при отверждении сульфидных полимеров . Он также используется в конструкции высоковольтных молниеотводов . [6]
Диоксид свинца используется в качестве анодного материала в электрохимии. β- PbO 2 более привлекателен для этой цели, чем α-форма, поскольку он имеет относительно низкое удельное сопротивление , хорошую коррозионную стойкость даже в среде с низким pH и высокое перенапряжение для выделения кислорода в электролитах на основе серной и азотной кислот. Диоксид свинца также может противостоять выделению хлора в соляной кислоте . Аноды из диоксида свинца недороги и когда-то использовались вместо обычных платиновых и графитовых электродов для регенерации дихромата калия . Их также применяли в качестве кислородных анодов при гальванике меди и цинка в сульфатных ваннах. В органическом синтезе аноды из диоксида свинца нашли применение для получения глиоксиловой кислоты из щавелевой кислоты в сернокислом электролите. [13]
Свинцово-кислотный аккумулятор
[ редактировать ]Наиболее важным применением диоксида свинца является катод свинцово-кислотных аккумуляторов . Его полезность обусловлена аномальной металлической проводимостью ПбО 2 . Свинцово -кислотная батарея сохраняет и высвобождает энергию путем смещения равновесия (сопропорционирования) между металлическим свинцом, диоксидом свинца и солями свинца (II) в серной кислоте .
- Pb + PbO 2 + 2 HSO − 4 + 2 H + → 2 PbSO 4 + 2 H 2 O E ° = +2.05 V
Безопасность
[ редактировать ]Соединения свинца являются ядами . [14] Диоксид свинца является сильным окислителем, поэтому любой контакт кожи, глаз с диоксидом свинца или его парами может привести к тяжелым травмам в виде ожогов, которые могут даже привести к смерти.
PbO 2 не горюч, но усиливает воспламеняемость других веществ и интенсивность пожара. В случае пожара он выделяет раздражающие и токсичные пары. [15]
Диоксид свинца и другие соединения свинца представляют опасность для окружающей среды, если их не утилизировать должным образом. он особенно ядовит для водной флоры и фауны. [16]
Ссылки
[ редактировать ]- ^ Мик, Терри Л.; Гарнер, Лия Д. (1 февраля 2005 г.). «Электроотрицательность и треугольник связи». Журнал химического образования . 82 (2): 325. Бибкод : 2005ЖЧЭд..82..325М . дои : 10.1021/ed082p325 . ISSN 0021-9584 .
- ^ Jump up to: а б с Иглсон, Мэри (1994). Краткая энциклопедия химии . Вальтер де Грюйтер. п. 590. ИСБН 978-3-11-011451-5 .
- ^ Хайдингер, В. (1845). «Второй класс: геогениды. II порядок. Барит VII. Свинцовый барит. Платтнерит.». Справочник по определению минералогии (PDF) (на немецком языке). Вена: Браумюллер и Зайдель. п. 500.
- ^ Jump up to: а б с Таггард, Дж. Э. младший; и др. (1988). «Скрутиньит, природное месторождение α-PbO 2 из Бингема, Нью-Мексико, США, и Мапими, Мексика» (PDF) . Канадский минералог . 26 :905.
- ^ Харада, Х.; Саса, Ю.; Уда, М. (1981). «Кристаллические данные β-PbO 2 » (PDF) . Журнал прикладной кристаллографии . 14 (2): 141. дои : 10.1107/S0021889881008959 .
- ^ Jump up to: а б с д Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . п. 386. ИСБН 978-0-08-037941-8 .
- ^ Кумар Де, Анил (2007). Учебник неорганической химии . Нью Эйдж Интернэшнл. п. 387. ИСБН 978-81-224-1384-7 .
- ^ Барак, М. (1980). Электрохимические источники питания: первичные и вторичные батареи . ИЭПП. стр. 184 и далее. ISBN 978-0-906048-26-9 .
- ^ М. Баулдер (1963). «Оксид свинца(IV)». В Г. Брауэре (ред.). Справочник по препаративной неорганической химии, 2-е изд . Том. 1. Нью-Йорк, Нью-Йорк: Академик Пресс. п. 758.
- ^ Виберг, Нильс (2007). неорганической химии (на немецком языке Учебник ). Берлин: де Грюйтер. п. 919. ИСБН 978-3-11-017770-1 .
- ^ Сатклифф, Артур (1930). Практическая химия для студентов старших курсов (изд. 1949 г.). Лондон: Джон Мюррей.
- ^ «Платтнерит: информация и данные о минерале платтнерита» . www.mindat.org . Проверено 12 апреля 2018 г.
- ^ Jump up to: а б Франсуа Кардарелли (2008). Справочник материалов: краткий настольный справочник . Спрингер. п. 574. ИСБН 978-1-84628-668-1 .
- ^ «ДИОКСИД СВИНЦА» . опасность.com . Проверено 12 апреля 2018 г.
- ^ ПабХим. «Диоксид свинца» . pubchem.ncbi.nlm.nih.gov . Проверено 15 декабря 2022 г.
- ^ «Идентификация продукта и компании» (PDF) . ltschem.com . Проверено 29 февраля 2024 г.
